הבדלים בין גרסאות בדף "גישה ניאו-אדג'ובנטית למלנומה מתקדמת עם פוטנציאל נתיחות - A neoadjuvant approach to advanced melanoma"
מ (Motyk העביר את הדף גישה ניאו-אדג'ובנטית למלנומה מתקדמת עם פוטנציאל נתיחות לשם גישה ניאו-אדג'ובנטית למלנומה מתקדמת עם פוטנציאל נתיחות - A neoadjuvant approach to advanced melanoma) |
גרסה אחרונה מ־20:45, 9 בנובמבר 2023
| גישה ניאו-אדג'ובנטית למלנומה מתקדמת עם פוטנציאל נתיחות | ||
|---|---|---|

| ||
| יוצר הערך | ד"ר דב זיפל | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מלנומה
הקדמה
שיעורי ההישרדות לחמש שנים במחלת מלנומה גרורתית היו נמוכים מ-10 אחוזים[1], אך אנו עדים למהפך דרמטי בטיפול במחלה זו, הודות לפריצות דרך בטיפול האימונולוגי והטיפול המכוונן (ממוקד מטרה). מלנומה מתאפיינת במהלך ביולוגי אימונוגני, ולכן אין פלא שהשימוש במעכבי 4-CTLA - Ipilimumab (יירבוי)[2] ומעכבי 1-PD - Pembrolizumab (קיטרודה)[2], Nivolumab (אופדיבו)[2] תרם רבות לשיפור סיכויי התגובה וההישרדות בחולי מלנומה גרורתיים. כמו כן, השימוש בנוגדי BRAF ו-MEK בחולים בעלי מוטציה בשרשרת MAPK (Mitogen Activated Protein Kinase) הוביל גם הוא לתגובות מרשימות מאוד בחולים אלו. ההצלחות בחולי מלנומה שלב IV הובילו להערכת יעילות תכשירים אלו גם בחולים בשלבי מחלה מוקדמים יותר, במסגרת טיפול קדם ובתר ניתוחי.
מלנומה בשלב מחלה III מייצגת מגוון רחב של חולים, הנע בין תת-שלב IIIA, עם שיעור הישרדות של כמעט 90 אחוזים בעשר שנים, ובין תת-שלב IIID, עם שיעור הישרדות של 25 אחוזים בלבד[3]. גישת הטיפול הקדם-ניתוחי תופסת תאוצה בגידולים סולידיים אחרים, כגון גידולי שד וגידולי פי הטבעת. היתרון של הטיפול הקדם-ניתוחי נובע מיכולת השפעה כמעט מיידית על היקף המחלה המקרוסקופית, השפעה המשליכה על היקף הניתוח המתוכנן ומאפשרת שימור איברים, תפקוד והקטנת סיבוכים. כך למשל, בגידולי שד ניתן להמיר ניתוח כריתת שד בניתוח משמר שד, ובגידולי פי הטבעת ניתן להמיר ניתוחים לכריתה מלאה של הרקטום בניתוח ליצירת סטומה (APR - Abdominal Perineal Resection - כריתה אבדומינופריניאלית), ובניתוח משמר סוגרים. בנוסף, המטופל מהווה מעין "מעבדה חיה", ומאפשר להעריך את התגובה לטיפול, כך שאם אין תגובה כלל או שיש התקדמות למחלה, ניתן לשנות גישה או להקדים התערבות ניתוחית.
במלנומה בשלב III, המעורבות הבלוטית עלולה לעיתים להיות משמעותית מאוד, כך שהסרה (דיסקציה) מלאה של הבלוטות האזוריות והשארת אגן ניקוז נקי ממחלה עשויות לגרום לתחלואה ולפגיעה משמעותית באיכות חיי המטופל. גם הגידול הראשוני עלול להיות נרחב, ולהצריך ניתוח מורכב שיחייב הנחת שתל עור או העברת מתלה (Flap) מאזור מרוחק. בחולים אלה, כריתה מלאה של הגידול הראשוני ושל אגן הניקוז עלולה להיות נרחבת, או בלתי ישימה לאור היקף המחלה, ולכן גישה נאו-אדג'ובנטית היא הכרחית. גם בחולים עם מחלה נתיחה מראש, טיפול קדם-ניתוחי מהווה מקור מידע פרוגנוסטי אמין המאפשר לחזות את יעילות הטיפול, דבר שאינו מתאפשר במתכונת בתר-ניתוחית.
טיפול קדם-ניתוחי מיטבי מאופיין בהשגת שיעורי תגובה גבוהים בזמן סביר ומלווה במיעוט יחסי של תופעות לוואי. באופן זה הטיפול מאפשר לצלוח את הניתוח בבטחה, עם מיעוט סיבוכים בתר-ניתוחיים, וסיכון מועט ביותר להתקדמות המחלה תחת הטיפול.
בנוסף, קיימות עדויות לכך שחשיפה לטיפול סיסטמי כבר בשלבי מחלה מוקדמים עשויה להשפיע על אופן התקשורת הבין-תאית (Cell Signaling) בין תאי הסרטן לסביבת הגידול (Micro-environment), ולהפחית את הסיכון התקדמות המחלה למחלה הטרוגנית גרורתית[4][5].
טיפולי הזרקה תוך גידולית קדם ניתוחית - Intra-lesional
Talimogene laherparepvec) TVEC) הוא נגיף אונקולוגי מהונדס מסוג HSV (Herpes Simplex Virus) type 1. התכשיר ניתן בהזרקה תוך-גידולית ומאושר לשימוש למלנומה גרורתית M1a או בשלב III מתקדם בלתי נתיח. מדובר בשיעורי תגובה כוללת של 25 אחוזים לערך, אך עם שיעורי תגובה מלאה של 11 אחוזים באתר המוזרק. יעילותו של התכשיר נבדקת במחקר קליני מבוקר בחולי מלנומה שלב III נתיחה, ומתבצעת הקצאה אקראית (רנדומיזציה) בין כריתה ראשונית לטיפול מקדים בשש זריקות ואחריו טיפול ניתוחי (NCT02211131)[6]. בנוסף, נבדקת אפשרות של שילוב זריקות TVEC עם טיפולים סיסטמיים. בשלב זה מוקדם להעריך את יעילות הטיפול בשלבים מוקדמים של מלנומה - נמתין לתוצאות המחקר הצפויות ב-2022.
טיפול סיסטמי קדם ניתוחי
טיפול קדם-ניתוחי סיסטמי מתחלק לטיפול מכוונן (ביולוגי) ולאימונותרפיה.
טיפול קדם-ניתוחי מכוונן במעכבי BRAF ומעכבי MEK
ההסבר לשימוש במעכבי BRAF במתכונת קדם-ניתוחית נובע מהשיעור הגבוה של חולים המגיבים לטיפול זה, ובה בעת ממיעוט תופעות הלוואי ומחומרתן הפחותה. יעילות מרבית ופרופיל רעילות נסבל יותר ניתן להשיג על ידי שילוב של מעכבי BRAF ומעכבי MEK, לאור חסימה כפולה בשרשרת ה-MAPK, תוך הימנעות מהפעלה פרדוקסלית של השרשרת באמצעות עיכוב של RAF בלבד. הטיפול הביולוגי מהווה קו טיפול נפוץ במלנומה גרורתית, כך שהצטברו עדויות מספקות ונצבר ניסיון רב בשימוש ובניהול תופעות הלוואי שלו.
הפרסום הראשון של שימוש במעכבי BRAF במתכונת קדם-ניתוחית בחולי מלנומה בלתי נתיחים או בעלי נתיחות גבולית, יצא לאור ב-Journal of Surgical Oncology בשנת 2017, ומבוסס על קבוצת חולים שנותחו במרכז הרפואי שיבא ובמרכז הרפואי תל אביב על שם סוראסקי[7]. הראינו תגובה מלאה לטיפול בכ-30 אחוזים מהמטופלים (pCR - pathologic Complete Response) והצלחה של כריתה בשוליים נקיים ב-12/13 חולים, שהוגדרו כבלתי נתיחים טרם תחילת הטיפול המקדים. ב-2018 התפרסמה עבודה ב-Lancet Oncology המראה תוצאות דומות בניסוי אקראי בין טיפול מקדים לטיפול אדג'ובנטי[8].
בעקבות שני הפרסומים הללו מתנהלים כעת מספר מחקרים קליניים המעריכים את השימוש במעכבי BRAF ו-MEK בחולי מלנומה שלב III נתיחים ובלתי נתיחים. מחקרים אלו אמורים לספק עדויות נוספות לגבי יעילות התכשירים האלו בחולים בשלב III, אך רק כ-50 אחוזים מחולי מלנומה נושאים מוטציה מסוג V600 בגן BRAF, ולכן השימוש בתכשירים אלו מוגבל מראש לכמחצית מכלל חולי המלנומה המתקדמים. המענה לצורך במסלול נאו-אדג'ובנטי סיסטמי לחולים שהם BRAF wild type טמון באימונותרפיה.
טיפול קדם-ניתוחי באימונותרפיה
לאימונותרפיה במלנומה יש היסטוריה בת יותר ממאה שנים, החל בטיפול ב"חיסון של Coley" ב-1893 וכלה באימונותרפיה מודרנית עם מעכבי PD-1 ו-CTLA-4. בשנות ה-90 של המאה הקודמת נקבע המונח "Chemo-bio-therapy" - שילוב בין כימותרפיה לטיפול ביולוגי אימונותרפי ב-IL-2 (Interleukin 2) וב-INF (Interferon). טיפול זה במתכונת קדם-ניתוחית השיג שיעורי תגובה שנעו בין 20 אחוזים ל-30 אחוזים, אך היה כרוך בתופעות לוואי קשות שגרמו לדחייה של הניתוח בעד מחצית מהמטופלים. לאור תוצאות אלה רווחה האמונה שאין ערך משמעותי לטיפול קדם-ניתוחי בשילוב של אימונותרפיה וכימותרפיה[9]. ההצלחות פורצות הדרך בעשור האחרון בתחום מעכבי נקודות הבקרה האימונותרפיים (Immune checkpoint inhibitors) גרמו לחשיבה מחודשת בנושא, והובילו למחקרים נוספים בעניין טיפול קדם-ניתוחי לחולי מלנומה.
אחד מהניסיונות הראשונים היה מחקר OPACIN, שבדק את ההיתכנות (Feasibility) של טיפול משולב ב-Ipilimumab ו-Nivolumab לפני ניתוח בהשוואה לטיפול בתר-ניתוחי באותם תכשירים. תגובה לטיפול נרשמה ב-80 אחוזים מהמקרים, אך זו הייתה מלווה בתופעות לוואי שהצריכו הפסקת טיפול ב-90 אחוזים מהמטופלים[10]. בעקבות כך החל מחקר קליני בשם Neo-Opacin הבודק שילובים ומינונים שונים של התכשירים הללו, במטרה להשיג תגובה מיטבית עם שיעור תופעות לוואי סביר. מחקר זה נמצא בשלבי גיוס מטופלים ובעתיד הקרוב אמורות להתפרסם תוצאות ראשונות.
נוסף על כך, מתקיימים מחקרים קליניים רבים המגייסים מטופלים לטיפול אימונולוגי קדם-ניתוחי, אך עדיין מוקדם להסיק מסקנות לגבי השילובים והמינונים היעילים ביותר למטופלים בשלב III שאינם מתאימים לטיפול במעכבי BRAF.
קיימת תופעה מוכרת בשימוש בתכשירים אימונולוגיים הנקראת Pseudoprogression. המשמעות היא שהטיפול האימונולוגי גורם לתגובה דלקתית מהירה באזור הנגע הגידולי, דבר שעלול להתפרש לא רק כאי-תגובה לטיפול, אלא אף כהתקדמות המחלה על אף הטיפול. כתוצאה מתופעה זו דרוש לעיתים טיפול קדם-ניתוחי ממושך יותר לצורך התרשמות מספקת מתגובה קלינית, טרם ההחלטה על היתכנות ניתוחית של הממצא.
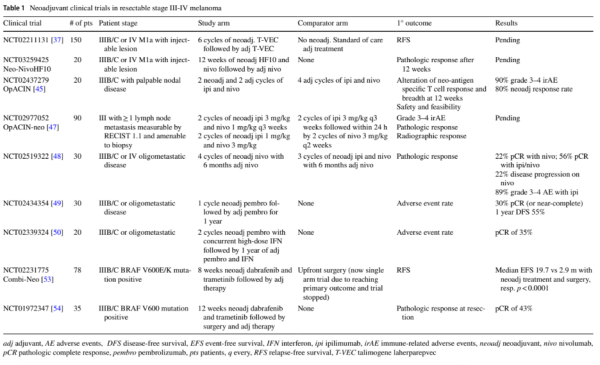
בטבלה מספר 1 מסוכמת רשימה חלקית של ניסויים קליניים הצפויים לספק תוצאות בקרוב[11].
סיכום
עקרון הטיפול הקדם-ניתוחי הוא המשך הגיוני להצלחות שניתן לראות בעשור האחרון בטיפול בחולי מלנומה גרורתיים. התכשירים הקיימים משיגים תגובה טיפולית טובה באחוז ניכר של המטופלים, עם תופעות לוואי סבירות. הדבר מאפשר למנתח, בסופו של דבר, להשיג תוצאה רצויה של הסרה כירורגית של הגידול והגרורות בבלוטות, וכך להפחית את הסיכון להתקדמות המחלה לשלב גרורתי.
הניסיון בטיפול בסרטן השד מלמד שתגובה מלאה לטיפול קדם-ניתוחי יכולה להיות סמן (Surrogate) להישרדות טובה יותר.
עדיין מוקדם להכריע אם אכן זהו המצב גם במלנומה, אך התקווה היא שעם שימוש נרחב יותר בעולם בטיפול קדם-ניתוחי, תעמוד לנו היכולת לנבא הישרדות על סמך תגובה ראשונית לטיפול. למידע פרוגנוסטי זה ערך רב בחולי שלב III, שכן הוא מאפשר לברור אפשרויות טיפול בתר-ניתוחי ואת אופן המעקב בהמשך.
מנגד סביר להניח שחולים שמחלתם מתקדמת על אף טיפול מקדים ושאינם מצליחים להגיע לניתוח דפינטיבי, מוכיחים את הביולוגיה המורכבת של מחלתם כבר בשלב מוקדם, כך שכירורגיה כנראה לא תסייע להתמודד עם מחלתם הקשה. באופן כזה, טיפול קדם-ניתוחי מאפשר "לברור" את החולים המתאימים לטיפול ניתוחי.
בנוסף, ידוע שמחקריים קליניים בטיפול קדם-ניתוחי יכולים להוביל לאישור FDA (Food and Drug Administration) במסלול מהיר יותר לעומת מחקרים בטיפול מונע, הודות לכך שתוצאות של מחקרים קדם-ניתוחיים מתקבלות בטווח קצר יחסית, לעומת מחקרים בטיפול מונע, המתקבלות רק לאחר מספר שנים.
כמו כן, טיפול קדם-ניתוחי מספק מידע פתולוגי רב-ערך: האפשרות לבחון שינויים ברקמת הגידול וסביבתה לאחר הטיפול נותנת לנו הזדמנות לבחון השפעות ספציפיות ברמה המולקולרית, וכן להעשיר ולהעמיק את ידיעותינו לגבי תהליכים ביולוגיים תחת השפעת הטיפול המכוונן או האימונולוגיה.
נכון ל-2019, לא ידועים ביו-מרקרים היכולים לנבא תנגודת ראשונית לטיפול באימונותרפיות או במעכבי BRAF ו-MEK. אך בהמשך, תוצאות המחקרים העתידיים בתחום הטיפול הקדם-ניתוחי צפויות להניב כלים לבחירה נכונה של מטופלים שיפיקו את המרב מטיפול קדם-ניתוחי, ובכך ניתן יהיה לשפר את הישרדותם.
לסיכום, המחקר בטיפול הקדם-ניתוחי במלנומה מהווה תחום מחקר מרתק וחשוב, שתוצאותיו בעתיד הלא רחוק עשויות להוות נקודת מפנה בטיפול בחולי מלנומה שלב III.
ביבליוגרפיה
- ↑ Balch CM, Buzaid AC, Soong SJ, et al. Final version of the American Joint Committee on cancer staging system for cutaneous melanoma. J Clin Oncol. 2001 Aug 15;19(16):3635- 48
- ↑ 2.0 2.1 2.2 או תרופות המכילות חומר פעיל דומה, בעלות שמות מסחריים אחרים
- ↑ Gershenwald JE, Scolyer RA, Hess KR, et al. Melanoma staging: evidence-based changes in the American Joint Committee on cancer eighth edition cancer staging manual. CA Cancer J Clin. 2017 Nov;67(6):472-92. Epub 2017 Oct 13
- ↑ Davar D, Tarhini AA, Kirkwood JM. Adjuvant immunotherapy of melanoma and development of new approaches using the neoadjuvant approach. Clin Dermatol. 2013 May- Jun;31(3):237-50
- ↑ Liu J, Blake SJ, Yong MC, et al. Improved efficacy of neoadjuvant compared to adjuvant immunotherapy to eradicate metastatic disease. Cancer Discov. 2016 Dec;6(12):1382-99. Epub 2016 Sep 23
- ↑ Andtbacka RHI, Chastain M, Li A, et al. Phase 2, multicenter, randomized, open-label trial assessing efficacy and safety of talimogene laherparepvec (T-VEC) neoadjuvant treatment (tx) plus surgery vs surgery for resectable stage IIIB/C and IVM1a melanoma (MEL) [abstract]. J Clin Oncol. 2017 Jan 31;33(15_suppl). Abstract 9094
- ↑ Zippel D, Markel G, Shapira-Frommer R, et al. Perioperative BRAF inhibitors in locally advanced stage III melanoma. J Surg Oncol. 2017 Dec;116(7):856-61. Epub 2017 Jun 26
- ↑ Amaria RN, Prieto PA, Tetzlaff MT, et al. Neoadjuvant plus adjuvant dabrafenib and trametinib versus standard of care in patients with high-risk, surgically resectable melanoma: a single-centre, open-label, randomised, phase 2 trial. Lancet Oncol. 2018 Feb;19(2):181-93. Epub 2018 Jan 18
- ↑ Kounalakis N, Gao D, Gonzalez R, et al. A neoadjuvant biochemotherapy approach to stage III melanoma: analysis of surgical outcomes. Immunotherapy. 2012 Jul;4(7):679-86
- ↑ Rozeman EA, Blank CU, van Akkooi ACJ, et al. Neoadjuvant ipilimumab + nivolumab (IPI+NIVO) in palpable stage III melanoma: updated data from the OpACIN trial and first immunological analyses [abstract]. J Clin Oncol. 2017 May 20;35(15_suppl). Abstract 9586
- ↑ McKean MA, Amaria RN. Challenges and opportunities of neoadjuvant treatment in locally advanced melanoma. Am J Clin Dermatol. 2018 Oct;19(5):639-46
המידע שבדף זה נכתב על ידי ד"ר דב זיפל - מכון אלה למלבאום לאימונותרפיה ומלנומה, מחלקה כירורגית, המרכז הרפואי ע"ש שיבא, תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק