הבדלים בין גרסאות בדף "חידושים בלוקמיה לימפובלסטית חריפה בילדים - 2021 - Innovations in acute lymphoblastic leukemia in children"
מ (Motyk העביר את הדף חידושים בלוקמיה לימפובלסטית חריפה בילדים - 2021 לשם חידושים בלוקמיה לימפובלסטית חריפה בילדים - 2021 - Innovations in acute lymphoblastic leukemia in children) |
גרסה אחרונה מ־16:43, 2 בנובמבר 2024
| חידושים בלוקמיה לימפובלסטית חריפה בילדים | ||
|---|---|---|
| Innovations in acute lymphoblastic leukemia in children | ||
| 250px | ||
Two girls with ALL demonstrating intravenous access for chemotherapy
| ||
| ICD-10 | Chapter C 91.0 | |
| ICD-9 | 204.0 | |
| MeSH | D054198 | |
| יוצר הערך | פרופסור שי יזרעאלי, ד"ר שרה אליצור | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה לימפובלסטית חריפה
מבוא
לוקמיה לימפובלסטית חריפה - לל"ח (Acute Lymphoblastic Leukemia - ALL) היא המחלה הממארת השכיחה ביותר בילדים. פריצת הדרך הראשונה בטיפול דווחה ב-1948 על ידי סידני פרבר, שפיתח את האנטי פולאט הראשון[1]. ריפוי החל רק בסוף שנות השבעים. מאז חל שיפור דרמטי בתוצאות הטיפול, והסיכוי להירפא מהמחלה עומד על קרוב ל-90 אחוזים[2].
סקירה זו תעסוק בשני נושאים עיקריים:
- רפואה מותאמת אישית ולל"ח
- המהפכה האימונותרפית בלל"ח
לבסוף יצויינו האתגרים המרכזיים העומדים בפני הטיפול בלל"ח.
מרבים לדבר על מהפכת "רפואה מדויקת מותאמת אישית" ו"טיפול ביולוגי ממוקד מטרה". כמו בתחומים רבים, אונקולוגיית ילדים הייתה חלוצה. זה שנים שהטיפול בלל"ח מותאם אישית לשורה של מאפיינים של הלוקמיה ולתגובה המולקולרית לטיפול, שנמדדת באמצעים טכנולוגיים מתקדמים. בנוסף, נכנסו תרופות ממוקדות מטרה. הטיפולים האימונותרפיים החדשניים מייצגים מגמה הפוכה לטיפול ממוקד מטרה. הם מכוונים נגד מטרות המשותפות לכל תאי הלוקמיה.
ההתקדמות הושגה לא רק הודות לפריצות מדעיות במחקר מעבדתי, אלא גם משום שכל הילדים עם לוקמיה מטופלים במסגרת פרוטוקולים בינלאומיים. אמנם פרוטוקולים אלה הם מחקר לכל דבר, אבל הסטנדרט בטיפול בלוקמיה, ולמעשה בכל סוגי הסרטן בילדים, הוא בפרוטוקולי מחקר בינלאומיים. רק כך נאספים נתונים בצורה מבוקרת וחלה התקדמות. הפרוטוקולים האלה תלויים לחלוטין בפילנתרופיה, ותרומת האגודה למלחמה בסרטן לפרוטוקולים האלה בישראל חשובה.
רפואה מותאמת אישית באבחון, סיווג לקבוצות סיכון וטיפול בלל"ח
כל לל"ח עוברת עיבוד ציטוגנטי ומולקולרי מפורט לקביעת תת-הסוג המדויק של הלוקמיה. שינויים מסוימים הם בעלי משמעות פרוגנוסטית המחייבת התאמת זרוע הטיפול[2].
סוג הלוקמיה הנפוץ ביותר הוא של תאי B. השינוי הגנטי הנפוץ ביותר הוא הטרנסלוקציה שמביאה לאיחוי בין הגנים RUNX1-ETV6 שמנבאת בדרך כלל פרוגנוזה מצוינת ומביאה בפרוטוקולים רבים לסיווג בסיכון נמוך ולהפחתת טיפול. כך גם ריבוי כרומוזומים - לוקמיה היפרדיפלואידית (hyperdiploid leukemia). שתי הלוקמיות הנזכרות למעלה הן הנפוצות בילדים.
לעומת זאת, מיעוט כרומוזומים - לוקמיה היפודיפלואידית - היא בעלת פרוגנוזה גרועה במיוחד, ומחייבת בדרך כלל השתלת מח עצם. כך גם חלק מהלוקמיות עם טרנסלוקציה המערבת את הגן MLL, במיוחד בתינוקות.
לשינויים מסוימים המתגלים בעיבוד גנטי מתקדם יותר משמעות פרוגנוסטית. לוקמיה היא הצטברות קלונאלית (שמוצאה בתא אחד) של תאים לא ממוינים. כך למשל, במרבית הלוקמיות מסוג B ניתן למצוא מוטציות בגנים המקדדים לפקטורי שיעתוק האחראיים להתמיינות תאי B. פגיעה בחלבונים האלה גורמת להצטברות תאים לא ממוינים. חסר באחד מהגנים האלה, "איקארוס", הוא בעל משמעות פרוגנוסטית חמורה. חסר שלו בתוספת חסר בגנים אחרים גורם לסיווג החולים לקבוצת סיכון גבוהה יותר המטופלת בכימותרפיה אינטנסיבית יותר[3].
בלוקמיות מסוג T, אימונופנוטייפ המצביע על תאים צעירים במיוחד (ETP) מרמז על פרוגנוזה גרועה אך איננו משמש בדרך כלל להחלטות טיפוליות[4]. חלק מהלוקמיות הן בעלי אפיון אימונולוגי מורכב יותר - מיאלואידי 1-B או מיאלואיד׳ 1-T או אפילו קרוב יותר לתאי גזע המטופויטים. בקבוצת הלוקמיות הביפנוטיפיות האלה קשה יותר לטפל, והפרוגנוזה שלהם, ככלל, גרועה יותר[5].
הגורם הפרוגנוסטי החשוב ביותר הוא התגובה בשלבים הראשונים של הטיפול למספר תרופות מוגבל יחסית. פותחו אמצעים טכנולוגיים מתקדמים במיוחד למדידה מדויקת של מחלה שאריתית (MRD - Measurable or Minimal residual Disease). מדידה באמצעות (FACS - Flow Cytometry) מאפשרת זיהוי תא לוקמי אחד מתוך 5,000-1,000 תאים, בעוד שמדידה מולקולרית באמצעות PCR (Polymerase Chain Reaction) וריצוף גנטי עמוק מהדור החדש, מאפשרים רגישות של 1 ל-100,000 תאים. רמת ה-MRD היא הגורם הפרוגנוסט׳ החשוב ביותר, הרבה יותר ממרבית השינויים הגנטיים בתאי הלוקמיה[6][7]. כך למשל סיכוי ההבראה של חולים עם לוקמיה שכבר בסוף החודש הראשון אינה ניתנת לזיהוי במח עצם גם באמצעים הרגישים ביותר הם כ-95 אחוזים ויותר, ועל כן מסווגים בדרגת הסיכון הנמוכה ביותר ומטופלים בהתאם. לעומתם חולים בהם 1:1,000 תאי מח עצם מזוהים כלוקמיים כעבור כחודשיים וחצי של טיפול נזקקים להשתלת מח עצם.
הגורם הפרוגנוסטי החשוב ביותר הוא הטיפול. כך שורה של מאפיינים שהיו גורמים פרוגנוסטיים בעבר איבדו את המשמעות הבלתי תלויה שלהם. למשל סוג הלוקמיה B או T, רמת ההמוגלובין, ספירת התאים באבחנה ועוד. לכן כל גורם פרוגנוסטי צריך להישקל על פי סוג הטיפול שניתן לחולים.
הרפואה המדויקת לא מתבטאת רק בהתאמה האישית של קבוצת הסיכון אלא גם באמצעות טיפול מכוון מטרה. פריצת הדרך בתחום הייתה פיתוח מעכבי קינאזות ספציפיים ל-ABL, למשל - imatinib (גליבק) שהביאו למהפכה בטיפול בלוקמיה מיאלואידית כרונית (CML - Chronic Myeloid Leukemia), המתאפיינת בנשיאת הגן המאוחה BCR ABL שנובע מטרנסלוקציה בין כרומוזום 9 לכרומוזום 22 (הכרומוזום 22 תוצאת הטרנסלוקציה הזו נקרא כרומוזום פילדלפיה)[8][9]. כ-5 אחוזים מהלל"ח בילדים ולפחות 20 אחוזים מהלל"ח במבוגרים נושאים את האיחוי הזה וכרוכים בפרוגנוזה גרועה במיוחד. רובם נזקקו להשתלת מח עצם. הצירוף של מעכבי קינאזות וכימותרפיה חולל מהפיכה בתחום[10]. מרבית הילדים עם BCR ABL ALL לא נזקקים להשתלת מח עצם.
המחקר הגנטי המתקדם הוביל לגילוי תת-קבוצה של לל"ח בילדים ומבוגרים בעלי חתימה גנטית דומה לזו של לוקמיות עם כרומוזום פילדלפיה. הקבוצה הזו נקראת "PH LIKE". היא מתאפיינת בשפעול בלתי מבוקר של קינאזות[11]. יש שתי קבוצות עיקריות בלוקמיות - האחת בה הקינאזה העיקרית היא JAK והשנייה דומה ביותר ל-BCR-ABL. חשוב לאפיין את הקבוצה השנייה, משום שמעכבי ABL כגון Imatinib או Dasatinib (ספרייסל[12]) יעילים בטיפול. לכן, באופן שגרתי חלק גדול מהלוקמיות עוברות עיבוד נוסף לאבחון לוקמיות דמויות פילדלפיה.
הטיפול האימונותרפי
הבעיה בטיפול ממוקד היא שתאי סרטן מתאפיינים בחוסר יציבות גנטית. התוצאה של טיפול עלולה להיות סלקציה של קלונים (clones) יציבים לטיפול. כך למשל, לוקמיות המתאפיינות במוטציות ב-JAK עוברות הישנות שמקורה בתתי-אוכלוסיות הנושאות מוטציות ב-RAS[13].
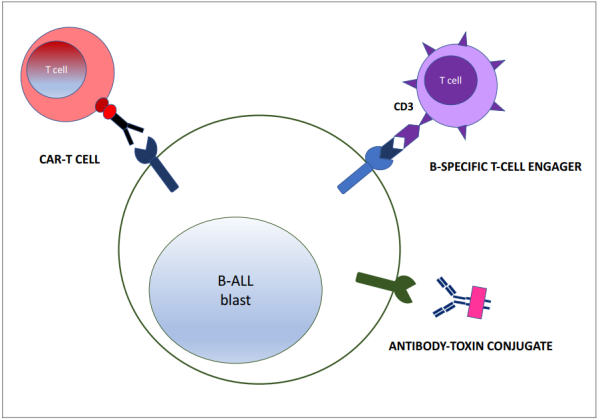
העיקרון שמאחורי הטיפול האימונותרפי הוא הפוך לטיפול ממוקד מטרה. הוא מיועד להשמיד את כל התאים הסרטניים באמצעות תקיפת אנטיגן המצוי על קרום התא של כולם. העיקרון המשותף לכל הטיפולים האימונותרפיים ל-לל"ח מסוג B נובע מהסינדרום התורשתי לאגמאגלובולינמיה שגילה ברוטון (Bruton agammaglobulinemia)[14]. מתברר כי ניתן לחיות ממושכות ללא תאי B כל עוד מספקים לחולה נוגדנים. הטיפולים האימונותרפיים ל-לל"ח מסוג B מכוונים בעיקר לשני אנטיגנים: CD19 או 22. הם גורמים להשמדת כל תאי B הבריאים והלוקמיים. הם מתחלקים לשלושה סוגים:
- נוגדן המחובר לרעלן - כשהנוגדן נקשר הוא עובר אינטרנליזציה יחד עם הרעלן והורג את התא. הנוגדן המוצלח במיותר הוא - Inotuzumab ozogamicin (בספונסה[12]) נגד החלבון CD22[15]
- נוגדן ביספציפי בעל שתי זרועות - האחת כנגד האנטיגן של תאי המטרה והשנייה כנגד אנטיגן של תאי T. בדרך הזו הנוגדן מביא תאי T בסמוך לתא המטרה ואלה משמידים אותו. Blinatumomab (בלינסייטו[12]) היא תרופה מסוג זה שמאושרת לשימוש. זהו נוגדן ביספציפי המכוון את תאי ה-T של החולה לפעול כנגד תאי לוקמיה מסוג B-ALL. ל-Blinatumomab שני אתרי קישור: אחד ל-CD3, המהווה חלק מהקולטן של תאי T, והשני לאנטיגן CD19, המבוטא על פני תאי B. התכשיר מקשר בין שני התאים וגורם לשפעול תא ה-T ולהרס התא הלוקמי[16][17][18]. עקב ההצלחה בשימוש ב-Blinatumomab בילדים עם לוקמיה נשנית/רפרקטורית, במחקרים קליניים פרוספקטיביים עכשוויים (כגון AIEOP 2017 BFM ALL הפועל בישראל), הוכנס Blinatumomab לקו הראשון של הטיפול, כחלופה לקורסים של כימותרפיה אינטנסיבית מאוד, בניסיון להפחית את רעילות הטיפול, וכן כניסיון להפחית את שיעור ההישנויות
- תאי T עם קולטן לנוגדן כימרי - CAR-T cells - (Chimeric Antigen Receptor T-cells) - עיקרון הנוגדן הבי-ספציפי מתקדם במקרה זה צעד אחד קדימה - מכניסים את הנוגדן לתוך תאי T שנאספים מהחולה, מרבים אותם בתרבית ומחזירים לחולה.
תאי ה-T המהונדסים תוקפים ישירות את תא המטרה ללא צורך בתיווך, כגון בנוגדן בי-ספציפי. הטכנולוגיה מבוססת על המצאה של פרופ' זליג אשחר, שחיכתה 30 שנה לפיתוח טכנולוגיית הנדסה גנטית מתקדמת[19]. ה-CAR-T המאושרים לשימוש קליני תוקפים את האנטיגן CD19. מחקרים מצביעים על כך שטיפול ב-CAR-T בלל"ח עמיד או נשנה מסוג B מביא לשיעורי הישרדות כעבור שנתיים של כ-50 אחוזים[20]
הטיפולים האימונולוגיים הם נשק טיפולי חדש ומהפכני. הם מאפשרים לטפל ללא הרעילות של התרופות הכימיות. במאמר שפרסמנו, תיארנו ילדים רבים שסבלו מרעילות קשה, בדרך כלל זיהומית, משנית לטיפול כימי, וניצלו כתוצאה מטיפול ב-Blinatumomab[21].
כמו כל טיפול גם הטיפולים החדשניים האלה כרוכים בתופעות לוואי, כגון סערת ציטוקינים, רעילות נוירולוגית שהמנגנון לה לא ברור. הרעלנים המצומדים לנוגדנים עלולים לגרום למחלה חסימתית של ורידי הכבד (Sinusoidal obstruction syndrome) לאחר השתלת מח עצם. לא ברור אם הטיפולים יכולים לעמוד בפני עצמם או לשמש גשר להשתלת מח עצם ומה מקומם במחלה ראשונית לא עמידה לטיפול (רפרקטורית). תאי סרטן הם "יצירתיים" מאוד במנגנוני התנגודת. ההישנות לאחר טיפול אימונותרפי נגרמת לעיתים קרובות על ידי תאי לוקמיה החסרים על פני הקרום שלהם את האנטיגן כנגדו מכוון הטיפול האימונולוגי[22]. המקום המדויק של הטיפולים האלה במערך הטיפולי המורכב בלל"ח ייקבע במחקרים קליניים במסגרת פרוטוקולים פרוספקטיביים.
האתגרים
אלו הם מקצת מהאתגרים הניצבים בטיפול בלל"ח:
- מעורבות המוח - ללא טיפול מונע, לוקמיה תחזור במוח (בחלל התת-עכבישי) ביותר ממחצית מהחולים[23]. התוספת של קרינה מונעת למוח הביאה לקפיצה הראשונה בריפוי ילדים חולי לל"ח. אבל היא גם גרמה לנזק ארוך טווח קשה, פגיעה באינטליגנציה, חסרים אנדוקריניים ועוד. הקבוצה הישראלית הייתה הראשונה שביטלה את הקרינה המונעת למוח[24][25]. מרבית החולים לא מקבלים קרינה, אלא תרופות כימיות לתעלת השדרה. אך גם הטיפול הזה עלול לגרום לנזקים נוירולוגים מיידים ומאוחרים למוח. גילינו שתאי הלוקמיה במוח נאלצים לסנטז חומצות שומן בלתי רוויות. מחוץ למוח החומצות האלה קיימות במיקרו-סביבה של מח העצם. אך אין חומצות כאלה בנוזל השדרה. הראנו שתרופות שמעכבות את הסינתזה שלהם מנעו את ההתפשטות של לוקמיה אנושית למוחם של עכברים מדוכאי חיסון[26][./index.php%3Ftitle=חידושים_בלוקמיה_לימפובלסטית_חריפה_בילדים_-_2021#cite_note-הערה25-26 [26]]. טיפול ביולוגי מכוון מטרה עשוי בעתיד למנוע לוקמיה מוחית
- עמידות לטיפול - חלק מהלוקמיות הלימפובלסטיות לא ניתנות לריפוי. למשל הפרוגנוזה של הישנות של לוקמיה מסוג T גרועה ביותר. כך גם חלק מהלוקמיות מסוג B, למשל לוקמיה מסוג TCF3-HLF או הישנות של לוקמיה עם TCF3-PBX1. מתסכל גם שההתאמה האישית של קבוצות הסיכון לא מושלמת. מבחינה מספרית מרבית ההישנויות מקורן בקבוצת הסיכון הבינונית
- רעילות - זהו האתגר המרכזי בטיפול בלל"ח[27]. מספר שווה של ילדים נפטר מרעילות טיפול ומהישנות מחלה. הבעיה העיקרית היא זיהומים, כולל זיהומים פטרייתיים[28]. כך למשל, התוספת של טיפול במעכבי קינאזות מסוג ABL לכימותרפיה מנעה אמנם השתלות מח עצם, אך גרמה לעלייה תלולה מאוד של תמותה מזיהומים[10]. אולי מאחר ש-ABL חשוב לתפקוד של תאי T
תרופות "ביולוגיות" אחרות, כגון Asparaginase, עלולות לגרום פנקראטיטיס קשה[29] או קרישי דם[30][31]. לסטרואידים תופעות לוואי קשות בטווח הקצר והארוך. פגיעות בעצמות היא תופעה (avascular necrosis) נפוצה של הטיפול בסטרואידים, בעיקר במתבגרות. קשה ביותר לטפל בה. תופעות נוספות ארוכות טווח הן סינדרום מטבולי, פגיעה בלב (מאנתרציקלינים) ועוד. מבחינת הרעילות של הטיפול האימונולוגי, ייתכן כי בשילוב מינון כימותרפי נמוך יותר ניתן יהיה להפחית את הרעילות, וייתכן שנראה גם רעילות ארוכת טווח של הטיפול האימונולוגי, בעיקר בתאי CAR. בנוסף לנטייה לזיהומים, עליה ניתן להתגבר במתן נוגדנים, חסר תאי B לזמן ממושך, כגון במחלת ברוטון, מלווה ברעילות נוספת.
סיכום
לוקמיה לימפובלסטית חריפה אינה רק הגידול הממאיר הנפוץ בילדים אלא גם המחלה בה התאמה אישית ומדויקת של הטיפול למבנה הגנטי של תאי הלוקמיה ולתגובה שלהם לתחילת הטיפול הביאה להחלמה בשיעור שניתן היה רק לחלום עליו לפני מספר שנים. טיפול ביולוגי בתרופות ממוקדות מטרה, ובעיקר בנוגדנים ותאים מהונדסים לפגיעה אימונולוגית בתאים, משנה את הטיפול והפרוגנוזה גם של הלוקמיות הקשות ביותר. האתגר העתידי הוא להבריא כל ילד מלוקמיה ברעילות מזערית ככל האפשר.
ביבליוגרפיה
- ↑ Farber S, Diamond LK. Temporary remissions in acute leukemia in children produced by folic acid antagonist, 4-aminopteroyl-glutamic acid. N Engl J Med. 1948 Jun 3;238(23):787-93.
- ↑ 2.0 2.1 Pui CH, Yang JJ, Hunger SP, et al. Childhood acute lymphoblastic leukemia: progress through collaboration. J Clin Oncol. 2015 Sep 20;33(27):2938- 48. Epub 2015 Aug 24.
- ↑ Stanulla M, Dagdan E, Zaliova M, et al. IKZF1plus defines a new minimal residual disease-dependent very-poor prognostic profile in pediatric B-cell precursor acute lymphoblastic leukemia. J Clin Oncol. 2018 Apr 20;36(12):1240-9 Epub 2018 Mar 2..
- ↑ Coustan-Smith E, Mullighan CG, Onciu M, et al. Early T-cell precursor leukaemia: a subtype of very high-risk acute lymphoblastic leukaemia. Lancet Oncol. 2009 Feb;10(2):147-56. Epub 2009 Jan 13.
- ↑ Hrusak O, De Haas V, Stancikova J, et al. International cooperative study identifies treatment strategy in childhood ambiguous lineage leukemia. Blood. 2018 Jul 19;132(3):264-76. Epub 2018 May 2.
- ↑ Conter V, Bartram CR, Valsecchi MG, et al. Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia: results in 3184 patients of the AIEOP-BFM ALL 2000 study. Blood. 2010 Apr 22;115(16):3206-14. Epub 2010 Feb 12.
- ↑ Schrappe M, Valsecchi MG, Bartram CR, et al. Late MRD response determines relapse risk overall and in subsets of childhood T-cell ALL: results of the AIEOP-BFM-ALL 2000 study. Blood. 2011 Aug 25;118(8):2077-84 . Epub 2011 Jun 30.
- ↑ Druker BJ, Sawyers CL, Kantarjian H, et al. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med, 2001 Apr 5;344(14):1038-42.
- ↑ Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med. 2001 Apr 5;344(14):1031-7.
- ↑ 10.0 10.1 Biondi A, Gandemer V, De Lorenzo P, et al. Imatinib treatment of paediatric Philadelphia chromosome¬positive acute lymphoblastic leukaemia (EsPhALL2010): a prospective, intergroup, open-label, single-arm clinical trial. Lancet Haematol. 2018 Dec;5(12):e641-e52.
- ↑ Izraeli S. Beyond Philadelphia: 'Ph-like' B cell precursor acute lymphoblastic leukemias - diagnostic challenges and therapeutic promises. Curr Opin Hematol. 2014 Jul;21(4):289-96.
- ↑ 12.0 12.1 12.2 או תרופות המכילות חומר פעיל דומה, בעלות מות מסחריים אחרים
- ↑ Schwartzman O, Savino AM, Gombert M, et al. Suppressors and activators of JAK-STAT signaling at diagnosis and relapse of acute lymphoblastic leukemia in Down syndrome. Proc Natl Acad Sci U S A. 2017 May 16;114(20):E4030-E9. Epub 2017 May 1.
- ↑ Buckley CR. Agammaglobulinemia, by Col. Ogden C. Bruton, MC, USA, Pediatrics, 1952;9:722-728. Pediatrics. 1998 Jul;102(1 Pt 2):213-5.
- ↑ Kantarjian HM, DeAngelo DJ, Stelljes M, et al. Inotuzumab ozogamicin versus standard therapy for acute lymphoblastic leukemia. N Engl J Med. 2016 Aug 25;375(8):740-53. Epub 2016 Jun 12.
- ↑ Brown PA, Ji L, Xu X, et al. Effect of postreinduction therapy consolidation with blinatumomab vs chemotherapy on disease-free survival in children, adolescents, and young adults with first relapse of B-cell acute lymphoblastic leukemia: a randomized clinical trial. JAMA. 2021 Mar 2;325(9):833-42.
- ↑ Locatelli F, Zugmaier G, Rizzari C, et al. Effect of blinatumomab vs chemotherapy on event-free survival among children with high-risk first-relapse B-cell acute lymphoblastic leukemia: a randomized clinical trial. JAMA. 2021 Mar 2;325(9):843-54.
- ↑ Shukla N, Sulis ML. Blinatumomab for treatment of children With high-risk relapsed B-cell acute lymphoblastic leukemia. JAMA. 2021 Mar 2;325(9):830-2.
- ↑ Eshhar Z. From the mouse cage to human therapy: a personal perspective of the emergence of T-bodies/ chimeric antigen receptor T cells. Hum Gene Ther. 2014 Sep;25(9):773-8.
- ↑ Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med. 2018 Feb 1;378(5):439-48.
- ↑ Elitzur S, Arad-Cohen N, Barzilai-Birenboim S, et al. Blinatumomab as a bridge to further therapy in cases of overwhelming toxicity in pediatric B-cell precursor acute lymphoblastic leukemia: report from the Israeli Study Group of Childhood Leukemia. Pediatr Blood Cancer. 2019 Oct;66(10):e27898. Epub 2019 Jul 2.
- ↑ Sotillo E, Barrett DM, Black KL, et al. Convergence of acquired mutations and alternative splicing of CD19 enables resistance to CART-19 immunotherapy. Cancer Discov. 2015 Dec;5(12):1282-95. Epub 2015 Oct 29.
- ↑ Frishman-Levy L, Izraeli S. Advances in understanding the pathogenesis of CNS acute lymphoblastic leukaemia and potential for therapy. Br J Haematol. 2017 Jan;176(2):157-67. Epub 2016 Oct 21.
- ↑ Stark B, Avrahami G, Nirel R, et al. Extended triple intrathecal therapy in children with T-cell acute lymphoblastic leukaemia: a report from the Israeli National ALL-Studies. Br J Haematol. 2009 Oct;147(1):113-24. Epub 2009 Aug 19.
- ↑ Stark B, Sharon R, Rechavi G, et al. Effective preventive central nervous system therapy with extended triple intrathecal therapy and the modified ALL-BFM 86 chemotherapy program in an enlarged non-high risk group of children and adolescents with non-B-cell acute lymphoblastic leukemia: the Israel National Study report. Cancer. 2000 Jan 1;88(1):205-16.
- ↑ Savino AM, Fernandes SI, Olivares O, et al. Metabolic adaptation of acute lymphoblastic leukemia to the central nervous system microenvironment is dependent on Stearoyl CoA desaturase. Nat Cancer. 2020 Oct;1(10):998-1009. Epub 2020 Sep 28.
- ↑ Schmiegelow K, Attarbaschi A, Barzilai S, et al. Consensus definitions of 14 severe acute toxic effects for childhood lymphoblastic leukaemia treatment: a Delphi consensus. Lancet Oncol. 2016 Jun;17(6):e231-e9.
- ↑ Elitzur S, Arad-Cohen N, Barg A, et al. Mucormycosis in children with haematological malignancies is a salvageable disease: a report from the Israeli Study Group of Childhood Leukemia. Br J Haematol. 2020 Apr;189(2):339-50. Epub 2019 Dec 29.
- ↑ Wolthers BO, Frandsen TL, Baruchel A, et al. Asparaginase-associated pancreatitis in childhood acute lymphoblastic leukaemia: an observational Ponte di Legno Toxicity Working Group study. Lancet Oncol. 2017 Sep;18(9):1238-48. Epub 2017 Jul 20.
- ↑ Barzilai-Birenboim S, Arad-Cohen N, Nirel R, et al. Thrombophilia screening and thromboprophylaxis may benefit specific ethnic subgroups with paediatric acute lymphoblastic leukaemia. Br J Haematol. 2019 Mar;184(6):994-8. Epub 2019 Jan 10.
- ↑ Barzilai-Birenboim S, Nirel R, Arad-Cohen N, et al. Venous thromboembolism and its risk factors in children with acute lymphoblastic leukemia in Israel: a population-based study. Cancers (Basel). 2020 Sep 25;12(10):2759.
המידע שבדף זה נכתב על ידי פרופ' שי יזרעאלי, ד"ר שרה אליצור - המערך ההמטו-אונקולוגי ע"ש פרופ' רנה זייצוב, מרכז שניידר לרפואת ילדים בישראל; הפקולטה לרפואה ע"ש סאקלר, אוניברסיטת תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק