הבדלים בין גרסאות בדף "טיפול אימונולוגי במחלות המטולוגיות ממאירות - Immunological treatment of malignant hematological diseases"
| שורה 1: | שורה 1: | ||
| − | |||
{{מחלה | {{מחלה | ||
|תמונה=Asklepios.3.jpg | |תמונה=Asklepios.3.jpg | ||
|כיתוב תמונה= | |כיתוב תמונה= | ||
|שם עברי=טיפול אימונולוגי במחלות המטולוגיות ממאירות | |שם עברי=טיפול אימונולוגי במחלות המטולוגיות ממאירות | ||
| − | |שם לועזי= | + | |שם לועזי=Immunological treatment of malignant hematological diseases |
|שמות נוספים= | |שמות נוספים= | ||
|ICD-10= | |ICD-10= | ||
גרסה מ־09:06, 2 בנובמבר 2024
| טיפול אימונולוגי במחלות המטולוגיות ממאירות | ||
|---|---|---|
| Immunological treatment of malignant hematological diseases | ||

| ||
| יוצר הערך | ד"ר אורי רוביו | |
מבוא
בשנת 1900 הרצה ד"ר פול ארליך את ההרצאה הקרוניאנית השנתית לחברה המלכותית בלונדון. ההרצאה נקראה "על חיסוניות עם זיקה מיוחדת לחיי התא" (On Immunity with Special Reference to Cell Life)[1]. שם הוא הציג את התיאוריה שלו על שרשרות הצד בתא (Side-Chain theory). כבר אז שיער ארליך כי קיימת אינטראקציה בין רעלנים (טוקסינים) שלהם שייר, שאותו כינה "הפטופור", לשרשרת צדית על פני התא. חלומו המדעי של ארליך היה מציאת "כדורי קסם" (Magic bullets), קרי סנתוז כימיקלים שלהם מבנה משלים למבנים על פני התאים ושעל ידי טיפול בהם ניתן לקבל אפקט טיפולי. ניתן רק לשער את שמחתו הרבה כאשר באותה שנה בה הרצה גילו שני עמיתיו במכון על שם רוברט קוך בברלין, קיטאסאטו ופון ברינג, את הימצאותם של מרכיבים אימוניים בדם - אנטיטוקסינים, שלימים התברר כי הם הנוגדנים. גם למעלה ממאה שנה לאחר מכן, עדיין ניתן לחוש בהרצאה זו את הדמיון הרומנטי וחזון הרוח יוצאי הדופן שהביאו לטביעת המושג חיסוניות ויסוד האימונולוגיה המודרנית.
מאמר זה מתייחס לשלושה פיתוחים טיפוליים שהם פועל יוצא של המחקר והבנת מערכת החיסון:
- הפיתוח הראשון, ממש בהתאם לחזון של "כדורי הקסם", הוא ייצור מלאכותי של נוגדנים ספציפיים מונוקלונליים (חד-שבטיים) המכוונים נגד אנטיגן מסוים על פני התאים הסרטניים. Rituximab (Mabthera), המכוון נגד CD20 מהווה אב-טיפוס של תכשירים אלו
- הפיתוח השני, שאת הבסיס לו הניח ד"ר סטיבן רוזנברג מהמכונים הלאומיים לבריאות בארצות הברית (NIH - National Institutes of Health), הוא טיפול בעירוי תאי T נגד סרטן (Adoptive T-cell therapy). שיטה זו התפתחה מאוד, ולמעשה עירוי תאי T עם קולטנים כימריים נגד אנטיגנים ספציפיים (Chimeric Antigen Receptors, CAR-T cells) מהווה את הפיתוח המתקדם ביותר
- הפיתוח השלישי מבוסס על הבנה עמוקה של מערכת החיסון ותפקודה, שהביאה לפיתוח תכשירים הפועלים בנקודות ביקורת אימוניות (Immune checkpoints) וכך מסירים עיכוב על פעילות תאי T ומשפעלים אותם נגד תאים סרטניים
נוגדנים מונוקלונליים בהמטולוגיה
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – Monoclonal antibodies
שימוש בנוגדנים נגד תאי סרטן, ובמיוחד נגד לימפומה שאינה הודג'קין (Non-Hodgkin’s Lymphoma - NHL), היוו פריצת דרך באימונותרפיה.
Rituximab הוא הראשון בשורת נוגדנים מלאכותיים שאושרו על ידי רשות המזון והתרופות האמריקנית (FDA - Food and Drug Administration) לשימוש בטיפול בסרטן[2]. הימצאות הקולטן CD20 על פני רוב תאי NHL-B, והעובדה שמולקולה זו אינה עוברת אינטרנליזציה או נושרת הפכו אותה למטרה מצוינת. הנוגדן הוא כימרי, כלומר חלק ה-FC הומני וחלק ה-AB עכברי נגד CD20.
על אף הניסיון הרב שנצבר, מנגנון הפעולה המלא עדיין אינו ברור. מחקרים הראו כי האפקט האנטי-סרטני של התרופה כולל השראת אפופטוזיס ישירות, ADCC (Antibody Dependent Cellular Cytotoxicity), עצירת מחזור חלוקת התא, סנסיטיזציה לתרופות ציטוטוקסיות ו-CMC (Complement Mediated Cytotoxicity)[3].
מנגנון נוסף שתואר הוא אימונוסנסיטיזיציה. קישור Rituximab ל-CD20, מעכב פעילות NFKB ו-YY1, ירידה בעיכוב של YY1 על ביטוי FAS ו-DR5 מביא בסופו של דבר לביטוי מוגבר של קולטני מוות אלה על קרום התאים וחשיפתם לאפופטוזיס דרך FAS/TRAIL על ידי תאים אפקטוריים של מערכת החיסון המבטאים את הליגנד FAS/TRAIL[4].
אימונותרפיה עם הנוגדן, ובמיוחד עם משלבים כימותרפיים למחלות לימפופרוליפרטיביות של תאי B, הראתה תוצאות מרשימות. במעקב של חמש שנים (חציון מעקב 63 חודשים) אחר חולים במחקר פאזה 2 הראשון של ווס וחבריו, נמצא כי טיפול בRituximab עם משלב CHOP (Cyclophosphamide, Doxorubicin, Hydrochloride, Vincristine, Prednisone) ללימפומות אגרסיביות NHL-B נותן תגובה טובה יותר הן במדדי PFS (82 אחוזים) והן במדדי OS (88 אחוזים)[5].
Rituximab משמש ברוב הפרוטוקולים למחלות לימפופרוליפרטיביות מסוג B עם תוצאות טובות מאוד, והביא לפיתוחה של שורה ארוכה של נוגדנים מונוקלונליים נוספים נגד CD20 וכן מטרות נוספות כמו CD22.
אפקט ייחודי אחר של שימוש בנוגדנים מונוקלונליים ניתן להדגים עם Elotuzumab (Empliciti) המשמש בטיפול במיאלומה נפוצה. זהו נוגדן מונוקלונלי ממקור הומני מלא הספציפי נגד SLAMF7 (Signaling Lymphocytic Activation Molecule-F7). SLAMF7 מבוטא הן על תאי NK (Natural Killers) והן על תאי מיאלומה. הנוגדן נקשר לתאי NK ומשפעלם, ובמקביל נקשר גם לתאי המיאלומה וכך חושף אותם ל-ADCC המתווך על ידי אותם תאי NK[6] (איור 1).
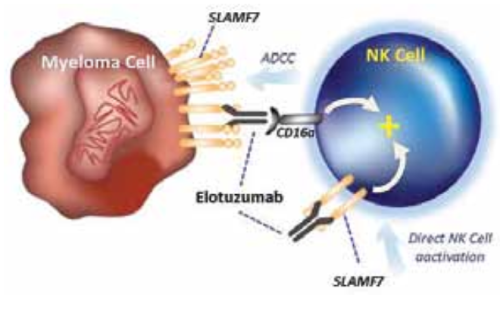
מחקר פאזה 1–2 כבר הראה שטיפול במשלב Elotuzumab עם Lenalidomide (Revlimid) ו-Dexamethasone בחולי מיאלומה נפוצה רפרקטוריים לטיפולים קודמים, הביא לנסיגה של כ-30 אחוזים בסיכון להתקדמות המחלה או למוות[7][8].
Daratumumab (Darzalex) הוא נוגדן מונוקלונלי נוסף לטיפול במיאלומה נפוצה המכוון נגד CD38 על פני תאי הפלזמה. נוגדן זה הראה תוצאות מצוינות הן כמונותרפיה והן בשילובים עם תרופות נוספות, ובמיוחד בחולים שטופלו במספר רב של קווי טיפול ופיתחו עמידות[8][9].
טיפול בעירוי תאי T
עירוי תאי T אוטולוגיים ספציפיים לגידול מהווה את אחת התשתיות הטיפוליות היעילות ביותר ובעלות הפוטנציאל להשיג את המטרה העליונה בטיפול בסרטן, והיא ריפוי החולה. העיקרון העומד מאחורי שיטה זו הוא שניתן לרתום את יכולתם הציטוטוקסית של תאי T במערכת החיסון, ועל ידי מניפולציה שלהם לכוונם נגד תאי הגידול. את הבסיס לשיטה זו הניח ד"ר סטיבן רוזנברג בטיפול במלנומה של העור. הוא מיצה תאי T שהסנינו רקמת גידול מלנומה שהוסרה בניתוח מהחולה (Tumor Infiltrating Lymphocytes, TILs). רוזנברג שיער כי תאי T אלו הם התאים שתקפו את הגידול והם ספציפיים לאנטיגנים מסוימים בו, ואם כך הרי שריבוי תאים אלו ושפעולם עשוי לחסל את הגידול וכן תאים גרורתיים. התאים המעטים יחסית שמוצו מהגידול טופלו ועברו השראה לחלוקה עם אינטרלוקין 2 ואז הוחזרו בעירוי לחולה. טיפול זה הראה תוצאות טובות עם נסיגה חלקית ולעיתים אף שלמה של מלנומה גרורתית בחולים[10].
בתחילת שנות ה-90 של המאה ה-20, החל ד"ר זליג אשחר במעבדתו של רוזנברג בניסויים בבעלי חיים ובהמשך הם התקדמו לניסויים קליניים בבני אדם, עם פיתוח נוסף של טכנולוגיית תאי ה-T אשחר פיתח קולטנים כימריים נגד אנטיגנים ספציפיים (Chimeric antigen receptors, CAR-T cells).
ה-CAR הוא למעשה חלבון איחוי המשלב שרשרת בודדת של נוגדן נגד אנטיגן מסוים מחובר לחלבון קוסטימולטורי המאותת לשפעול תאי T. התהליך מתבצע על ידי בידוד תאי T של החולה, מניפולציה על אותם תאים והחדרת הרצפטור הכימרי נגד האנטיגן הרצוי, ריבוי אותם תאים ועירוים חזרה לחולה.
ניסויים קליניים בפאזה מוקדמת הראו יכולת יוצאת מן הכלל של אותם תאי T שעברו מניפולציה של CAR לחסל תאי B של מחלות לימפופרוליפרטיביות. רוב תאי ה-B הממאירים מבטאים CD19, וייצור CAR-T נגד CD19 שימש באותם ניסויים ראשונים. הניסוי הראשון דווח ב-2010 לאחר שחולה עם לימפומה במצב מתקדם טופל והשיג נסיגה חלקית של מחלתו והיעלמות תאי B נורמליים לטווח ארוך. חולים נוספים עם ממאירויות שונות של תאי B (כולל לוקמיה לימפוציטית כרונית ואקוטית) שטופלו בשיטה זו השיגו הפוגה ממושכת. טיפול זה כרוך בתופעות לוואי חריפות, ובעיקר עלייה חדה של ציטוקינים דלקתיים בסרום החולה. פרוטוקולים מתקדמים יותר של טיפול ב-CAR-T משלבים גם נוגדן לאינטרלוקין 6 על מנת לווסת תגובה דלקתית עודפת זו[11].
אין ספק כי טכנולוגיה זו מציגה תוצאות מרשימות בטיפול במחלות שלא היה להן פתרון, ולמעשה מבחינות רבות ה-CAR-T הם "כדורי הקסם" העתידיים בטיפול בממאירויות המטולוגיות ונראה שגם בגידולים סולידיים אחרים.
התערבות בנקודות ביקורת של מערכת החיסון
העיקרון שעמד במרכז שני הפיתוחים שהוזכרו לעיל הוא ייצור נוגדן או תא T "מהונדס" שיתקוף אנטיגן על פני תא ממאיר ויחסלו. העיקרון שעומד בפיתוח השלישי של טיפולים אימונולוגיים הוא שונה. מבחינה פיזיולוגית שפעול תאי T מווסת ומבוקר בנקודות צומת אימוניות. נקודות אלו נועדו למנוע פעילות יתר של תאי T העלולה לפגוע ברקמה בריאה ובמאחסן. הפיתוח השלישי בטיפולים אימונולוגיים מבוסס על התערבות בנקודות הביקורת ושפעולם מחדש של התאים האפקטוריים של מערכת החיסון נגד התאים הממאירים.
גידולים סולידיים וממאירויות לימפואידיות מפתחים שלל מנגנוני חמיקה ממערכת החיסון של המאכסן. אחד ממנגנוני החמיקה של הגידול פועל על ידי השפעה בדיוק על אותן נקודות ביקורת. נקודת ביקורת אחת חשובה היא PD-1 (Programmed cell death 1-protein) והליגנד שלו PD-L1. חלבון זה מעכב פעילות תאי T ישירות באינטראקציה שלהם עם תאי המטרה ומונע שפעולם. גידולים רבים יודעים לבטא את הליגנד של 1-PD וכך להיקשר ל־1-PD על גבי תאי T ולעכבם ובמקרים אחרים לבטא 1-PD עם תוצאה דומה.
נוגדנים נגד 1-PD או PD-L1, נמצאים בפיתוח ובניסויים קליניים בפאזות שונות, הן בממאירויות סולידיות והן בממאירויות המטולוגית כמו B-HLN, HL, וגם במיאלומה נפוצה. נוגדנים אלו מעכבים פעילות 1-PD או מונעים קישור הליגנד וכך למעשה מסירים את העיכוב מתאי ה-T וכן מתאי NK ומשפעלים אותם לתקיפת התאים הממאירים והשמדתם (איור 2).
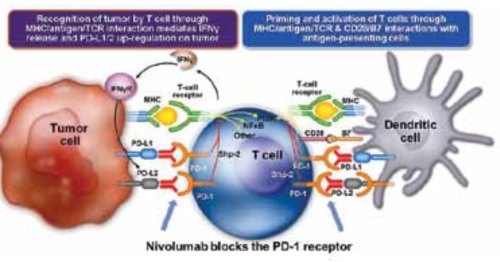
(CD28/B7 = cluster of differentiation 28/B7
IFNg = interferon-gamma
IFNgR = IFNg receptor
MHC = major histocompatibility complex
NFgB = nuclear factor kappa B
PD-1 = programmed cell death 1
PI3K = phosphoinositide-3 kinase
Shp-2 = ubiquitously expressed tyrosine-specific protein phosphatase
PD-L1 = programmed cell death ligand-1
TCR = T-cell receptor.
Adapted from Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012 Mar 22;12(4):252-64.
ברגר וחבריו פרסמו ב-2008 את מחקר הפאזה הראשון שבדק את התכשיר Pidilizumab (011-CT). Pidilizumab הוא נוגדן הומני מלא נגד 1-PD, שניתן ל-17 חולים עם ממאירויות המטולוגיות שונות. מחקר זה הדגים בטיחות התכשיר, והושגה בו תגובה ב-33 אחוזים מהחולים[12]. מחקרים נוספים עם תכשיר זה ועם נוגדנים נוספים דומים הראו תוצאות שונות של הצלחה.
מחקר שפורסם על ידי אנסל וחבריו תיאר טיפול ב-Nivolumab - נוגדן הומני מלא נגד 1-PD 23 חולי לימפומה מסוג הודג'קין, מחלה עמידה לקווי טיפול קודמים רבים, טופלו בנוגדן. התוצאות הראו תגובה של 87 אחוזים מתוכם, 17 אחוזים עם הפוגה מלאה ו-70 אחוזים עם תגובה חלקית[13].
סיכום
טיפולים אימונולוגיים ("אימונותרפיה") בממאירויות המטולוגיות מהווים את חזית המלחמה בסרטן. הפיתוחים שתוארו לעיל מהווים יישום ישיר של ידע רב שהצטבר על תפקוד מערכת החיסון וגם על חוסר תפקודה כתוצאה מעיכוב המושרה על ידי תאי הגידול. ההתפתחות הטכנולוגית בתרביות תאים, היברידומות (יכולת לייצר נוגדנים מונוקלונליים), ביולוגיה מולקולרית ואימונולוגיה - כל אלה אפשרו לייצר "כדורי קסם", כפי שחזה אותם בצורתם הפשוטה ד"ר פול ארליך לפני יותר ממאה שנה.
מניפולציה של מערכת החיסון ושפעולה ושימוש ב"טילים מונחים" פוטנטיים נגד תאי הגידול, יאפשרו לבסוף להגיע להכחדה מלאה של תאי הגידול וליעד הנכסף של ריפוי החולה.
ציטוט מסכם מהרצאתו הקרוניאינית של ד"ר פול ארליך (בתרגום חופשי מאנגלית):
"אני תקווה שחיסונים כפי שתיארתי, שהם בעלי עניין תאורטי רב, יהיו זמינים לטיפול קליני בגידולים אפיתליאליים חדשים ובעיקר קרצינומה באמצעות סרום אנטי-אפיתליאלי ספציפי... אני סמוך ובטוח, נכבדיי, כי יותר לא נמצא עצמנו אבודים בים הפתוח והרחב, וכי כבר עתה קיבלנו הצצה חטופה על היבשה שאנו מקווים, לא, שאנו מצפים, תוליד אוצרות עצומים לידע הביולוגיה ולטיפול בחולים."[1]
ביבליוגרפיה
- ↑ 1.0 1.1 Erlich P. On immunity with special reference to cell life. [Croonian Lecture]. Proc R Soc Lond. 1899 Jan 1;66:424-48.
- ↑ Leget GA, Czuczman MS. Use of rituximab, the new FDA-approved antibody. Curr Opin Oncol. 1998 Nov;10(6):548-51.
- ↑ Maloney DG. Anti-CD20 antibody therapy for B-cell lymphomas. N Engl J Med. 2012 May 24;366(21):2008-16.
- ↑ Vega MI, Huerta Yepez S, Martinez-Paniaqua M, et al. Rituximab-mediated cell signaling and chemo/ immuno-sensitization of drug-resistant B-NHL is independent of its Fc functions. Clin Cancer Res. 2009 Nov 1;15(21):6582-94.
- ↑ Vose JM, Link BK, Grossbard ML, et al. Long-term update of a phase II study of rituximab in combination with CHOP chemotherapy in patients with previously untreated, aggressive non-Hodgkin's lymphoma. Leuk Lymphoma. 2005 Nov;46(11):1569-73.
- ↑ 6.0 6.1 Balasa B, Yun R, Belmar NA, et al. Elotuzumab enhances natural killer cell activation and myeloma cell killing through interleukin-2 and TNF- a pathways. Cancer Immunol Immunother. 2015 Jan;64(1):61-73.
- ↑ Lonial S, Dimopoulos M, Palumbo A, et al. Elotuzumab therapy for relapsed or refractory multiple myeloma. N Engl J Med. 2015 Aug 13;373(7):621-31.
- ↑ 8.0 8.1 van de Donk NW, Moreau P, Plesner P, et al. Clinical efficacy and management of monoclonal antibodies targeting CD38 and SLAMF7 in multiple myeloma. Blood. 2016 Feb 11;127(6):681-95.
- ↑ Lokhorst HM, Plesner T, Laubach JP, et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med. 2015 Sep 24;373(13):1207-19.
- ↑ Hinrichs CS, Rosenberg SA. Exploiting the curative potential of adoptive T-cell therapy for cancer. Immunol Rev. 2014 Jan;257(1):56-71.
- ↑ Kochenderfer JN, Rosenberg SA. Treating B-cell cancer with T cells expressing anti-CD19 chimeric antigen receptors. Nat Rev Clin Oncol. 2013 May;10(5):267-76.
- ↑ Berger R, Rotem-Yehudar R, Slama G, et al. Phase I safety and pharmacokinetic study of CT-011, a humanized antibody interacting with PD-1, in patients with advanced hematologic malignancies. Clin Cancer Res. 2008 May 15;14(10):3044-51.
- ↑ Ansell SM, Lesokhin AM, Borrello I, et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin’s lymphoma. N Engl J Med. 2015 Jan 22;372(4):311-9.
המידע שבדף זה נכתב על ידי ד"ר אורי רוביו - המכון ההמטולוגי, מרכז רפואי אוניברסיטאי סורוקה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק