גורם ההתמיינות לגדילה 15- Growth differention factor 15
| מדריך בדיקות מעבדה | |
| גורם ההתמיינות לגדילה 15 | |
|---|---|
| Growth differention factor 15 | |
| שמות אחרים | MIC-1 או macrophage inhibitory cytokine-1, PDF או prostate derived factor, NAG-1, PTGFβ, NRG-1. |
| מעבדה | כימיה-גנטיקה בדם |
| תחום | מחלות מיטוכונדריאליות, סרטניות וקרדיו-וסקולאריות |
| טווח ערכים תקין | בגיל של 3 חודשים ומעלה, רמת GDF-15 נמוכה מ-750 פיקוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
GDF-15 עשוי לשמש סמן ביולוגי למחלות מיופתיה מיטוכונדריאליות כמו גם למפגעים אחרים, כמפורט להלן: מחלת Alpers, מחלת Leigh, חמצת לקטית, ציטופתיה מיטוכונדריאלית, חסר פירובט קרבוקסילאז, תסמונת Pearson, מוטציות POLG, תסמונת Barth (3-Methylglutaconic Aciduria, Type II), תסמונת אטקסיה נירופתית (ANS), אנצפלופתיה מיטוכונדריאלית, חסר פירובט דהידרוגנאז, פגמים בשרשרת הנשימה, חסר DNA מיטוכונדריאלי, תסמונת Kearns-Sayre, חסר Coenzyme Q10, חסר Cytochrome C Oxidase, חסרים של קומפלקסים I, II, III, IV ו-V, Chronic Progressive External Ophthalmoplegia או CPEO, Myoclonic Epilepsy with Ragged-Red Fibers או MERRF, Mitochondrial Recessive Ataxia Syndrome או MIRAS, Spinocerebellar Ataxia with Epilepsy או SCAE, Sensory Ataxia, Neuropathy Dysarthria, Ophthalmoplegia או SANDO, Neuropathy, Ataxia Retinitis Pigmentosa או NARP, Mitochondrial Neurogastrointestinal Encephalopathy או ,MNGIE Mitochondrial encephalomyopathy lactic acidosis, and stroke-like episodes או MELAS, Myoclonic Epilepsy ,Myopathy ,Sensory Ataxia או MEMSA ו- Leber's Hereditary Optic Neuropathy או LHON.
מבנה ותכונות של GDF-15
הגן האנושי של GDF-15 ממוקם על הזרוע הקצרה של כרומוזום 19p13.1–13.2 כפי שנקבע על ידי in situ hybridization. באדם ובמכרסמים הגן ל-GDF-15 מורכב מ-2 אקסונים ומ-intron יחיד. החלבון הבשל שמשקלו המולקולרי הוא 34,140 דלטון, מכיל 7 שיירי ציסטאין משומרים היוצרים "לולאת ציסטאין". בדומה לחברים אחרים במשפחת העל של TGF-β, האורך המלא של GDF-15 הוא קטע של pre-pro-domain, והחלבון הבשל נוצר לאחר ביקוע של האתר דמוי-furin. הרצף של חומצות האמינו בין מינים שונים נמוך יחסית עם 70% דמיון, שהוא הנמוך ביותר בתוך משפחת TGF-β.
חלבון זה זוהה לראשונה כ- macrophage inhibitory cytokine-1 או MIC-1 (Bootcov וחב' ב- Proc Natl Acad Sci USA משנת 1997). מדובר בחלבון שהוא חבר בתת-המשפחה של TGF-β. בתנאים נורמליים, GDF15 בא לביטוי בריכוזים נמוכים ברוב האיברים, והוא משתדרג בעקבות פציעה של הכבד, כליות, לב וריאות (Zimmers וחב' ב-Shock משנת 2005, Hsiao וחב' ב- Mol Cell Biol משנת 2000 ו-Ago ו-Sadoshima ב-Circ Res משנת 2006). התפקיד של GDF15 אינו מובהר לחלוטין, אך נראה שהוא מווסת מסלולים דלקתיים ומעורב בוויסות של אפופטוזיס, תיקון תאים ושגשוגם, במפגעים קרדיו-וסקולרים וסרטניים (Wollert וחב' ב-Circulation משנת 2007, ו-Kempf וחב' ב-Res משנת 2006). נמצא ש-GDF15 הוא חלבון פרוגנוסטי חזק במטופלים עם מחלות לב ומחלות סרטניות (Wallentin וחב' ב-PLos One משנת 2013).
Growth/differentiation factor-15 (להלן GDF-15) מבוטא באופן נרחב ברקמות רבות ביונקים. הביטוי שלו מווסת ומושרה לרוב בתגובה למצבים הכרוכים עם עקה תאית. רמות GDF-15 בנסיוב כרוכות עם מחלות רבות, כולל מצבי דלקת, ממאירות, מחלות קרדיו-וסקולריות והשמנת יתר, ורמות אלו משמשות פוטנציאלית בתור מנבא אמין של התפתחות המחלה. תפקיד פונקציונאלי עבור GDF-15 הוצע במפגעים סרטניים, מחלות קרדיו-וסקולריות, מחלות כליה ומחלות מטבוליות. עם זאת, ידע של ממש על התפקוד הפתו-פיזיולוגי של GDF-15 ברמה המולקולרית עדיין מוגבל. הזיהוי של קולטן אנדוגני של GDF-15, עשוי לספק הבנה נוספת על המנגנונים המולקולריים של החלבון האמור, והקשר שלו למצבי מחלה.
הערכה של סמנים חדשים במקרה של MELAS
במחקר של Matsui וחב' ב-Neuromusc Disorders משנת 2017, נבחנה היעילות של FGF-21 ושל GDF-15 על מנת לאשר את היעילות של טיפולים ב-L-arginine ושל סודיום פירובט במטופלת בת 60 שנה עם אנצפלופתיה מיטוכונדריאלית, חמצת לקטית ואפיזודות דמויות שבץ (תסמונת MELAS). המטופלת הייתה עם מוטציה mtT3271C, שפתולוגית השרירים שלה וממצאי מעבדה תאמו את תסמונת MELAS. היא טופלה עם L-arginine וסודיום פירובט, אך מצבה החמיר והיא נפטרה לאחר שנתיים. שני הסמנים שהוזכרו, הראו ערכים גבוהים, שהלכו וגדלו עם החמרת מהלך המחלה. הטיפולים עם ארגינין וסודיום פירובט שהביאו למיתון זמני בדרגת תסמיני המחלה, היו כרוכים בערכים נמוכים יותר של FGF-21 ושל GDF-15.
GDF-15, הידוע גם כ-MIC-1, NAG-1, PLAB ו-PTGFβ, התגלה בשנות ה-90 (Bootcov וחב' ב-Proc Natl Acad Sci USA משנת 1997, Hromas וחב' ב-Biochim Biophys Acta משנת 1997 ו-Lawton וחב' ב-Gene מנת 1997). במהלך המאמץ לזהות גנים המבוטאים בהקשר של שפעול מקרופאגים, נעשה שימוש בשורת תאים מונוציטואידים הידועה כ-U937, נסקרה ספריית cDNA של תאים אלה שטופלו או שלא טופלו עם phorbol 12 myristate 13-acetate או PMA. בתהליך זה זוהה MIC-1 כגן חדש המקודד לחלבון המכיל מאפיינים מבניים הדומים ל-TGF-β. הביטוי של mRNA של MIC-1 במקרופאגים, הוגבר על ידי מגוון של גירויים כגון אלה של IL1β, TNF-α, IL2 ו- macrophage colony-stimulating factor או M-CSF. גישה דומה שימשה לזיהוי של גנים המווסתים על ידי מעכבים של cyclooxygenase. ספריית cDNA נבנתה משורת תאים של המעי הגס באדם הידועה כ-HCT-116, שטופלו עם NSAIDs. הגן NAG-1 המשופעל על ידי NSAID, זוהה מספריה זו ונמצא מכיל רצף זהה ל-MIC-1 (Baek וחב' ב-Mol Pharmacol משנת 2001). בשני ניסיונות נפרדים נוספים לזהות חברים חדשים של משפחת העל TGF-β, וחלבונים מורפוגנטיים של העצם (BMPs) הנמצאים בשליה באופן מועשר, שובט אותו גן ונקרא PLAB או placental bone morphogenetic protein, וכן PTGFβ או Placental Transforming Growth Factor β. GDF15 זוהה על ידי סריקה של database של חומר שלייתי מאדם, מכיל motif של "לולאה ציסטינית" השכיחה בחברים אחרים של משפחת העל TGF-β (Bottner וחב' ב-Gene משנת 1999).
מחקרים אחדים מצאו רמות מוגברות של GDF-15 בנסיוב של סוגי סרטן רבים (Welsh וחב' ב-Proc Natl Acad Sci USA משנת 2003, וכן Welsh וחב' ב-Oncogene משנת 2002).
GDF-15 כרוך עם מחלות רבות ובטבלה מסוכמים התפקודים הפנוטיפיים שלו:
GDF-15 כסמן
כיוון שריכוז החלבון GDF-15 יכול להיקבע בקלות בצירקולציה, מחקרים רבים זיהו את GDF-15 כסמן חשוב בפלזמה הכרוך במספר מחלות. GDF-15 נכרך עם מחלות קרדיו-וסקולריות, מחלת עורקים כליליים, ופרפור פרוזדורי. רמות מוגברות של GDF-15 בצירקולציה נמצאות בסוכרת, סרטן, פגיעה קוגניטיבית ובמצב של cachexia (Adela ו-Banerjee ב-J Diabetes Res משנת 2015, Tsai וחב' ב- Int J Obes משנת 2016 ו-Wollert וחב' ב-Chem Clin משנת 2017). במחקר של נשים בריאות בבסיסו, רמות הבסיס של GDF-15 נקבעו ב-257 משתתפות שפיתחו במהלך המעקב של 4 שנים אוטם שריר לב, שבץ מוחי, או שנפטרו מאירוע קרדיו-וסקולרי, וכן בקבוצת ביקורת של 257 נשים שלא דיווחו על כל אירוע בריאותי משמעותי. בנשים שפיתחו אירוע קרדיו-וסקולרי נמצאו רמות GDF-15 מוגברות פי 2.7 מאשר בקבוצת הביקורת.
ההשפעה הייתה בלתי תלויה בגורמי סיכון קרדיו-וסקולריים מסורתיים כגון C-reactive protein (על פי Brown וחב' ב-Lancet משנת 2002). מחקר נוסף בחן את רמות GDF-15 ב-14,577 מטופלים עם מחלת לב כלילית יציבה ומצא שרמות GDF-15 היו כרוכות במוות מסיבה קרדיו-וסקולרית, במוות פתאומי, במוות מאי-ספיקת לב, ובאשפוז מסיבה של כשל לבבי (Hagstrom וחב' ב-Clin Chem משנת 2017). הקשר בין GDF-15 לתוצאים קרדיו-וסקולריים נלמד גם כחלק ממחקר הלב של Framingham (בו נכללו 3,248 משתתפים, בגיל ממוצע של 59 שנים, עם 53% נשים). GDF-15 נכרך בתמותה מכל-סיבה, באי-ספיקת לב, ובאירועים קרדיו-וסקולריים משמעותיים (Wang וחב' ב-Circulation משנת 2012). הקשר בין GDF-15 לבין מוות מכל-סיבה, נחקר גם ב-1,391 משתתפי מחקר Rancho Bernardo (גיל ממוצע של 70 שנה, ללא היסטוריה של מחלה קרדיו-וסקולרית), שהיו במעקב במשך 11 שנה. נמצא במחקר האחרון ש-GDF-15 היה מנבא חזק של תמותה מסיבה כלשהי, או מתמותה שאינה מסיבה קרדיו-וסקולרית (Daniels וחב' ב-Circulation משנת 2011).
Brown וחב' ב-Clin Cancer Res משנת 2003, מדדו רמות GDF-15 בדגימות נסיוב של 260 תורמי דם בריאים, ו-193 מטופלים עם פוליפים אדנומטיים או עם קרצינומה של המעי הגס והחלחולת. נמצאה עליה פרוגרסיבית ברמות GDF-15 באלה עם פוליפים אדנומטיים או באלה עם קרצינומה של המעי הגס. רמות GDF-15 היו גם במתאם עם שלב המחלה הגרורתית לבלוטות הלימפה. במחקר רטרוספקטיבי, רמות GDF-15 בנסיוב נקבעו ב-70 דגימות של חולים עם סרטן הערמונית, ובאלה עם תוצאות ביופסיה שליליות. רמות GDF-15 נמצאו מוגברות בחולים עם סרטן הערמונית, ותאמו את שלב המחלה (Li וחב' ב-PLos One משנת 2015).
GDF-15 בתגובה למצבי עקה
mRNA של GDF-15 הוא בעל תפוצה רחבה ברקמות רבות. הוא מבוטא מאוד בשלייה ובערמונית, אך ניתן גם למצוא אותו בלב, בבלוטת הלבלב, בכבד, בכליות, במעיים (בעיקר במעי הגס), ובריאות (Yokoyama-Kobayashi וחב' ב-J Biochem משנת 1997, Bottner וחב' ב-J Cachexia Sarcopenia Muscle משנת 2016, Tan וחב' ב-Proc Natl Acad Sci USA משנת 2000, ו-Koopmann וחב' ב-Clin Cancer Res משנת 2004). החלבון GDF-15 נוצר כחלבון באורך מלא של 35,000 דלטון. לאחר שהקצה ה-N טרמינלי מבוקע, החלבון הבשל מופרש כדימר בגודל של 25,000 דלטון בו שני המונומרים מחוברים בקשר דיסולפידי.
מחקרים הראו ש-GDF-15 הוא כעין ציטוקין המושרה על ידי עקה, בתגובה לפציעה רקמתית. לדוגמה Hsiao וחב' ב-Mol Cell Buol משנת 2000, הראו שהביטוי של GDF-15 בכבד, גדל משמעותית ובמהירות על ידי הזקת כימיקלים הידועים כגורמי נזק להפאטוציטים כגון כלורופורם. מעבר לפציעה כימית, חוקרים אלה הראו שהביטוי הכבדי של GDF-15 mRNA הושרה לאחר קטיעה חלקית של אונת כבד. הביטוי של GDF-15 יכול לגדול גם כתוצאה מנזק לתאי האפיתל של כיס המרה. כמו כן, פגיעה כימית בצינור המרה המושרית על ידי DAPM או methylenedianiline הביאה לעלייה בביטוי של GDF-15 mRNA.
היברידיזציה in situ אישרה ש-GDF-15 mRNA מושרה בהפאטוציטים, אך לא באזורי צינור המרה, שהוא אזור הנזק העיקרי הנגרם על ידי DAPM. עם זאת, למרות ההשריה הדרמטית לאחר נזק כבדי, לא נראה ש-GDF-15 משחק תפקיד משמעותי בפציעה כבדית, או ברגנרציה של פציעה זו. אכן, עכברים משוללי GDF-15 מתקנים את הנזק הכבדי שלהם באותו קצב של עכברי wild type, לאחר ניתוח הרחקה של חלק מהכבד.
Zimmers וחב' ב-Shock משנת 2005, חקרו את הרגולציה של GDF-15 במודלים של עכברים עם פציעה כלייתית או ריאתית. לאחר הזרקת כלורופורם, התגלתה בשיטת Western blotting עלייה בביטוי של GDF-15 בכליות ובריאות. בחמש מתוך שש הסרות ניתוחיות של הכליה, או במודלים של איסכמיה וזילוח מחדש, התגלתה עליה בביטוי של GDF-15 mRNA, בשיטת אנליזה של northern blotting. חוקרים אלה פיתחו גם 2 מודלים של פציעה ריאתית, על ידי החדרה של bleomycin לעכברים מבוגרים, או חשיפה היפראוקסית ממושכת בעכברים שזה עתה נולדו. בשני מודלים אלה נמצאה השרייה בולטת של GDF-15 mRNA.
הביטוי של GDF-15 עלה במהירות בתגובה לפציעה קרדיו-וסקולרית. לדוגמה, במודל עכברים בו ביטוי מוגבר של MEF2C או myocyte enhance factor 2C הגורם לקרדיומיופתיה נרחבת ולהחלשת שריר הלב, נמצא ש-GDF-15 mRNA הושרה משמעותית בלב הקרדיומיופתי בעכברים מבוגרים. במודל של איסכמיה, על ידי ליגציה קבועה של עורק כלילי בעכברים, נמצאה עליה מהירה של GDF-15 mRNA באזור האיסכמי.
GDF-15 וסרטן
רמות מוגברות של GDF-15 בנסיוב נכרכו עם סוגי סרטן רבים. מספר מחקרים הראו שביטוי מוגבר של GDF15 mRNA ושל החלבון עצמו, בדגימות ביופסיה מגידולים סרטניים (Welsh וחב' ב-Proc Natl Acad Sci USA משנת 2003, ו-Welsh וחב' ב-Cancer Res משנת 2001 מחקר שהתייחס ספציפית לסרטן הערמונית). עם זאת, מחקרים תפקודיים של תפקיד GDF-15 בסרטן מוגבלים במספרם. יש נתונים אחדים ש-GDF-15 הוא בעל פעילות מדכאת סרטן, אך מחקרים אחרים שוללים זאת.
פעילות מדכאת סרטן של GDF-15
כדי לאשש את השפעת GDF-15 על שגשוג תאים סרטניים, הוזרקו תאי MCF-7 המבטאים GDF-15 ביתר לתוך בלוטות החלב של עכברי nude במודל אורתוטופי של סרטן. ביטוי-יתר של NAG-1 נמצא מפחית את גודלו של גידול אורתוטופי בערך ב-50% (Martinez וחב' ב- J Pharmacol Exp Ther משנת 2006). במחקר אחר, תאי PC-3 שעברו טרנספקציה עם וקטור ריק, או כאלה שעברו טרנספקציה על ידי קונסטרקטים המבטאים ביתר GDF-15, הוזרקו מתחת לעורם אל הבטן של חולדות חסרות טימוס. גידולים שנוצרו על ידי הזרקת תאי PC-3 שעברו טרנספקציה עם וקטור ריק גדלו במהירות, ואילו גידולים שנוצרו על ידי הזרקת תאי PC-3 שעברו טרנספקציה עם GDF-15, גדלו בקצב איטי בהרבה (Lambert וחב' ב- J Cell Physiol משנת 2006). זאת ועוד, שורת התאים LN-Z308 המבטאים בעודף את GDF-15, הוזרקו תת-עורית לתוך הכֶּסֶל של חמישה עכברי Swiss nude, ונמצא שהפעילות הטומורוגנית בוטלה לחלוטין (Albertoni וחב' ב-Oncogene משנת 2002).
הפעילות מדכאת הסרטן של GDF-15 נבחנה כמו כן במודל של עכברים טרנסגנים ל-GDF-15, שטופלו עם הקרצינוגן azoxymethane הגורם לגידולים במעי הגס. בהשוואה לעכברים מאותו השגר שאינם טרנסגנים, העכברים הטרנסגנים פיתחו 50% פחות של מוקדים קריפטיים ולא פיתחו כלל גידולים. לאחר הצלבה עם עכברי ApcMin, שהוא מודל עכברים לגידולי מעי, עכברים הטרוזיגוטיים כפולים הראו ירידה של 60% בפוליפים, בהשוואה לעכברי ApcMin מאותו השגר שאינם טרנסגנים (Baek וחב' ב-Gastroenterology משנת 2006). עכברי GDF-15 טרנסגנים הוצלבו עם עכברי TRAMP או Transgenic Adenocarcinoma of Mouse Prostate, שהוא מודל של גידול ערמונית ספונטני. ביטוי-יתר של GDF-15 האריך את ההישרדות והגביל את שגשוג הגידול הסרטני בעכברי TRAMP (Husaini וחב' ב-PLos One משנת 2012). והיפוכו של דבר, איבוד GDF-15 הביא לעידוד שגשוג הגידול. עיכוב של יצירת פוליפים במעיים על ידי sulidac שהוא תכשיר מעכב COX, אבד בעכברי ApcMin החסרים GDF-15 (Zimmers וחב' ב-J Cancer Res Clin Oncol משנת 2010).
פעילות תומכת בטומורוגניות של GDF-15
Boyle וחב' ב- J Invest Dermatol משנת 2009, חקרו את ההשפעה של GDF-15 על השגשוג של גידולים במודל xenograft של עכברים. החוקרים ביצעו טרנספקציה של תאי מלנומה גרורתיים מהסוגים 04D, A2058 ו-C32, או עם ביקורת של shRNA או עם shRNA ספציפי ל-GDF-15. התאים הוזרקו תת-עורית לתוך עכברי nude. התאים שטופלו עם shRNA כביקורת התפתחו במהירות לגידולים נראים לעין, בעוד שחיסול GDF-15 הביא ליצירה מינימלית של גידולים. על מנת להעריך את התפקיד של GDF-15 בסרטן הערמונית, יוצרו תאי PC-3 המבטאים ביתר את GDF-15, והוזרקו לבלוטת הערמונית של עכברי nude חסרי טימוס. בהשוואה לחיות שהוזרקו עם תאי PC-3 שעברו טרנספקציה עם וקטור ריק, לא נמצא הבדל משמעותי בגודלה של השאת.
מספר מחקרים הראו ש-GDF-15 משחק תפקיד חשוב בדיכוי של התפתחות גידולים סרטניים. באותו זמן, הספרות מראה ביטוי-יתר של GDF-15 בגידולים, מה שלכאורה סותר את הפעילות מדכאת הסרטן של GDF-15. סתירה זו יכולה להתרחש בגין הפעילות מדכאת הגידול של GDF-15 בשלבים מוקדמים של התפתחות הגידול, ואילו בהמשך GDF-15 עלול להפוך ל-promoter של התפתחות הגידול לשלביו הממאירים. גם חברים נוספים במשפחת העל של TGFβ, נמצאו מדגימים בדומה השפעות מעודדות ומדכאות של גידולים, בתלות במקור הגידול, בשלב הגידול והקשר התאי שלו כמו הסטאטוס האפיגנטי של הגידול והמווסתים המשועתקים שלו (Matsumura וחב' ב-Genome Res משנת 2011). המנגנון המולקולרי של מסלול האיתות התוך-תאי של GDF-15 ממתין עדיין לפיענוח סופי. יתרה מכך, GDF-15 קיים במספר צורות כאשר גם צורת ה-pro-domain וצורת ה-mature domain שלו יכולות להיות בעלות פעילויות ביולוגיות שונות זו מזו (Bauskin וחב' ב-EMBO J משנת 2000, ו-Cancer Res משנת 2005).
GDF-15 והמערכת הקרדיו-וסקולרית
מספר מחקרים הציעו ש-GDF-15 מספק הגנה ללב. Xu וחב' במחקרם ב-Circ Res משנת 2006, גרמו בתאים קרדיומיוציטיים נאו-נטליים בתרבית לביטוי יתר של GDF-15 על ידי טרנספקציה עם נגיף adeno, וכך הפכו תאים אלה עמידים להיפרטרופיה מושרית על ידי אגוניסטים. יתרה מכך, חוקרים אלה יצרו עכברים טרנסגניים עם GDF-15 הספציפי ללב. עכברים טרנסגניים אלה היו נורמליים, אך הם היו מוגנים בפני היפר-טרופיה לבבית הנגרמת מלחץ עודף. לעומת זאת, עכברים החסרים GDF-15 שנראים גם כן נורמליים, טופלו על ידי ליגציה זמנית שנמשכה שעה אחת של עורק כלילי, ולוותה על ידי זילוח מחדש למשך 24 שעות. גודל השטח בסיכון כתוצאה מהחסימה הכלילית היה דומה לזה של עכברים תקינים מאותו שגר, אך גודל האוטם של שריר הלב לאחר הזילוח מחדש, היה משמעותית גדול יותר בעכברי משוללי GDF-15 (Kempf וחב' ב-Circ Res משנת 2006).
פרט ללב, ההשפעה של GDF-15 על טרשת עורקים נלמדה במספר מחקרים, אך תוצאותיהם סותרות. במחקר אחד, לאחר טיפול של עכברים משוללי קולטנים ל-LDL עם מנה קטלנית של קרינה, העכברים הושתלו עם מח עצם שנלקח מעכברים wild type או מעכברים המשוללים GDF-15, כאשר העכברים המוקרנים קיבלו מזון אתרוגני למשך 24 שעות. למרות שלא נמצא כל הבדל בשטח הטרשת, עכברי knockout ללא קולטן ל-LDL, שהוזרקו עם מח עצם מעכברים המשוללים GDF-15, הראו אגירה מוחשת של מקרופאגים, ומאפיינים של התרופפות רבדים טרשתיים, מה שמרמז לתפקיד הגנתי של GDF-15 בטרשת עורקים מתקדמת, ובמצב של הצטברות מקרופאגים (Preusch וחב' ב-Eur J Med Res משנת 2013). לעומת זאת, מחקר דומה הגיע למסקנה הפוכה. עכברי knockout ללא קולטנים ל-LDL, הושתלו עם עצם של עכברים משוללים GDF-15, ונגרמה ירידה בגודלם של נגעים טרשתיים מוקדמים, לאחר 4 שבועות על דיאטה עשירה בשומן. הרבדים הכילו תסנינים מופחתים של מקרופאגים, ויצירה מופחתת של ליבה נִמְקִית של התהליך הטרשתי (de Jager וחב' ב-J Biochem Mol Biol משנת 2011).
עדות תומכת נוספת על התפקיד ההגנתי שמעניק GDF-15 בהקשר של טרשת עורקים, מגיעה ממחקר שעשה שימוש בעכברים החסרים ApoE כמודל לטרשת עורקים. Johnen וחב' ב-Nat Med משנת 2007, חקרו את ההשפעה של ביטוי-יתר טרנסגני של GDF-15 במקרופאגים. לאחר תקופה של 6 חודשים בה הוזנו במזון עתיר-שומן, עכברים משוללי ApoE המבטאים ביתר GDF-15, היו בעלי נגעים קטנים יותר בסינוס של אבי העורקים, וב-thoracic aorta. גם באבי העורקים הבטני גודלם של הנגעים הטרשתיים היה מוקטן. לעומת זאת, כאשר עכברים משוללי GDF-15, זווגו עם עכברי knockout נטולי ApoE, נמצא שהחסר של GDF-15 גרם להתפתחות של נגעים טרשתיים בקשת אבי העורקים וכן בעורק האלמוני (innominate artery) שהוא עורק קצר המתחיל כענף הגדול הראשון היוצא מקשת אב העורקים, עובר מעלה וימינה, ומסתיים בחלק התחתון של הצוואר, זאת לאחר שעכברים אלה הועברו לדיאטה עתירת-כולסטרול למשך 20 שבועות, מה שמרמז ש-GDF-15 עשוי לעודד התפתחות של נגעים טרשתיים (Bonaterra וחב' ב-J Am Heart Assoc משנת 2012)
לסיכום, למרות ראיות ממחקרים אפידמיולוגים שמראים שרמות GDF-15 בצירקולציה כרוכות בחוזקה עם פרוגנוזה קרדיו-וסקולרית גרועה יותר, התפקיד המדויק של GDF-15 במערכת הקרדיו-וסקולרית עדיין אינו מובן באופן ברור.
GFG-15 משפר את הסיכון באוטם שריר הלב עם מקטע ST מוגבר
שיעורי התמותה במהלך אשפוז או לאורך זמן בקרב אלה עם אוטם שריר לב על רקע עלייה חדה ב- ST-segment (להלן STEMI), מראים הבדלים משמעותיים בין אלה המטופלים באופן פיברינוליטי כפי שהודגם כבר ב-1994 בניסוי ה-Fibrinolytic Therapy Trialists'. הערכת סיכון מוקדם או מתמשך חיוני אם כך להחלטות הטיפוליות. בין גורמי הסיכון לשיעורי תמותה גבוהים יותר נמצא גיל מתקדם של לחץ דם סיסטולי נמוך יותר, קצב לב מוגבר, דרגת סיווג גבוהה ע"ש Killip (Lee וחב' ב-Circulation משנת 1995). גורמים אלה ומשתנים קליניים אחרים נכללים במרד הערכת הסיכון ע"ש TIMI או thrombolysis in myocardial Infarction, מה שיכול לסייע בטיפול ליד מיטת החולה (Morrow וחב' ב-Circulation משנת 2000). הוכנסו מדדים כגון טרופונין ו-BNP המסייעים אף הם לספק הערכה פרוגנוסטית במקרי STEMI (Bjorklund וחב' משנת 2006).
GDF-15 זוהה כחלבון המשודרג במיוציטים של הלב על ידי איסכמיה, תרכובות עתירות חמצן פעיל (ROS) וציטוקינים תומכי-דלקת, מה שמעלה אפשרות ש-GDF-15 יכול להיות סמן של מסלולי עקה קרדיאלית (Kempf ב-Circ Res משנת 2006, ו-Xu וחב' באותו כתב עת מאותה שנה). למרות ש-GDF-15 אינו מבוטא באופן נורמאלי במיוקרדיום של מבוגרים, ביטויו ברקמה זו גדל משמעותית במהלך נזק הנגרם באיסכמיה ניסויית וזילוח מחדש. Wollert וחב' הראו ב-Circulation משנת 2007, שרמות GDF-15 בצירקולציה מוגברות ומתייחסות באופן בלתי תלוי לתמותה מסיבה כלשהי במטופלים עם תסמונת כלילית חריפה עם non-ST-elevation. כדי לברר האם GDF-15 עשוי לספק מידע פרוגנוסטי במטופלים עם STEMI, נמדדו רמותיו בנסיוב של האחרונים שהשתתפו בשני ניסויים קליניים, Assent-2 ו-Assent-plus.
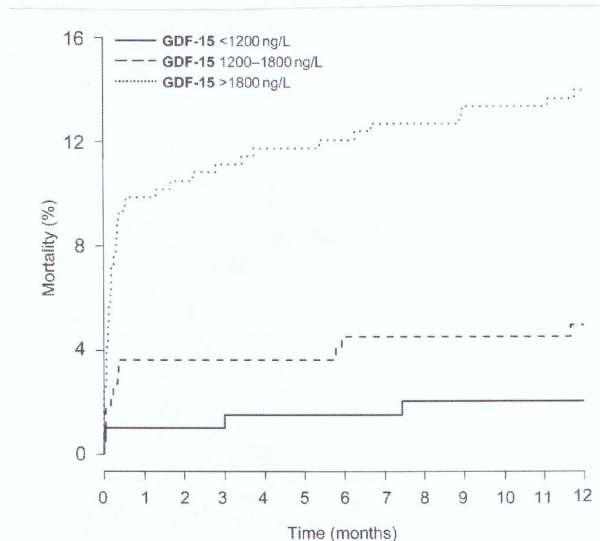
תוצאות מחקר של Kempf וחב' ב-Eur Heart J משנת 2007 היו כדלקמן: רמות GDF-15 בנסיוב נמדדו בשיטה אימונו-טורבידומטרית ב-741 מטופלים עם STEMI. בערך ב-72.2% מתוכם נמצאו רמות הגבוהות מ-1,200 ננוגרם/ליטר. רמות גבוהות של GDF-15 היו כרוכות בסיכון מוגבר של תמותה בהלך מעקב של שנה אחת. שיעורי התמותה מקץ שנה היו 2.1%, 5.0% ו-14.0% במטופלים עם רמות GDF-15 הנמוכות מ-1,200, או כאלה בין 1,200-1,800 או באלה עם רמות גבוהות מ-1,800 ננוגרם/ליטר, בהתאמה (p<0.001). GDF-15 נותר מנבא בלתי תלוי של תמותה לאחר התאמה עם משתנים קליניים כטרופונין T, או כ-N terminal pro-B-type natriuretic peptide.
GDF-15 והכליות
רמות של GDF-15 בצירקולציה נמצאו במתאם חזק עם הסיכון המוגבר של התקדמות מחלת כליות כרונית (CKD). שני מחקרים בלתי תלויים שהתייחסו לסוגיה זו, בהם השתתפו מטופלים מאובחנים היטב עם CKD, היו מחקר C-PROBE שכלל 224 משתתפים בגיל ממוצע של 58 שנה, ומחקר SKS (Seattle Kidney Study) שכלל 297 משתתפים בגיל ממוצע של 62 שנה. Nair וחב' ב- J Am Soc Nephrol משנת 2017, חקרו האם ביטוי ברקמת הכליות של GDF-15 mRNA, תואם את רמות GDF-15 בצירקולציה, וכן הם בחנו את הקשר בין תפקוד הכליות לרמת GDF-15 בצירקולציה. מתוך המדגם של C-PROBE נבחרו 24 מטופלים עם נתוני ביטוי גני שהופקו מדגימות ביופסיה של הכליות. נמצא ש- GDF-15 mRNA מהאזור האבובי-אינטרסטיציאלי של הכליה, הראה מתאם חיובי חזק עם רמות GDF-15 בצירקולציה. בחינת 2 המדגמים הגיעה למסקנה שרמות GDF-15 בצירקולציה היו כרוכות בדעיכה של 30% ב-GFR ובהתקדמות למצב של ESRD. משתתפי הניסוי עם רמות GDF-15 גבוהות יותר בנסיוב היו בסיכון מוגבר לדעיכה מתמשכת של ה-GFR.
מחקרים קדם-קליניים סיפקו ראיות מסוימות ש-GDF-15 עשוי לספק הגנה לכליות. נחקרה האפשרות של נזק כלייתי במודלים של עכברים משוללי GDF-15 עם סוכרת type 1 או type 2. בעכברים בהם סוכרת type 1 הושרתה על ידי streptozotocin, חסר GDF-15 הגביר את אובדן גלוקוזה בשתן, הגביר את יצירת השתן, הגדיל את צביעת α-SMA, הגדיל את הביטוי של mRNA של קולאגן type 1, וכן הגדיל את הביטוי של KIM-1 ושל סמנים דלקתיים. בעכברים סוכרתיים db/db type 2, שמט גנטי של GDF-15 גרם לרמות גבוהות יותר של גלוקוזה בשתן, ולקראטינין מוגבר בנסוב. אנליזה אימונו-היסטולוגית הדגימה גם כן צביעה אינטרסטיציאלית מוגברת יותר של α-SMA, וצביעת KIM-1 באבוביות, מה שמצביע על כך שבעכברים משוללי GDF-15 יש נזק אבובי גדול יותר באופן משמעותי, בהשוואה לעכברים wild type (Mozagova וחב' ב- Am J Physiol Renal Physiol משנת 2013).
מחקר עדכני יותר בחן את ההשפעות של GDF-15 רקומביננטי על תהליכי פיברוזיס כלייתי במודל של עכברים. לאחר ניתוח חד צדדי לחסימת השופכן, העכברים טופלו פעמיים בשבוע על ידי הזרקה תוך-פריטונאלית של GDF-15 רקומביננטי. לאחר 10 ימים, רקמות הכליה נחתכו ונצבעו בצביעת Masson’s tri-chrome ובצביעת Sirius להערכה של פיברוזיס כלייתית. גם α-SMA וקולאגן 1 נצבעו להערכת שפעול של פיברובלסטים. תהליך פיברוטי וכן שפעול פיברובלסטים פחתו משמעותית בכליות מעכברים המטופלים עם GDF-15 (Kim וחב' ב- Biochem Biophys Res Commun משנת 2018). למרות מחקרים אפידמיולוגיים שהדגימו בבירור קשר אמיץ בין רמות גבוהות של GDF-15 לבין סיכון מוגבר למחלות כליה ומחלות קרדיו-וסקולריות, הם אינם סותרים בהכרח את התפקיד ההגנתי המיוחס ל-GDF-15 בהקשר של הלב והכליות, המשתמע ממחקרים תפקודיים במודלים של חיות. השדרוג של GDF-15 עשוי להיות התגובה המפצה של הגוף לפציעה רקמתית. דוגמה דומה נמצא בפפטידים הנתריאורטיים, המשרים השפעה אנטי-היפרטרופית ומפחיתים לחץ דם, אך הם עדיין סמנים של תוצאים בלתי-רצויים (Woods וחב' ב-Clin Exp Pharmacol Physiol משנת 2004, ו- van der Velde וחב' ב- Curr Heart Fail Rep משנת 2014).
GDF-15 ומטבוליזם
Baek וחב' במחקרם משנת 2006, היו הראשונים שהבחינו בהשפעה של GDF-15 על משקל הגוף כאשר הם חקרו את השפעותיו האנטי-סרטניות בעכברים עם ביטוי רקמתי נרחב כתוצאה בביטוי-יתר של GDF-15. עכברים ממין זכרי או נקבי, היו בעלי משקל מופחת ומסת שומן פחותה, ועכברים עם ביטוי יתר של GDF-15 צרכו פחות מזון והוציאו אנרגיה מוגברת (Macia וחב' ב-PLos One משנת 2012, ו-Chrysovergis וחב' ב- Int J Obes משנת 2014). נתונים אלה הביאו לשיפור המצב המטבולי, ולהפחתה בציטוקינים דלקתיים, ובסך הכול האריכו את תוחלת החיים בעכברים הניזונים מדיאטת chow או מדיאטה עתירת שומן (Wang וחב' ב-Biochem J משנת 2014). לעומת זאת, עכברים משוללי GDF-15 נמצאו בעלי משקל גוף עודף, מסת שומן מוגברת ותיאבון אכילה מוגבר, מה שמצביע על מעורבות GDF-15 אנדוגני בוויסות של מטבוליזם (Tsai וחב' ב-PLos One משנת 2013). ממצאים אלה אושרו גם על ידי Kim וחב' ב-Sci Rep משנת 2018), שהראו שעכברים משוללי GDF-15 צפויים למשקעי שומנים מוגברים בכבד, ולתסמינים דמויי nonalcoholic fatty liver disease, בה בשעה שעכברים טרנסגניים המבטאים ביתר GDF-15 היו משוללים תסמינים אלה.
הגברת היצירה של GDF-15 בגידולי בלוטת הערמונית, וההגברה שנבעה מכך של רמות פפטיד זה בצירקולציה לאחר השתלת גידול סרטני בעכברים, הביאה את Johnen וחב' לבחון האם GDF-15 יכול להיות אחראי לתרחיש של אנורקסיה ואיבוד משקל כתוצאה מסרטן. עכברים עם השתלת גידולים היו מסוגלים לעלות במשקל, אלא שאלה מתוכם עם רמות מוגברות של GDF-15 ירדו במשקלם באופן הדרגתי. יתרה מכך, את הזרקת GDF-15 רקומביננטי ואיבוד המשקל שנגרם עקב כך, ניתן היה לחסום על ידי נוגדן כנגד GDF-15. התצפית של הקשר הקיים בחולים עם סרטן הערמונית בין שיעור איבוד המשקל שלהם לבין רמות GDF-15 בצירקולציה, הביאה למאמץ מחקרי לפתח תרפיה בה GDF-15 משמש כיעד לטפל בכיחשון (cachexia) מושרה בחולי סרטן (מחקרים מוקדמים של Gyuris, Lerner, Lin ב-J Cachexia Sarcopenia Muscle משנת 2016). כמו כן יש מאמץ מחקרי לפתח אנלוגים חדשים של GDF-15 לטיפול בהשמנת יתר ובסוכרת (Xiong וחב' ב- Sci Transl Med משנת 2017).
גילוי הקולטן של GDF-15
בתחילה הייתה סברה ש-GDF-15 משפיע על צריכת מזון ועל משקל הגוף דרך אינטראקציה עם הקולטן TGFβR2, שהוא הקולטן של TGFβ. אך מחקרים מאוחרים יותר לא הצליחו לאשש סברה זו (Wang וחב' ב-Aging משנת 2014, ו-Artz וחב' ב-Blood משנת 2016, Unsicker וחב' ב- Cytokine Growth Factor Rev משנת 2013, Hsu וחב' ב-Nature משנת 2017, Mullican וחב' ב-Nat Med משנת 2017, ו-Yang וחב' ב-Nat Med משנת 2017). ממצא עדכני קבע שמקורות מסחריים של GDF-15, עלולים להיות מזוהמים עם רמות נמוכות של TGFβ, מה שעלול לפגוע בהתפתחות מחקר זה (Olsen וחב' ב-PLos One משנת 2017).
אי היכולת לאשר את האינטראקציה עם TGFβRII, הביאה חוקרים אחדים לחיפוש אחר קולטנים אחרים עבור GDF-15. שתי אסטרטגיות נוצלו לזיהוי סימולטני של קולטנים עבור GDF-15 על ידי בחינה של 4 קבוצות מחקר. כיוון שתוארו מספר קולטנים של משפחת קולטני GDNF על ידי Airaksinen ו-Saarma ב-Nat Rev Neurosci משנת 2002, התבצע חיפוש סיסטמטי למציאת ליגנדים הנקשרים לקולטנים אלה. סריקה של GDF-15 כנגד קולטני GDNF, ובפרט כנגד קולטני GFRAL ו-GAS1, העלתה ש-GDF-15 מגיב עם GFRAL (על פי Emmerson וחב' ב-Nat Med משנת 2017). בנוסף, שלוש קבוצות מחקר זיהו באופן בלתי תלוי חלבון בודד, GFRAL, כקולטן ל-GDF-15 (על פי Hsu וחב' משנת 2017, Mullican וחב' באותה שנה, ו-Yang וחב' אף הם ב-2017). במקור זוהה GFRAL כחבר "יתום" במשפחת GDNF (על פי Li וחב' ב-J Neurochem משנת 2005). כחלבון טרנס-ממברנלי יחיד, GFRAL אינו מסוגל לאותת בעצמו והוא זקוק לאינטראקציה עם קולטן נוסף RET, בדומה לחברים נוספים של משפחת קולטני GDNF. השפעול המתווך על ידי GDF-15 של הפוספורילציה של RET, משרה איתות תוך תאי דרך מסלולי ERK ו-AKT. בשנת 2017 הציעו Yang וחב' ש-GFRAL יכול להגיב באופן דיפרנציאלי עם איזופורמים של RET, ובאופן החזק ביותר עם RET51.
ההשפעות המטבוליות של GDF-15 נמצאו על ידי כל קבוצות המחקר שהוזכרו, להיות תלויות באינטראקציה עם GFRAL, שכן ההשפעות האנורקסיגניות של GDF-15 אבדו באופן עקבי בעכברים המשוללים GFRAL. כדי לבטל את האפשרות שעכברים משוללי GFRAL אינם מגיבים ל-GDF-15 מסיבות שאינן קשורות לאינטראקציה ישירה, Emmerson וחב' ב-Front Physiol משנת 2018, השתמשו בנוגדנים חד-שבטיים כנגד אנטגוניסט של GFRAL, והדגימו שההשפעות in vivo של GDF-15 תלויות גם כן בקישור ל-GFRAL. בשנת 2017 הראו Hsu וחב' שעכברים משוללי GFRAL עמידים להשפעות של cisplatin, נתון התומך במסלול של GDF-15/GFRAL בהקשר של ההשפעות האנורקסיגניות של כל תכשירים כימותרפיים. למרות ש-GDF-15 מבוטא באופן נרחב ברקמות רבות, הביטוי של GFRAL מוגבל למוח ובעיקר לאזור הידוע כ-area postrema שהוא חלק מהמוח המאורך של גזע המוח. הזרקה של GDF-15 נמצאה משפעלת באופן ספציפי את הנירונים החיוביים ל-GFRAL-RET ב-area postrema, כפי שנמדד על ידי ביטוי מוגבר של c-Fos. נתונים אלה מחזקים את ההשערה שאזור ה-area postrema חיוני לתגובה של GDF-15 בתסמונת ה-anorexia-cachexia (על פי Borner וחב' ב-J Cachexia Sarcopenia Muscle משנת 2016). בנוסף, ביטוי מוגבל זה של GFRAL במוח, נמצא גם בעכברים, חולדות, קופים ואדם, מה שמציע שהשפעת GDF-15 על צריכת מזון ומשקל הגוף משומרים פילוגנטית מבחינה מטבולית.
הביטוי של GDF-15 במחלות מיטוכונדריאליות ונירולוגיות
GDF-15 מוגבר בילדים עם מחלות מיטוכונדריאליות והוא מושרה על ידי פגיעה בתפקוד המיטוכונדריאלי: מחלות מיטוכונדריאליות הן הקבוצה השכיחה ביותר מבין המחלות המטבוליות כאשר שכיחותן באוכלוסייה הכללית היא 1 ל-5000. הן מאופיינות על ידי מעורבות רב-מערכתית, ובדרך כלל פוגעות ברקמות עם דרישה אנרגטית גבוהה (DiMauro וחב' ב-Nat Rev Neurol משנת 2013, ו-Tulinius ו-Oldfors ב-Semin Fetal Neonatal Med משנת 2011).
GDF-15 מווסת מצבי דלקת ואפופטוזיס במחלות שונות. Yatsuga וחב' דיווחו ב-Nuromuscular Disorders משנת 2017, ש-GDF-15 הוא סמן חדש של מחלות מיטוכונדריאליות. במחקר זה נעשה שימוש ב-14 דגימות נסיוב של מטופלים עם MELAS, 15 מטופלים עם limbic encephalitis,10 מטופלים עם טרשת נפוצה, ו-19 דגימות של חולים ב-ALS. מדידת GDF-15 בוצעה בשיטת ELISA, רמה ממוצעת של GDF-15 בנסיוב של אלה עם מחלות מיטוכונדריאליות הייתה 2,860.7 פיקוגרם/מ"ל. הרמה הממוצעת של החלבון בנסיובי חולים עם limbic encephalitis הייתה 15,786.2 פיקוגרם/מ"ל, בטרשת נפוצה הרמה הממוצעת נקבעה כ-575.4 פיקוגרם/מ"ל, ואילו ב-ALS נקבעה רמה ממוצעת של 509.6 פיקוגרם/מ"ל. נראה אם כן ש-GDF-15 מוגבר משמעותית במחלות מיטוכונדריאליות. לעומת זאת, לא נמצא כל מתאם בין רמות GDF-15 לבין המאפיינים הקליניים, כמו מספר התאים ב-CSF, או ממצאים ב-MRI של המוח. נמצאה נטייה של קשר בין רמת GDF-15 לבין ריכוז החלבון ב-CSF של חולים עם limbic encephalitis. כמו כן נמצא מתאם חיובי בין רמת GDF-15 לבין EDSS או extended disability ststus scale בטרשת נפוצה.
הקשר של GDF-15 ומחלות מיטוכונדריאליות
במיטוכונדריה מתבצעות פונקציות מטבוליות חשובות, כאשר החיונית בהן היא יצירת אנרגיה בצורת ATP על ידי שרשרת הטרנספורט של אלקטרונים ומערכת החמצון על ידי פוספורילציה, המורכבת מ-5 קומפלקסים. כל אחד מקומפלקסים אלה מורכב מ-4–46 תת-יחידות המקודדות על ידי DNA גרעיני ומיטוכונדריאלי. מחלות מיטוכונדריאליות נגרמות על ידי פגמים בכל אחד מהמסלולים המטבוליים הרלוונטיים, והשכיחות של פגמים אלה היא 1 לכל 8,500 לידות חי. מחלות מיטוכונדריאליות מגוונות, כולל תסמונות שמט של DNA כמו בתסמונת Kearns-Sayre, תסמונות של פגיעה במבנה המיטוכונדריאלי כמו אלה הנגרמות על ידי מוטציות ב-TK2 ו-SUCLA2 או בגנים POLG ו-C10orf2, או תסמונות כתוצאה ממוטציות נקודתיות כמו אנצפלומיופתיה מיטוכונדריאלית, חמצת לקטית, ו-MELAS כמו גם אחרות.
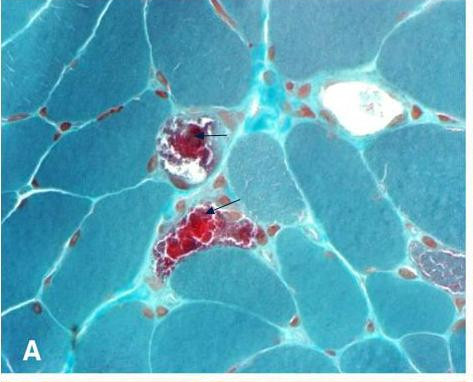
המאפיינים הקליניים של מחלות מיטוכונדריאליות מגוונים ביותר, וכוללים חמצת לקטית, מיופתיה, אופתלמופלגיה, פטוזיס, קרדיומיופתיה, איבוד שמיעה תחושתי-נוירלי, אטרופיה של עצב הראייה, רטינופתיה פיגמנטרית, סוכרת, אנצפלומיופתיה, פרכוסים, ואפיזודות דמויות שבץ-מוחי. האבחון של מחלות מיטוכונדריאליות מסובך בעיקר בילדים, בגלל המורכבות של התסמינים הקליניים וחסר של מדדי אבחון קלאסיים כגון ragged-red fibres בביופסיית שריר שניתן לזהות במיקרוסקופ לאחר צביעת גומורי.
הנחיות מדויקות לאבחון מתבססות על תסמינים קליניים, וקריטריונים ביוכימיים והיסטו-פתולוגיים (Bernier וחב' ב-Neurology משנת 2002, Morava וחב' באותו כתב-עת משנת 2006, ו-Haas וחב' ב-Mol Genet Metab משנת 2008). אך מדד הזהב היה ונותר האישור הגנטי, אם כי לעיתים קרובות הבסיס הגנטי של המחלה נותר בלתי מזוהה (Vasta וחב' ב-Genome Med משנת 2009, ו-Chi ב-Pediatr Neonatol משנת 2015). קו ראשון של בחינה, כולל אנליזה של מטבוליטים בדם, בשתן ובנוזל השדרה, למרות שמדדים אלה כגון, לקטאט, פירובאט, אלנין וחומצות אורגניות הם בעלי רגישות וספציפיות נמוכות, מה שמדגיש את הצורך בסמנים טובים יותר (Rodenburg ב-J Inherit Metab Dis משנת 2011, ו-Liang וחב' ב-Biochim Biophys Acta משנת 2014). השלב הבא באבחון הוא בדרך כלל נטילת ביופסיית שריר, בה נמדדים פעילויות אנזימטיות של שרשרת הנשימה, אם כי בדיקה זו אינה זמינה תמיד, ואף תוצאותיה קשות לאינטרפרטציה. GDF-15 מוזכר כביו-מדד פוטנציאלי של מחלות מיטוכונדריאליות. רמות GDF-15 mRNA עולות באופן דרמטי בשריר של חולים עם מוטציות TK2, והחלבון הזו מופרש על ידי תאי שריר שלד במחלות אלו (Kalko וחב' ב-BNC Genomics משנת 2014). בנוזל השדרה מבוטא GDF-15 ב-choroid plexus ופועל כגורם נויטרוטרופי פוטנטי על נירונים מוטוריים ותחושתיים (Strelau וחב' ב-J Neurosci משנת 2009).
Montero וחב' דיווחו ב-PLos One משנת 2016, על ממצאי המדידות של רמות GDF-15 בצירקולציה: רמות GDF-15 בצירקולציה היו כמעט זהות בילדים בריאים (ממוצע של 350.3 פיקוגרם/מ"ל) לעומת ילדים עם מיופתיה לא-מיטוכונדריאלית (349.1 פיקוגרם/מ"ל). רמות ממוצעות של GDF-15 בנסיוב, היו גבוהות פי-5 בילדים עם מפגע מיטוכונדריאלי בהשוואה לילדים בריאים (4,046 לעומת 885 פיקוגרם/מ"ל). הרגישות של בדיקת GDF-15 בהקשר של אבחון מחלה מיטוכודריאלית (כאשר ערך הסף של התחום הנורמלי נקבע כ-550 פיקוגרם/מ"ל) הייתה 72.7%, כאשר הספציפיות נקבעה כ-92.3%, ערך הניבוי החיובי (PPV) נקבע כ-84.2% ואילו ערך הניבוי השלילי (NPV) נקבע כ-83.3%).
הוראות לביצוע הבדיקה
יש ליטול דם במבחנת ספירת-דם (פקק סגלגל, EDTA). ניתן גם להשתמש במבחנת סודיום הפארין (פקק ירוק). יש לסרכז את הדם באופן מידי. אין לחשוף את הדגימה לאור ישיר או לחום. יש לפסול דגימה מאוד המוליטית, או מאוד ליפמית, אך ניתן לבצע את הבדיקה בדגימה המוליטית או ליפמית באופן מתון. כמו כן ניתן לבצע את הבדיקה בדגימה מאוד איקטרית. הדגימה יציבה בטמפרטורת החדר למשך 28 יום, וכדגימה מקוררת (מועדפת) או קפואה למשך 90 יום. הבדיקה מתבצעת בשיטת ELISA. הבדיקה אינה מומלצת לילדים בי פחות מ-3 חודשים, שכן בהם רמה מוגברת של GDF-15 יכולה לנבוע מרמתו הגבוהה בשלייה בתקופת ההיריון.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק