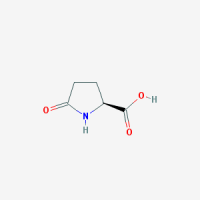
חומצה פירו-גלוטמית - Pyroglutamic acid
| מדריך בדיקות מעבדה | |
| חומצה פירו-גלוטמית | |
|---|---|
| Pyroglutamic acid | |
| שמות אחרים | keto proline-5 ,Oxo proline-5 , pidolic acid |
| |
משקל מולקולארי: 129.114 דלטון
| |
| מעבדה | כימיה בשתן |
| תחום | פגם במטבוליזם של חומצות אמינו העלול לגרום ל-high anion gap metabolic acidosis. |
| טווח ערכים תקין | פחות מ-70 מיליגרם/גר' קראטינין (פחות מ-100 מיקרומול'/מילימול' קראטינין). |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
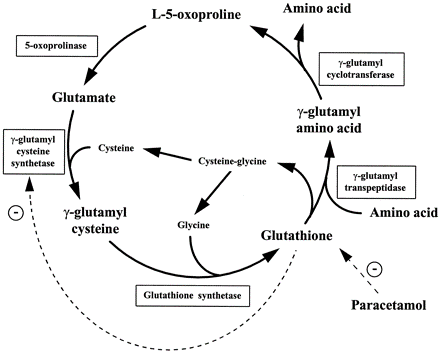
חומצה פירוגלוטמית היא מרכיב תזונה לא הכרחי (nonessential), שהגוף יודע לסנתז בכמויות הראויות, ובדרך כלל מופיעה בגוף כמטבוליט של "מעגל הגלוטתיון" הידוע גם כמעגל ה-γ-glutamyl.
לחומצה פירוגלוטמית יש 2 אננטיומרים, D ו-L, כאשר צורת L-pyroglutamic acid היא האננטיומר הפעיל ביולוגית בגוף האדם. משערים שהשימוש הביוכימי העיקרי של L-pyroglutamic acid הוא בהגברת הפעילות של הנירוטרנסמיטור אצטילכולין. הוא עשוי גם לשמש בתהליך יצירת הנירוטרנסמיטורים γ-aminobutyric acid (GABA) וגליצין.
חומצה פירוגלוטמית תוארה לראשונה על ידי Haitinger ב-1882 שמצא שהיא יכולה להיווצר מחימום חומצה גלוטמית בטמפרטורה של 180°C, בה אובדת מולקולת מים. עשרות שנים היו סבורים שחומצה פירוגלוטמית נוצרת בתאים באופן ספונטני ולא אנזימטי על ידי ציקליזציה של קבוצת האמינו החופשית של חומצה גלוטמית או של גלוטמין ליצירת lactam. אך רק ב-1942 הראו Woodward וחב' ב-J Biol Chem שחומצה פירוגלוטמית נוצרת מגלוטתיון על ידי פעולת האנזים γ-glutamyl cyclotransferase (להלן γ-GCT), ופעולתה יכולה להביא לאגירת חומצה גלוטמית, אך גם להביא להחלשת הפעילות של חומצה גלוטמית בעיקר במוח. בהמשך, התגלה האנזים oxoprolinase-5 שיכול לבקע חומצה פירוגלוטמית במעגל הגלוטתיון, ולהפכה לחומצה גלוטמית (Meister וחב' ב-Proc Natl Acad Sci USA משנת 1971).
בשנת 1988 קראו Moret ו-Briley ב-Trends Pharmacol Sci להתייחסות מחודשת בחומצת האמינו "הנשכחת" הזו, אך נענו באותה שנה ובאותו כתב עת על ידי Cristensen שאין להתייחס לחומצה פירוגלוטמית כאל חומצת אמינו, בהתבסס על המבנה הלא-צוויטריוני שלה. מיעוט המחקר הביוכימי על חומצה פירוגלוטמית, משתקף בעובדה ש- γ-GCT, האנזים שנחשב בתחילה בעיקר כמי שיוצר oxoproline-5, נוקה לראשונה ממוח אדם רק בשנת 1969 (על ידי Orlowski וחב' בדיווחם ב-Biochemistry), אך זהות האנזים דווחה על ידי Oakley וחב' לראשונה רק בשנת 2008 ב-J Biol Chem. בדומה, למרות שהאנזים oxoprolinase-5 נוקה על ידי Meister כבר בשנת 1971, והגן המקודד לו זוהה על ידי Ye וחב' ב-1996 ב-J Biol Chem, הביטוי של אנזים מעניין זה בתאים אאוקריוטים, פוענח רק בשנת 2010 על ידי Kumar ו-Bachhawat ב-FEMS Yeast Res. חלק מההאטה במחקר רלוונטי לפירוגלוטמאט נובע מהיעדר עד לאחרונה של שיטה אנזימטית אמינה ורגישה לזיהוי פירוגלוטמאט.
היווצרות חומצה פירוגלוטמית בתאים
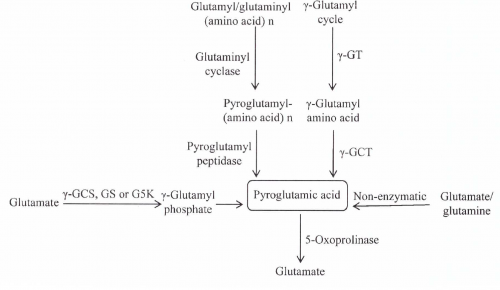
- קטבוליזם של גלוטתיון: במהלך הפירוק של גלוטתיון, האנזים γ-glutamyl transpeptidase (או γ-GT), פועל בתחילה על גלוטתיון לייצר γ-glutamyl amino acids המוחדרות אל תוך התאים ומשמשות מצע של γ-GCT, שפועל על γ-glutamyl amino acids ליצירה של פירוגלוטמאט ושל חומצות האמינו המתאימות. האנזים γ-GCT נפוץ בצורה רחבה ברקמות בעלי חיים ונוקה ממספר רקמות של יונקים, כמו כבד חזיר (Adamson וחב' ב-Can J Biochem משנת 1971), אריתרוציטים של אדם (Board וחב' ב-Biochem J משנת 1978) ורקמות נוספות (Orlowski ו-Meister ב-J Biol Chem משנת 1973). הגן המקודד לאנזים זה, C7orf24 , ממוקם על כרומוזום 7, זוהה על ידי ריצוף של האנזים המנוקה, שתואר כחלבון קטן בעל משקל מולקולארי של 21,000 דלטון. הומולוגים של אנזים זה ניתן למצוא גם ב-metazoa ובחיידקים.
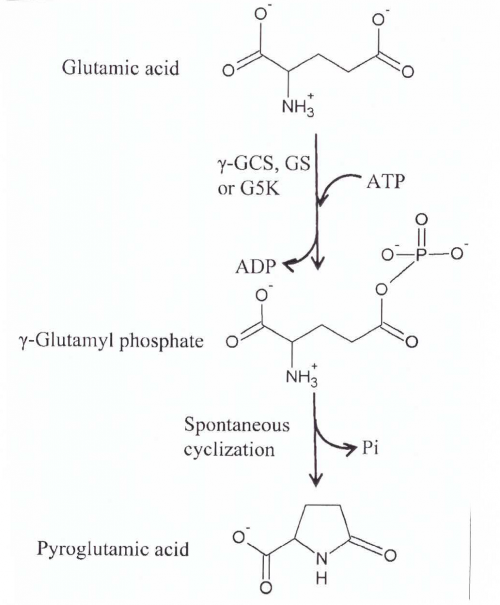
- ריאקציות הנובעות משפעול של חומצה גלוטמית: חומצה פירוגלוטמית נמצאה מיוצרת על ידי חומצה גלוטמית בנוכחות האנזימים γ-GCT, glutamine synthetase (להלן (GS ו-glutamate-5-kinase (להלן K5G) על פי Krishnaswamy וחב' ב-J Biol Chem משנת 1960, ו-Seddon וחב' ב-J Biol Chem משנת 1989. בכל שלושת הריאקציות האנזימטיות, החומצה הגלוטמית המשופעלת מועברת למולקולה קולטת, כגון ציסטאין, אמוניה ו-NADPH, בהתאמה. חומצה גלוטמית מזורחנת או משופעלת היא מאוד לא יציבה וחשופה לציקליזציה ספונטנית ליצירת חומצה פירוגלוטמית (Katchalsky ו-Paecht משנת 1954). אם המולקולה הקולטת אינה קיימת או זמינה, ציקליזציה ספונטנית של הגלוטמאט המשופעל יוצרת חומצה פירוגלוטמית. γ-GCT המקטלז את הצעד הראשון של הביוסינתזה של גלוטתיון, משפעל את החומצה הגלוטמית שיכולה להיות מותמרת בהיעדר ציסטאין לחומצה פירוגלוטמית.
- מפירוק של חלבונים המכילים חומצה פירוגלוטמית בקצה ה-N טרמינאלי שלהם: חומצה פירוגלוטמית נמצאה בקצה ה-N-טרמינאלי של חלבונים רבים , בהם הם בעלי תפקיד כפול של פעילות ויציבות. כיוון שחומצה פירוגלוטמית אינה יכולה להשתרבב לחלבונים ישירות דרך tRNA, הנוכחות של חומצה פירוגלוטמית בקצה ה-N-טרמינאלי של חלבונים אלה כאירוע post-translational הנובע מהתמרת של חומצה גלוטמית ושל גלוטמין בעמדה N-טרמינאלית לחומצה פירוגלוטמית על ידי פעולת האנזים glutaminyl cyclase (על פי Schilling וחב' ב-FEBS lett משנת 2004). הביקוע של חומצה פירוגלוטמית בעמדה ה-N-טרמינאלית מחלבונים אלה כתוצאה מפעולת האנזים pyroglutamyl peptidase, התגלה באורגניזמים רבים מחיידקים ועד יונקים. האננזים 5-oxoproline המהווה מסלול חשוב נוסף ליצירת חומצה גלוטמית בתאים (Cummins ו-O'Connor ב-Biochim Biophys Acta משנת 1998).
פגם מורש באנזים glutathione synthetase תואר לראשונה בשנת 1970 על ידי Jellum וחב' ב-Scand J Clin Lab Invest, בצעיר בן 19 בו הצטברות ניכרת של oxoproline-5 גרמה ל-anion gap חמור וגבוה במיוחד. חסר גלוטתיון מזוהה עם תסמינים כמו אנמיה המוליטית, תפקוד פגום של ליקוציטים, ומגוון של ליקויים נירולוגיים ההולכים ומחמירים.
גם הפגם המורש באנזים oxoprolinase-5 ששכיחותו נמוכה באוכלוסייה, תואר לראשונה רק בשנת 1981 בשני אחים בני 11 ו-16 שנה על ידי Larsson וחב' ב-Acta Pediatr Scand. נראה שמספר המקרים בהם פעילות אנזים זה משתבשת לא באופן גנטי אלא כתוצאה מטיפול אנטיביוטי מתמשך ב-flucloxacillin או ב-netilmicin עלולים היו לגרום ל- oxoprolinuria-5, כפי שהדבר נמצא במקרה של מטופלת בת 35 שנה בה הפסקה מוחלטת של הטיפול האנטיביוטי הזה, הביאה תוך מספר ימים להיעלמות כל התופעות הקליניות כגון החמצת המטבולית החמורה (Croal וחב' ב-Clin Chem משנת 1998).
האנזים oxoprolinase-5, וההידרוליזה של חומצה פירוגלוטמית ליצירת חומצה גלוטמית
אנזים זה, הוא האנזים היחיד הידוע כפועל על oxoproline-5, וחומצה גלוטמית הנוצרת יכולה או להיכנס מחדש למעגל ה-γ-glutamyl, או שהוא יכול להיות מנוצל לתפקודים תאיים אחרים. האנזים oxoprolinase-5 הוא אנזים דימרי גדול במיוחד עם משקל מולקולארי של 280,000 דלטון (Van der Werf וחב' ב-J Biol Chem משנת 1975). אנזים זה תלוי ב-ATP, ועל פי Meister בשלב הראשון אנזים זה חומצה פירוגלוטמית עוברת זרחון בסיוע ATP, בעמדת החמצן האמיד-קרבוקסילי ליצירת 5-oxoproline מזורחן, ותוצר ביניים זה עובר הידרוליזה ליצירה של γ-glutamylphosphate, המתפרק בהמשך ליצירת חומצה גלוטמית ופוספאט אנאורגני (Seddon ו-Meister ב-J Biol Chem משנת 1986). הגן המקודד לאנזים 5-oxoprolinase ביונקים זוהה ב-1996 אם כי לא הושג אז הניקוי של האנזים הריקומביננטי, ורק בשנת 2010 ניתן היה לנקות את האנזים הזה מ-Saccharomyces cerevisiae הדומה לאנזים זה באדם מה שאפשר אנליזה יותר מפורטת של המבנה-תפקוד שלו.
התפקידים הפיזיולוגיים של חומצה פירוגלוטמית
חלבונים רבים וכן פפטידים פעילים ביולוגית, מכילים חומצה פירוגלומית בקצה ה-N טרמינאלי שלהם. בין חלבונים ניתן למנות את gasrin ,neurotensin ,LHRH, vasoactive peptides ו-TRH. היצירה של חומצה פירוגלוטמית מתרחשת כאשר השייר ה-טרמינאלי של החלבון הוא גלוטמין או חומצה גלוטמית, כאשר קצב יצירת חומצה פירוגלוטמית מהיר יותר עם גלוטמין. האנזים גלוטמין ציקלאז יכול לפעול הן על גלוטמין וכן על חומצה גלוטמית. שייר החומצה הפירוגלוטמית מגן על החלבון מפני פעילות של amino peptidases. החלבונים המבניים פיברין, פיברינוגן וחלבונים דמויי-קולאגן, מכילים חומצה פירוגלוטמית N-טרמינאלית המגינה עליהם מפני דגרדציה (Pietzek וחב' ב-Biochim Biophys Acta משנת 1974). לאחרונה פרסמו Mandal ו-Balaram ב-Anal Bichem משנת 2007 שיטה מס-ספקטרומטרית לזיהוי חלבונים עם קצה N-טרמינאלי המכיל חומצה פירוגלוטמית.
בנוסף לתפקידו בהגנה על חלבונים מפני הידרוליזה, חומצה פירוגלוטמית חיונית לתפקודם של חלבונים ופפטידים. חומצה פירוגלוטמית חיונית בפעילותם של נירופפטידים רבים, כגון TRH או thyrotropin releasing hormone (על פי Boler וחב' ב-Biocim Biophys Res Commun משנת 1969, נוירוטנסין (Carraway ו-Leeman ב-J Biol Chem משנת 1975) והכימוקינים באדם, MCP1 ו-MCP4 (על פי Van Coillie וחב' ב-Biochemisry משנת 1998). נמצא ששייר פירוגלוטמי חיוני לפעילות TRH, וכל שינוי או שחלוף של טבעת ה-lactam הפחית באופן ניכר את הפעילות ההורמונאלית ויכולת הקישור של TRH לקולטן שלו (Hinkle ו-Tashjian ב-J Biol Chem משנת 1973). מאוחר יותר נמצא ש-TRH נקשר לקולטן שלו על ידי אינטראקציה בין טבעת הקרבוניל של החומצה הפירוגלוטמית ב-TRH לבין הקולטן (Perlman וחב' ב-J Biol Chem משנת 1994). כמו כן נמצא שהחלבון הכימוטקטי MCP2, המשפעל תאי חיסון רבים הוא בעל שייר פירוגלוטמי בקצה ה-N טרמינאלי שלו, החיוני לפעילותו ומגן על החלבון מפני פירוק פרוטאוליטי.
במפגעים נירו-דגנרטיביים אחדים פפטידים המכילים חומצה פירוגלוטמית מעורבים בפתוגנזה. במחלת אלצהיימר, הפפטיד amyloid beta (Aβ), המכיל חומצה פירוגלוטמית בקצה ה-N טרמינלי שלו, שהוא הפפטיד העיקרי ברובד העמילואידי, שהוא גם נירוטוקסי וגם גורם לצימות עצמי מהיר (Wirths וחב' ב-Acta Neuropathol משנת 2009). בשיטיון בריטי משפחתי, כמו גם בשיטיון דני משפחתי, מופיעים פפטידים השונים מ-Aβ, אך גם הם מכילי שייר פיקוגלוטמי N-טרמינאלי. ההשערה היא שהצטברות עודפת זו של פפטידים המכילים pGlu נובעת מיציבותם לפעילות אמינופפטידאזות (Tomidokoro וחב' ב-Irosaki Igaku משנת 2010). בנוסף, פפטידים אלה הם בעלי הידרופוביות מוגברת ומסיסות פחותה, מה שמגביר את יכולת השקיעה שלהם ברבדים (plaques) הפתוגניים (Schlenzig וחב' ב-Biochemistry משנת 2009). זאת ועוד, עיכוב של האנזים גלוטמיל ציקלאז במודל של עכברים הפחית את רמת פפטידי-Aβ והפחית בהם תסמיני אלצהיימר (Schilling וחב' ב- Nature Med משנת 2008).
התפקידים של חומצה פירוגלוטמית כמטבוליט תאי
- כאנלוג של חומצה גלוטמית: כיוון ש-pGlu הוא אנלוג של חומצה גלוטמית, וקודמן פוטנציאלי של חומצה זו, הוא כרוך באופן הדוק לכל התהליכים התאיים בהם מעורבת חומצה גלוטמית. pGlu פעיל בנטילה פומית, ויכול לעבור ביעילות טרנספורט מעבר למחסום דם-מוח (BBB), ואכן נמצא ש-pGlu מצטבר בריכוזים גבוהים במוח לאחר נטילה פומית (Caccia וחב' ב-Toxicol Lett משנת 1982, וכן Chanal וחב' ב-J Pharm Pharmacol משנת 1988, ו-Drago וחב' ב-Funct Neurol משנת 1988). נמצא שחומצה פירוגלוטמית יכולה למנוע אמנזיה מושרית על ידי scopolamine בחולדות, ועשויה לשפר כושר למידה במקרים של איבוד זיכרון מושרה על ידי אלכוהול. חומצה פירוגלוטמית יכולה להיקשר לקולטנים של חומצה גלוטמית, לעכב קליטה של חומצה גלוטמית על ידי הסינפּטוֹזוֹם, ואינפוזיה כרונית של חומצה פירוגלוטמית לתוך החלק התת-קורטיקאלי של המוח (striatum), נמצאה גורמת לאיבוד חמור של תאי מוח חולדות (Dusticier וחב' ב-Neuropharmacology משנת 1985). חומצה פירוגלוטמית פועלת גם כ-messenger שניוני בתהליך הוויסות של זמינות חומצות אמינו במוח, שכן על ידי התקשרותה למשאבות efflux של חומצות אמינו במחסום דם-מוח, היא משפעלת משאבות אלה וגורמת ליציאת חומצות אמינו מהמוח (Hawkins וחב' ב-FEBS Lett משנת 2006, ו-Lee וחב' ב-J Biol Chem משנת 1996). תפקוד דומה של חומצה פירוגלוטמית נמצא בשלייה ובבלוטות החלב (Vina וב-Biol Neonate משנת 1985).
- כמאגר של חומצה גלוטמית: כיוון שחומצה פירוגלוטמית יכולה להיות מוסבת לחומצה גלוטמית על ידי הידרוליזה, נראה שאחד מתפקידיה הוא לשמש עתודה לחומצה גלוטמית מטבוליט חיוני בתאים, ובעיקר בתאי מוח. פירוגלוטמית מסומנת מתגלה כחומצה גלוטמית מסומנת או כ-GABA מסומנת, מה שמוכיח את היותה במטבוליזם פעיל ברקמות אלה (Borg וחב' ב-Neurochem Int משנת 1986).
- תפקידים אפשריים נוספים של חומצה פירוגלוטמית: ביונקים הרמה של חומצה פירוגלוטמית ושל האנזים היוצר אותה γ-GCT, גבוהים משמעותית ברקמת העור ונראה שהיא עשויה לשמש קרם-לחות טבעי (Marstein וחב' ב-Clin Chim Acta משנת 1973, ו-Marstein ב-J Invst Dermatol משנת 1980). הסינתזה de novo של חומצה פירוגלוטמית בתגובה לעקה אוסמוטית, מוצעת כתהליך המתרחש על ידי האנזים המובנה glutamine synthetase הגורם לציקליזציה שלחומצה גלוטמית לחומצה פירוגלוטמית בהיעדר אמוניה. כמו כן הודגם בעכברים ובחולדות שיש לחומצה פירוגלוטמית השפעה מסייעת בסוכרת type 2, מה שכנראה מתרחש דרך מודיפיקציה של מטבוליזם של גלוקוזה ושל ליפידים (Yoshinari ו-Igarashi ב-Br J Nutr משנת 2011).
oxoprolinuria-5, פגמים במעגל γ-glutamyl, חמצת מטבולית מצריכת acetaminophen או מציסטינוזיס
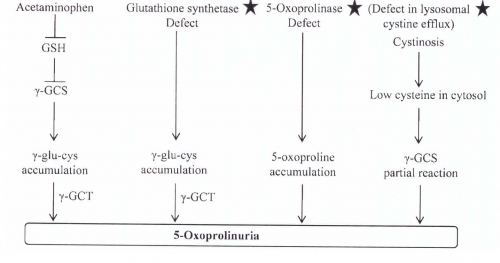
oxoprolinuria-5 אינה מתרחשת באנשים בריאים, וכמות חומר זה בשתן נעה בין 0.5-5.0 מיליגרם ליום, אלא שבמצבים פתולוגיים היא עלולה להגיע ל-50 גרם ליום (Ristoff ו-Larsson ב-Orphanet J Rare Dis משנת 2007). קיים למעשה מגוון של 4 מצבים פתולוגיים שעלולים לגרום ל-oxoprolinuria-5 (תרשים למטה).
חסכים בשלב של glutathione syntheatse (להלן GS) היא הסיבה לרוב המקרים של oxoprolinuria-5 (על פי Wellner וחב' ב-Proc Natl Acad Sci USA משנת 1974). האנזים GS אחראי לסינתזה של גלוטתיון מהקודמן שלו γ-glu-cys (על פי Snoke ב-J Biol Chem משנת 1955). שגיאה בשלב זה גורמת לרמה מופחתת של גלוטתיון, ולהצטברות של γ-glu-cys, המשמש מצע של γ-GCT, המייצר חומצה פירוגלוטמית מ- γ-glu-cys. האנזים הראשון במסלול הביוסינתזה של גלוטתיון, γ-glutamylcysteine synthetase, נמצא בוויסות של משוב על ידי גלוטתיון (Richman ו-Meister ב-J Biol Chem משנת 1975). רמות נמוכות של גלוטתיון כתוצאה מפגם בשלב ה-GS, משחררות את האנזים γ-glutamylcysteine synthetase מעיכוב פעילותו כתוצאה ממשוב זה, ולכן יש יצירה של יותר γ-glu-cys בתרחיש זה. מצב זה ליצירת-יתר של חומצה פירוגלוטמית עולה מעבר ליכולת האנזים oxoproline-5 (אנזים אטי יחסית) להסב אותה לחומצה גלוטמית, ולכן יש עלייה ברמת חומצה פירוגלוטמית בנוזלי גוף כדם, נוזל שדרה, ובשתן (Larsson ו-Mattsson ב-Clin Chim Acta משנת 1976). מצב זה מוביל לחמצת מטבולית חמורה, לאנמיה המוליטית, ולפגיעה בתפקוד ה-CNS (על פי Dahl וחב' ב-Hum Mol Genet ב-1997). נכון לשנת 2012 בסך הכול דווח על 70 מטופלים ברחבי העולם עם oxoprolinuria-5 כתוצאה מפגם באנזים GS.
פגם באנזים oxoprolinase}}f{{-5 התברר גם כגורם ל-oxoprolinuria-5 אם כי תרחיש זה אינו שכיח וחמור כמו במפגע הנובע מחסר או מפגם באנזים γ-glutamylcysteine synthetase (על פי Larsson וחב' ב-Acta Paediatr Scand משנת 1981, ו-Roesel וחב' ב-J Inherit Metab Dis משנת 1981). חסר של oxoprolinase-5 היא מחלה אוטוזומאלית-רצסיבית נדירה ביותר. נכון לשנת 2012 אותרו בספרות רק 8 מטופלים מ-6 משפחות, שזוהו על בסיס רמות גבוהות במיוחד של חומצה פירוגלוטמית בשתן, למרות שהייתה להם בתאים רמה נורמאלית של האנזים GS, ולא נמצאה אצלם חמצת מטבולית. תרחיש של oxoprolinuria-5 הנגרמת על ידי צריכת acetaminophen נמצא בקו עליה. ידוע שצריכת תרופה זו מדלדלת את מלאי הגלוטתיון דרך מטבוליט הביניים N-acetyl-p-benzoquinone imine או NAPQI. חומר ביניים אחרון זה נקשר באופן בלתי-הפיך עם גלוטתיון, ובכך משחרר את האנזים γ-glutamylcysteine synthetase מעיכוב על ידי משוב של גלוטתיון, וכך מצטבר γ-glu-cys וכפועל יוצא גם חומצה פירוגלוטמית (Humphreys וחב' ב-Am J Kidney Dis משנת 2005, ו-Lawrence וחב' ב- J Am Osteopath Assocמשנת 2010). מעניין לציין שחמצת מטבולית על רקע acetaminophen מדווחת באופן בלעדי בנשים.
oxoproliuria-5 נתגלה במטופלים עם ציסטינוזיס. זו מחלה תורשתית הנגרמת על ידי פגם ב-CTNS, שהוא טרנספורטר ליזוזומאלי של ציסטין, מתאפיינת על ידי הפקעה של ציסטין בליזוזום, מה שגורם לאי-תפקוד של האבוביות הקריבניות בכליות (Town וחב' ב-Nature Genet משנת 1998). היבט עיקרי בפתופיזיולוגיה של מפגע זה הוא החסר של ATP בתאים ציסטינוטיים, חסר שאינו נובע מירידה בסינתזה של ATP (על פי Levtchenko וחב' ב-Pediatr Res משנת 2006). תצפית בחולים עם ציסטינוזיס נפרופתית, הראו שהם מפרישים בשתן חומצה פירוגלוטמית ברמות הגבוהות כמעט פי-60 מרמתו בשתן תקין (Rizzo וחב' ב-J Inherit Metab Dis משנת 1999). הסבר אפשרי הוצע על ידי Kumar ו-Bachhawat ב-J Biosci משנת 2010, ולפיהם פגם בגן של cystinosin גורם לכך שהתא אינו מסוגל להגיע לרמות מספיקות של ציסטאין בציטוזול. נתון זה יכול לגרום ליצירת חומצה פירוגלוטמית דרך ריאקציה חלקית בלבד של האנזים γ-GCT, שכן ידוע שאם אנזים זה נכשל במציאת ה-acceptor (ציסטאין) של γ-glutamyl phosphate, עובר γ-glutamyl phosphate המשופעל ציקליזציה עצמית ליצירת חומצה פירוגלוטמית.
צריכת acetaminophen כגורם ל-pyroglutamic aciduria
צריכת-יתר (overdose) של acetaminophen היא בפירוש צריכת היתר הפרמצבטית השכיחה ביותר בארצות המפותחות (Liss וחב' ב-Clin Toxicol משנת 2013). מספר המקרים המתוארים בספרות הרפואית על pyroglutamic aciduria מועט ביותר, אם כי הביטוי הקליני של תרחיש זה עלול להיות משמעותי בהחלט. בשנת 1989 דיווחו Creer וחב' ב-Clin Chem על אישה בת 52 שהגיעה לאשפוז עם תופעות נירולוגיות וקשיי נשימה, באשפוזה אובחנה חמצת מטבולית חמורה עם anion gap מחושב של 27 מילימול'/ליטר, אך רמת חומצה לקטית הייתה בתחום הנורמה ללא גופי קטו, סליצילטים, מתנול או אתילן-גליקול. האישה הייתה ידועה כצרכנית כרונית של acetaminophen, שנטילתו הופסקה בעת אשפוזה. הצעד האחרון הביא לירידה מידית של חומצה פירוגלוטמית בדם וכן בשתן במקביל לירידה ב-anion gap ב-50% עד לערך של 13 מילימול'/ליטר.
בשנת 1990 דיווחו Pitt וחב' ב-J Inherit Metab Dis על מקרה דומה של מאושפזת שצרכה aceaminophen באופן כרוני. כיוון שרמת האנזימים glutathione synthetase ו-oxoprolinase-5 בפיברובלסטים שנלקחו מעורה היו תקינות, נראה היה שהצריכה הממושכת של acetaminophen היא שהייתה אחראית ליצירת חסר בגלוטתיון שהביאה ליצירת עודף ב-oxoproline-5. בהמשך דיווחו Pitt ו-Hauser ב-Clin Chem משנת 1998 על 11 מקרים נוספים בהם צריכה ממושכת של acetaminophen גרמה ל-pyroglutamic aciduria.
גם Kortmann וחב' תיארו בשנת 2008 שלושה מקרים של נשים הולנדיות בגיל חידלון הווסת, שהגיעו לאשפוז עם תסמינים שונים, שהבולט בהם היא חמצת מטבולית ו-anion gap מעל 30 מילימול'/ליטר. בכל שלושת המקרים טופלו נשים אלו על ידי flucloxacillin בשל זיהומים כרוניים בדרכי השתן במינונים יומיים שנעו בין 2-12 גרם, וכן טופלו על ידי acetaminophen במינון של 1-2 גרם ליום לשיכוך כאבים בעיקר מסיבות של arthritis. רמת oxoproline-5 בשתן נמדדה אצלן בין 4,200 ל-16,600 מיקרומול'/מילימול' קראטינין, כאשר רמת הנורמה נמוכה מ-100 מיקרומול'/מילימול' קראטינין. הפסקת הטיפולים במהלך האשפוז בתכשיר האנטיביוטי וב-acetaminophen הפחיתה תוך ימים אחדים את רמת oxoproline-5 לרמתו התקינה, תוך שיפור במצב הקליני.
בשנת 2000 תיארו Dempsey וחב' ב-Crit Care Med על 4 מקרים של נשים בטווח הגילים שבין 54 ל-80 שנה, שהגיעו לחדר מיון עם תסמינים שונים של קוצר נשימה, anion gap מוגבר, ואחת מהן על סף מצב של תרדמת. בכולן נמצאה חמצת מטבולית, עם רמות תקינות של חומצה לקטית וגופי קטו, עם רקע של מספר שבועות של טיפול ב-acetaminophen לשיכוך כאבים שונים. הפסקת הטיפול האחרון הביאה להעלמות כמעט מוחלטת של oxoproline-5 בשתן. מסקנת והצעת חוקרים אלה היא כדלקמן: "כאשר אנשים מגיעים לאשפוז עם anion gap גבוה, חמצת מטבולית שלא ניתן לייחס לסיבות שכיחות יותר כמו ketoacidosis, lactic acidosis, או שתייה לא מודעת של חומרים טוקסיים כמו paraldehyde ,salicylates, מתנול או אתילן גליקול, יש לקחת בחשבון אפשרות של pyroglutamic aciduria ולשלוח למעבדה דגימת שתן למדידה של חמצה פירוגלוטמית". יש להדגיש ש-82% מהמקרים שדווחו עד כה כמקרים של חמצת מטבולית ו-anion gap מוגבר היו התרחשו בנשים (Fenves וחב' ב-Clin J Am Soc Nephrol משנת 2006).
דיווח עדכני משנת 2016 ב-J Med Case Reports של Lanoy ו-Bouckaert מדגים יפה את השילוב של טיפול ב-flucloxacillin ו-acetamionophen כגורם אטיולוגי מובהק להתרחשות של 5-oxoproliuria. מדובר באישה בת 82 שנה שהובהלה ליחידת טיפול נמרץ בגין הלם ספטי כתוצאה מזיהום ב-MRSA שטופל משך 10 ימים טרם אשפוזה ב-flucloxacillin בעירוי ורידי במינון של 2 גרם 6 פעמים ביום ו-rifampicin, וכן acetaminophen בעירוי ורידי במינון של 1 גרם 4 פעמים ביום, ופיתחה חמצת מטבולית עם anion gap גבוה. כיוון שנשללה אצלה האפשרות של בליעת חומרים טוקסיים הידועים כגורמים לתרחיש זה, ואף רמות D-lactate היו שליליות, נעשתה אנליזה של השתן בה התגלתה רמה גבוהה של חומצה פירוגלוטמית (9,789 מיקרומול'/מילימול' קראטינין). הפסקת הטיפול ב-flucloxacillin וב-acetaminophen הביא לשיפור מידי במצבה, התפוגגות החמצת המטבולית וירידה ברמת חומצה פירוגלוטמית לתחום הנורמה. מטופלת זו שוחררה לביתה לאחר 8 ימים.
מספר המקרים המתוארים בספרות הרפואית על pyroglutamic aciduria מועט ביותר, אם כי הביטוי הקליני של תרחיש זה עלול להיות משמעותי בהחלט. בשנת 1989 דיווחו Creer וחב' ב-Clin Chem על אישה בת 52 שהגיעה לאשפוז עם תופעות נירולוגיות וקשיי נשימה, באשפוזה אובחנה חמצת מטבולית חמורה עם anion gap מחושב של 27 מילימול'/ליטר, אך רמת חומצה לקטית הייתה בתחום הנורמה ללא גופי קטו, סליצילטים, מתנול או אתילן-גליקול. האישה הייתה ידועה כצרכנית כרונית של acetaminophen, שנטילתו הופסקה בעת אשפוזה. הצעד האחרון הביא לירידה מידית של חומצה פירוגלוטמית בדם וכן בשתן במקביל לירידה ב-anion gap ב-50% עד לערך של 13 מילימול'/ליטר.
טיפול בנוגד הפרכוסים vigabatrin כגורם לפירוגלוטיק אאצידוריה
בשנת 1989 התפרסם ב-Lancet דיווח של Bonham וחב' על 2 תינוקות בגילים 14 ו-15 חודשים, שטופלו ב-vigabatrin ואובחנה בהם הפרשה ניכרת חומצה פירוגלוטמית בשתן, שלא הייתה קיימת בהם קודם לתחילת הטיפול בתרופה זו. לא אובחנה ב-2 תינוקות אלה חמצת מטבולית, האופיינית להפרשה ניכרת של חומצה פירוגלוטמית במקרים של חסר אנזימטי מולד במעגל ה-γ-glutamyl עם חסר באנזימים glutathione synthetase או oxoprolinase-5. הועלתה ההשערה ש-vigabatrin מעכב במערכת העצבים המרכזית את האנזים γ-aminobutyric acid aminotransferase, וייתכן שההפרעה של תכשיר זה ברמת מעגל γ-glutamyl, עלולה להתרחש אם קיימות הפרעות בתהליך הסינתזה של גלוטתיון. מצב זה עלול להיות משמעותי במיוחד במצבים של favism על רקע חסר של האנזים G6PD, או בנטילת יתר של acetaminophen בו יש דרישת יתר לגלוטתיון.
במרכז הרפואי שיבא אובחנה אישה בת 75 שנה, עם חמצת מטבולית קשה, ספסיס חמור (CRP מעל 275 מיליגרם/ליטר), ו-anion gap מוגבר. בחינת השתן שלה בעזרת GC-MS הראתה שיא של חומצה פירוגלוטמית ברמה שמעל 15,000 מיקרומול'/מילימול' קראטינין הגבוהה בערך פי-200 מרמתו הנורמאלית של חומצה אורגנית זו בשתן תקין. חולה זו הייתה מטופלת תקופה ממושכת ב-vigabatrin.
דיאטות מלאכותיות כסיבה לרמה מוגברת של חומצה פירוגלוטמית
אחד הדיווחים המוקדמים על pyroglutamic acidemia הייתה זו של Oberholzer וחב' משנת 1975 ב-Clin Chim Acta. היו אלה 4 מטופלים שניזונו מדיאטה נטולת-לקטוזה (בפורמולה הידועה כ-Nutramigen) במקרים של gastroenteritis או של אי-סבילות ללקטוזה. כל המקרים המתוארים התאפיינו בחמצת מטבולית, עם רמות גבוהות של חומצה פירוגלוטמית בדם ובשתן, כאשר בשתן נמדדו רמות שמעל 1,700 מיליגרם/גרם קראטינין. בכל המקרים כאשר הופסקה הדיאטה המתוארת, פחתו רמות חומצה פירוגלוטמית בשתן תוך 24 שעות לשליש מערכן המקורי. בתכשיר ה-Nutramigen תכולת החנקן מורכבת מקזאין שעבר הידרוליזה, ולכן יש להניח שפורמולות אחרות המכילות קזאין מבוקע כגון Pregestimil תגרומנה אף הן להגברה ניכרת ברמת חומצה פירוגלוטמית. הפורמולה Nutramigen מכילה 600 מיליגרם של חומצה פירוגלוטמית /100 גרם של אבקה (Larson וחב' ב-Acta Pediatr Scand משנת 1981).
שיטות למדידת חומצה פירוגלוטמית ו-oxoprolinase-5, גורם מעכב בחקר חומצה פירוגלוטמית
לעתים התקדמות מחקר בתחום ביולוגי כלשהו, מתעכבת או מוגבלת ב-assay נוח לביצוע, וזה גם היה רלוונטי בתחום החומצה הפירוגלוטמית ו-oxoprolinase-5. אנזים זה ביונקים הוא אנזים אטי, ודורש שיטת קביעת פעילות רגישה על מנת ללמוד את פעילותו. מספר שיטות מוקדמות לקביעת oxoproline-5 סבלו מחסרונות שונים, ואחד מאלה, המשמש עד היום, מבוסס על גילוי של חומצה גלוטמית מסומנת באופן רדיואקטיבי, הנוצרת על ידי הפעולה של האנזים על המצע oxoproline-5 המסומן. אך בשיטה זו יש להפריד בין החומצה הפירוגלוטמית המסומנת רדיואקטיבית שלא עברה הידרוליזה לבין חומצה גלוטמית מסומנת אף היא, מה שניתן להשיג בעזרת כרומטוגרפיה של ion exchange. שיטה זו תוך שימוש בעמודת +Dowex 50 H ארוכה ומייגעת.
כיוון ש-oxoprolinase-5 הוא אנזים תְלוי-ATP, הפוספאט האנאורגני המשתחרר מפעילות ATPase של 5-oxoprolinase נוצל לצורך ה-assay של האנזים. אלא ששיטה זו אינה ספציפית דווקא לאנזים זה שכן ATPases שונים עלולים להשפיע עליו. שיטות נוספות כללו כרומטוגרפיה על נייר, בהן חומצה פירוגלוטמית הוסבה ל-glutamyl hydroxamate ואז נמדדה באופן קולורימטרי, או בשיטה ספקטרופוטומטרית המבוססת על זיהוי של ציסטאין הנוצר מפעולת oxoprolinase-5 על OTC שהוא אנאלוג של חומצה פירוגלוטמית המכיל גופרית ומשמש מצע ל-oxoprolinase{{כ]}-5 (על פי Mochizuki ב-Arch Microbiol משנת 1999), אלא ששיטות אלה הן בעלות רגישות נמוכה, כאשר שיטת OTC אף אינה עובדת עם מצע טבעי.
גילוי חומצה גלוטמית נוסה גם כשיטת כימות של oxoprolinase-5. על ידי דריבטציה של חומצה גלוטמית עם O-phthaldialdeyde בנוכחות של thiol, מלווה על ידי הפרדת התוצר בשיטת HPLC (על פי Weber וחב' ב-J Biochem Biophys Methods משנת 1999). אך שיטה זו גוזלת זמן רב, ולכן נוסתה שיטה אחרת בה מגלים חומצה גלוטמית על ידי מדידת H2O2 הנוצר, אך למרות רגישות שיטה זו היא מסורבלת לביצוע (Watanabe וחב' ב-Biol Pharm Bull משנת 2004. לאחרונה פיתחו Kumar ו-Bachhawat שיטה פלואורימטרית פשוטה ומאוד רגישה, המבוססת על Amplex-Red, שניתן למדוד חומצה גלוטמית אף בריכוז של 1 פיקומול.
הוראות לביצוע הבדיקה
את דגימת השתן השנייה של הבוקר יש לשלוח בקירור למעבדה. דגימות המטוריות במיוחד לא תתקבלנה. יש לסרכז את דגימת השתן, ולהפריד בין הנוזל לבין משקעים או גבישים אפשריים.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - בדיקות ביוכימיות
- בדיקות מעבדה - חשיפה לרעלים והרעלות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק