גורם גדילה שלייתי - Placental growth factor
| מדריך בדיקות מעבדה | |
| גורם גדילה שלייתי | |
|---|---|
| Placental growth factor | |
| שמות אחרים | PGF, PlGF |

| |
| מעבדה | כימיה בדם |
| תחום | מהלך היריון ו-preeclampsia |
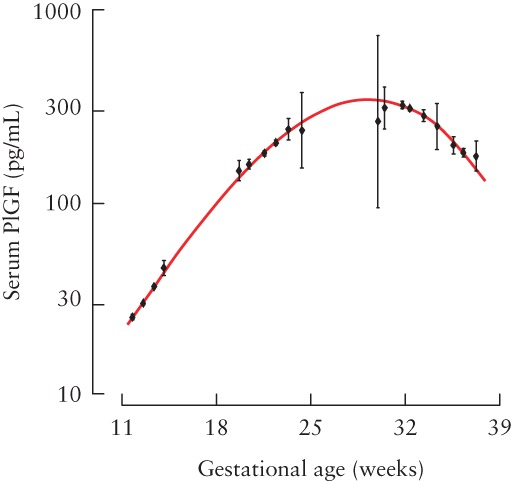
| טווח ערכים תקין | PGF מגיע לשיא של 300 פיקוגרם/מ"ל בשבוע ה-28–30 של היריון תקין |
| יוצר הערך | פרופ' בן-עמי סלע |
Placental growth factor (להלן PGF) הוא חלבון המקודד באדם על ידי הגן PGF (Maglione וחב' ב-Oncogene משנת 1993). PGF חבר במשפחת ה- VEGF או vascular endothelial growth factor, והוא מולקולת מפתח באנגיוגניות וביצירת כלי-דם. המקור העיקרי של PGF במהלך ההיריון הוא הטרופובלסט השלייתי, PGF מבוטא גם ברקמות רבות נוספות כולל הטרופובלסט של סיסי השלייה (Khalil וחב' ב-PLos One משנת 2008). PGF כרוך כאמור באנגיוגניות, והוא משחק תפקיד בגידול של טרופובלסטים ובהתמיינות. תאים טרופובלסטים, אחראיים לפלישה לעורקי האישה ההרה. התפתחות ראויה של כלי דם בשלייה הכרחית להתפתחות ראויה של העובר. בתנאים פיזיולוגיים נורמליים, PGF מבוטא גם ברמה נמוכה באיברים נוספים כמו הלב, הריאות, בלוטת התריס, ושריר השלד. ההתבטאות של PGF בתוך נגעים טרשיים כרוכה בדלקת של הרובד הטרשית ובשגשוג ה-neovascular (Khurana וחב' ב-Circulation משנת 2005, ו-Shibuya ב-BMB Rep משנת 2008).
המבנה של PGF
PGF מופרש כהומודימר מסוּכּר (glycosylated), ומכיל 6 שיירים של ציסטאין על כל מונומר היוצרים שלושה קשרים די-סולפידים תוך-מולקולריים, האחראיים למבנה תלת ממדי הידוע כ-cystine-knot motif. שני שיירי ציסטאין של כל מונומר משמשים ליצירת שני קשרים די-סולפידים תוך מולקולריים הנחוצים ליצירת ה-.homodimer כל הומודימר מכיל שני cystine-knot motifs הממוקמים בקטבים הנגדיים של המולקולה. למרות ש-PGF באדם מראה רק 42% של זהות חומצות אמינו עם החבר הפעיל ביותר במשפחת VEGF, הידוע כ-VEGF-A, המבנה התלת ממדי של PGF שנבחן ברמת רזולוציה של 2.0Å והושווה לזה של VEGF-A, הצביע על זהות טופולוגית בין 2 החלבונים (Muller וחב' ב-Structure משנת 1997, ו-Iyer וחב' ב-J Biol Chem משנת 2001).
הדימר PGF-1 מורכב מ-2 גדילי (helices) אלפא, ומ-7 שזירי (strands) בטא בכל מונומר, כאשר שני המונומרים קשורים ביניהם על ידי 2 קשרים דיסולפידיים בצורה אנטי-מקבילה. אנליזה מבנית וזאת של מוטגנזה, הצביעה על כך ש-2 שיירים טעונים יחסית (Asp 72 ו-Glu73) הממוקמים בלולאה beta3-beta4, הם קריטיים לקישור של דימר זה לקולטן (Errico וחב' ב-J Biol Chem משנת 2004). שיירים נוספים החיוניים להכרת הקולטן ממוקמים ב-alfa-helix ה-N-טרמינלי, כמו גם ב-beta6 strand. מוטציה באחד (Asn84) משני השיירים המסוכרים של PGF, קובע פעילות קישור מופחתת לקולטן, מה שמראה שבניגוד ל-VEGF-A, גליקוזילציה משחקת תפקיד חשוב בקישור לקולטן.
הפעילות הביולוגית של PGF
PGF הוא החבר השני במשפחת VEGF שהתגלה. שם החלבון מתייחס לשלייה כיוון שהוא שובט מספריה של cDNA שלייתי מאדם (Maglione וחב' ב-Proc Natl Acad Sci USA משנת 1991). הגן האנושי PGF מופיע על כרומוזום 14 בעמדה 14q24, בעוד שגן זה בעכבר מופה על כרומוזום 12. שני הגנים מורכבים מ-7 אקסונים (Maglione וחב' ב-Oncogene משנת 1993, ו-DiPalma וחב' ב-Mamm Genome משנת 1996). כמו חברים אחרים במשפחת VEGF, איזופורמים שונים מקודדים על ידי הגן PGF כתוצאה מ-splicing חלופי (Ferrara וחב' ב-Nat Medicine משנת 2003, ו-Takahashi ו-Shibuya ב-Clin Sci משנת 2005). הגן מקודד ל-4 איזופורמים (PlGF 1-4), המורכבים מ-131, 152, 203 ו-224 חומצות אמינו בהתאמה, לאחר הסרת ה-signal peptide שאורכו 18 חומצות אמינו (Cao וחב' ב- Biochem Biophys Res Commun משנת 1997, ו-Yang וחב' ב- J Reprod Immunol משנת 2003).
איזופורמים של PGF
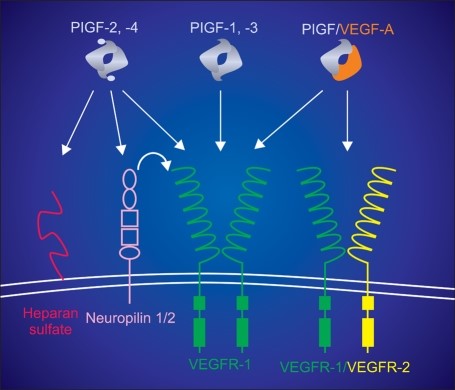
ההבדל העיקרי בין ארבעת האיזופורמים הוא בכך ש-PGF-1 ו-PGF-3 הם איזופורמים שאינם קושרים הפארין, בה בשעה ש-PGF-2 ו-PGF-4 הם איזופורמים עם מקטעים של 21 חומצות אמינו מאוד בסיסיים בעלי יכולת קישור להפארין (Hauser ו-Weich ב-Growth Factors משנת 1993, ו-Maglione וחב' באותו כתב עת משנת 1993). לעומת זאת, הגן PGF בעכברים מקודד לאיזופורם בודד, PlGF-2, המסוגל לקשור הפארין ומורכב מ-140 חומצות אמינו בצורתו הבשלה.
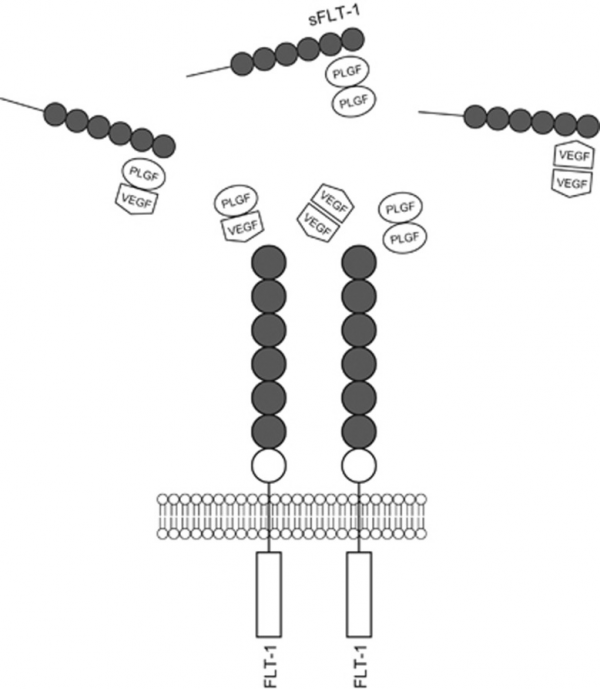
מבין ארבעת האיזופורמים של PGF, PGF-1 ו-PGF-2 הם הנפוצים ביותר, ובשעת היריון הם מופרשים תוך תיאום חזק. הנוכחות של מקטעים קושרי הפארין ב-2 האיזופורמים PGF-2 ו-PGF-4, מצביעה על כך ששניהם נשארים קשורים לממברנה, ופועלים באופן אוטוקריני, ואילו האיזופורמים המסיסים משפיעים על יעדיהם באופן פאראקריני. עכברים מייצרים רק את הווריאנט PGF-2. נמצא ש-PGF נקשר ל-VEGFR-1 או ל-FLT-1 ולצורה המסיסה sFLT-1, אך אינו נקשר ל-VEGFR-2 (הידוע גם כ-KDR או Kinase insert domain receptor) וכן ידוע כ-FLK-1 או fetal liver kinase-1). PGF נקשר גם ל-NP-1 או neurophillin receptor-1, שהתגלה בשלייה אך תפקידו עדיין לא ברור (Arad וחב' ב-Int J Gynecol Pathol משנת 2016).
יתרה מכך, בדומה לאיזופורמים אחרים של חברים במשפחת VEGF, המסוגלים לקשור הפארין, PGF-2 מסוגל לקשור את שני הקולטנים neurophilin-1 ו-neurophilin-2, שהתגלו כ-co-receptors של class 3 sematophorins על ידי שהם מזהים את המקטעים b1b2 של ה-sematophorins (Migdal וחב' ב-Biol Chem משנת 1998, Mamluk וחב' ב-J Biol Chem משנת 2002, ו-Gaur וחב' ב-Clin Cancer Res משנת 2009).
הביטוי של PGF
PGF מבוטא באופן יוצא דופן בשלייה בכל שלבי ההיריון. כיוון ש-PGF מפקח על הגידול וההתמיינות של הטרופובלסט (Khaliq וחב' ב-Growth Factors משנת 1996), הנתון הזה מצביע על חשיבות PGF בשלב החדירה של הטרופובלסט לתוך ה-decidua (שהיא השכבה ברירית הרחם) (Vuorela וחב' ב-Biol Reprod ב-1997). אנליזות אימונו-היסטוכימיות גילו את הנוכחות של PGF בממברנה הואקולו-סינסיציאלית ובנוזל של כלי דם גדולים בשלייה. אנליזה בשיטת היברידיזציה in situ הראתה נוכחות של PGF ב-villous trophoblast, בעוד שבהקשר הזה נמצא ש-VEGF-A מבוטא בתאים ממקור מזנכימלי בתוך הפלטה הכוריונית אך לא בתאי השלייה. PGF מבוטא בשלב מוקדם של התפתחות העובר. אכן, עותקים המקודדים ל-PGF מעכבר היו בשפע בתאי הענק הטרופובלסטיים, הכרוכים עם שק החלמון הפרייטאלי בשלבי האמבריוגנזה המוקדמים מה שמרמז לתפקיד של PGF בקואורדינציה של וסקולריזציה ב-deciduum ובשלייה בשלבי אמבריוגנזה מוקדמים (Achen וחב' ב-Growth Factors משנת 1997). בנוסף, PGF מבוטא ברמה נמוכה במספר איברים אחרים כמו הלב, ריאות, תירואיד, שריר שלד ורקמת השומן בתנאים פיזיולוגיים נורמליים (Viglietto וחב' ב-Oncogene משנת 1995, ו-Voros ב-Endocrinology משנת 2005).
ברמה התאית, הביטוי של PGF הודגם בתאי אנדותל (Hauser ו-Weich ב-Growth Factors משנת 1993), בתאי תירואיד, בפיברובלסטים מותמרים מעוברי עכברים, ובשורת תאי מעוברי עכברים, ובשורת תאי 3T3 מעכבר. בשונה מ-VEGF-A, הביטוי של PGF מתרחש רק במספר מצומצם של שורות תאים ממקורות של גידולים סרטניים (Cao ב-Sci Signal שנת 2009).
התפקיד של PGF באנגיוגניות
הראייה הראשונה לכך ש-PGF הוא גורם מעודד אנגיוגניות התפרסמה בשנת 1997 על ידי Ziche וחב' ב-Lab Invest, שהדגימו ש-PGF-1 הישרה תגובה אנגיוגנית בקרנית של ארנבות ובממברנה הכוריו-אלנטואית של עוברי תרנגולת. בהמשך, יצירת עכברי knockout משוללי PGF, סייעה רבות להבנת תפקידיו הביולוגיים של PGF. למרות הריכוז הגבוה של PGF בשלייה, חסר של גורם זה לא פגע בהתפתחות הנורמלית של עכברים אלה. למעשה, עכברים משוללי PGF, נולדים בריאים ופוריים. PGF חיוני לאנגיוגניות פיזיולוגית המושרית בלב ובשריר על ידי פעילות גופנית (Gigante וחב' ב-Angiogenesis משנת 2004). נתון זה מצביע על כך ש-PGF מְיֻתָּר להתפתחות הווסקולרית ולתחזוק הפיזיולוגי של עכברים מבוגרים בריאים. עם זאת, בעכברי knockout מבוגרים ומשוללי PGF, נפגעת האנגיוגניות והתהליך של יצירת עורקיקים, במהלך תהליכים של שגשוג גידולים, ותהליכי איסכמיה של הלב והעין (Pipp וחב' ב-Circ Res משנת 2003, ו-Rakic וחב' ב- Invest Ophthalmol Vis Sci משנת 2003). במודל אחר של עכברי knockout כפול לחסר PGF וכן לחסר האנזים enodothelial nitric oxide synthase (או eNos), התחזקו הראיות לחשיבות PGF באנגיוגניות פתולוגית. עכברים שהם eNos -/- וגם PGF -/-, הראו אנגיוגנזה מופחתת במצבים פתולוגיים (Murohara וחב' ב-J Clin Invest משנת 1998). מודל זה בחיות הוא הראשון שמצביע על פגם באנגיוגניות המאפשר למקד את הקשר הפונקציונלי בין PGF ל-eNOS (Gigante וחב' ב-FASEB J משנת 2006).
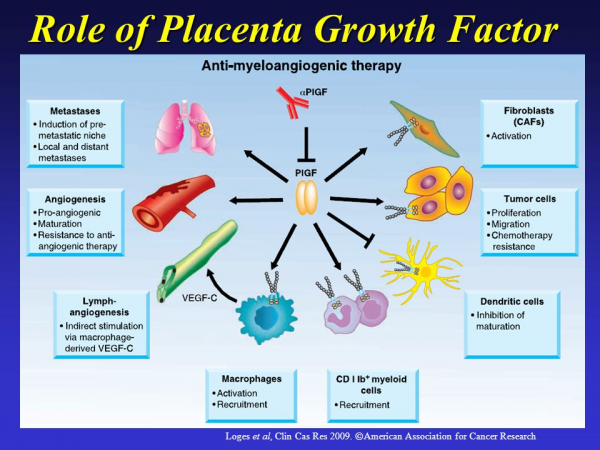
במחקרים אחרים נוצרו עכברים טרנסגניים המבטאים ביתר את PGF בעור תחת הפיקוח של פרומוטר של keratin-14, ואלה הראו עלייה ניכרת במספר כלי הדם הדרמליים, כמו גם בהסתעפות ובגודל של כלי-דם אלה, עם עליה משמעותית של כלי דם עתירי שריר חלק (Odorisio וחב' ב-J Cell Sci משנת 2002). בהתאם, טרנספר בסיוע של נגיף adeno ללב ולגפה אחורית איסכמיים היה מסוגל לגרום לתגובה אנגיוגנית חזקה, וליצירת כלי-דם גדולים אחדים, עם יעילות שניתן כמעט להשוות אותה לזו של VEGF-A. טיפול עם PGF רקומביננטי סייע משמעותית במצבים איסכמיים (Autiero וחב' ב-Nat Med משנת 2003). PGF עשוי לעודד ישירות צמיחת כלי-דם על ידי פעולתו על גדילה, נדידה והישרדות של תאי-אנדותל (Adini וחב' ב-Cancer Res משנת 2002, ו-Fischer וחב' ב-Cell משנת 2007), על הבשלת כלי-דם על ידי הגדלת השגשוג והגיוס של תאי שריר חלק, ושל פיברובלסטים (Yonekura וחב' ב-J Biol Chem משנת 1999, ו-Bellik וחב' ב- Br J Pharmacol משנת 2005). יתרה מכך, PGF קריטי לגיוס ולהבשלה של פרוגניטורים ממקור של מח עצם הכרוכים בתהליך אנגיוגני (Hattori וחב' ב-Nat Med משנת 2002, ו-Rafii וחב' ב- Ann N Y Acad Sci משנת 2003), וכן לסייע להתמיינות ולשפעול של שורת המונוציטים-מקרופאגים המסוגלים לסייע לגירוי האנגיוגני (Clauss וחב' ב-J Biol Chem משנת 1996, Scholz וחב' ב- J Mol Cell Cardiol משנת 2003, ו-Selvaraj וחב' ב-Blood משנת 2003).
הספקטרום הרחב של הפעילות הפאראקרינית של PGF נקשר ישירות לביטוי של הקולטן VEGFR-1 בשורות תאים רבות (Fischer Nat Rev Cancer משנת 2008). התפקיד הספציפי של PGF במצבים פתולוגיים קיבל אישור נוסף על ידי התצפית שבמהלך אנגיוגניות פתולוגית, PGF ותאים אנדותליאליים נמצאים במרכז התהליך (Ponticelli וחב' ב- J Biol Chem משנת 2008), כמו גם תאי שריר חלק, פיברובלסטים (Green וחב' ב-Cancer Res משנת 2001), פרוגניטורים של מח עצם Lyden) וחב' ב-Nat Med משנת 2001, ו-Hattori וחב' באותו כתב-עת ומאותה שנה), כאשר כל התאים הללו מתחילים לבטא PGF. כיוון שתאים אלה מבטאים גם כן את הקולטן VEGFR-1, PGF מפעיל פעילות אוטוקרינית לסייע לאנגיוגניות.
אנגיוגניות הוא תהליך ביולוגי מסובך החיוני להתפתחות העובר ולגדילה לאחר הלידה. בחיי המבוגר אנגיוגניות הוא תהליך המוגבל לרחם ולשחלות בפאזות השונות של המחזור החודשי, כמו גם ללב ולשרירי השלד לאחר פעילות גופנית ממושכת ורצופה. לעומת זאת, אנגיוגניות היא גם תהליך התורם לפתוגניות כמו בסרטן, טרשת עורקים, דלקת מפרקים, רטינופתיה סוכרתית וניוון של המאקולה בגיל המתקדם. בין הגורמים המשתתפים בתהליך האנגיוגניות, נכללים מספר חברים של משפחת VEGF-B ,VEGF-A ,VEGF ו-PGF. כמו כן, משתתפים בתהליך האגיוגניות הקולטנים הרלוונטיים VEGFR-1, ו-VEGFR-2.
הפעילות התומכת באנגיוגניות של חברי משפחת VEGF, מתבצעת דרך קישור ושפעול של שני קולטנים טירוזין קינאזה (TK), שזוהו במקור כקולטנים ל-VEGF-A, שהם VEGFR-1 (de Vries וחב' ב-Science משנת 1992) ו-VEGFR-2 (Terman וחב' ב-Biochem Biophys Res Commun משנת 1992). קולטנים אלה מורכבים מ-7 מקטעים חוץ-תאיים דמויי-Ig, ממקטע טרנס-ממברנלי וממקטע TK תוך-תאי. הקישור של ליגנדים משרה דימריזציה של הקולטן, ופוספורילציה. למרות הדמיון במבנה התלת-ממדי עם VEGF-A, ל-PGF ישנה היכולת להיקשר באופן בלעדי ובזיקה גבוהה לקולטן VEGFR-1 (Park וחב' ב-J Biol Chem משנת 1994), זאת בהשוואה ל-VEGF-A ול-VEGF-B, שני החברים האחרים במשפחה המסוגלים להיקשר לקולטן VEGFR-1 (Olofsson וחב' ב-Proc Natl Acad Sci USA משנת 1998). מקטע הקולטן המינימלי הדרוש להתקשרות של VEGF-A, של VEGF-B ושל PGF, הוא המקטע דמוי-Ig-2 כפי שתועד באנליזה תלת-ממדית של גבישי הקולטן ברזולוציה של 1.7 אנגסטרום (Wiesmann וחב' ב-Cell משנת 1997), וכן על פי Christinger וחב ב-J Biol Chem משנת 2004, ו-Iyer וחב' ב-J Biol Chem משנת 2001).
התפקיד של PGF במחלות שונות
המחקר על PGF באנגיוגניות פתולוגית סיפק אפשרות לייחס לציר PGF/VEGFR-1 תפקיד מרכזי בשפעול ובתחזוק של המהפך הדלקתי הכרוך עם האנגיוגניות. יתרה מכך, הרבה סוגים אחרים של תאים המבטאים PGF במצבים פתולוגיים, כמו קרטינוציטים (Odorisio וחב' ב-J Dermatol Sci משנת 2006), קרדיו-מיוציטים (Luttun וחב' ב-Nat Med משנת 2002), תאי פיגמנט אפיתליאליים של הרשתית (Hollborn וחב' ב-Graefes Arch Clin Exp Ophthalmol משנת 2006, ו-Miyamoto וחב' ב-Diabetologia משנת 2007), תאים אפיתליאליים של סמפונות הריאה (Mohammed וחב' ב-Am J Physiol Lung Cell Mol Physiol משנת 2007), ותאי סרטן (Parr וחב' ב-Eur J Cancer משנת 2005, Wei וחב' ב-Gut משנת 2005, Fischer וחב' ב-Cell משנת 2007). שדרוג זה של PGF אינו נגרם רק בגלל היפוקסיה, אלא גם כתגובה לגירויים נוספים כולל חד-תחמוצת החנקן (NO), ציטוקינים דוגמת IL-1 ו-TNFα (על פי De Ceuninck וחב' ב-Biochem Biophys Res Commun משנת 2004), גורמי גדילה כמו TGF-β1 (Yao וחב' ב-FEBS Lett משנת 2005), ואונקוגנים (Larcher וחב' ב-Mol Carcinog משנת 2003). במצבים פתולוגיים הקולטן VEGFR-1 עובר מודולציה על ידי היפוקסיה.
נתונים אלה הביאו למחקר האם PGF בעל תפקיד בפתולוגיות נוספות, מחקר שנעשה תוך שימוש בעכברי knockout. כך נמצא ש-PGF משחק תפקיד גם בטרשת עורקים, ברגישות-יתר (delayed type) של העור, בהשמנת-יתר, בתהליכי תיקון בסחוס ובעצם ובדלקת פרקים שגרונית (RA) (Carmeliet וחב' ב-Nat Med משנת 2001, Oura וחב' ב-Blood משנת 2003, Lijnen וחב' ב-Diabetes משנת 2006, Maes וחב' ב-J Clin Invest משנת 2006, ו-Yoo וחב' ב- Arthritis Rheum משנת 2009). בכל המודלים הפתולוגיים שנלמדו, חסר של PGF מנע את הדלקת הנלווית ו/או את האנגיוגניות, מה שגרם להפחתה כללית בסטאטוס הפתולוגי. בנוסף, במודל של תיקון שבר, הודגם ש-PGF מסוגל לשפעל גם תהליכים בלתי-צפויים, בכך שהוא השרה שגשוג והתמיינות אוסטאוגנית של פרוגניטורים מזנכימאליים, ובכך לעודד תהליכי turnover של הסחוס, כמו גם עיצוב מחדש של עצם חדשה, על ידי עידוד של התמיינות של האוסטאוקלסטים. כצפוי, כל סוגי התאים הכרוכים בתהליכים ביולוגים אלה, ביטאו את הקולטן VEGFR-1.
עבור קישור של PGF לקולטן VEFGR-1, למקטע דמוי-Ig 3 יש תפקיד חשוב. כמו ל-VEGF-A, הקטעים 2 ו-3 נחוצים לקישור של PGF בזיקה טבעית (Keyt וחב' ב-J Biol Chem משנת 1996). עם זאת, בהשמטה של מקטע 3 נגרמת ירידה של פי-50 בקישור של VEGF, חלה ירידה של פי-500 ביכולת הקישור של PGF למקטע 2 (Davis-Smyth וחב' ב-J Biol Chem משנת 1998). למרות ספציפיות הקישור ל-VEGFR-1, PGF מסוגל באופן בלתי-ישיר לשפעל את הקולטן VEGFR-2 בדרכים חלופיות. אפשרות אחת מיוצגת על ידי היכולת של PGF להיקשר ל-VEGFR-1, תוך שהוא דוחק ומפנה את VEGF-A מקולטן זה וגורם ל-VEGF-A להיות זמין לקישור ל-VEGFR-2. יתרה מכך, אם מבוטאים הדדית באותו תא, PGF ו-VEGF-A יכולים ליצור מבנה הטרומרי (DiSalvo וחב' ב-J Biol Chem משנת 1995), שמסוגל להיקשר ולשפעל VEGFR-1 אך גם להשרות דימריזציה של VEGFR-1/VEGFR-2 אם שני הקולטנים מבוטאים על פני אותו תא (Tarallo וחב' ב-Cancer Res משנת 2010). בנוסף, דווח שברגע ש-PGF שפעל את הקולטן VEGFR-1, גם הקולטן VEGFR-2 יכול להיות משופעל על ידי מנגנון של טרנספוספורילציה (Autiero וחב' ב- Nat Mrd משנת 2003).
בגין התפקיד העיקרי שיש לגירוי היפוקסי בשדרוג של מספר רב של גורמים המסייעים לאנגיוגניות כאשר נדרשת בנייה של כלי-דם צעירים, המחקרים לזיהוי המודולציה של ביטוי PGF ברמה המולקולרית התבצעו בעיקר במצבים של היפוקסיה. המשפיעים העיקריים ליצירת גירוי היפוקסי הם גורמי שעתוק הידועים כ-hipoxia inducible factors או HIFs (Semenza ב-Ann Rev Cell Dev Biol משנת 1999). למרות שדיווחים אחדים הצביעו על שדרוג של PGF בתאים הנחשפים להיפוקסיה, אנליזה של אזור ה-promoter/enhancer של PGF, לא הצליחה להראות אלמנט המגיב להיפוקסיה (HRE), כמו שניתן היה למצוא עבור VEGF-A והקולטן VEGFR-1 (Green וחב' ב-Cancer Res משנת 2001, Oura וחב' ב-Blood משנת 2003, ו-Salvaraj וחב' באותו כתב-עת מאותה שנה). באותו אזור, נצפתה נוכחות של מספר ניכר של רצפים הניתנים להכרה על ידי NF-κB ועל ידי metal transcription factor-1 (או MTF-1). אכן, Cramer וחב' דיווחו ב-Biol Chem משנת 2005, ש-NF-κB תורם לשעתוק של PGF וכן מגיב עם MTF-1 בתאי אדם במצבי היפוקסיה. כמו כן נמצא שביטוי-יתר של HIF-1α בתאי אנדותל (Yamakawa וחב' ב-Circ Res משנת 2003) או בתאי לב או כלי-דם (Kelly וחב' באותו כתב-עת מאותה שנה) משפיע באופן חיובי על הביטוי של PGF. תוצאות אלו מצביעות על כך ש-HIFs הם בעלי תפקיד במנגנון הבקרה של ביטוי PGF.
נתונים אלה הביאו למחקרים שנועדו לבחון האם PGF משחק תפקיד בתרחישים פתולוגיים אחרים, וגם כאן עכברי knockout משוללי pgf היוו כלי מחקרי מרכזי. נמצא גם ש-PGF משחק תפקיד בטרשת עורקים, ברגישות-יתר עורית מהסוג של delayed type, ב-obesity, בתהליכי תיקון עצם וסחוס, ובן בדלקת פרקים שגרונית (RA) (על פי Carmeliet וחב' ב-Nature Med משנת 2001, Lijnen וחב' ב-Diabetes משנת 2006, Maes וחב' ב-J Clin Invest משנת 2006, ו-Yoo וחב' ב-Arthritis Rheum משנת 2009).
בכל המודלים הפתולוגיים שנחקרו, חסר של PGF הפריע לתהליכי דלקת או אנגיוגנסיס והביא להפחתה כללית בסטאטוס הפתולוגי. בנוסף, במודל של תיקון שברים, הודגם ש-PGF מסוגל לשפעל גם מנגנונים בלתי צפויים. הוא הישרה שגשוג והתמיינות אוסטאוגנית של תאי-אב מזנכימליים, מה שגרם ל-turnover של סחוס, כמו גם ל-remodeling של עצם צעירה הנוצרת על ידי עידוד של התמיינות של תאים אוסטאוקלסטים. כצפוי, כל סוגי התאים הכרוכים בתהליכים ביולוגיים אלה מבטאים את הקולטן VEGFR-1.
המעורבות של PGF בעידוד תהליך האנגיוגניות קיבלה אישור במחקרים של gain-of-function. עכברים טרנסגניים המבטאים בעודף את PGF בעור תחת הפיקוח של keratin-14 promoter, הראו הגברה משמעותית במספר, בהסתעפות ובגודל של כלי הדם בעור, עם הגדלה ניכרת של כלי-דם בשלים המכילים תאי שריר חלק (Odorisio וחב' ב-J Cell Sci משנת 2002). בהתאם לכך, טרנספר של PGF בתיווך נגיף adeno ללב או לגפה הנמצאים באי-ספיקה, הביא לתגובה אנגיוגנית חזקה, להגדלה של מספר כלי-דם, זאת ביעילות כמעט זהה לזו המתקבלת על ידי VEGF-A. גישה זהה של העברת PGF לגידולים קסנוגניים, לא הביאה להגדלה בנפח הגידול הסרטני או בצפיפות כלי הדם, אך הגדילה את נהור (lumen) כלי-הדם, ואת בשלותם של כלי הדם (Tarallo וחב' ב-Cancer Res משנת 2010). העברה של הומודימר רקומביננטי של PGF או של הטרודימר של PlGF/VEGF-A, הגביר באופן ניכר אנגיגניות במצבים איסכמיים.
שני תפקודים חשובים תוארו ביחס ל-PGF. הראשון מתייחס למקרופאגים הקשורים לגידולים המוכרים כ-TAM. בגידולים סרטניים יש ל-TAM פעילות המשפעלת מקרופאגים, המאופיינת על ידי פעילות תומכת-דלקת, מציגת אנטיגנים וממיסה גידולים. במקרה של גידולים ממאירים, TAMs משפעלים שגשוג תאים סרטניים על ידי הגברת אנגיוגניות. זאת על ידי דיכוי של פעילות אנטי-סרטנית, ועל ידי מניעת שפעול של תאים דנדריטים, של CTLs ושל תאי NK (על פי Mantovani ו-Sica ב-Curr Opin Immunol משנת 2010, ו-Qian ו-Pollard ב-Cell משנת 2010). התפקוד השני של PlGF מתייחס לתגובה הנחוצה ל-remodeling הלבבי האדפטיבי במהלך הצרות רוחבית של אבי העורקים (tranverse aortic constriction) (Carnevale ו-Jain ב-Nature משנת 2011). תהליך ה-remodeling הלבבי, מתקדם על ידי תגובה היפרטרופית אדפטיבית מוקדמת, המאופיינת על ידי קואורדינציה של שגשוג של קרדיו-מיוציטים, אנגיוגניות ותהליכי דלקת (Hunter ו-Chien ב- N Eng J Med משנת 1999, ו-Frey ו-Olson ב-Ann Rev Physiol משנת 2003). החסר של PlGF, הוֹבִיל לדיס-רגולציה של ה-remodeling הלבבי, שמשפיע באופן שלילי על שגשוג השריר. ברמה המולקולרית, פעילות פגומה של TNF-α converting enzyme (או TACE) כתוצאה מהגדלה ניכרת של פעילות המעכב שלו TIMP-3 (או (tissue inhibitor of metalloproteinase, נצפתה (Vanhoutte ו-Heymans ב-J Mol Cell Cardiol משנת 2010). TACE חיוני לשפעול של TNF-alfa מצורתו הקשורה לממברנה, שהוא אחד האירועים המוקדמים ביותר ב-overload של הלב (Wang וחב' ב-Hypertension משנת 2009, ו-Ding וחב' ב-J Immunol משנת 2010). לכן, PGF מכוונן באופן מדויק וויסות ואיזון של הציר TIMP-3/TACE, ומאפשר את התגובה הדלקתית הנחוצה ל-remodeling האדפטיבי של הלב.
PGF ו-preeclampsia
PGF הוא סמן פוטנציאלי של preeclampsia מצב בו כלי הדם בשלייה צרים מדי וגורמים ללחץ-דם גבוה. תאים טרופובלסטים ממקור של extravillous פולשים לתוך העורקים הספירליים ברחם האישה ההרה שזהו שלב חיוני בכִּינוּן של היריון (Maglione וחב' ב-Proc Natl Acad Sci USA משנת 1991, Shore וחב' ב-Placenta משנת 1997, ו-Vuorela וחב' ב-Biol reprod משנת 1997). כישלון של טרופובלסטים לפלוש באופן סדיר לעורקים אלה מביא לכשל בהתרחבותם של העורקים, והוא אחד הגורמים ל-preeclampsia. אכן, רמות נמוכות של PGF נמצאו בנשים שאובחנו בהמשך הריונן עם preeclampsia.
רמות של PGF ושל sFlt-1 (או soluble fms-like tyrosine kinase-1 הידוע גם כ-soluble VEGF receptor-1) בנסיוב, משתנות בנשים עם preeclampsia. מחקרים הראו שבשלבים מוקדמים אך גם מאוחרים של preeclampsia, הרמות בנשים הרות של PGF נמוכות יותר, ואילו הרמות של sFlt-1 גבוהות יותר. בנוסף, הרמות של sFlt-1 בשלייה של נשים עם preeclampsia היו גבוהות משמעותית, ורמות PGF נמוכות משמעותית, בהשוואה לרמות אלה בנשים עם הריונות סדירים. נתונים אלה מרמזים שרמות sFlt-1 ו-PGF בשלייה משקפות שינויים בנסיוב של נשים הרות, והם תואמים את ההשקפה שהשלייה היא המקור העיקרי של sFlt-1 ושל PGF במהלך היריון (Achen וחב' ב-Growth Factors משנת 1997).
שלושת הטרימסטרים של היריון ורמות PGF בנסיוב: רמות PGF בשבוע ה-11–13 של ההיריון נמוכות יותר בהריונות בהן העובר אנפלואידי (מצב של כרומוזום עודף או כרומוזום חסר בתא) או בהריונות עם השרשה פגועה כתוצאה מ-preeclampsia, או בהריונות בהם היילוד קטן מהצפוי לתאריך לידתו (Zaragosa וחב' ב-Ultrasound Obstet Gynecol משנת 2009, Pandya וחב ב-Fetal Diagn Ther משנת 2012, Poon וחב' ב-Prenat Diagn משנת 2008, Alolekar וחב' באותו כתב עת משנת 2011). רמות PGF בנסיוב גם כן נמוכות בטרימסטרים ה-2 וה-3 בהריונות בהם מתפתחת preeclampsia או שהיילודים בהם נולדים קטנים מהצפוי (Lai וחב' ב-Fetal Diagn Ther משנת 2014, Chaiworapongsa וחב' ב-J Matern Getal Neonat Med משנת 2011, Velohren וחב' ב-Am J Obstet Gynecol משנת 2012, Sihiude וחב' ב-PLos One משנת 2012, ו-Chappell וחב' ב-Circulation משנת 2013).
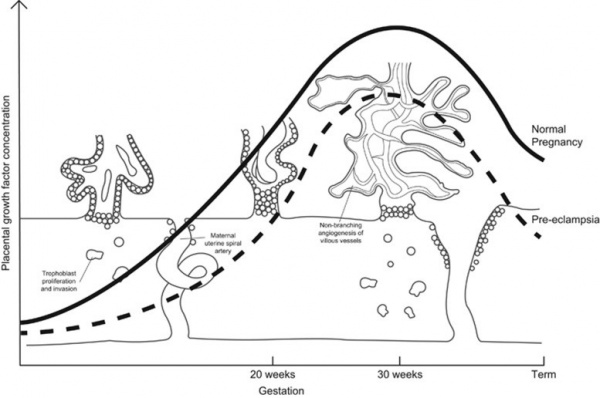
במחקר של Tsiakkas וחב' משנת 2015 ב-Ultrasound Obstet Gynecol, נמדדו רמות PGF בנסיוב של 38,002 נשים בטרימסטר ראשון להיריון, 10,281 נשים בטרימסטר השני, ו-12,392 נשים בטרימסטר השלישי. נמצאו הבדלים בלתי תלויים ברמות PGF שהיו קשורים לשלב ההיריון, לגיל האישה ההרה, למשקלה ולמוצאה האתני, לעישון, לסוכרת, למשך ההיריון, ולמשקל היילוד בלידה. נמצא שרמת PGF בנסיוב לאורך ההיריון היא בעלת אופי של עקומה (עֲקֻמָּה) כאשר שיא הריכוז מופיע בשבוע 28–30 להיריון.
כן נמצא שרמת PGF נמוכה יותר בנשים שמנות, גבוהה יותר בנשים ממוצא אפרו-קריביאני, מדרום ומזרח אסיה, וכן בנשים מעשנות במהלך ההיריון. לעומת זאת, רמת PGF נמוכה יותר בנשים עם סוכרת type 1, ואלו עם סוכרת type 2 הנזקקות לטיפול באינסולין. בנשים ולדניות (עם אחת או יותר לידות קודמות) רמת PGF בהיריון גבוהה יותר מזו של נשים שלא ילדו קודם לכן.
יתר לחץ-דם פוגע ב-10% מהנשים ההרות, ו-preeclampsia מסבכת כ-3% מההריונות של עובר יחיד (Duley ב-Semin Perinatol משנת 2009, ו-Tan וחב' ב-Ultrasound Obstet Gynecol משנת 2018). נשים עם preeclampsia הן לרוב א-תסמיניות, והאבחון של תרחיש זה מבוסס על יתר לחץ-דם, על רמת חלבון גבוהה בשתן, אך מדדים אלה חשופים להטרוגניות בבדיקות המעבדה (Villar וחב' ב-Am J Obstet Gynecol משנת 1989, ו-Durnwald ו-Mercer באותו כתב-עת משנת 2003). התצוגה של preeclampia היא לעיתים לא חד-ערכית מבחינה קלינית, מה שגורם לביקורים רבים במרפאה או אף בבית החולים, כרוך בהוצאות כספיות ומסב דאגה לאישה ההריונית.
גורמים אנגיוגניים כרוכים עם הפתו-פיזיולוגיה של preeclampsia (על פי Maynard וחב' ב-J Clin Invest משנת 2003). במחקר שפורסם על ידי Chappell וחב' ב-Circulation משנת 2013, דווח על דיוק הבדיקות השונות להערכת preeclampsia, ונמצא שרמות נמוכות של PGF היו בעלות רגישות גבוהה של 96% וערך ניבוי שלילי (NPV) של 98% באבחון של preeclampsia חמורה שחייבה הקדמת הלידה תוך 14 יום. מחקר זה מצא שהשטח תחת עקומת ROC עבור רמה נמוכה של PGF בקביעת תרחיש של preeclampsia היה 0.87, ערך גבוה משמעותית מכל הבדיקות המתבצעות בשגרה להערכת מצב זה, כגון מדידת לחץ-דם, ורמת האנזים ALT כמו גם מדידת רמת חומצת שתן. מחקרם הרב-מוסדי של Duhig וחב' ב-Lancet משנת 2019, נועד למצוא את הקשר בין PGF לבין נשים החשודות ל-preeclampsia. בין יוני 2016 ואוקטובר 2017 גויסו למחקר 1,035 נשים הרות המטופלות ב-11 מרפאות נשים ברחבי בריטניה. בין משתתפות המחקר, רמות נמוכות של PGF (מתחת ל-100 מיקרוגרם/מ"ל), היו מדד אמין ל-preeclampsia שדרשה ביצוע לידה תוך 14 יום, עם רגישות של 94.9%, וערך ניבוי שלילי (NPV) של 98.3%, בנשים בשלה היריון הנמוך מ-35 שבועות.
הוראות למדידת PGF בנסיוב
נטילת דם למבחנה כימית (פקק אדום או צהוב) לוותה מיד בסרכוז, כאשר הנוזל העליון נבדק תוך 10 דקות באנלייזרים אוטומטיים כגון DELFIA express system או ב-Cobas e411 system.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק