אבחון טרום השרשתי למחלות שביטוין בגיל מבוגר - Pre-implantation diagnosis of diseases expressed in adulthood
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| אבחון טרום השרשתי למחלות שביטוין בגיל מבוגר | ||
|---|---|---|
| Pre-Implantation Diagnosis of diseases expressed in adulthood | ||
| יוצר הערך | פרופ' אלכס סימון, פרופ' נרי לאופר |
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אבחון טרום השרשה
בשנים האחרונות חלה התקדמות רבה ביכולת האבחון של מחלות תורשתיות באדם.
כיום נהוג לזהות את הפגמים הגורמים למחלות רבות על ידי בחינת תאים עובריים הנדגמים במהלך ההיריון בטרימסטר הראשון או השני, באמצעות דגימת סיסי שליה או בדיקת מי שפיר, ובמידה שנמצא כי העובר שנבדק חולה, מומלצת הפסקת היריון.
אחד הפיתוחים בתחום הביולוגיה המולקולרית והגנטיקה הוא היכולת להקדים את האבחון הגנטי לשלבים מוקדמים של העובר עוד טרם ההשרשה ברחם, Preimplantation Genetic Diagnosis) PGD). בתהליך זה מתבצעת הפריה חוץ גופית, העוברים המתקבלים בתהליך עוברים דגימה של בלסטומרים ועל תאים אלה מבצעים בדיקה גנטית לברר אם מקורם מעובר חולה, נשא הפרעה גנטית או בריא. בהתאם לתוצאה מבצעים את ההחלטה אילו עוברים להחזיר לחלל הרחם לקבלת היריון של עובר בריא. בחירתם והחזרתם לרחם של עוברים תקינים בלבד חוסכות את הצורך בהפסקות היריון של עוברים הנגועים במחלות גנטיות קשות, המאובחנות בשיטות הקונבנציונליות שהוזכרו לעיל.
תהליך האבחון בעוברים בשלב טרום השרשה מתבסס מחד על היכולת לדגום תא בודד מעובר שעבר מספר קטן של חלוקות מבלי לפגוע בחיוניותו של העובר, ומאידך על המיומנות הדרושה בביצוע האבחנה הגנטית על תא יחיד ברמת רגישות גבוהה[1].
דגימת תאי עובר ושיטות האבחון
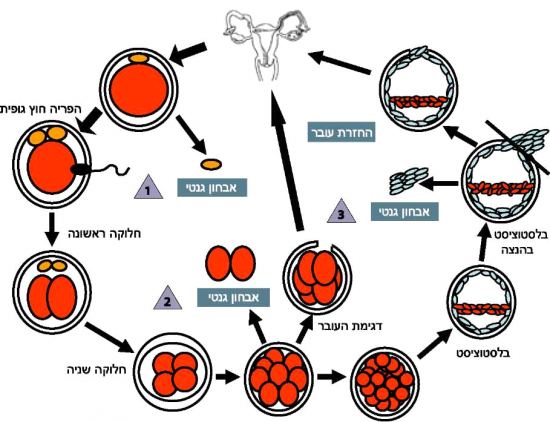
על מנת לאפשר אבחן טרום השרשה, על האישה לעבור טיפול בהפריה חוץ גופית. במהלך הטיפול מתקבלות ביציות שאותן מפרים בתאי זרע ולאחר ההפריה, מתפתחים עוברים. האבחון הגנטי יכול להתבצע החל משלב הביצית הבשלה עד לשלב שבו העובר התפתח לכדי בלסטוציסט (איור 1). הביציות, כמו גם העוברים בתחילת התפתחותם, עטופות 2-zona pellucida (המעטפת השקופה). על מנת לדגום את הגופיף הקוטבי (polar body) מהביצית או את תאי העובר, יש צורך תחילה לגרום לפתח במעטפת זו. את הפתח ניתן לבצע באמצעים של המסה כימית או על ידי קרן לייזר. לאחר גרימת הפתח ניתן, על ידי פיפטה, לשאוב את התאים לבדיקה גנטית. מהעובר ניתן לדגום עד שליש ממספר הבלסטומרים שבו מבלי לפגום ביכולת שאר מקבץ התאים הפלוירופוטנטיים להתפתח לכדי עובר והיריון תקינים.
בהתאם להפרעה הגנטית הנבדקת, התאים שנדגמו מועברים לאבחון בשיטות הביולוגיה המולקולריות, כגון Fluorescent In Situ Hybridization) FISH) או כזו המבוססת על polimerase chain reaction) PCR) .
כאשר ההפרעה הגנטית מקורה במוטציה נקודתית על פני הגן, בין אם המחלה רצסיסית או דומיננטית, מקטע הגן (המכיל שני אללים) החשוד כפגום עובר האדרה (אמפליפיקציה) בשיטת ה-PCR ולאחר קבלת תעתיקים רבים של אותו מקטע ניתן לבצע אנליזה גנטית באם המוטציה קיימת או שלא, ובכך לקבוע באם התא הנבדק מקורו מעובר בריא, נשא או חולה.
כאשר ההפרעה הגנטית מקורה בתבנית כרומוזומים לקויה כגון חשד לאנואופלואידיה, טריזומיה או טרנסלוקציה בלתי מאוזנת של הכרומוזומים, אזי מפעילים את שיטת ה-FISH. בשיטה זו משתמשים בגלאים פלואורסנטים ספציפיים הנקשרים אל הכרומוזום המתאים ובאמצעות מיקרוסקופ פלואורסנטי ניתן לזהות את הגלאי. נוכחות הגלאי מעידה על נוכחות הכרומוזום שאליו הוא נקשר. קיימים גלאים פלואורסנטים למגוון כרומוזומים וניתן בבדיקה אחת של התא הנבחן לזהות חסר או עודף כרומוזומים. כך גם ניתן לקבוע את מין העובר באמצעות גלאים פלואורסנטיים לכרומוזומי X או Y.
ההתוויות לשימוש באבחון טרום השרשתי
ערך מורחב – אבחון טרום השרשה - Pre-implantation diagnosis
אוכלוסיית המטופלים שתזדקק לסוג זה של אבחון עוברים הם זוגות שאחד מבני הזוג חולה במחלה דומיננטית וצאצאיהם בסיכון של 50 אחוז לרשת את הגן הפגום, זוגות ששניהם נשאים של גנים רצסיביים וצאצאיהם בסיכון של 25 אחוז להיות חולים, או כאלה אשר תבנית הכרומוזומים של ילדיהם עלולה להיות בלתי מאוזנת (טבלה 1).
קבוצה אחרת של מטופלים שהוצע כי היא עשויה להפיק תועלת משימוש בשיטת טיפול זו היא נשים בגיל מתקדם שאצלן סיכויי ההפלה גבוהים עקב השרשה של עוברים פגומים מבחינה גנטית. בטיפול המוצע, המכונה PGS (Preimplantation Genetic Screening), ניתן יהיה להחזיר לרחם רק עוברים תקינים ובכך למנוע השרשה של עוברים בלתי תקינים המובילים בסופו של דבר להתפתחות הפלה. עבודות מחקר שפורסמו לאחרונה מעידות על כך כי אין בטיפול זה כדי להעלות את שיעור לידות החי לעומת טיפול הפריה חוץ גופית רגילה בקבוצה זו[2].
גם נשים שאצלן קיים סיפור של הפלות חוזרות שסיבתן אינה ברורה עשויות למצוא פתרון לבעייתן באבחון טרום השרשה. במקרים אלה, ייתכן שההפלות החוזרות נובעות מהשרשת עוברים פגומים. בחירה מוקדמת של עוברים שאינם נושאים הפרעה גנטית תשפר את סיכויי ההישרדות של ההיריון. בשיטת האבחון טרום ההשרשה, ניתן גם באופן ודאי לקבוע את מין העובר. כיום קיים היתר לבצע בחירה של מין העובר מסיבות רפואיות בלבד, כגון: מחלת ההמופילה שבה האם היא נושאת את הגן הפגום אך היא בריאה בעוד בנה עלול לרשת ממנה גן זה ולחלות במחלה. במקרים אלה יוחזרו לחלל הרחם עוברים ממין נקבה בלבד.
בחירת מין העובר מסיבה שאינה רפואית, מה שמכונה בקשה "לאיזון משפחתי של הצאצאים", עוררה ויכוח אתי נרחב בארץ ובעולם. אבחון מסוג זה נאסר בארצות אירופה ואילו בארץ, נושא בחירת מין העובר שלא לצורך רפואי נדון על ידי הוועדה של האקדמיה הלאומית הישראלית בשיתוף עם נציגים ממשרד הבריאות. הוועדה המשותפת המליצה שלא להתיר את בחירת מין היילוד שלא לצורך רפואי אלא במקרים חריגים במיוחד ובנסיבות מחמירות ביותר. ההיתר יינתן לאחר דיון בוועדה ארצית של משרד הבריאות ובתנאי שהוועדה השתכנעה כי לזוג שלו ארבעה ילדים מאותו המין קיים סיכון ממשי וניכר לפגיעה מהותית ומשמעותית בבריאות הנפשית של אחד מהם או של הילד העתיד להיוולד אם התהליך לא יבוצע. מאז פרסום חוזר מנכ״ל משרד הבריאות בשנת 2005, הוועדה אישרה טיפול זה ל-21 (20 אחוז) זוגות מתוך 103 שנדונו.
- טבלה 1. התוויות לביצוע אבחון גנטי טרום ההשרשה
| Application of PGD | |
|---|---|
| Preventing genetic disorders in couples at risk | |
| Reducing the risk of spontaneous abortions in couples carrying translocations | |
| Sex selection (Medical and Social) | |
| PGS: | |
| Adavanced maternal age | Recurrent abortion |
| Repeated implantation failure | Male infertility |
| Preventing potential late onset diseases | |
| Treating a sick sibling needed BM transplantation | |
אבחון טרום השרשתי למחלות שביטויין בגיל מבוגר
אבחון טרום השרשה לבחירת מין העובר מסיבה שאינה רפואית לא היה הנושא היחידי שעורר ויכוח אתי נרחב בעקבות היכולות הטכניות שהשיטה מציעה. דיון והתייחסות למשמעות המוסרית היו גם בנושא יצירת עוברים שיוכלו עם לידתם לתרום דם מחבל הטבור על מנת לטפל במחלה של אח או אחות הנזקקים להשתלת מח עצם[3], [4].
בדומה, עלה לדיון ציבורי ובקהילה הרפואית נושא בחירת עוברים שעם לידתם הם בריאים, אולם בהיותם נושאים בעיה גנטית, הם עלולים לפתח מחלות בגיל מתקדם יותר, כגון: מחלת הנטינגטון, סרטן שד, סרטן שחלה וסרטן המעי הגס. לאחר שיח נרחב, הרשות לאמבריולוגיה והפריה של האדם בבריטניה (HFEA) הרחיבה בשנת 2006 את ההתוויות של השימוש ב-PGD גם למחלות המתפתחות בגיל המאוחר (PGD - Preimplantation Genetic Diagnosis for late onset diseases) .
דיון מקיף בנושא ההתוויות לשימוש ב-PGD נעשה בוועדה העליונה לביואתיקה רפואית בראשותו של פרופ׳ מישל רבל. דיון זה, שפורסם בחוברת, עוסק בין השאר בהיתר לשימוש בתהליך PGD למחלות שביטויין הקליני לאחר גיל הילדות.[5]
טבלה 2 מפרטת את המחלות שביטויין בגיל שלאחר הילדות ושניתן לבצע עבורן אבחון טרום השרשתי. אלו נחלקות לכאלו הבאות לידי ביטוי כמחלה נוירודגנרטיבית או מחלת ניוון שרירים, נשאות לגנים הטומנים בחובן התפתחות סרטן (שד, שחלה, מעי גס) ומחלות המערבות את המערכת הקרדיווסקולרית. השיח הציבורי נסב סביב המוסריות במתן ההיתר לביצוע PGD למחלות אלו כאשר החשש מהמדרון החלקלק עומד בפני החברה. החשש הוא כי הרחבה הדרגתית של ההתוויות עלולה תגרום בסופו של דבר דרישה לבחירת תכונות אחרות כמו צבע עיניים, גובה, כשרון מוזיקלי או אינטליגנציה. בחירת תכונות כאלו היא תחילת תהליך של Eugenics - בחירת תכונות לשם שיבוח הגזע. טענות המתנגדים והמצדדים להחלת PGD למחלות המתפתחות בגיל המאוחר ניתנות לסכום בנקודות הבאות:
- לטענת המתנגדים, צפויות שנות בריאות רבות לפני הופעת המחלה. האם מוצדק למנוע היריון כאשר צפויה תקופה לא מבוטלת של חיים בריאים? המצדדים ישיבו כי מחלה חמורה היא נוראה בכל גיל וכי המועקה הקשה של ההורים ומאוחר יותר של הפרט ביודעו כי הוא עלול לחלות במחלה קשה, מצדיקה להשתמש בטכנולוגיה קיימת למנוע זאת.
- ניתן לטעון כי תיתכן פריצת דרך בטיפול המחלה או מניעתה. לכן, היות שמדובר בביטוי קליני שיתפתח בעוד שנים לא מבוטלות, הרי שעם הזמן שיחלוף, ייתכן שיימצא מרפא למחלה. על כן, היכן ההצדקה למניעת היריון מסוג זה? לטענה זו המצדדים ישיבו, כי אין ביטחון כלל למציאת פתרון בעתיד וגם אם יימצא, ייתכן שהפתרון כרוך בסבל נוסף, נפשי ופיזי.
- הטיפול מחייב הפריה חוץ גופית והאישה נוטלת סיכון בביצוע התהליך הכולל פעולה ניתוחית. ההצדקה לנטילת סיכון זה נראית פחותה יותר במקרה של מחלה המתבטאת מאוחר בחיים לעומת מחלה המופיעה מיד עם הלידה.
- טבלה 2. מחלות והפרעות שונות אשר ביטויין הקליני בגיל המבוגר וניתן לבצע עבורן אבחון טרום השרשתי
| ניוון שרירים ומחלות נוירולוגיות כיווניות |
|---|
| Huntington's Disease |
| Jacob-Creutzfeld Disease |
| Myotonic dystrophy |
| Charcot Marie Tooth |
| Spinicerebellar ataxia |
| Limb-girdle muscular dystrophy |
| Oculopharyngeal muscular dystrophy |
| Fascioscapulohumeral dystrophy |
| Alzheimer's Disease |
| נטייה תורשתית למחלות ממאירות |
| BRCA1 and BRCA 2 carriers |
| Li-Fraumeni Syndrome (P53 mutation) |
| Familial adenomatous polyposis |
| Heredetary non-polyposis colon cancer (HNPCC) |
| Von Hippel Lindau Syndrome |
| Multiple endocrine neoplasia 1 and 2 (MEN1/2) |
| קרדיווסקולרי |
| Genetic Cardiomyopathy |
| Marfan Syndrome |
לראיה, בשאלון שהועבר לנשאיות BRCA לגבי עמדתם לביצוע PGD למניעת הולדת ילד נשא של המוטציה, רק 34 אחוז מהמשיבות ענו שהיו בוחרות לעבור את התהליך[6]. הטענה שכנגד תהיה כי הסיכון, אם קיים, הרי שהוא מזערי ולאחר מתן הסבר מפורט לגבי התהליך, יש להיעתר לבני הזוג שהחליטו כי נטילת הסיכון מצדיקה הולדת ילד שלא יחלה בעתיד ובכך עשו למען ילדם על מנת שיחסך ממנו הסבל של המחלה העתידה להתפתח.
אחד המאפיינים של מחלות גנטיות המתבטאות בגיל מאוחר הוא כי לא ניתן לחזות בכולן את הופעתן או את מידת חומרתן. כך לדוגמה, מחלת הנטינגטון תתבטא ב-100 אחוז מנשאי המוטציה, כמו גם מחלת יעקב-קרויצפלד, שבסופן, לאחר תופעות נוירולוגיות קשות, יגרמו למות החולה. לעומתם, נשאיות BRCA1 ו-BRCA2 עלולות לפתח סרטן שד בסיכון של 80-50 אחוז וסרטן השחלה בסיכון של 50-20 אחוז. לא ניתן לחזות מי אמנם תחלה ומי לא, אך הסיכון בהחלט נחשב לגבוה עד כדי המלצות לכריתת שחלות מניעתית ואף כריתת שדיים מניעתית. יתר על כן, מעקב וטיפול מוקדם עשויים למנוע את המחלה בעוד למחלה כגון יעקב-קרויצפלד, הנטינגטון או אלצהיימר גנטי, אין יכולת ריפוי. גם חומרת המחלה לא תמיד ניתנת לחיזוי, Myotonic Dystrophy עלולה להתבטא בילדות ובחומרה קשה ובחולה אחר הביטוי עשוי להיות קל עם הופעה בגיל מבוגר. במקרה זה, קיים קשר בין מספר החזרות בבסיסים שבגן הגורמים להפרעה למידת חומרתה. לא ניתן לחזות מראש את מידת חזרת הבסיסים ולכן, גם לא את חומרת המחלה העלולה להתפתח. בדומה, Li-Fraumeni syndrome (מוטציה בגן P53) עלולה להתבטא בילדות בהתפתחות סרטן מוח או לויקמיה, או לבוא לידי ביטוי רק בגיל מאוחר כסרטן שד, או שלא לבוא לידי ביטוי כלל.
בישראל מקובל להמליץ על ביצוע הפסקת היריון בגלל רמת סיכון של חמישה אחוזים להיווצרות מחלה חמורה, מכאן שהיכולת למנוע מחלה כזו בהחלט מצדיקה ביצוע PGD. באם מביאים בחשבון גם את זכות ההורים להשתמש בטכנולוגיה קיימת להולדת ילד בריא ולמנוע ממנו את האפשרות או אף הסיכון (גם אם איננו 100 אחוז) לחלות בעתיד, ובהתחשב בחופש הפרט, לבחור לעצמו טיפול תוך נטילת סיכון במודע, הרי שנימוקים אלה, כפי שפורטו בחוברת שהוצאה לאור על ידי הוועדה הביו-אתית העליונה (ראה קישור אינטרנט לעיל), הביאו את הוועדה לאשר גם בישראל ביצוע PGD למחלות שביטוין מאוחר בגיל. בבית החולים הדסה, בהתאם למסקנות הוועדה ולאור פניית נשים בבקשה לסייע להן במצוקתן, ביצענו טיפולים באבחון טרום השרשתי במקרים של מחלת יעקב קרויצפלד שסיבתה גנטית וכן החזרת עוברים שאינם נושאי מוטציה ל-BRCA, לבקשת בני הזוג. מחלת יעקב קרויצפלד היא מחלה נוירודגנרטיבית הנגרמת על ידי פריון (חלבון פגום שכאשר בא במגע עם חלבון תקין, גורם לו להפך לפגום אף הוא ומכאן כושר "ההדבקה" של הפריון). הצטברותו של הפריון בתאי המוח גורם להסתמנות הקלינית. המחלה בעלת שלוש צורות העברה: זיהומית - יאטרוגנית (פחות מאחוז אחד של החולים), אקראית (90 אחוז מהחולים) ותורשתית (חמישה עד עשרה אחוזים מהחולים). שכיחות המחלה ביהודים ממוצא לובי היא פי 100 מאשר באוכלוסיה הכללית והיא נובעת מהעברה תורשתית של המחלה. מוטציה אופיינית ליוצאי לוב, המכונה E200K בגן PrP שעל כרומוזום 20, גורמת ליצירת חלבון פגום - הפריון אשר מצטבר במוח וגורם לסימפטומטולוגיה של המחלה. ההעברה היא אוטוזומאלית דומיננטית, כך שהסיכוי לחלות במחלה הוא 50 אחוז לצאצא של פרט חולה.
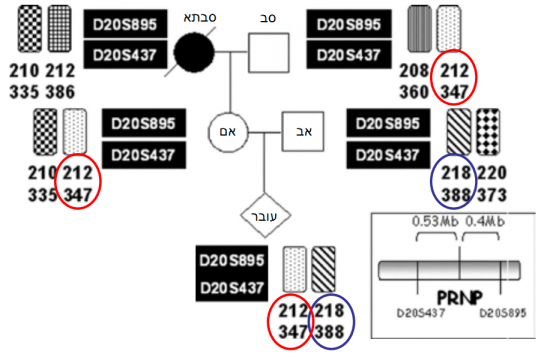
המחלה מתבטאת בדרך כלל בשנות ה-50 עם התפתחות שיטיון, הפרעות פסיכיאטריות, מיוקלונוס, אטקסיה ולבסוף מוות המתרחש בתוך חצי שנה עד שנתיים. להדסה פנו מספר זוגות יוצאי לוב בבקשה לבצע אבחון טרום השרשה להחזרת עוברים שאינם נושאים את המוטציה. כאשר ברור שהפרט שפנה לטיפול נושא מוטציה, מבצעים PGD לנוכחות המוטציה ומחזירים לחלל הרחם עוברים בריאים. אולם, כמה מהפונים אינם יודעים אם הם נושאים מוטציה (חולים) ואף אינם רוצים לדעת זאת בגיל צעיר, אך מבקשים כי ילדם בכל מקרה יהיה בריא. במקרה זה ניתן לבצע תהליך הנקרא exclusion of) PGD (the disease[7]. בתהליך זה בודקים סמנים פולימורפים על האללים המתאימים של בני הזוג והוריהם ומוחזרים לרחם עוברים שבוודאות אינם נושאים אף אלל שמקורו על פי הסמנים שנבדקו מאותו הורה (סב/ סבתא) חולה (איור 2). עד כה טיפלנו בחמישה זוגות שעברו 12 מחזורי טיפול PGD ובהם הושגו שלוש לידות ושתי הפלות.
כאמור, נשאיות לגן מוטנטי BRCAI או BRCA2 עלולות לפתח סרטן שד במהלך חייהן בסיכון של 80-50 אחוז ואילו סרטן שחלה בסיכון של 50-20 אחוז. מעבר לעובדה והחרדה בחשש הקיים לחלות במחלות אלו, קיים גם הנטל הנפשי של הידיעה כי הם עלולים להעביר לצאצאיהם בסיכוי של 50 אחוז את ההפרעה הגנטית המאיימת להתפתחות סרטן. כמה מהנשים היו מבקשות לחסוך לצאצאיהן את החרדות וההתמודדות שאותן הן חוות בגלל נשאותם את המוטציה להתפתחות סרטן. בשנתיים האחרונות פנו להתייעצות למרפאה הגנטית בהדסה עשר נשים בגיל הפוריות נשאיות BRCA1/2 מתוך רצון לבצע PGD לקיום המוטציה והחזרת עוברים שאינם נושאים אותה. לאחר הסבר מקיף על התהליך, סיכוניו וסיכוייו, שש מהזוגות החליטו לעבור את התהליך. עד כה, ארבע נשים ביצעו את האבחון, שתיים מהן הרו וילדו, האחת תינוק יחיד והשנייה תאומים. לאחר דיון עם בני הזוג ולאור היבטים מוסריים העוסקים בזכויות העובר והיילוד, הוחלט כי במהלך ההיריון ומיד אחריו לא תבוצע בדיקה לאימות האבחון טרום ההשרשה[8].
לסיכום, PGD היא טכנולוגיה חדשנית המתפתחת במהירות ובעלת יכולת אבחונית מתקדמת הדורשת שיתוף פעולה בין צוותים מולטידיסציפלינרי גדולים.
יכולות השיטה מתרחבות במהירות בהתאם להתפתחות המהירה של שיטות האבחון בביולוגיה המולקולרית. למרות היותה כלי טיפולי מהמעלה הראשונה, הרי שהשיטה מייצרת פוטנציאל לבעיות אתיות ההולכות ומתרבות. ההערכה האתית, הדיון והשיח הציבורי מאפשרים להשתמש בה בצורה מושכלת כך שאיכות החיים של המטופלים וצאצאיהם תשתפר בצורה משמעותית.
ביבליוגרפיה
- ↑ Tsafrir A, Shufaro Y, Simon A, Laufer N: Preimplantation genetic diagnosis. In: The embryo: Scientific discovery and medical ethics. Edited by Blazer S and Zimmer EZ. Published by Karger, Basel, pp166-201, 2005.
- ↑ Fauser BC. Preimplantation genetic screening: the end of an affair? Hum Reprod. 23(12):2622-5, 2008.
- ↑ Simon A, Schenker JG. Ethical consideration of intentioned preimplantation genetic diagnosis to enable future tissue transplantation. Reprod Biomed Online. 10(3):320-4, 2005.
- ↑ Kuliev A, Rechitsky S, Verlinsky O, Tur-Kaspa I, Kalakoutis G, Angastiniotis M, Verlin-sky Y. Preimplantation diagnosis and HLA typing for haemoglobin disorders. Reprod Biomed Online. 11 (3):362-70, 2005.
- ↑ סוגיות ביואתיות בנושא אבחון גנטי טרום השרשתי (PGD)
- ↑ Menon U, Harper J, Sharma A, Fraser L, Burnell M, ElMasry K, Rodeck C, Jacobs I. Views of BRCA gene mutation carriers on preimplantation genetic diagnosis as a reproductive option for hereditary breast and ovarian cancer. Hum Reprod. 22(6):1573-7, 2007.
- ↑ Meiner V, Weinberg N, Safran A, Israela L, Sagi M, Rosenmann H, Aizenman E, Abe-liovich D, Laufer N, Simon A. Preimplantation exclusion of embryos at risk for prion diseases. Neurology 66(4):607-8, 2006.
- ↑ Sagi M, Weinberg N, Eilat A, Aizenman E, Werner M, Girsh E, Siminovsky Y, Abe-liovich D, Peretz T, Simon A, Laufer N. Preimplantation Genetic Diagnosis (PGD) for BRCA1/2 - a novel clinical experience. Prenat Diagn 2009 (In press)
קישורים חיצוניים
- אבחון טרום השרשתי למחלות שביטויין בגיל מבוגר, Themedical
המידע שבדף זה נכתב על ידי פרופ׳ אלכס סימון, מנהל המרכז להפריה חוץ גופית, פרופ׳ נרי לאופר, מנהל החטיבה למיילדות וגינקולוגיה, המרכז הרפואי הדסה, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק