אבנים בדרכי השתן בילדים - Urolithiasis in pediatric patients
| אבנים בדרכי השתן בילדים | ||
|---|---|---|
| Urolithiasis in pediatric patients | ||
| 250px | ||
| יוצר הערך | ד"ר עמוס נאמן, ד"ר אייל זיפמן, פרופ' אבישלום פומרנץ 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אבנים בדרכי השתן
אבנים בדרכי השתן נחשבו בעבר לנחלתם של המבוגרים. בעשורים האחרונים פורסמו סדרות רפואיות רבות המוכיחות שאבני כליה לא נדירות בשנים הראשונות לחיים; כיום מקובל לחשוב שמדובר במחלה הפוגעת גם באוכלוסיית הילדים. מדובר במצב רפואי המאובחן בשכיחות שעולה בהתמדה בשנים האחרונות.
אבחון נכון ומוקדם, בירור מטבולי מתאים וטיפול הולם ימנעו סבל מאותם ילדים הלוקים באבנים בדרכי השתן, וימזער את הנזק הכלייתי והסיבוכים העתידיים. מידע עדכני לגבי מחלת אבנים בדרכי השתן בילדים, תוך התייחסות לאפידמיולוגיה, פתופיזיולוגיה, אבחון והטיפול האורולוגי במצב מתואר להלן.
אפידמיולוגיה
במדינות מפותחות, שעל אוכלוסיותיהן נכתבות רוב רובן של העבודות, ההיארעות השנתית של אבנים בדרכי השתן היא כ-4.7-5.5 מקרים לכל מאה אלף ילדים, לעומת 62 מקרים למאה אלף באנשים מעל גיל 20[1],[2],[3]. בעשורים האחרונים חלה עלייה בשכיחות של מחלת אבנים בדרכי השתן בעולם המתועש, בעיקר בקרב מבוגרים, אך גם בקרב ילדים[1]. מחקר אחד הראה עלייה בשיעור של פי 5 בהיארעות של אבנים, בשנים 1994-2005.
ניתן באורח נדיר למצוא גם מטופלים בני מספר חודשים, אך באופן כללי השכיחות עולה עם הגיל. מחלת אבנים אצל תינוקות, במיוחד אם היא מלווה בסיפור משפחתי, מצריכה בירור מקיף אחר מחלה מטבולית מולדת[4].
באופן כללי, מחלת אבנים בכליות נפוצה מעט יותר בבנים לעומת בנות. במחקרים שונים מוצגים נתונים שונים, אך ברוב הסדרות היחס בין המינים הוא לטובת הבנים, ועומד על 1:1.3-1.7[5],[6],[7]. עם זאת, בסדרה אחת של 6,764 ילדים בארצות הברית נמצא שבנים מושפעים יותר בעשור הראשון לחיים (יחס 1:1.2) בעוד הבנות הן הרוב בעשור השני (יחס 1:0.35)[7].
במטופלים משני המינים רוב האבנים הן אבני סידן-חומצה אוקסלית (קלציום-אוקסלט) או אבני סידן-זרחן (קלציום-פוספט), אך אצל בנים יש שכיחות גבוהה יותר של אבני סידן עם חומצה אוקסלית בעלת שתי מולקולות מים (קלציום אוקסלט דיהידרט) לעומת בנות. לעומת זאת, אצל בנות יש שכיחות גבוהה יותר של אבני הידרוקסי-אפטיט (Hydroxyapatite, חומר היסוד האנ-אורגני הבונה את העצם)[6].
אטיולוגיה
פתופיזיולוגיה
אבנים בדרכי השתן הן גבישים הנוצרים מיונים חופשיים הנמצאים בשתן. החומרים שמהם מורכבות אותן אבנים הם:
- סידן-חומצה אוקסלית
- סידן-זרחן
- חומצה אורית
- ציסטאין
- סטורוויט (Sturvite, מגנזיום-אמוניום-זרחן)
ניתן לחלק את האבנים המורכבות מסידן וחומצה אוקסלית לכאלה שבהן המלח הוא בעל מולקולת מים אחת (מונוהידרט) ולכאלה שבהן הוא בעל שתי מולקולות מים (דיהידרט).
סידן, עם חומצה אוקסלית או עם זרחן, הוא המרכיב המרכזי ב-80-90% מהאבנים בדרכי השתן[1]. המאגר העיקרי של מינרלים אלו בגוף הוא בעצמות. איזון ברמת המינרלים בדם מווסת על ידי המערכת ההורמונלית ועל ידי הכליה. אם נוצרים בדם עודף של מינרלים, הם מופרשים בשתן.
הרוב המוחלט של הילדים אינו יוצר אבני כליה, מאחר שיש מספר תנאים מקדימים הנדרשים כדי שגביש ייווצר ויגדל. ריכוז המומסים הוא הגורם העיקרי להיווצרות אבנים במערכת השתן. כאשר ריכוז זה עובר סף מסוים (סף הרוויון), תהליך יצירת האבן מתחיל. עד ריכוז מומסים מסוים אין די בנוכחות היונים בלבד כדי ליצור גביש חדש.
ריכוז המומסים בשתן תלוי בשני גורמים: כמות המומס ותפוקת השתן. ככל שההפרשה של המומסים בשתן רבה יותר, וככל שכמות השתן הנוצרת קטנה יותר, כך עולה ריכוז המומסים ואיתו הסיכוי להגיע לסף הרוויון. היונים החופשיים המומסים בשתן מתחברים לגרעיני היווצרות, ובכך מרחיבים אותם בהדרגה.
גרעיני היווצרות הגביש אצל בני האדם אינם מכילים על פי רוב את אותם יונים היוצרים לבסוף את הגביש. חומצה אורית או מונוסודיום-אוראט (Monosodium urate), למשל, יכולים להוות גרעין היווצרות לגביש של סידן-חומצה אוקסלית. גם מרכיבים תאיים שונים מסוגלים להוות גרעין היווצרות כזה. עם זאת, כאשר ריכוז היונים גבוה מספיק, אותו גרעין יכול להיווצר מאותם מינרלים שיהוו לבסוף את עיקר האבן. כך ניתן למצוא גבישים שבהם גם גרעין ההיווצרות וגם הגביש עצמו בנויים מאותם מרכיבים.
שומנים שונים, כגון כולסטרול, כולסטרול-אסטר (Cholesterol ester), טריגליצרידים ופוספוליפידים, מעורבים גם כן ביצירת האבנים. במטופלים עם אבני סידן וחומצה אורית נמצאו רמות גבוהות יותר של שומנים שונים בשתן מאשר אצל נבדקים ללא אבנים בדרכי השתן.
חלק מהמומסים בשתן דווקא מעכבים יצירת גבישים - בעיקר ציטראט (Citrate), מגנזיום ופירופוספט (Pyrophosphate). למומסים אלה מצטרפים חומרים נוספים, כגון כונדרויטין סולפט (Chondroitin sulfate), אבץ וחומצות גרעין שונות.
פרט לריכוז המומסים, יש גורמים נוספים המשפיעים על יצירת האבן: המטען החשמלי של החלקיקים וערך ההגבה (רמת החומציות, pH). למעשה, ערך ההגבה משנה את יחס החלקיקים הטעונים ובכך את כמות החומר הזמין בשתן ליצירת הגביש. בשתן חומצי, דהיינו ערך הגבה של מתחת ל-6, המסיסות של תצמיד סידן-זרחן מוגברת, והאפשרות ליצירת גבישים קטנה. לעומת זאת, המסיסות של סידן-חומצה אוקסלית אינה מושפעת בערכי הגבה פיזיולוגיים.
גורמי סיכון
גורמי הסיכון למחלת אבנים[8]:
- הפרשת סידן מוגברת בשתן (המתגלה בכמחצית מהמטופלים)
- הפרשת ציטראט נמוכה
- באופן פחות משמעותי, הפרשות מוגברות של חומצה אוקסלית וחומצה אורית
- היסטוריה משפחתית, המתוארת ברבע עד חצי מהמטופלים, היא גורם סיכון, גם אם האבנים התגלו אצל ההורים בגיל מבוגר יותר[8],[2],[9].
- מתברר שלמשקל יש השפעה עקיפה על הסיכון למחלת אבנים. בילדים שמנים יותר נמצאו רמות גבוהות יותר של מומסים המעורבים ביצירת האבנים[10].
- מומים מבניים בדרכי השתן, גם הם גורם סיכון לזיהומים חוזרים ולהיווצרות אבנים בדרכי השתן.
נוסף על עלייה בשכיחות אבנים בדרכי השתן, הפרשת סידן מוגברת והפרשת ציטראט מופחתת בשתן מעלים את הסיכון גם לדלקות בדרכי השתן.
קליניקה
חשיבות מכרעת נודעת למודעות הקלינאי במרפאה או במיון לבעיית אבני כליה בילדים נוכח העובדה שמדובר בבעיה שאינה נדירה, וששכיחותה עולה בשנים האחרונות.
כאבי בטן הם ההסתמנות הנפוצה ביותר, והם מופיעים ב-60-80% מהילדים[2],[11]. לרוב הכאבים נוטים להיות חד-צדדיים, אך מופיעים בשני הצדדים בכ-8-10% מהמטופלים. בילדים קטנים יותר ובתינוקות, שלא מסוגלים להתלונן על כאב, אי שקט הוא התסמין הנפוץ ביותר[12].
בחילות והקאות הן לעתים חלק מהתמונה הקלינית בעת ההתייצגות הראשונית[13].
הכאב האופייני לאבנים בדרכי השתן מתבטא בכאבים חזקים, עוויתיים, מלווים לעתים בבחילות ובהקאות. הכאב יכול להקרין למותן, למפשעות ולאברי המין החיצוניים.
כמות דם מיקרוסקופית בשתן (המטוריה מיקרוסקופית) מופיעה ברוב המטופלים, ב-90% מהם, בעוד כמות מאקרוסקופית של דם בשתן מופיעה בשיעור נמוך של 14-32%.
גם דלקת בדרכי השתן (מוכחת בתרבית) יכולה להיות סימן ראשון לאבנים, אך זו נפוצה הרבה פחות משאר דרכי ההסתמנות, ונוטה להופיע במטופלים הצעירים יותר, בעיקר מתחת לגיל שנה[9].
ככלל, חום אינו סימן המחשיד למחלת אבנים, ויש צורך לחפש מקור אחר לתלונות חוץ מבמקרים שבהם מדובר בדלקת בדרכי השתן המלווה את הופעת האבנים.
אבחנה
באנמנזה יש לכוון את השאלות לאותם מצבים המגבירים סיכון להיווצרות אבנים, כגון:
- התייבשות ממושכת עקב צריכת נוזלים מופחתת
- פעילות יתר של יותרת התריס (היפר-פאראתירואידיזם), אוסטאופורוזיס וריתוק למיטה
- סקירת הדיאטה עשויה לזהות צריכה מוגברת של סידן, חומצה אוקסלית, חלבון ומלח.
- יש לשאול תמיד על שימוש בתרופות ותוספי מזון:
- סידן, ויטמין D וקורטיקוסטרואידים גורמים להפרשת יתר של סידן בשתן
- נטילת ויטמין C וויטמין B6 מעלים את הפרשת החומצה האוקסלית
- Indinavir, המשמשת לטיפול בנשאי נגיף הכשל החיסוני האנושי (HIV - Human immunodeficiency virus), עלולה לגרום למחלת אבנים בשל מסיסות נמוכה של התרופה בשתן
תלונות אורינריות, כגון כאב בעת מתן שתן, הן חשובות. אם הכאב מופיע רק בעת מתן שתן יש לחשוד בדלקת בדרכי השתן, אם נוסף על מחלת אבנים ואם במקומה, כמקור לתלונות. מיקום הכאב חשוב אף הוא, ויכול להצביע על מיקום האבנים: מותניים, בטן מרכזית או תחתונה ושופכה.
תלונות אורינריות אחרות, כגון דחיפות, תכיפות ואי שליטה במתן שתן מכוונות יותר למחלה זיהומית, אך עלולות ללוות מחלת אבנים, כאשר האבנים גורמות לפגיעה מכנית ברירית השופכה והשלפוחית.
בקרב מטופלים הסובלים מכאבי מותן או בטן נמצאה היסטוריה של אירועים קודמים של אבנים בדרכי השתן בקורלציה חיובית משמעותית למחלת אבנים[11].
בדיקת שתן
דם בשתן אומנם מופיע ברוב המטופלים, אך בדיקה זו אינה ספציפית מכיוון שניתן למצוא כמות דם מיקרוסקופית בשכיחות מוגברת גם במטופלים אשר בהם לא נמצאו אבנים[11]. ממצא של דם בשתן, בעיקר אם מתבטא כשתן דמי (Gross hematuria), אמור להעלות מחלת אבנים באבחנה המבדלת.
בדיקת מבנה כדוריות הדם האדומות בשתן במקרים של כמות דם מיקרוסקופית (בדיקת שתן באור מקוטב) תעזור לנו לאבחן דם שמקורו מהשופכנים ודרכי השתן ולא מפקעיות הכליה (הגלומרולי).
מצד שני, חשוב לזכור שבחלק מהמטופלים (10-23%) הסובלים מאבנים בדרכי השתן, אין דם בשתן בהתייצגות הראשונית. לעתים היעדר דם בשתן מעיד על כך שקיימת חסימה מוחלטת של השופכן על ידי האבן, ולכן אין שתן שישטוף את הכדוריות האדומות לשלפוחית. לא ניתן לפסול אבחנה זו על סמך היעדר דם בשתן.
הדמיה
אמצעי דימות שונים משרתים אותנו בניסיון לאבחן מחלת אבנים, ולאתר את מיקומן.
צילום בטן
צילום בטן, שנעשה לעתים קרובות לבירור כאבי בטן, יכול לעתים לאבחן אבנים. האבנים הנראות בשיעור גבוה יותר בצילום בטן ריקה (דהיינו, ללא בליעת חומר ניגוד) הן אבנים בעלות מרכיב דומיננטי של סידן.
צילום בטן ריקה הוא בעל רגישות נמוכה לאבחון אבנים: אבנים עם הרכב נמוך של סידן, אבני חומצה אורית ואבני Indinavir לא יודגמו בצילום. הימצאות כמות גדולה של גזים או צואה במעי יכולה למסך את האבנים. כמו כן, איכות טכנית ירודה של הצילום תשפיע על יכולת האבחון של אבנים.
לעתים ניתן לראות בצילום מקטע של מעי המראה תמונה של חסימת מעי שיתוקית (Paralytic ileus). תמונה זו היא לעתים סימן משני כתגובה של המעי לבצקת מקומית באזור של אבן בשופכן. צילום בטן ריקה הוא בעל רגישות נמוכה ברוב המקרים, ובמיוחד כאשר האבנים קטנות[13],[14].
בדיקת על-קול (US - Ultrasound)
יתרונה של בדיקת העל-קול הוא בזמינותה הגבוהה ברוב המרכזים הרפואיים, היותה זולה והיעדרות קרינה. חסרונה בכך שלרוב היא תדגים רק אבנים הממוקמות בכליה. לעתים ניתן להדגים גם אבנים בקצה הרחיקני של השופכן, בחלק שבו השופכן נכנס לכיס השתן. לבדיקת העל-קול רגישות ששיעורה 60% עד 90% באבחון אבנים בדרכי השתן[13]. במקרים שבהם האבן בשופכן, בדיקת העל-קול לא תדגים את האבן או את מיקומה.
קיימים סימנים משניים היכולים להעלות את הסבירות כי קיימת אבן. הרחבה של אגן כליה יכול לרמז כי קיים גורם חוסם בשופכן, אך אסור להגיע למסקנה נחרצת שמדובר באבן מכיוון שיש מצבים נוספים שיכולים לגרום להרחבת אגן כליה, כמו: היצרות מולדת, החזר שלפוחית-שופכן (רפלוקס), או תהליכים חיצוניים שגורמים ללחץ על השופכן.
רדיולוג מיומן יכול לבדוק את סימן הסילון (Jet sign) - בהפעלת דופלר (Doppler ultrasound) ניתן לראות לעתים את סילון השתן שיוצא מהשופכן. בדיקה זו אינה סגולית (ספציפית) ואינה רגישה, אך יכולה לרמז על כך שקיימת חסימה לאורך השופכן.
מרכזים מעטים מתייחסים למדידת הפרש הזרימה בכלי הדם התוך-כלייתיים (Renal index) כמדד להידרדרות מכנית בדרכי השתן. גם בדיקה זו אינה רגישה ואינה סגולית, ומתבצעת רק במספר מצומצם של מרכזים.
חיסרון נוסף של בדיקת העל-קול הוא הצורך במפענח מנוסה, וההבדלים שניתן למצוא בין בודק לבודק.
טומוגרפיה ממוחשבת (CT - Computed tomography)
הטומוגרפיה ממוחשבת (CT - Computed tomography) משמשת כלי אבחנתי ראשי בשנים האחרונות, בכל הנוגע לאבנים בדרכי השתן. ניתן לבצע בדיקה זו במהירות יחסית, והיא זמינה ברוב המרכזים הרפואיים כמעט בכל שעות היממה.
אומנם אורוגרפיה (Urography) נחשבה בעבר למדויקת ביותר בכל הנוגע לאבחון בעיה זו, אך עדויות רבות שהצטברו הוכיחו רגישות גבוהה יותר לבדיקת ה-CT[15]. נוסף על כך, האורוגרפיה משמשת לזיהוי עקיף של האבנים, מאחר שהבדיקה מדגימה את החסימה בדרכי השתן הנגרמת מהאבן. אבנים קטנות עלולות שלא להתגלות באמצעי דימות זה. כמו כן, קיימת סוגיית הקרינה: בכל אורוגרפיה מנת הקרינה היא כ-1.5-3.5 mSv.
החשש העיקרי בבדיקות הטומוגרפיה הממוחשבת הוא מתן קרינה, אשר עלולה לגרום בעתיד להופעת גידולים[16]. חשש זה גובר באותם מטופלים הנזקקים לבדיקות חוזרות עקב תסמינים המופיעים פעמים רבות[17].
בעשור האחרון, אנו עדים לירידה במספר הבדיקות המבוצעות במטרה להפחית את כמות הקרינה אליה נחשפים הילדים. נוסף על כך, מחקרים שבוצעו בשנים האחרונות, מצביעים על אפשרות טכנית לצמצם את הקרינה הניתנת לילדים ללא פגיעה משמעותית ביכולת לזהות את האבנים בדרכי השתן והכליות[18],[19],[20].
למעשה, תוך ניצול הטכנולוגיות הזמינות כיום להפחתת הקרינה בבדיקת הטומוגרפיה הממוחשבת, ניתן להפחית את כמות הקרינה שאליה חשוף המטופל, לרמה הנמוכה אפילו מזו הנגרמת מביצוע אורוגרפיה, דהיינו: 0.5-2.8 mSv[21],[22]. כמות קרינה זו שוות ערך לביצוע 10-70 צילומי חזה.
בירור מטבולי ואבחנה מבדלת
הפרעת אבנים בדרכי השתן מתבטאת בשכיחות גבוהה באוכלוסיות ילדים מסוימות. בירור מטבולי הוא נדבך חשוב באבחנה ובעיבוד של מידע הקשור לילדים עם אבנים בכליות. כאשר יש אירועים חוזרים או נמצאות אבנים בשני הצדדים, כמעט תמיד הסיבה למחלה תהיה הפרעה מטבולית[23]. נוסף על כך, כאשר מחלת האבנים מופיעה בגיל צעיר, הסיכוי להפרעה מטבולית עולה.
הבירור כולל מספר בדיקות המבוצעות על דגימות שתן ודם של המטופל:
- בדיקות שתן: במטופלים המשתפים פעולה, יש לקחת את הבדיקות משתן שנאסף במשך 24 שעות רצופות, אך לעתים מדובר בילדים צעירים או בתינוקות, ואז תילקח דגימת השתן ממתן חד-פעמי. שתן כזה עדיף לקחת משתן ראשון של הבוקר, כי הוא נוטה להיות מרוכז יותר. הבדיקות יכללו:
- ספירה של תאים לבנים וניטריטים
- תרבית לחיידקים
- ערך ההגבה
- אוסמולליות
- חלבון
- מיקרוסקופיה של השתן בחיפוש אחר גבישים או גלילים - אלו יצביעו לרוב על בעיה בפקעיות הכליה
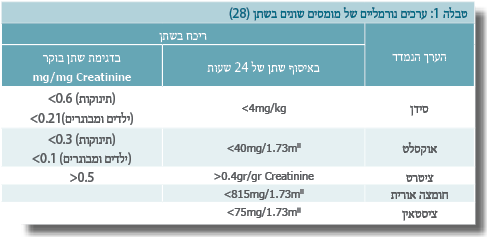
- כימות הפרשת המומסים בשתן: קראטינין, סידן, חומצה אוקסלית, חומצה אורית, ציטראט, ציסטאין, זרחן, נתרן ואשלגן.
- בדיקות דם יכללו:
- אפיון האבנים: בכל מקרה בו ניתן לשלוח את האבנים עצמן לאפיון (אנליזה של האבן), יש לעשות זאת, מאחר שכך מתקבל מידע חיוני לגבי ההפרעה הקיימת, מידע שניתן להכווין באמצעותו את הטיפול.
הפרשת סידן מוגברת בשתן
ההפרעה המטבולית השכיחה ביותר היא הפרשת סידן מוגברת בשתן (היפרקלציאוריה). זו מופיעה ב-33-78% מכלל המקרים שבהם מבוצע בירור מטבולי[2],[23],[24]. הפרשת סידן מוגברת בשתן מוגדרת בערכים הגדולים מ-4 מ"ג לק"ג ליום. הפרשת סידן בשתן תלויה במערכת מורכבת של הורמונים, ובראשם ויטמין D והורמון הפאראתירואיד (PTH - Parathyroid hormone).
ספיגת סידן במעי מושתתת על שני מנגנונים - הראשון תלוי בוויטמין D ואילו השני תלוי רק בכמות הנצרכת של סידן בתזונה. הפרשת הסידן, לעומת זאת, מבוצעת בעיקר בכליה. בכליה, רק סידן שאינו מצומד לאלבומין, עובר סינון בפקעית ל-Ultrafiltrate. עיקר הספיגה חזרה מה-Ultrafiltrate מבוצעת באבובית המפותלת הקריבנית (Proximal convoluted tubule), ואילו שאר הספיגה מבוצעת בחלק העולה של לולאת הנלה ובאבובית המפותלת הרחיקנית (Distal convoluted tubule). בשני האזורים הראשונים, כ-90% מהסידן בתסנין נספג כפועל יוצא של ספיגת הנתרן, ואילו באבובית המפותלת הרחיקנית התהליך מצריך תעלות ספציפיות, חלבונים נושאי סידן והשקעה אנרגטית. חלק זה בספיגת סידן מתווך על ידי הורמון הפאראתירואיד ועל ידי ויטמין D.
ברוב המקרים הפרשת הסידן המוגברת בשתן היא ראשונית או אידיופטית, אך במקרים נדירים יותר מדובר בהפרעה המשנית לפתולוגיה קיימת, כגון מחלה על שם Dent או חמצת עקב ליקוי באבוביות הכליה (Renal tubular acidosis).
כאשר הפרשת הסידן המוגברת היא ראשונית, מדובר בשלוש הפרעות אפשריות או שילוב שלהן: ספיגה מוגברת במעי, ספיגת עצם מוגברת או ספיגה מופחתת בכליה. בשתי הראשונות כמות הסידן המגיע לכליה גבוהה מהנורמה, ובשלישית הכמות המגיעה ל-Ultrafiltrate תקינה, אך אין ספיחת סידן מספקת חזרה באבוביות הכליה. בשנים האחרונות נמצאו מספר גנים האחראים על תסמונות שונות המתבטאות בהפרשת יתר של סידן בשתן, אך ברוב המטופלים הדפוס הוא פוליגני, ככל הנראה.
הפרשה מוגברת של חומצה אוקסלית בשתן
הפרעה מטבולית נוספת היא הפרשה מוגברת של חומצה אוקסלית בשתן. זו יכולה להיות ראשונית או משנית למצבים פתולוגיים אחרים. שני אנזימים ספיציפיים בודדו כמקור להפרשת מוגברת של חומצה אוקסלית בשתן ממקור ראשוני, ושניהם מועברים בתורשה אוטוזומלית רצסיבית. מצבים שניוניים המלווים בהפרשת מוגברת של חומצה אוקסלית בשתן כוללים, בין היתר:
- מחלת מעי דלקתית
- לייפת כיסתית (ציסטיק פיברוזיס)
- צריכת יתר של ויטמין C
- חסר בוויטמין B6
- מצב לאחר כריתת מעי דק
- שחמת של הכבד
בחלק מאותן מחלות יש פגיעה בחדירות הבררנית של המעי ובחלק ספיחה של סידן לחומצות שומן, דבר הגורם לכמות חומצה אוקסלית חופשית גבוהה יותר במעי. התוצאה הסופית היא ספיגה מוגברת של חומצה אוקסלית דרך דופן המעי וכתוצאה מכך הפרשתו בריכוז גבוה בשתן. הפרעה זו נמצאה בשכיחות בשיעור 3-27% מהמקרים בסדרות שונות[23],[24],[25].
מחלה גנטית שגורמת לאבני כליה היא מחלת Dent: המחלה נגרמת על ידי מוטציות בגן שמקודד לתעלת הכלור CLCN5, וכן הפרשה מוגברת של חומצה אוקסלית בשתן, ראשונית או שניונית.
ציסטאינוריה
ציסטאינוריה מאופיינת בהפרשת ציסטאין ומספר חומצות אמינו נוספות (ליזין, ארגינין ואורניטין) בכמות גדולה בשתן. זוהי מחלה מטבולית נוספת שגורמת להופעת אבנים בדרכי השתן.
ניתן למצוא את המחלה בכ-5-8% מהילדים עם מחלת אבנים(23,24). מקור ההפרעה הוא פגיעה בנשאים ספציפיים לחומצות אמינו, אלו הממוקמים בחלק הלא מפותל של האבובית הקריבנית. האבחנה מתאפשרת על ידי מציאת אבני ציסטאין או הפרשה מוגברת בשתן של חומצות אמינו אלה. הופעת אבנים בדרכי השתן מתרחשת לרוב בעשור השני או השלישי לחיים.
צריכת מלמין (Melamine formaldehyde)
מלמין (Melamine formaldehyde) הוא חומר המצוי בתעשיית המזון. למרות שהשימוש בו אסור במדינות רבות, חברות שונות המייצרות תרכובות מזון לתינוקות (פורמולות) השתמשו בחומר זה, מאחר שהוא גורם הטיה כלפי מעלה (הטיה שקרית) בערך החלבון הנמדד בתרכובת המזון. השימוש במלמין, בעיקר בסין, גרם להופעת מקרים רבים של אבני כליה המורכבים מחומצה אורית או מזרחן-אמוניום[26].
ארגון הבריאות העולמי קבע ריכוז יומי מומלץ הנמוך מ-0.2mg/kg. עם זאת, נמצא שגם ברמה זו קיים סיכון מוגבר לפתח מחלת אבנים[27]. בישראל בעיה זו אינה מוכרת שכן אין שימוש במלמין בקרב החברות המייצרות פורמולה לתינוקות.
טיפול
ערך מורחב – אבנים בדרכי השתן בילדים - טיפול - Urolithiasis in pediatric patients - treatment
הטיפול בילד עם אבנים בכליה תלוי במספר גורמים: חומרת התסמינים, נוכחות של זיהום בדרכי השתן, מיקום האבן וגודלה, מחלות רקע ומומים מבניים בדרכי השתן.
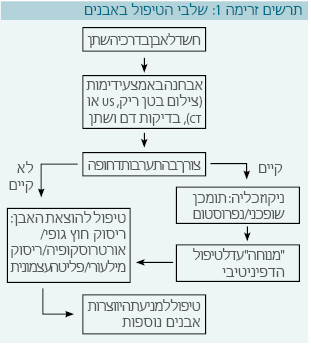
חשוב להבדיל בין שלבי הטיפול השונים במחלת אבנים בילדים ולהבין את מהות הטיפול בכל שלב. כפי שצוין, לרוב ההסתמנות הקלינית תתבטא לראשונה בכאב במותן. נראה ילד זה לראשונה במיון, אך לעתים גם במרפאה ראשונית. לאחר שאובחן כי אכן מדובר באבן בדרכי השתן, צריך לקבוע אם קיימת התוויה לאשפוז ולטיפול דחוף.
ההתוויות לאשפוז הן:
- כאבים שלא מגיבים לטיפול פומי במשככי כאבים
- עדות לחסימה מכנית של הכליה - מתבטא בהרחבת שופכן ומערכת מאספת, או לעתים רחוקות יותר בדליפה של שתן לחלל האחור-צפקי (Retroperitoneal space) והתפתחות אורינומה (Urinoma)
- חשש קליני לזיהום בדרכי השתן ופגיעה בתפקוד כלייתי
במקרים אלו יישקל ביצוע פעולה לניקוז הכליה כדי לאפשר ניקוז של השתן ולמנוע התפתחות של נזק כלייתי ואלח דם (ספסיס).
לאחר שהתמונה החריפה חולפת, נבחר בין המתנה ופליטה עצמונית של אבן קטנה לבין אחד מהטיפולים הסופיים לפינוי האבן:
- ריסוק חוץ-גופי (ESWL - Extracorporeal shockwave lithotripsy)
- ריסוק אנדוסקופי, אורטרוסקופיה (Ureteroscopy)
- ריסוק מילעורי (PCNL - Percutaneous nephrolitotomy)
לאחר פליטת האבן ו/או פינוי של האבן, מומלץ לבצע בירור מטבולי וקביעת הרכב האבן, במקביל לדאוג לשינוי הרגלי תזונה ושתייה ולעתים לטפל בתרופות כדי למנוע הישנות של האבנים.
טיפול שמרני
אם מבחינה קלינית הדבר מתאפשר, מומלץ בשלב הראשון להתחיל בניסיון לטיפול שמרני. הטיפול השמרני נועד לאפשר פליטה עצמונית של אבנים (Spontaneous expulsion of urinary stone). הבסיס לטיפול זה הוא מתן נוזלים ומשככי כאבים. טיפול זה מתאפשר כאשר האבן קטנה מחמישה מ"מ, ואין תסמינים משמעותיים של כאב או זיהום חריף בדרכי השתן.
הסיכוי שהטיפול העצמוני יצליח תלוי בגודל האבן ובמיקומה. נהוג לחלק את השופכן לשלושה חלקים:
- שופכן קריבני - אותו חלק של השופכן המתחיל באגן הכליה ומסתיים בכניסה לאגן הקטן
- שופכן אמצעי - החלק של השופכן שעובר על פני עצם האגן
- שופכן רחיקני - החלק של השופכן שנכנס לשלפוחית השתן
יש שלוש נקודות אנטומיות שבהן השופכן צר יותר ומקשה את מעבר האבן: אזור מעבר אגן הכליה-שופכן, האזור שבו השופכן חוצה את כלי הדם הכסליים (Iliac vessles) והאזור הרחיקני ביותר של השופכן, בו הוא עובר בתוך שריר שלפוחית שתן.
ככל שהאבן גבוהה יותר וגדולה יותר, כך הסיכוי לפליטה עצמונית נמוך יותר. אבן שקוטרה עד 2 מ"מ סיכוייה להיפלט נאמדים ב-80%, ואילו באבן שקוטרה 3-5 מ"מ הסיכוי הוא 67%. אבנים גדולות מ-5 מ"מ הן בעלות סיכוי נמוך לפליטה עצמונית[28].
הטיפול התרופתי בחסמי אלפא (α-blockers) במחלת אבנים במבוגרים הוכח כמשפר את אחוז הפליטה העצמונית של אבנים. טיפול זה אינו מבוסס בילדים. רוב המאמרים כוללים קבוצות קטנות של ילדים, מינונים שונים ותרופות שונות, ולכן לא ניתן לקבוע חד-משמעית אם טיפול זה מביא תועלת.
לאחרונה, פורסם מאמר שכלל 39 ילדים עם אבנים רחיקניות שחולקו לשתי קבוצות: קבוצה אחת טופלה ב-Doxazosin במינון של 0.03mg/kg, וקבוצה שנייה טופלה במשככי כאבים בלבד. בעבודה זו לא נמצאו הבדלים סטטיסטיים משמעותיים בשיעור פליטת האבנים. ייתכן שקיימת נטייה מסוימת לשיפור בשיעור הפליטה העצמונית באבנים גדולות יותר[29]. מאמר אחר שבדק שימוש ב-Tamsulosin במינון 0.4 מ"ג פעם ביום, הראה כי קיים סיכוי גבוה יותר לפליטה עצמונית של האבן וכן שהזמן עד לפליטת האבן קצר יותר.
ניקוז כליה
במקרים בהם יש חשד לזיהום חריף בדרכי השתן, קיימים כאבים חזקים שאינם נשלטים במשככי כאבים, פגיעה בתפקוד כלייתי או עדות ליציאה של שתן מהכליה לחלל הבטן (אקסטרווזציה, Extravasation, של שתן), יש חשיבות לניקוז מהיר ככל הניתן של הכליה.
קיימות שתי צורות ניקוז כליה עיקריות:
- תומכן (סטנט) שופכני, שיעקוף את האבן ויאפשר מעבר של שתן מהכליה לשלפוחית השתן
- נפרוסטום (Nephrostomy tube), המוחדר במותן דרך העור אל אגן הכליה, ומאפשר ניקוז שתן לשקית שתן הממוקמת מחוץ לגוף
לכל אחת משיטות אלו יש יתרונות וחסרונות. אין קווים מנחים ברורים לבחירת שיטת ניקוז הכליה. באופן כללי, לרוב נבחר בהכנסת נפרוסטום באבנים קריבניות, ובמקרים של אבנים רחיקניות נבחר בהכנסת תומכן שופכני. אם קיים זיהום בדרכי השתן, חשוב מאוד לתת טיפול אנטיביוטי הולם כדי להקטין את הסיכון לאלח דם עקב ביצוע הפעולה.
היתרונות שמציעה הכנסת הנפרוסטום הם שניים: ראשית, במבוגרים ההליך מתבצע בהרדמה מקומית (בילדים שאינם משתפים פעולה יתרון זה מתבטל). בנוסף, אם אגן הכליה מורחב, קל יחסית לנקז את הכליה, ואין צורך לעבור את אזור האבן החוסמת. החיסרון של שיטה זו הוא דימום אפשרי עקב חדירה דרך העור ודרך הפרנכימה של הכליה.
היתרון בהכנסת תומכן שופכני הוא הסיכוי הנמוך לדימום משמעותי. מצד שני, החסרונות בשיטה זו הם שהיא מתבצעת בהכרח בהרדמה, ובזמן הכנסת התומכן צריך לעבור את אזור החסימה של האבן. במקרים מסוימים, בהם האבן חוסמת באופן מוחלט את חלל השופכן, קיים קושי במעבר התומכן.
טיפול ניתוחי
עם העלייה בשכיחות מחלות אבנים בילדים, קיימת התפתחות במכשור הכירורגי הנועד לפנות אבנים מדרכי השתן. בכל ילד עם מחלת אבנים יש צורך לבצע בירור כדי לשלול מחלות מטבוליות או מומים אנטומיים המהווים גורם סיכון ליצירת אבנים. הגישה הטיפולית משקללת מספר מדדים: גודל האבן, מיקום האבן, הרכב האבן, גיל הילד, מומים אנטומיים ועוד. הגישה הטיפולית צריכה להיות מדורגת כך שבשלב הראשון, מתחילים בטיפול שמרני שמטרתו פליטה עצמונית של האבנים במידת האפשר. אם הצורך בניקוז הכליה דחוף, בוחרים אופציה ניתוחית מתאימה, כאשר יש שלוש אפשרויות:
- ריסוק חוץ-גופי
- ריסוק אנדוסקופי, אורטרוסקופיה
- ריסוק מילעורי
עקב מורכבות הטיפול הכירורגי יש לשים דגש רב על מניעה של יצירת האבנים כדי למנוע ככל הניתן התערבויות כירורגיות חוזרות ולהפחית את הסיבוכים הפוטנציאליים של טיפולים אלו.
ריסוק חוץ-גופי
העיקרון מאחורי שיטת טיפול זו נעוץ ביצירת גלי הלם על ידי מתמר שנמצא מחוץ לגוף האדם. גל ההלם המירבי הנוצר משפיע בנקודה מרוחקת מהמתמר. בזמן הריסוק החוץ-גופי מניחים את המטופל כך שמיקום האבן יהיה במדויק בנקודה שבה ההשפעה של גלי ההלם היא מירבית.
הצלחת הטיפול על ידי ריסוק חוץ-גופי תלויה במספר גורמים: גודל האבן, מיקום האבן, הרכב האבן (אבני סידן-חומצה אוקסלית-מונוהידרט ואבני ציסטאין נחשבות לקשות יותר, ולכן שיעור ההצלחה של ריסוק חוץ-גופי נמוך יותר) ומומים מבניים בכליה.
ההתוויה המקובלת לשימוש בריסוק חוץ-גופי בילדים היא אבני כליה או אבנים בשופכן הקריבני. ככל שהאבן גדולה יותר, כך הסיכוי להשגת שיעור גבוה של חופש מאבנים (SFR - Stone free rate) נמוך יותר. אין גודל אבן מסוים שממנו לא מבצעים ריסוק, אך נהוג לבצע ריסוק באבנים הקטנות מ-2 ס"מ.
יש סוגים שונים של מכונות לריסוק חוץ-גופי, המתבססות על טכנולוגיות שונות לייצור גל ההלם. מכונות מסוג Electrohydraulic מייצרות גל הלם חזק. היתרון במכונות אלו הוא ששיעור ריסוק האבן גבוה, אך החיסרון הוא הצורך בהרדמה כללית.
מכונות מסוג Piezoelectric מייצרות גל הלם חלש יותר, ולכן הפעולה פחות כואבת ואינה מצריכה הרדמה, מצד שני, שיעור האבנים המתרסקות נמוך יותר.
אמצעי הדימות למיקום האבן משתנים לפי שיטת הריסוק של האבן שבה אנו בוחרים. לאיתור האבן בזמן הריסוק רוב המכונות משתמשות בשיקוף, ולכן במקרה של אבנים שאינן נראות בשיקוף (אבנים Radiolucent, כמו אבני חומצה אורית) לא ניתן לקבוע את מיקומן המדויק ועל כן לא ניתן לרסקן. יש מכונות המשתמשות בעל-קול כאמצעי דימות המאפשר איתור גם של אבנים שלא נראות בשיקוף.
אחוזי הצלחה המוגדרים כשיעור חופש מאבנים דומים בילדים ובאוכלוסייה המבוגרת: באבנים הקטנות מ-1 ס"מ - 84%, באבנים בגודל 1-2 ס"מ - 77% ובאבנים הגדולות מ-2 ס"מ - 50% לערך בלבד[30]. במקרים שבהם ריסוק חוץ גופי כשל, ניתן לפנות לאחת מהאפשרויות הטיפוליות הבאות: ריסוק חוץ-גופי חוזר (אחוזי ההצלחה כאן הם סביב 50%), ריסוק מילעורי או אורטרוסקופיה.
הועלו מספר שאלות לגבי השפעה של ריסוק חוץ-גופי על הכליה המתפתחת של ילדים והועלו חששות כי תיתכן פגיעה כלייתית שעלולה להוביל להתפתחות יתר לחץ דם בעתיד בילדים אלו. עד היום לא פורסמה אף עבודה המאמתת חששות אלו.
במחקר אחד שבדק 63 ילדים שעברו ריסוק חוץ-גופי לא הודגם אף מקרה של צלקת כלייתית, יתר לחץ דם או פגיעה בתפקוד הכלייתי במעקב של 45 חודשים[31]. מחקר נוסף שבו בוצע מיפוי כליות (Tc-DTPA) ב-84 ילדים, הראה אומנם ירידה מסוימת בקצב הסינון הפקעתי (GFR - Glomerular filtration rate) מיד לאחר הריסוק, אך לאחר שלושה חודשים התפקוד הכלייתי חזר לתפקוד שנמדד לפני הריסוק[32].
סיבוכים פוטנציאליים נוספים כוללים: זיהום, דימום וחסימה של השופכן בזמן פינוי פירורי האבן שרוסקה (Steinstrasse).
לאחר הריסוק יש צורך בביצוע פעולות דימות נוספות כדי לוודא כי אכן כל הפירורים פונו. לרוב הדימות מתבצעת על ידי טומוגרפיה ממוחשבת.
לסיכום, ריסוק חוץ-גופי בילדים יכול לשמש כקו ראשון בטיפול באבני כליה הקטנות מ-2 ס"מ. אחוזי הצלחה גבוהים ורמת פולשנות נמוכה עומדים לזכות שיטה זו.
במקרים שבהם קיים מום מבני בכליה, אבן גדולה משני ס"מ או ידוע שקיימת אבן בעלת הרכב כימי קשה, אחוזי הצלחת הטיפול נמוכים יותר.
בשנים האחרונות עלתה המודעות לנזקי הקרינה, במיוחד בילדים, ולכן ניתן לראות בכך חיסרון נוסף לשיטת הריסוק החוץ-גופי.
אורטרוסקופיה
עקרון פעולה זו הוא הכנסת סיב אופטי דרך השופכה אל שלפוחית השתן, זיהוי פיית השופכן וכניסה לשופכן עד לאבן בהסתכלות ישירה. פינוי האבן מתבצע על ידי ריסוק האבן לחלקים קטנים יותר בשימוש באנרגיית לייזר והוצאת פירורי האבן על ידי סלסלות או מלקחיים. גם כאן אין הגדרות ברורות מתי יש לבצע אורטרוסקופיה. ככלל אצבע, משתמשים באורטרוסקופיה כקו ראשון במקרים של אבנים בשופכן האמצעי והרחיקני.
בשנים האחרונות חלה התקדמות משמעותית בציוד האנדוסקופי. מיוצרים מכשירים בעלי קוטר דק, מכשירים גמישים, ומוזערו מקורות האנרגיה, כגון לייזר. כל אלו מאפשרים ביצוע אורטרוסקופיה גם בילדים הקטנים ביותר.
השימוש באורטרוסקופיה בילדים זכה לפופולריות בקרב אורולוגים של ילדים החל משנת 1988[33]. הפעולה מתבצעת בדומה לפעולה במבוגרים, אך קיימים מספר שיקולים טכניים ייחודיים לילדים. קוטר השופכן בילד הוא 2-5 מ"מ, ולעתים קרובות לפני הפעולה יש צורך להרחיב את פיית השופכן כדי לאפשר כניסה של האורטרוסקופ בעל קוטר רחב יותר. במקרים מסוימים יש התוויה להכנסת תומכן שופכני לתקופה מסוימת, כדי להרחיב את קוטר פיית השופכן וכשבועיים לאחר מכן לבצע את האורטרוסקופיה והוצאת האבן. שיקולי קרינה הם חשובים ביותר באוכלוסיית צעירים, ולכן יש להימנע משיקוף ככל שניתן בזמן הפעולה. אם אנו בטוחים שפינינו את כל האבן בזמן הפעולה, אין צורך בדימות חוזר לאחר הפעולה.
שיעור חופש מאבנים לאחר ביצוע אורטרוסקופיה הוא גבוה, ומדווח במאמרים שונים על כ-77-100%[34].
לסיכום, מזעור ושיפור של המכשור הרפואי מעלים את אחוזי ההצלחה של טיפול זה. חשיפה נמוכה לקרינה והמיומנות הנרכשת של המנתחים הביאו לכך שברוב בתי החולים ביצוע אורטרוסקופיה לאבנים הקטנות מס"מ וחצי לאורך כל השופכן, ולעתים גם בכליה, הוא טיפול הבחירה[35].
הסיבוכים הפוטנציאליים מפעולה זו הם זיהום, דימום, היצרות של השופכן (1-4% מהמקרים לפי סדרות שונות) ופגיעה בשופכן בזמן הפעולה.
ריסוק מילעורי
צורת טיפול זו נחשבת לחודרנית ביותר מבין שיטות הטיפול באבנים בדרכי השתן, ולכן משתמשים בריסוק מילעורי במקרים נבחרים בלבד. ההתוויות העיקריות לריסוק מילעורי הן:
- מסת אבן גדולה (בדרך כלל אבנים הגדולות מ-2 ס"מ)
- מומים מבניים בכליה שיקשו על פינוי פירורי אבנים לאחר ריסוק חוץ-גופי
- כישלון של ניסיון קודם לטיפול בריסוק או באורטרוסקופיה
- הרכב אבן קשה, כמו אבני ציסטאין, שהוא בעל שיעור ריסוק נמוך בריסוק חוץ-גופי
- אבנים Radiolucent (אשר לא ניתן לראות בשיקוף, בעיקר אבני חומצה אורית)
בשלב הראשון מחדירים תומכן דרך שלפוחית השתן אל השופכן והכליה בצד המנותח. לאחר מכן משיגים גישה למערכת המאספת של הכליה דרך העור. בשלב הבא, מרחיבים את המעבר כדי לאפשר החדרת מכשיר עבודה (Nephroscope), ולאחר מכן מרסקים את האבן על ידי אנרגיות שונות: גלים פנאומטיים, גלי קול, לייזר ועוד.
הפרוצדורה ארוכה ומורכבת יותר ביחס לשתיים האחרות, דורשת זמן אשפוז ממושך יותר ובעלת שיעור סיבוכים גבוה יותר. הסיבוכים הפוטנציאליים כוללים זיהום, כאב לאחר הפעולה, איבוד דם ולעתים צורך במתן דם, היפותרמיה בזמן הפעולה ופגיעה כלייתית.
לצד החסרונות יש לשיטה מספר יתרונות בולטים: שיעור הצלחה גבוה של 80-100% ואפשרות לטפל באבנים גדולות בפעולה אחת. בשנים האחרונות פותחו ונכנסו לשימוש מכשירים עדינים יותר לשימוש בילדים. נראה כי שימוש במכשירים אלו לא האריך את זמן הפעולה והפחית בצורה משמעותית את הצורך במתן דם לאחר הניתוח[36].
לסיכום, ריסוק מילעורי הוא טיפול הבחירה לאבני כליה גדולות מ-2 ס"מ. מזעור המכשור ושיפור מקורות האנרגיה לריסוק האבן מפחיתים את שיעור הסיבוכים בפעולה חודרנית זו.
דגלים אדומים
ביבליוגרפיה
- Cameron MA, Sakhaee K, Moe OW. Nephrolithiasis in children. Pediatr Nephrol 2005;20(11):1587-1592
- Milliner DS, Murphy ME. Urolithiasis in pediatric patients. Mayo Clin Proc 1993;68(3):241-248
- ↑ 1.0 1.1 1.2 Yasui T, Iguchi M, Suzuki S, et al. Prevalence and epidemiological characteristics of urolithiasis in Japan: national trends between 1965 and 2005. Urology 2008;71(2):209-213
- ↑ 2.0 2.1 2.2 2.3 Edvardsson V, Elidottir H, Indridason OS, et al. High incidence of kidney stones in Icelandic children. Pediatr Nephrol 2005;20(7):940-944
- ↑ Tanaka ST, Pope JC. Pediatric stone disease. Curr Urol Rep 2009;10(2):138-143
- ↑ Cochat P, Pichault V, Bacchetta J, et al. Nephrolithiasis related to inborn metabolic diseases. Pediatr Nephrol 2009
- ↑ Coward RJ, Peters CJ, Duffy PG, et al. Epidemiology of paediatric renal stone disease in the UK. Arch Dis Child 2003;88(11):962-965
- ↑ 6.0 6.1 Costa-Bauza A, Ramis M, Montesinos V, et al. Type of renal calculi: variation with age and sex. World J Urol 2007;25(4):415-421
- ↑ 7.0 7.1 Novak TE, Lakshmanan Y, Trock BJ, et al. Sex prevalence of pediatric kidney stone disease in the United States: an epidemiologic investigation. Urology 2009;74(1):104-107
- ↑ 8.0 8.1 Acar B, Inci AF, Emeksiz S, et al. Risk factors for nephrolithiasis in children. World J Urol 2008;26(6):627-630
- ↑ 9.0 9.1 Alpay H, Ozen A, Gokce I, et al. Clinical and metabolic features of urolithiasis and microlithiasis in children. Pediatr Nephrol 2009;24(11):2203-2209
- ↑ Sarica K, Eryildirim B, Yencilek F, et al. Role of overweight status on stone-forming risk factors in children: a prospective study. Urology 2009;73(5):1003-1007
- ↑ 11.0 11.1 11.2 Persaud AC, Stevenson MD, McMahon DR, et al. Pediatric Urolithiasis: Clinical Predictors in the Emergency Department. Pediatrics 2009
- ↑ Gur GA, Koyun M, Emre BY, et al. Urolithiasis in the first year of life. Pediatr Nephrol 2009
- ↑ 13.0 13.1 13.2 Kit LC, Filler G, Pike J, et al. Pediatric urolithiasis: experience at a tertiary care pediatric hospital. Can Urol Assoc J 2008;2(4):381-386
- ↑ Chan VO, Buckley O, Persaud T, et al. Urolithiasis: how accurate are plain radiographs? Can Assoc Radiol J 2008;59(3):131-134
- ↑ Sourtzis S, Thibeau JF, Damry N, et al. Radiologic investigation of renal colic: unenhanced helical CT compared with excretory urography. AJR Am J Roentgenol 1999;172(6):1491-1494
- ↑ Brenner D, Elliston C, Hall E, et al. Estimated risks of radiation-induced fatal cancer from pediatric CT. AJR Am J Roentgenol 2001;176(2):289-296
- ↑ Katz SI, Saluja S, Brink JA, et al.. Radiation dose associated with unenhanced CT for suspected renal colic: impact of repetitive studies. AJR Am J Roentgenol 2006;186(4):1120-1124
- ↑ Singh S, Kalra MK, Moore MA, et al. Dose reduction and compliance with pediatric CT protocols adapted to patient size, clinical indication, and number of prior studies. Radiology 2009;252(1):200-208
- ↑ Memarsadeghi M, Heinz-Peer G, Helbich TH, et al.Unenhanced multi-detector row CT in patients suspected of having urinary stone disease: effect of section width on diagnosis. Radiology 2005;235(2):530-536
- ↑ Karmazyn B, Frush DP, Applegate KE, et al. CT with a computer-simulated dose reduction technique for detection of pediatric nephroureterolithiasis: comparison of standard and reduced radiation doses. AJR Am J Roentgenol 2009;192(1):143-149
- ↑ Strouse PJ, Bates DG, Bloom DA, et al. Non-contrast thin-section helical CT of urinary tract calculi in children. Pediatr Radiol 2002;32(5):326-332
- ↑ Ulahannan D, Blakeley CJ, Jeyadevan N, et al. Benefits of CT urography in patients presenting to the emergency department with suspected ureteric colic. Emerg Med J 2008;25(9):569-571
- ↑ 23.0 23.1 23.2 Bak M, Ural R, Agin H, et al. The metabolic etiology of urolithiasis in Turkish children. Int Urol Nephrol 2009;41(3):453-460
- ↑ 24.0 24.1 Dursun I, Poyrazoglu HM, Dusunsel R, et al. Pediatric urolithiasis: an 8-year experience of single centre. Int Urol Nephrol 2008;40(1):3-9
- ↑ Spivacow FR, Negri AL, del Valle EE, et al. Metabolic risk factors in children with kidney stone disease. Pediatr Nephrol 2008;23(7):1129-1133
- ↑ Bacchetta J, Dubourg L, Juillard L, et al. Non-drug-induced nephrotoxicity. Pediatr Nephrol 2009
- ↑ Li G, Jiao S, Yin X, et al. The risk of melamine-induced nephrolithiasis in young children starts at a lower intake level than recommended by the WHO. Pediatr Nephrol 2009
- ↑ Pietrow PK, et al. Clinical outcome of pediatric stone disease. J Urol 2002;167(2 Pt 1):670-673
- ↑ Aydogdu O, et al. Effectiveness of Doxazosin in treatment of distal ureteral stones in children. J Urol 2009;182(6):2880-2884
- ↑ Raza A, et al. Pediatric urolithiasis: 15 years of local experience with minimally invasive endourological management of pediatric calculi. J Urol 2005;174(2):682-685
- ↑ Brinkmann OA, et al. Extracorporeal shock wave lithotripsy in children. Efficacy, complications and long-term follow-up. Eur Urol 2001;39(5):591-597
- ↑ Vlajkovic M, et al. Long-term functional outcome of kidneys in children with urolithiasis after ESWL treatment. Eur J Pediatr Surg 2002;12(2):118-123
- ↑ Shepherd P, Thomas R, Harmon EP. Urolithiasis in children: innovations in management. J Urol 1988;140(4):790-792
- ↑ Wu HY, Docimo SG. Surgical management of children with urolithiasis. Urol Clin North Am 2004;31(3):589-594
- ↑ Smaldone MC, et al. Is ureteroscopy first line treatment for pediatric stone disease? J Urol 2007;178(5):2128-2131
- ↑ Bilen CY, et al. Percutaneous nephrolithotomy in children: lessons learned in 5 years at a single institution. J Urol 2007;177(5):1867-1871
קישורים חיצוניים
- אבני כליה בילדים, מדיקל מדיה
- הטיפול הכירורגי באבנים בדרכי השתן, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר עמוס נאמן ד"ר אייל זיפמן פרופ' אבישלום פומרנץ


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק