אוסטיאופורוזיס בקרב מבוגרים - אבחון, מניעה וטיפול - נייר עמדה 2012
הופניתם מהדף אוסטיאופורוזיס בקרב מבוגרים - אבחון, מניעה וטיפול לדף הנוכחי.
|
| |
|---|---|
| אוסטיאופורוזיס בקרב מבוגרים -אבחון, מניעה וטיפול נייר עמדה 2012 | |
| |
| האיגוד המפרסם | העמותה הישראלית לאוסטיאופורוזיס ומחלות עצם - עיל"א |
| יוצר הערך | הוועדה מטעם העמותה הישראלית לאוסטיאופורוזיס ומחלות עצם - עיל"א ההסתדרות הרפואית בישראל / המועצה המדעית / האגף להבטחת איכות |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אוסטאופורוזיס
חברי הוועדה לכתיבת נייר העמדה
- פרופ' אורי ליברמן - יושב ראש עמותת עיל"א (העמותה הישראלית לאוסטיאופורוזיס), המחלקה לפיזיולוגיה ולפרמקולוגיה, הפקולטה לרפואה על שם סאקלר, תל אביב
- ד"ר לאה אהרוני - השירות הגריאטרי, מחוז חיפה וגליל מערבי, שירותי בריאות כללית
- פרופ' צופיה איש-שלום - היחידה למטבוליזם העצם והסידן, מרכז רפואי רמב"ם, הקריה הרפואית לבריאות האדם, הפקולטה לרפואה של הטכניון, חיפה
- ד"ר רקפת בכרך - רפואת המשפחה, שירותי בריאות כללית
- פרופ' מרדכי וייס - המכון האנדוקריני, מרכז רפואי אסף הרופא, צריפין
- ד"ר איריס ורד - השירות למחלות עצם ומינרלים, המכון האנדוקריני, המרכז הרפואי המשולב ע"ש חיים שיבא, תל השומר
- ד"ר שרי טל - המרפאה לבריאות העצם, מחלקה פנימית גריאטרית, מרכז רפואי קפלן
- פרופ' יעקב מנצ'יל - ביה"ח על שם הרצוג, ירושלים
- פרופ' שאול סוקניק - המחלקה לרפואה פנימית, בית החולים האוניברסיטאי סורוקה, באר-שבע emeritus
- פרופ' יוסף פולדש - המרכז לאוסטיאופורוזיס, בית החולים האוניברסיטאי הדסה, ירושלים
- פרופ' ברי קפלן - בית חולים לנשים, מרכז רפואי רבין, פתח תקווה
מזכירת הוועדה, גברת אירית ענבר - העמותה הישראלית לאוסטיאופורוזיס ומחלות עצם.
מבוא
אוסטיאופורוזיס היא מחלה ששכיחותה עולה עם הגיל, והיא פוגעת בעיקר בנשים לאחר גיל המעבר. המחלה היא אחד הגורמים העיקריים לפגיעה באיכות החיים בגיל מבוגר. עם העלייה בתוחלת החיים הממוצעת, צפוי כי יותר נשים וגברים ילקו באוסטיאופורוזיס, ויש לכך השלכות רפואיות, חברתיות וכלכליות.
העלות של הטיפול בשברי הירך הקריבנית למערכות האשפוז הדחוף והאשפוז השיקומי מוערכת במאות מיליוני שקלים בשנה, ולכך נוספות עלויות של טיפול סיעודי והפסד השתכרות של החולים ושל קרובי משפחתם.
בעשורים האחרונים חלה התקדמות ניכרת בהבנת המנגנונים התאיים והמולקולריים שבבסיס המחלה, פותחו אמצעי אבחון מדויקים ונגישים ואושרו לשימוש תרופות אשר מעכבות את התקדמות התהליך. האתגר העומד בפני הרופא הראשוני והמומחה כאחד הוא למנוע את המחלה, לאבחן אותה ולטפל בה בצורה מושכלת.
נייר עמדה זה הוא פרסום רשמי של העמותה הישראלית לאוסטיאופורוזיס ולמחלות עצם (עיל׳׳א), ומטרתו לרכז את המידע העדכני והרלוונטי בנושא, על מנת שיהיה זמין לרופא המטפל.
נייר עמדה זה אינו עוסק בתהליכי דלדול עצם בילדים ובמתבגרים.
רקע
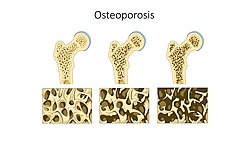
אוססיאופורוזיס היא מחלת עצם המאופיינת בדלדול של המסה ובשינויי איכות הגורמים לשבירות מוגברת של השלד. השברים האופייניים מופיעים בעקבות חבלה קלה יחסית או ללא חבלה כלל, בעיקר בחוליות עמוד השדרה, בחלק הקריבני של הירך ושל הזרוע, ובחלק הרחיקני של האמה. ייתכנו שברים גם בעצמות אחרות. המחלה מתפתחת כתוצאה מהפרת האיזון בין תהליכי הפירוק לתהליכי הבנייה של העצם.
אוסטיאופורוזיס מסווגת כמחלה ראשונית או שניונית. בקבוצה המחלות המסווגות כאוסטיאופורוזיס ראשונית נכללות אוסטיאופורוזיס לאחר גיל המעבר של נשים, אוסטיאופורוזיס תלוית גיל של שני המינים ואוסטיאופורוזיס אידיופתית של ילדים ושל נשים וגברים צעירים. אוסטיאופורוזיס שניונית נגרמת כתוצאה ממחלות או משימוש בתרופות.
מסמך זה דן בצורות השכיחות של אוסטיאופורוזיס של מבוגרים.
אוסטיאופורוזיס של מבוגרים תלויה במסת העצם שנבנתה בשני העשורים הראשונים לחיים (מסת העצם המרבית, Peak bone mass) ובמידת דלדול העצם בהמשך מהלך החיים. גורמי סיכון להתהוות אוסטיאופורוזיס כוללים מרכיבים תורשתיים וסביבתיים, וכן מצבים רפואיים העלולים לגרום לאוסטיאופורוזיס שניונית (ראה נספח 1). חשוב להכיר את כל גורמי הסיכון למחלה ולזהותם כדי למנוע אותם או לצמצמם כמה שאפשר.
אבחון
הקדמה
לתהליך דלדול העצם אין תסמינים, סימנים גופניים או ממצאי מעבדה ייחודיים.
האבחנה מתבצעת לאחר הופעת שברים אוסטיאופורוטיים אופייניים, ו/או באמצעות מדידה כמותית של מסת (צפיפות) העצם.
שבר אוסטיאופורוזי הוא שבר הנגרם על ידי חבלה קלה יחסית במיקום אופייני בשלד, כגון גופי החוליות (שבר קליני או רנטגני), הירך הקריבנית (Proximal femur), האמה הרחיקנית (Distal forearm) והזרוע הקריבנית (Proximal humerus). אמנם רוב השברים הם אירועים קליניים המאובחנים בבירור, אך שברים בחוליות עלולים שלא להיות מאובחנים בעת התרחשותם. איבוד גובה והופעת גבנון מעוררים חשד לקיומם של שברים בחוליות.
מדידת צפיפות העצם היא האמצעי העיקרי לאבחון מדויק ומוקדם ולניטור תהליך האוסטיאופורוזיס. מסמך זה מתייחס לסוג המדידות, לשימוש במדידה לצורך אבחון ולצורך קבלת החלטות לגבי הטיפול המתאים, וכן להתוויות שעל פיהן יש להפנות מטופל למדידה ראשונה ולמדידה חוזרת. ההמלצות עשויות להשתנות בעתיד, בהתאם להתפתחויות בטכנולוגיות המדידה ובאמצעי הטיפול.
יש כמה שיטות למדידת צפיפות העצם. השיטה המקובלת לאבחון (קריטריונים להגדרת אוסטיאופורוזיס, ראה להלן) ולניטור אוסטיאופורוזיס היא מדידת צפיפות העצם בעמוד השדרה המותני ובירך הקריבנית (״השלד המרכזי״) בשיטת DXA (Dual-energy X-ray Absorptiometry). מדידת DXA בשלד המרכזי היא הבסיס לקביעת הזכאות לטיפול תרופתי ולמעקב במימון ציבורי (במסגרת סל הבריאות) בישראל.
שימוש במדידת DXA לאבחון אוסטיאופורוזיס
על סמך מדידת צפיפות העצם בשיטת DXA והשוואת התוצאה לערך הממוצע של צפיפות העצם בגיל צעיר (מסת העצם המרבית - Peak bone mass), הגדיר ארגון הבריאות העולמי (WHO - World Health Organization) את המצבים הבאים:
- מצב תקין: צפיפות עצם בתחום השווה לסטיית תקן אחת מתחת לממוצע בגיל צעיר או יותר (T- score שווה ל-(1-) או יותר)
- אוסטיאופניה: צפיפות עצם בתחום שבין סטיית תקן אחת לבין 2.5 מתחת לממוצע בגיל צעיר (T- score בין (1-) ל-(2.5-))
- אוסטיאופורוזיס: צפיפות עצם בתחום השווה ל-2.5 סטיות תקן מתחת לממוצע בגיל צעיר או פחות (T- score שווה ל-(2.5-) או פחות)
הערות
- זיהוי שבר אוסטיאופורוטי אופייני (לאחר חבלה קלה או ללא חבלה ידועה) מספיק כדי לאבחן אוסטיאופורוזיס ללא תלות בתוצאות בדיקת צפיפות העצם, לאחר שלילת סיבות משניות אחרות לשבר (כגון גרורות)
- הנתונים התקניים בכל מכשירי ה-DXA בארץ, אשר מהם נגזרים ערכי הצפיפות המגדירים אוסטיאופניה ואוסטיאופורוזיס, מבוססים על אוכלוסייה צפון-אמריקאית לבנה (Caucasian). יש מקום לבדוק את התאמתם לקבוצות האוכלוסייה השונות בישראל על ידי קביעת בסיס נתונים מקומי
- קביעת אבחנה של אוסטיאופורוזיס תיעשה על פי תוצאות המדידה בעמוד השדרה (L4-L1 או שתי חוליות לפחות), בצוואר הירך (Neck) או בירך הקריבנית (Total). הערך הקובע לאבחון הוא הערך הנמוך מבין שלושתם
- שינויים ניווניים בעמוד השדרה, ששכיחותם עולה עם הגיל, עקמת וכן שברי דחיסה, גורמים להטיה כלפי מעלה בבדיקת צפיפות העצם בחוליות. במקרים אלה עדיף להסתמך על מדידת צפיפות העצם בירך
- מדידת צפיפות העצם ברדיוס הרחיקני (שליש דיסטלי של הרדיוס בלבד) מומלצת במצבים הבאים: חוסר אפשרות לבצע מדידה אמינה של עמוד השדרה ו/ או של הירך, היפרפאראתירואידיזם, משקל יתר של החולה (יותר ממגבלת המשקל של מכשיר המדידה)
- אפשר להשוות את תוצאת בדיקת צפיפות העצם לערך הממוצע באותו גיל, תוך שימוש בסטיות תקן (Z-score). ערך השווה ל-2 סטיות תקן מתחת לממוצע באותו גיל או נמוך יותר (Z-score שווה ל- (2-) או נמוך יותר), מעיד על דלדול עצם מעבר לצפוי בגיל ומצריך בירור לצורך שלילת אוסטיאופורוזיס משנית
התוויות למדידה ראשונה של צפיפות העצם של נשים לאחר מנופאוזה ושל גברים מבוגרים
הגישה המקובלת היא להפנות גברים ונשים למדידת צפיפות עצם על פי שיקול קליני:
גיל מתקדם - מקובל לשלוח לבדיקה כל אישה מגיל 65 וכל גבר מגיל 70.
כמו כן, מקובל לשלוח לבדיקה נשים לפני גיל 65 וגברים לפני גיל 70 שנמצאו אצלם גורמי סיכון אחרים לשברים, כמפורט להלן:
- שבר בגיל מבוגר שלא כתוצאה מטראומה משמעותית
- עדות בצילום רנטגן לשבר או להנמכת גוף חוליה, או ממצא המצביע על דלדול עצם (דמינרליזציה, ירידה במספר קוריות העצם או קליפת עצם דקה)
- שבר אוסטיאופורוטי אצל בן משפחה מדרגת קרבה ראשונה
- מנופאוזה לפני גיל 45
- משקל גוף ירוד (BMI פחות מ-19)
- צריכת סידן מועטה לאורך כל החיים (הימנעות מצריכת מוצרי חלב)
- מחלות או טיפולים כרוניים שונים המלווים בצפיפות עצם נמוכה (ראה נספח), כולל אל-וסת משנית ממושכת (מעל שנה) בקרב נשים בגיל הפוריות. * בעת שימוש ממושך בגלוקוקורטיקואידים סיסטמיים, או סמוך לתחילת טיפול כזה, אם הוא צפוי להימשך יותר מ-3 חודשים
מדידת צפיפות העצם נכללת בסל הבריאות בישראל לנשים ולגברים מעל גיל 60 ובמצבים אחרים כמפורט בטבלה בנספח.
התוויות למדידה חוזרת של צפיפות העצם
מדידה חוזרת עשויה לעזור לקבל החלטה בדבר הצורך בהתחלת טיפול תרופתי במקרים שאינם מטופלים, ועשויה לסייע במעקב אחר טיפול תרופתי.
השוואה אופטימלית בין בדיקות עוקבות אפשרית רק אם הבדיקות התבצעו במכשיר דומה, ועדיף אף באותו מכשיר ממש. השוואת בדיקות שבוצעו במכשירים או במכונים שונים יכולה להועיל רק לאחר - Cross calibration בין המכשירים, אך הליך זה אינו מבוצע באופן שגרתי.
תדירות הבדיקות החוזרות תלויה בקצב השינוי הצפוי בצפיפות העצם ביחס להדירות (Reproducibility) של המדידה. ההדירות תלויה בשיטת הבדיקה, באזור שנבדק ובמבצע הבדיקה (טכנאי המדידה), ומבוטאת כ-(CV%) Coefficient of variation. על כל מפעיל של מכשור לבדיקת צפיפות העצם מוטלת האחריות לקבוע את ה-CV של המכשיר עבור כל אחד מאזורי המדידה בשלד. לדוגמה, אם ה-CV הוא 1.5 אחוזים, אזי השינוי המזערי שניתן לזהות במדידות עוקבות הוא כ-4 אחוזים. בתנאים אופטימליים, כאשר הצפיפות הבסיסית תקינה, השינוי המזערי שמקובל לראות כבעל משמעות קלינית (ודאות של 95 אחוזים שהשינוי אכן אמיתי) הוא 3–5 אחוזים. אצל חולי אוסטיאופורוזיס השינוי המזערי המשמעותי גבוה יותר, ועל כן אין להתייחס לשינויים הקטנים מ-5–6 אחוזים.
התדירות המקובלת למדידת צפיפות עצם היא אחת לשנתיים עד חמש שנים. במקרים שבהם צפויה ירידה מהירה בצפיפות העצם, אפשר לחזור על המדידה לאחר תקופה קצרה יותר.
הערכה קלינית של חולי אוסטיאופורוזיס
האנמנזה, הבדיקה הגופנית ובדיקות המעבדה אינן רגישות דיין לאבחון אוסטיאופורוזיס, אך הן מסייעות בבחינת הסיבות לאוסטיאופורוזיס והגורמים העלולים להוביל להחמרת המחלה, בהערכת הסיכון לנפילות ובבחירת הטיפול המתאים.
אנמנזה ובדיקה גופנית יכולות לספק מידע בכמה היבטים:
- גורמי סיכון לדלדול העצם - סיפור משפחתי של אוסטיאופורוזיס, שברים בעבר, התנהגויות המשפיעות על בריאות העצם (כגון הרכב התזונה, רמת הפעילות הגופנית, מידת החשיפה לשמש, עישון וכדומה) וכן מחלות או נטילת תרופות העלולות להזיק לעצם
- מצבים רפואיים המהווים התוויית נגד לטיפולים מסוימים, כגון יתר-קרישיות או מחלות במערכת העיכול
- סיכון לנפילות - נפילות בעבר, הערכת התפקוד בחיי היום-יום, הערכת בריאות כללית ושימוש בתרופות לשינה והרגעה ובתרופות הגורמות לצניחת לחץ דם אורתוסטטית
- בדיקות מעבדה - בדיקות אלה נחוצות להערכה בסיסית ולגילוי אוסטיאופורוזיס משנית למחלות אחרות. בדיקות דם בסיסיות אצל חולי אוסטיאופורוזיס תכלולנה תפקודי כליה, רמת סידן, זרחן, אלבומין, פוספטזה בסיסית, ספירת דם, TSH ו- 25-hydroxyvitamin D
אצל חולי אוסטיאופורוזיס הסובלים משברים, או כאשר צפיפות העצם נמוכה בלפחות שתי סטיות תקן מהערך הממוצע הצפוי לפי הגיל (2->Z score), מומלץ לשקול הרחבה של הבירור ולערוך בדיקות נוספות, וביניהן PTH, טסטוסטרון (לגברים), אלקטרופורזה של חלבוני הנסיוב והשתן, נוגדנים לכרסת והפרשת סידן וקריאטינין בשתן ביממה.
סמנים ביוכימיים של משק העצם
סמנים אלו מאפשרים להעריך באופן לא פולשני את קצב תהליכי בניית העצם ופירוקה. הסמנים הנחשבים למשקפים את שחלוף העצם בצורה המיטבית הם CTX 1-P1NP בסרום. אפשר להשתמש במדידת הסמנים לצורך הערכת הסיכון לשבר והחלטה על צורך בטיפול, למעקב אחר חולים המטופלים בתכשירים נוגדי פירוק עצם לאורך זמן, למעקב אחר טיפול אנאבולי או למעקב לאחר הפסקת הטיפול ככלי להחלטה על חידושו. מדידת הסמנים אינה כלולה עדיין בסל שירותי הבריאות. תדירות הבדיקה תיקבע על פי שיקול דעת קליני.
גורמי סיכון לשברים
שברים אוסטיאופורוטיים הם גורם משמעותי לתחלואה ולתמותה בקרב האוכלוסייה המבוגרת.
עם עליית המודעות והתחלת עידן הטיפולים התרופתיים השונים התבססה הגישה לטיפול בחולה אוסטיאופורוזיס על בדיקת צפיפות העצם (T-scores), המאפשרת הערכה של הסיכון היחסי לשברים. אף על פי שחולי אוסטיאופורוזיס נמצאים בסיכון הגבוה ביותר לשברים, הרי שרוב האוכלוסייה הקשישה נמצאת בתחום האוסטיאופני ומרבית השברים קורים לאנשים שאינם מוגדרים כחולי אוסטיאופורוזיס על פי צפיפות העצם. לאור ההבנה שבדיקת צפיפות העצם אינה רגישה דיה לאיתור אנשים שנמצאים בסיכון לשברים[1][2] פיתח ארגון הבריאות העולמי (WHO) בשנת 2008 כלי להערכת הסיכון לשברים - FRAX (Fracture Risk Assessment): זהו אלגוריתם הכולל מקבץ של גורמי סיכון קליניים וצפיפות עצם בצוואר עצם הירך, לצורך הערכת הסיכון לשברים תוך 10 שנים[3][4][5].
גורמי הסיכון הקליניים הכלולים ב-FRAX הם גיל, מין, משקל גוף, שבר קודם לאחר גיל 40, שבר בצוואר הירך אצל אחד ההורים, עישון, טיפול בגלוקוקורטיקואידים, דלקת מפרקים שגרונית, שתיית אלכוהול, צפיפות העצם בצוואר הירך ומחלות הגורמות לאוסטיאופורוזיס משנית.
- גיל החולה - גיל הוא גורם הסיכון הראשון במעלה כגורם יחיד. בכל צפיפות עצם נתונה, הסיכון לשברים הולך ועולה עם הגיל[3][6]
- מין - כל השברים שכיחים יותר בקרב נשים, אך אינם נדירים בקרב גברים, ושכיחים בעיקר בקרב גברים מבוגרים. אצל שיעור ניכר מהגברים הסובלים מאוסטיאופורוזיס מתחת לגיל 65 אפשר לאבחן מצבים הגורמים לאוסטיאופורוזיס משנית
- שבר קודם - גם שבר אוסטיאופורוטי קודם הוא גורם סיכון רב משקל לשבר נוסף. בעבודות שונות נמצא סיכון מוגבר של לפחות פי 2 לשברים בקרב נשים וגברים שחוו שבר אוסטיאופורוטי קודם[4][7]
- שבר אוסטיאופורוטי אצל קרוב משפחה מדרגה ראשונה - שבר צוואר הירך של אחד ההורים הוא גורם סיכון רב משקל, ונמצא כי הסיכון לשבר בצוואר הירך כפול במקרים אלו באופן בלתי תלוי במצב צפיפות העצם
- משקל גוף נמוך - משקל נמוך נמצא קשור לסיכון מוגבר לאוסטיאופורוזיס ולשברים. בקרב אנשים שערך ה-BMI שלהם הוא 20, הסיכון לשבר בצוואר הירך כפול מזה של אנשים שערך ה-BMI שלהם הוא 25. לעומת זאת, BMI של 30 היה כרוך בהפחתה מתונה בלבד (17 אחוזים) של הסיכון לשברי ירך בהשוואה ל-BMI של 25, נתון המצביע על כך שרזון הוא גורם סיכון משמעותי לשברים, אך אין לראות בהשמנה גורם מגן משמעותי[8]. איבוד משקל אחרי גיל 50 שנה מעלה את הסיכון לשבר בצוואר הירך. ירידה בצפיפות העצם בירך נמצאה אצל אנשים שהפחיתו משקל על ידי הגבלת קלוריות, בזמן שאצל אנשים שהפחיתו משקל זהה על ידי פעילות גופנית ללא הגבלת קלוריות לא נמצא שינוי בצפיפות העצם[9][10][11]
- עישון סיגריות - עישון נמצא קשור לצפיפות עצם מופחתת ולסיכון מוגבר לשברים. עישון בעבר כרוך אף הוא בעלייה בסיכון, אך בעישון מתמשך הסיכון גבוה יותר[12][13]
- טיפול בגלוקוקורטיקואידים - טיפול כרוני בגלוקוקורטיקואידים מגביר את הסיכון לשברים בהתאם למינון המצטבר[14]. גורם סיכון זה תלוי בירידה בצפיפות העצם באופן חלקי בלבד[3]. טיפול הנמשך מעל 3 חודשים במינון המקביל ל-5 מיליגרם פרדניזון ומעלה, נחשב לגורם סיכון. איבוד מסת העצם בקצב המהיר ביותר מתרחש במחצית השנה הראשונה לטיפול בגלוקוקורטיקואידים. לכן יש לבצע הערכה לפני התחלת טיפול ממושך בהם ובמהלך הטיפול (טיפול תרופתי הוכח כיעיל בהפחתת שברים בקרב חולים אלה)
- צריכת אלכוהול - הסיכון לשברים קשור באופן ישיר לכמות האלכוהול הנצרכת. צריכה של יותר משני משקאות אלכוהוליים ביום (כ-28 גרם של אלכוהול טהור) נמצאה קשורה לשבר בצוואר הירך[15][16]
- דלקת מפרקים שגרונית - דלקת מפרקים שגרונית (Rheumatoid arthritis) היא גורם סיכון לשברים, ללא תלות בצפיפות העצם ובשימוש בגלוקוקורטיקואידים[3]
- אוסטיאופורוזיס שניונית - נמצא קשר בין מחלות רבות לבין צפיפות עצם מופחתת וסיכון מוגבר לשברים, וביניהן דלקת מפרקים שגרונית, מחלת מעי דלקתית, מחלת צליאק, סיסטיק פיברוזיס, היפרתירואידיזם, היפרפאראתירואידיזם, סוכרת, אי-ספיקת כליות, היפוגונדיזם בקרב נשים וגברים, מנופאוזה מוקדמת, כריתת שחלות או אשכים, אנורקסיה נרבוזה, טיפולים מעכבי יצירת אסטרוגן הניתנים לחולות סרטן השד וכן טיפולים מעכבי יצירת טסטסטרון הניתנים לחולי סרטן הערמונית. הסיבה לירידה בצפיפות במקרים אלו יכולה להיות דלקת, תת-ספיגה, הפרשת יתר של סידן בשתן או נטילת תרופות
- נפילות חוזרות - רוב השברים האוסטיאופורוטיים מתרחשים בעקבות נפילה. הנטייה ליפול עולה עם הגיל. ניתן לזהות גורמי סיכון רפואיים וסביבתיים לנפילות בגיל מתקדם. בין הגורמים הרפואיים אפשר למנות הפרעות לוקומוטוריות, הפרעות יציבה, ראייה לקויה, השפעות של תרופות (ישנוניות, צניחת לחץ דם אורתוסטטית) חוסר בוויטמין D ותשישות. בין הגורמים הסביבתיים ניתן לציין מכשולים, משטחים חלקים, שימוש במכשירי עזר להתניידות ותאורה לקויה
לסיכום
בעת הערכת הסיכון לשברים יש לקחת בחשבון את כלל גורמי הסיכון של המטופל ולא להסתפק בבדיקת צפיפות העצם בלבד. לצורך כך יש ללמוד את ההיסטוריה האישית והמשפחתית של החולה ובעיקר לשים לב לשברים, להרגלי החיים, למחלות ולתרופות שהמטופל נוטל. יש להעריך גם את הסיכון לנפילות ולהעריך את משק הסידן וויטמין D. ניתן להשתמש באלגוריתם ה-FRAX ככלי עזר, תוך הבנה שהנתונים לא נאספו באוכלוסייה הישראלית.
מניעה
יש להבחין בין מניעת אוסטיאופורוזיס לבין מניעת שברים הכוללת גם נקיטת אמצעים לצמצום שיעור הנפילות ולמזעור החבלה הנגרמת בנפילה, בעיקר לאגן ולירך הקריבנית.
במובן הרחב יותר, מניעת אוסטיאופורוזיס בגיל מבוגר כוללת גם שיפור של מסת העצם המרבית ושימורה, ולכן ניתן להחיל את ההמלצות, לפחות את חלקן, על ילדים, על מתבגרים ועל מבוגרים צעירים.
בטיפול המונע יש להתמקד בגורמי הסיכון הקשורים לאורח החיים וניתנים לשינוי, ובזיהוי מוקדם של מצבים רפואיים או של תרופות שעלולים להחיש את קצב דלדול העצם.
מרכיבי אורח החיים
פעילות גופנית
פעילות גופנית, ובפרט זו הכרוכה בהעמסה (Weight bearing exercise), מסייעת לבניית מסת העצם בתקופת הילדות וההתבגרות, וייתכן שהיא מעכבת את דלדול העצם בגיל המבוגר. נוסף לכך, כל פעילות גופנית משפרת את הניידות ואת תגובת שיווי המשקל, ועשויה לסייע בצמצום שיעור הנפילות.
עישון וצריכת אלכוהול
מומלץ להימנע מעישון ומצריכה מופרזת של אלכוהול בשל השפעתם המזיקה על השלד ועל מערכות אחרות של הגוף.
תזונה
מומלץ להקפיד על תזונה מאוזנת ולהימנע מדיאטות קיצוניות, כולל כאלו המובילות למשקל גוף נמוך במיוחד. כמו כן יש המלצות ספציפיות בדבר צריכת סידן וויטמין D.
- סידן - כמות הסידן היומית המומלצת, בהתאם לגיל, מפורטת בטבלה הבאה. עדיף להשיג את הצריכה המומלצת של סידן במזון. במידת הצורך ניתן להיעזר בתכשירי סידן במינון הולם
| גיל (שנים) | כמות הסידן היומית (מיליגרם) |
|---|---|
| 3-1 שנים | 500 |
| 8-4 שנים | 800 |
| 18-9 שנים | 1,300 |
| 19 שנים עד הפסקת מחזור הווסת | 1,000 |
| נשים לאחר הפסקת מחזור הווסת | 1,200 |
| נשים בהיריון ובהנקה ונשים מיניקות | 1,300-1,000 |
שימוש במלחי סידן
סידן הוא המינרל העיקרי בעצם. בתור שכזה, צריכה מופחתת שלו גורמת למחלות עצם מטבוליות שונות במהלך החיים.
ספיגת הסידן מתבצעת במעי, ושיעורה הממוצע בקרב מבוגרים צעירים עומד על כ-35 אחוזים. יעילות הספיגה פוחתת עם הגיל. ירידה בחומציות הקיבה ודיאטה עתירת סיבים ודלה בשומן מפחיתות את ספיגת הסידן. הצריכה המומלצת של סידן לנשים ולגברים מגיל 50 היא כ-1,000 מיליגרם ביום, אך אוכלוסיית היעד בעולם המערבי צורכת רק כמחצית מכמות זו וזקוקה במקרים רבים להשלמה באמצעות תוספים.
שני מלחי הסידן העיקריים הנמצאים בשימוש קליני הם קלציום קרבונאט וקלציום ציטראט: 40 אחוזים ממשקל תכשירי הקלציום קרבונאט ו-21 אחוזים ממשקל תכשירי הקלציום ציטראט הוא סידן. רוב תכשירי הקלציום קרבונאט מכילים 500–600 מיליגרם סידן ואילו תכשירי הקלציום ציטראט מכילים 250–300 מיליגרם סידן אלמנטרי. הספיגה המיטבית היא במינון של עד 500–600 מיליגרם סידן בכל נטילה.
קלציום קרבונאט נספג באופן מיטבי עם מזון. עקב תכולת הסידן הגבוהה בתכשיר, אפשר ליטול מספר קטן של טבליות וכך להגביר את יעילות הטיפול.
לעומת זאת, ספיגת קלציום ציטראט אינה תלויה בחומציות הקיבה, לכן תכשיר זה מומלץ למטופלים הסובלים מירידה בחומציות הקיבה, בין אם עקב מחלה ובין אם כתוצאה מטיפול תרופתי. נוסף על כך, תכשיר זה מומלץ למטופלים שאורח חייהם אינו מאפשר להם הצמדת טיפול בסידן לארוחות במהלך היום. תכשירי קלציום לקטאט וגלוקונאט מכילים כמויות קטנות יחסית של סידן (13 אחוזים ו-9 אחוזים, בהתאמה), עובדה המקשה על שימוש קליני שגרתי בהם.
במחקרים שהתפרסמו עלו חששות לגבי הקשר בין צריכת תוספי סידן במינון גבוה לבין סיכון מוגבר לאירועים קרדיווסקולאריים. מינון נמוך של מלחי סידן נחשב בטוח, ורק במקרים מיוחדים (הפרעות ספיגה, שימוש בגלוקוקורטיקואידים) יש צורך במינונים גבוהים. עצירות וכאבי בטן הן תופעות לוואי שכיחות בעת טיפול בתוספי סידן. יש להיזהר משימוש בתוספים אלו אם ידוע על אבני כליה או על הפרעות במטבוליזם הסידן.
מלחי סידן סופחים אליהם תירוקסין, ברזל, טטרציקלינים, קוינולונים וביספוספונאטים. עקב כך, יש להפריד בין נטילתן של תרופות אלו לבין נטילת טבליות הסידן. הכלל הוא שתכשירים אלו יינטלו שעתיים לפני צריכת טבליות הסידן או 4 שעות לאחר מכן.
ויטמין D
לוויטמין D יש תפקיד חשוב במשק המינרלים. ויטמין D מייעל את ספיגת הסידן והזרחן במעי ומשפיע על בריאות השלד והשרירים. ויטמין D פעיל ברקמות רבות נוספות.
חוסר בוויטמין D נפוץ באוכלוסייה בכלל, ובמיוחד באוכלוסייה הבוגרת והקשישה, עקב ירידה בייצור האנדוגני בעור ובשל צריכה מועטה של ויטמין D במזון.
רמה נמוכה של ויטמין D מגבירה את הסיכון לנפילות ולשברים. חוסר חמור בוויטמין זה מפריע לשקיעת המינרלים בשלד וגורם לרככת אצל ילדים ולאוסטיאומלציה אצל מבוגרים. חוסר בוויטמין D עלול לגרום לחולשת שרירים ולכאבים בלתי ספציפיים בשלד ובשרירים, ולחקות מחלות כגון פיברומיאלגיה, תסמונת העייפות הכרונית ואוסטיאוארתריטיס. במחקרים אפידמיולוגיים נמצא קשר בין חוסר בוויטמין D לבין תחלואה מגוונת, הכוללת בין היתר מחלות אוטואימוניות, מחלות לב וכלי הדם והפרעות אנדוקריניות. ייתכן שוויטמין D תורם גם לעיכוב התפתחותם של גידולים שונים.
הערכת מצב הספיקה של ויטמין D נעשית על ידי מדידת רמת הנגזרת 25-הידרוקסי ויטמין D. ניתן להיעזר במדידת רמות הסידן, הזרחן, הפוספטאזה הבסיסית והורמון הפראתירואיד (PTH) בדם, ובמדידת הפרשת הסידן לשתן במשך 24 שעות כדי להעריך את ההשפעה הביולוגית של חסר בוויטמין D.
רמה מספקת של ויטמין D חשובה לשמירה על רמות תקינות של סידן ושל זרחן בדם ולמניעת הפרשה עודפת של PTH.
רמות הוויטמין D בדם מסווגות לשלוש דרגות :
- חסר, Deficiency: פחות מ-10 ננוגרם/מיליליטר או 25 ננומול/ליטר
- חסר יחסי, Insufficiency: 29-10 ננוגרם/מיליליטר או 25–74 ננומול/ליטר (שני מצבי החסר נקראים גם Inadequacy)
- רמת תקינה: 30 ננוגרם/מיליליטר (75 ננומול/ליטר) ומעלה. יש הסוברים שרמה של 20 ננוגרם/מיליליטר (50 ננומול/ליטר) יכולה להיחשב לתקינה ומספקת
סיווג זה אינו נגזר מהתפלגות רמות ויטמין D באוכלוסייה. ערך סף תחתון רצוי של 30 ננוגרם/מיליליטר נקבע על פי השפעת ויטמין D על משק המינרלים ועל הסיכון לנפילות. אין די מידע על מנת לקבוע מהן הרמות המיטביות של פעילות ויטמין D במערכות אחרות.
הצריכה היומית המומלצת לנשים ולגברים מגיל 50 ואילך היא 1,000-800 יחידות ליום. זהו מינון בטוח, שאינו מצריך ניטור של רמת ויטמין D. נמצא כי מינון זה יעיל להאטת קצב דלדול רקמת העצם בגיל מבוגר ולהקטנת הסיכון לנפילות ולשברים.
יש לשקול מדידת רמת 25-הידרוקסי ויטמין D במצבים שבהם עולה חשד לחסר משמעותי, למשל אצל קשישים חוסים בבתי אבות, באוכלוסיות שאינן נחשפות במידה מספקת לשמש, אצל חולי אוסטיאופורוזיס ועוד. יש לשאוף להגיע לרמה המומלצת של 20–30 ננוגרם/מיליליטר (50–75 ננומול/ליטר).
יש לתקן את מצב החסר בוויטמין D בעזרת תכשירי ויטמין D3 או D3) ,D2 עדיף על פני D2) ולא באמצעות נגזרות פעילות כגון 1 אלפא D3 או 1,25 דיהידרוקסי ויטמין D. כמו כן יש להיזהר בעת שימוש בתכשירים המשלבים ויטמין A, כיוון שצריכה גבוהה של ויטמין A אינה מומלצת.
העלאה של רמת הוויטמין D מחייבת לעיתים קרובות מינונים גבוהים יותר מהמינון הבסיסי. ניתן לערוך בדיקת ביקורת להערכת מידת התיקון הדרוש ולהתאים את מינון הוויטמין לאחר 2–4 חודשי טיפול. לאחר שהושגה הרמה הרצויה מומלץ להתמיד במינון האחרון ולנטר את רמת הסידן והוויטמין D בדם פעם בשנה.
הקפדה על נטילה סדירה של 1,000-800 יחידות ויטמין D ליום מגיל 50 ואילך מונעת בדרך כלל חסר חמור בוויטמין D ואינה מצריכה בדיקות מעקב כלשהן. ניתן לתת ויטמין D במינון יומי, שבועי או חודשי על פי שיקול דעת קליני.
היבטים אורתופדיים במניעת שברים
- הימנעות מהרמת משאות כבדים
- מגיני ירכיים (Hip pads) הבולמים את עצמת החבטה לירך הקריבנית בעת נפילה
- במצבים מיוחדים - שימוש במחוכים הגורמים ליישור יתר (היפראקסטנציה) של עמוד השדרה ועל ידי כך להעברת העומסים מגוף החוליות לקשת האחורית של החוליות, הנפגעת פחות באוסטיאופורוזיס
צמצום הסיכון לנפילות
- התאמת תנאי הדיור לצרכים (שטיחי גומי למניעת החלקה באמבטיה, ידית אחיזה בשירותים, כיסאות ומיטות בגובה מתאים, תאורה טובה וסילוק מכשולים המפוזרים בבית)
- שימוש באמצעי עזר להליכה
- איתור מוקדם של מטופלים שהליכתם אינה יציבה ושל כאלה הסובלים מליקויי ראייה
- שימוש מושכל בתרופות שעלולות לגרום לצניחת לחץ דם אורתוסטטית
- טיפול להפחתת תדירות נוקטוריה
טיפול באסטרוגן (ET)
טיפול אסטרוגני הוא הטיפול המועדף לתסמינים של גיל המעבר. עבור נשים שלא עברו כריתת רחם יש לשלב טיפול הורמונלי בפרוגסטרון, בהתאם להמלצות הגינקולוגיות המקובלות.
אסטרוגן מעכב את תהליך דלדול העצם לאחר המנופאוזה על ידי צמצום תהליך פירוק העצם (Bone resorption) ומפחית משמעותית את הסיכוי להיארעותם של שברי צוואר הירך ושברי עמוד השדרה. אין הוכחה לכך שטיפול המשלב אסטרוגן עם תכשירים נוספים לטיפול באוסטיאופורוזיס אכן מונע שברים במידה רבה יותר מאשר טיפול בתכשיר אחד בלבד. הפסקת הטיפול ההורמונלי מלווה בתהליך מואץ של דלדול העצם בשנים הראשונות לאחר הפסקת הטיפול.
שכיחות סרטן השד עולה בעקבות טיפול הורמונלי משולב עם פרוגסטרון לתקופה של 5 שנים או יותר. עלייה זו לא נצפתה בעקבות טיפול באסטרוגן בלבד. טיפול באסטרוגן כרוך בסיכון מוגבר לתופעות טרומבואמבוליות ורידיות.
נמצאה השפעה מיטיבה של טיפול באסטרוגן על הסיכון למחלה קרדיווסקולארית רק כאשר הטיפול החל סמוך לגיל המעבר. תחילת טיפול יותר מעשר שנים לאחר המנופאוזה כרוכה בעלייה בסיכון למחלות קרדיווסקולאריות.
לא מומלץ לטפל באסטרוגנים למניעת מחלות כרוניות, כולל אוסטיאופורוזיס, ובכל מקרה, החלטה על טיפול באסטרוגן חליפי צריכה להתקבל באופן פרטני, תוך שקילת היתרונות והחסרונות של הטיפול עבור כל אישה בנפרד.
טיבולון - תכשיר סינתטי סטרואידי בעל פעילות הורמונלית משולבת - אסטרוגנית, פרוגסטגנית ואנדרוגנית. בדומה לאסטרוגן, תכשיר זה מונע דלדול של העצם בקרב נשים לאחר המנופאוזה ומפחית את הסיכון לשברים. השימוש בו כרוך בסיכון מוגבר לאירועים מוחיים. יש דיווחים סותרים לגבי השפעת הטיפול על הסיכון לסרטן השד.
פיטואסטרוגנים - לחומרים אלה פעילות חלשה דמוית-אסטרוגן, אך אין הוכחות ליעילותם בטיפול באוסטיאופורוזיס או במניעת המחלה.
טיפול תרופתי לאוסטיאופורוזיס
טיפול תרופתי מומלץ לכל אישה לאחר המנופאוזה ולכל גבר בגיל 50 ויותר, אשר אובחנו כסובלים מאוסטיאופורוזיס על סמך שבר אופייני או T-score השווה ל-(2.5-) או נמוך יותר, או כאשר יש סיכון מוגבר להופעת שבר אוסטיאופורוטי בשנים הקרובות, על פי הערכה המבוססת על שילוב של גורמי סיכון קליניים ושל צפיפות העצם. התרופות המאושרות לטיפול באוסטיאופורוזיס משתייכות לשלוש קבוצות עיקריות לפי מנגנון הפעולה:
- תרופות המפחיתות פירוק עצם על ידי עיכוב פעילות התאים האוסטיאוקלסטים. בעזרת תרופות אלו אפשר לשמר ואף להעלות, במידה מוגבלת, את צפיפות העצם. במחקרים מבוקרי אינבו, שנמשכו 3–5 שנים נמצא שהטיפול התרופתי מפחית את הסיכון לשברים אוסטיאופורוטים חדשים
- תרופות אנבוליות, הפועלות במנגנון של עידוד בניית העצם ושיקום המבנה המיקרוסטרוקטורלי שלה. הטיפול בהן נועד לחולים הסובלים מאוסטיאופורוזיס קשה
- תרופות שמנגנון פעולתן אינו ברור
כל ההמלצות בפרק על מניעת אוסטיאופורוזיס, אשר התייחסו למרכיבי אורח החיים, תקפות גם עבור נשים וגברים המקבלים טיפול תרופתי לאוסטיאופורוזיס קיימת.
אין הוכחות לכך שטיפול תרופתי משולב מפחית את שיעור השברים יותר מאשר מרכיביו הבודדים. קיים חשש לדיכוי יתר של שחלוף העצם ולהגברת הסיכון להופעת שברים אטיפיים כאשר משלבים שני תכשירים המדכאים פעילות אוסטיאוקלסטית.
לחולים שסבלו משברים בשעה שטופלו בתכשירים נוגדי פירוק מומלץ לעבור לטיפול בתכשיר אנבולי.
תרופות המפחיתות פירוק עצם
ביספוספונאטים
קבוצת חומרים בעלי זיקה לעצם, המסתפחים למינרל העצם ומעכבים את הפעילות האוסטיאוקלסטית. תכשירים אלו מתפנים דרך הכליות, ואי לכך השימוש בהם מוגבל לחולים שנמצא אצלם GFR (Glomerular Filtration Rate) מעל 35 מיליליטר/דקה. אין לתת ביספוספונטים במתן פומי לחולים הסובלים מהפרעות בליעה, מרפלוקס ושטי פעיל ומהפרעה בתנועתיות הוושט.
רשומים בישראל שלושה תכשירים בהתוויה של אוסטיאופורוזיס לנשים ולגברים:
אלנדרונאט (ALENDRONATE)
- טיפול במינון יומי של 10 מיליגרם במשך 3 שנים העלה את צפיפות העצם בעמוד השדרה ובצוואר הירך והפחית בכ-50 אחוזים את הסיכון לשברים בחוליות, בצוואר הירך ובאמה
- יש מידע על המשכיות ההשפעה על צפיפות העצם והפחתת השברים הקליניים בחוליות במשך 10 שנות טיפול
- נטילת טבלייה אחת של 70 מיליגרם פעם בשבוע למשך שנתיים, הובילה לשיפור בצפיפות העצם בשיעור דומה לנטילת 10 מיליגרם מדי יום
- תופעות הלוואי העיקריות קשורות לדרכי העיכול העליונות, והסיכוי לסבול מהן פוחת אם מקפידים על הוראות הנטילה
- קיים תכשיר שבועי המשלב אלנדרונאט 70 מיליגרם עם ויטמין D - 5,600 יחידות (מקביל למינון יומי של 800 יחידות/יום). ספיגת שני רכיבי התכשיר נבדקה במחקרים קליניים ונמצאה יעילה במידה זהה לספיגתו של כל רכיב בנפרד
ריזדרונאט (Risedronate)
- הטיפול במינון יומי של 5 מיליגרם Risedronate במשך 3 שנים העלה את צפיפות העצם בעמוד השדרה ובצוואר הירך והפחית בכ-50 אחוזים את הסיכון לשברים בחוליות
- במחקר שבחן נשים מעל גיל 70 הסובלות מאוסטיאופורוזיס, נמצאה ירידה בשכיחותם של שברי צוואר הירך בשיעור של כ-30 אחוזים
- נטילת טבלייה אחת של 35 מיליגרם פעם בשבוע למשך שנה, הובילה לשיפור בצפיפות העצם בשיעור דומה לזה שבמתן 5 מיליגרם מדי יום
- נטילת טבלייה אחת של 150 מיליגרם אחת לחודש הובילה לשיפור בצפיפות העצם בשיעור דומה לזה שבמתן 5 מיליגרם מדי יום ולשיפור בהיענות לטיפול[17][18]
- תופעות הלוואי העיקריות של התרופה קשורות לדרכי העיכול העליונות והסיכון להן פוחת כאשר מקפידים על הוראות הנטילה
חומצה זולדרונית (ZOLEDRONIC ACID)
- מתן תוך-ורידי של 5 מיליגרם פעם בשנה במשך 3 שנים הוביל לירידה של כ-70 אחוזים בשיעור השברים בחוליות בעמוד השדרה, לירידה של כ-41 אחוזים בשיעור שברי עצם הירך הקריבנית ולירידה של 25 אחוזים בשיעור השברים בגפיים[19]
- מתן תוך-ורידי של 5 מיליגרם פעם בשנה לחולים לאחר שבר בעצם הירך הקריבנית עד 90 יום לאחר התיקון הכירורגי של השבר, הוביל לירידה של 35 אחוזים בהיארעות של שברים סימפטומטיים במעקב ממוצע של 19 חודשים, וכן לירידה של 28 אחוזים בשיעור התמותה. ב-Post Hoc Analysis נמצא שהטיפול מועיל אם הוא מותחל לפחות שבועיים לאחר הניתוח[20]
- תופעות הלוואי השכיחות ביותר בטיפול בתכשיר זה הן חום וכאבי שרירים ושלד, המופיעים אצל 10–15 אחוזים מהמטופלים בשבוע הראשון לאחר מתן העירוי. ניתן להקל על תופעות אלה באמצעות נטילתם של תכשירים אנלגטיים ואנטיפירטיים[21]
משך הטיפול בביספוספונאטים - אין הסכמה לגבי משך הטיפול המרבי המומלץ, ויש הממליצים על הפסקות יזומות בטיפול לאחר 5–10 שנים בהתאם למצבו של המטופל, ועל בחינת חידוש הטיפול לאחר שנה וחצי-שנתיים, בהתאם להערכה מחודשת (שיכולה לכלול הערכה קלינית, מדידת צפיפות עצם ומדידת סמני שחלוף עצם).
במחקר הפרוספקטיבי הממושך ביותר לגבי שימוש בביספוספונאטים הוערך הטיפול באלנדורנאט במשך עד 10 שנים. במחקר זה לא נמצאו פגיעות כלשהן בבריאות העצם בקרב מטופלות במשך 10 שנים. במעבר לאינבו ל-5 שנים לאחר 5 שנות טיפול רציף, נראו בקבוצת האינבו שימור של צפיפות העצם או ירידה איטית בצפיפות, לעומת שימור של צפיפות העצם או עלייה מתמשכת בצפיפות בקבוצה שהמשיכה בטיפול. כמו כן נראתה עלייה משמעותית במדדי שחלוף העצם בקבוצת האינבו, אם כי הערכים נותרו נמוכים מהערכים של תחילת המחקר. לא ניתן להסיק מסקנה חד-משמעית ממחקר זה על התועלת במניעת שברים בטיפול של 10 שנים לעומת 5 שנים, אך נמצאו רמזים לכך שהטיפול הממושך מועיל בהפחתת שיעור השברים הקליניים בחוליות[22][23].
תופעות לוואי נדירות שעשויות להיות קשורות לטיפול בביספוספונאטים:
אוסטיאונקרוזיס של הלסת - תופעה נדירה המופיעה אצל חולים הנוטלים טיפול פומי או תוך-ורידי אחת לשנה, ומתבטאת בעצם חשופה בחלל הפה במשך למעלה מ-6 שבועות. אוסטיאונקרוזיס של הלסת קורית בדרך כלל בעקבות פעולות כירורגיות בחניכיים או ניתוחי סינוסים. התופעה שכיחה יותר בקרב מטופלים בביספוספונאטים במינון מצטבר גבוה בהתוויה אונקולוגית[24].
שברים בלתי טיפוסיים בחלק הדיאפיזלי של עצם הירך (Atypical Subtrochanteric Hip Fractures) - דווח על מקרים מעטים של שברים עם תזוזה בעיקר בחלק הדיאפיזלי של עצם הירך, במהלך טיפול בביספוספונאטים במשך שנתיים לפחות. שימוש מקביל בתרופות נוספות המשפיעות על שחלוף העצם, כגון גלוקוקרטיקואידים ותכשירי אסטרוגן, עלול להגדיל את הסיכון. ריפוי שברים אלו ממושך מאוד ועשוי להשתפר על ידי טיפול ב-Teriparatide[25][26][27]. כאב מתמיד במרכז הירך עשוי להקדים את הופעת השבר ומחייב התייחסות (צילום רנטגן ומיפוי עצם).
מפעילים ברירניים של קולטני האסטרוגן (SERMS - Selective Estrogen Receptor Modulators)
קבוצת חומרים שיש להם השפעה אגוניסטית-אנטגוניסטית על קולטני האסטרוגן ברקמות השונות. בישראל, רלוקסיפן הוא התכשיר היחיד מקבוצה זו המותווה למניעה של אוסטיאופורוזיס ולטיפול בה עבור נשים לאחר המנופאוזה.
הטיפול אינו מתאים לגברים או לנשים לפני המנופאוזה.
רלוקסיפן (Raloxifene)
Raloxifene היא תרופה שיש לה השפעה דמוית אסטרוגן על העצם והשפעה נוגדת אסטרוגן על הרחם והשד.
- טיפול במינון יומי של 60 מיליגרם העלה את צפיפות העצם והפחית ב-30–50 אחוזים את הסיכון לשברים בחוליות. לא הוכחה יעילות בהפחתת שברים חוץ-חולייתיים, כולל בצוואר הירך, ועל כן התכשיר מיועד לנשים שאינן נמצאות בסיכון גבוה לשברים חוץ-חולייתיים בטווח הקרוב
- התרופה הפחיתה ב-70 אחוזים היארעות של סרטן שד ראשוני בקרב נשים לאחר הפסקת המחזור, כולל נשים בסיכון גבוה לסרטן שד, בהשוואה לנשים שקיבלו אינבו, והיא רשומה בישראל להתוויה זו
- תופעות הלוואי העיקריות של התרופה הן גלי חום והתכווצויות בשרירי הגפיים. נוסף לכך נמצא סיכון מוגבר פי 2 לאירועים טרומבואמבוליים-ורידיים, בדומה לטיפול באסטרוגנים
בזדוקסיפן (SERM - (Bazedoxifene שנרשם בישראל. אינו משווק.
דנוסומאב (DENOSUMAB)
נוגדן מונוקלונלי RANKLE, שהוא גורם חיוני להתמיינות ולפעילות של האוסטיאוקלסטים. התכשיר מעכב את פירוק העצם.
- טיפול במינון של 60 מיליגרם בהזרקה תת-עורית כל 6 חודשים במשך 3 שנים לנשים הסובלות מאוסטיאופורוזיס לאחר המנופאוזה, העלה את צפיפות העצם והפחית את הסיכון לשברי חוליות בכ-70 אחוזים, לשברים חוץ-חולייתיים בכ-20 אחוזים ולשברים בצוואר הירך בכ-40 אחוזים[28][29]
- בקבוצה המטופלת נראתה עלייה קלה בשכיחות הזיהומים, ועלייה קלה אך מובהקת בזיהומי עור. דווח על אוסטיאונקרוזיס של הלסת בעת טיפול בדנוסונאב במינון מצטבר גבוה בהתוויה אונקולוגית
- התרופה רשומה לטיפול בנשים לאחר המנופאוזה ובגברים הסובלים מסרטן הערמונית ומקבלים טיפול המדכא את יצירת הורמוני המין
שימוש בתרופה זאת מתאים גם לחולי אי-ספיקת כליות.
קלציטונין
קלציטונין מיוצר בתאי C של בלוטת התריס ויש לו השפעה אנטי-אוסטיאוקלסטית. סונתזו כמה צורות של התכשיר, הנפוצה ביותר היא צורה סינתטית של קלציטונין ממקור דג הסלמון. הטיפול רשום לנשים לאחר גיל המעבר.
קלציטונין-סלמון (SALMON CALCITONIN)
ניתן בהזרקה תת-עורית או כתרסיס לאף.
תרסיס לאף במינון יומי של 200 יחידות בין-לאומיות העלה את צפיפות העצם בעמוד השדרה והפחית ב-36 אחוזים את הסיכון לשברים בחוליות. משמעות התוצאות נתונה לוויכוח. לא הוכחה יעילות התכשיר בהפחתת שברים בגפיים, כולל בצוואר הירך.
תיתכן השפעה של שיכוך כאבים הנגרמים עקב שברים בעצמות, בעיקר בחוליות.
קלציטונין כתרסיס לאף הוא חלופה לטיפול באוסטיאופורוזיס, בעיקר במצבים של אי-ספיקת כליות. תופעות הלוואי העיקריות של התכשיר הן גלי חום, סומק, בחילה ופריחה בעור, והן שכיחות יותר אחרי זריקות. נטילת התרופה בתרסיס לאף עלולה לגרום לריניטיס.
הערה: התפרסמה המלצה של EMA (Europeans Medicines Agency) להפסיק את השימוש בקלציטונין סלמון לטיפול באוסטיאופורוזיס, עקב נתונים המצביעים על סיכון מוגבר לסרטן.
תרופות המעודדות בניית עצם
TERIPARATIDE
מקטע רקומביננטי של חומצות אמינו 1–34 של הורמון הפרתירואיד. התכשיר ניתן בהזרקה יומית תת-עורית במינון של 20 מיקרוגרם למשך תקופה של עד 24 חודשים. טיפול בתרופה זו לנשים לאחר המנופאוזה שסבלו בעבר משברים בחוליות, במשך 21 חודשים בממוצע, הוביל לעלייה בצפיפות העצם בעמוד השדרה ובצוואר הירך, להפחתה של כ-65 אחוזים בסיכון לשברים בחוליות ולהפחתה של כ-53 אחוזים בשברים חוץ-חולייתיים. הטיפול רשום גם לגברים.
תופעות הלוואי העיקריות של התכשיר הן בחילה, תחושת חום, התכווצויות בשרירי הגפיים וכאבי מפרקים, והן חולפות בדרך כלל במשך הטיפול. תופעה נוספת היא היפרקלצמיה מתונה וחולפת. כמו כן עלולה להיות היפרקלציאוריה, שלא נמצא כי היא קשורה לעלייה בשכיחותן של אבנים בדרכי השתן.
התכשיר נבדק ונמצא יעיל גם לגברים[30][31].
אין לתת תרופה זאת לחולים עם היפראפארהתירואידיזם ראשוני או משני, מחלת פאג׳ט (Paget's disease) או ממאירות פעילה, לחולים שעברו הקרנות לשלד ובמקרים שצמיחת השלד טרם הסתיימה.
תרופות שמנגנון פעולתן לא ברור
סטרונציום רנלאט
מבוסס על היסוד סטרונציום המצוי בכמויות מזעריות בתזונה, ויש לו זיקה להידרוקסיאפטיט (מינרל העצם). לתכשיר יש השפעה על הפחתת פירוק העצם ובנייתה, אם כי מנגנון הפעולה שלו עדיין אינו ברור דיו. הטיפול מעלה את צפיפות העצם במידה ניכרת לאורך 10 שנים[1]. עלייה זו נובעת ממשקלו המולקולרי הגבוה של יסוד זה המצטבר בעצם[2] ומהעלייה במסת העצם[3][4].
- הטיפול מקטין את הסיכון לשברים בעמוד השדרה ב-30–40 אחוזים ולשברי גפיים בכ-20 אחוזים. ב-Post Hoc Analysis נראתה ירידה של כ-30–40 אחוזים בהיארעות שברי צוואר הירך בקרב אוכלוסייה בסיכון גבוה. התרופה נבדקה בקרב נשים לאחר המנופאוזה בטווח גילים רחב (כולל נשים מעל גיל 80)[5], בדרגות חומרה שונות של המחלה ובמקרים של גורמי סיכון שונים לשברים[6]
- הטיפול ניתן במינון יומי של 2 גרם, באבקה המומסת במים, במתן פומי
- תופעות הלוואי האפשריות הן בחילות ושלשולים, אך הללו חולפים כמה שבועות לאחר תחילת הטיפול. ייתכנו תפרחות בעור המחייבות הפסקה מיידית של הטיפול, לאור דיווחים על מקרים נדירים של Drug-Reaction With Eosinophilia and Systemic Symptoms) DRESS). תיתכן עלייה בסיכון לאירועים טרומבואמבוליים, ולכן ה-EMA המליצה להימנע מטיפול זה לחולים מעל גיל 80[32][33]. אין לתת תרופה זאת לחולים הסובלים מאי-ספיקת כליות
תרופות אחרות
בישראל רשומות כמה תרופות נוספות בהתוויה של טיפול באוסטיאופורוזיס שהשימוש בהן אינו מקובל. תרופות אלו (פלואוריד, סטרואידים אנבוליים, ואלפא קאלצידול (1a-(OH)vitamin D3) נרשמו בשל השפעתן החיובית על מסת העצם, בתקופה שבה לא נדרשה עדיין הוכחה ברורה ליעילותן בהפחתת שברים כתנאי לקבלת ההתוויה לטיפול באוסטיאופורוזיס.
היבטים אורתופדיים / שיקומיים
לאחר שבר בחוליה:
- מומלץ לעודד ניידות ותרגילים לחיזוק שרירי הגוף, תוך מתן משככי כאבים לפי הצורך
- יש להתאים מחוך קשיח המסייע להפחתת כאבי גב
- ורטברופלסטיה, על ידי הזרקת מלט סינתטי לגוף החוליה שקרסה, תורמת לייצוב החוליה השבורה ולהפחתת הכאב. אין עדיין נתונים על יעילותו ועל סיכוניו של טיפול זה לאורך זמן
- טיפול כירורגי עקב חסרים נאורולוגיים, סיבוך נדיר של שברים בחוליות, בעיקר המותניות
לאחר שבר בירך הקריבנית
- ניתוח הוא הטיפול הנבחר בכ-90 אחוזים מהמקרים. דחיית הניתוח בכמה ימים לאחר השבר עלולה להקטין את הסיכוי לשיקום מוצלח ולהעלות את הסיכון לתחלואה ולתמותה
- מומלץ טיפול לשיקום, כולל תרגילים לחיזוק השרירים ותרגילי עמידה והליכה, תוך שימוש באמצעי עזר (הליכון, קביים או מקל)
אוסטיאופורוזיס כתוצאה מטיפול בגלוקוקורטיקואידים[34]
השימוש בגלוקוקורטיקואידים (ג"ק) הוא הסיבה השכיחה ביותר לאוסטיאופורוזיס משנית. טיפול ממושך (יותר מ-3 חודשים במינון יומי שווה ערך ל-5 מיליגרם פרדניזון לפחות) עלול לגרום לירידה במסת העצם, לשינוי מיקרוסטרוקטורלי ולעלייה ניכרת בשכיחות השברים. הטיפול בג"ק מגדיל את הסיכון להופעת שברים בכל אזורי השלד, אך במיוחד באזורים העשירים בעצם ספוגית, כגון חוליות עמוד השדרה והצלעות. אצל כמחצית מהמטופלים תתפתח אוסטיאופורוזיס כתוצאה מטיפול ממושך. קיימת שונות גבוהה בין המטופלים בתגובת העצם לג"ק ואין קשר לתופעות הלוואי האחרות של הסטרואידים.
הגורמים המגבירים סיכון לשברים אוסטיאופורוטיים במהלך טיפול ב"ק הם גיל מתקדם, מנופאוזה, צפיפות עצם נמוכה, מינון הג"ק ומשך הטיפול.
איבוד עצם מהיר מתחיל עם תחילת הטיפול בג"ק, ונמשך כ-6 עד 12 חודשים. לאחר מכן מתרחשת ירידה מתונה יותר. קצב הירידה בצפיפות העצם בחוליות עמוד השדרה נע בין 5 אחוזים ל-10 אחוזים בשנה הראשונה לטיפול.
גישה למטופל בג"ק
יש להעריך את הסיכון להופעת שברים אצל חולה המטופל בג׳׳ק או המתעתד להתחיל טיפול.
מומלץ לבצע בדיקת צפיפות עצם, DXA, בעמוד השדרה ובצוואר הירך מיד עם תחילת הטיפול לחולים הצפויים להתמיד בטיפול במשך יותר מ-3 חודשים.
אם צפיפות העצם תקינה בתחילת הטיפול יש להתחיל טיפול מונע בתוספי סידן וויטמין D, ולחזור על בדיקת DXA כעבור שנה, תוך הקפדה על ביצוע בדיקת השוואה איכותית מבחינה טכנית.
אצל חולים המקבלים טיפול בביספוספונאטים, לא צפויה תועלת רבה מביצוע מעקב תכוף אחרי צפיפות העצם, כיוון שבמרבית המקרים השינוי המצופה קרוב מאוד לשגיאת המדידה של המכשיר.
טיפול
ניתן לסווג את החולים המתחילים בנטילת מינון גבוה של ג׳ק לשתי קבוצות עיקריות:
- חולים שצפיפות העצם שלהם תקינה, עדיין לא נראה אצלם איבוד עצם משמעותי והסיכון שלהם לסבול משברים נמוך. לחולים אלו דרושה מניעה ראשונית
- חולים הנמצאים בסיכון גבוה להופעת שברים עקב צפיפות עצם ירודה, שברים אוסטיאופורוטיים בעבר או גורמי סיכון נוספים. חולים אלה זקוקים לטיפול תרופתי יעיל למניעת שברים
שברים בחוליות עלולים להתרחש גם במקרים שבהם רמות צפיפות העצם גבוהות מאלו הנראות במקרים של אוסטיאופורוזיס לאחר המנופאוזה. לפיכך יש לשקול מתן טיפול לחולים שערכי שלהם נמצאים בתחום האוסטיאופניה.
מניעה ראשונית
- מומלץ להשתמש במינון ג"ק נמוך ככל האפשר כטיפול אחזקה. טיפול במינון גבוה של ג"ק למשך זמן קצר עדיף על פני טיפול כרוני או ממושך במינון נמוך. גם מנת אחזקה קטנה עלולה לגרום לאיבוד עצם
- יש לעודד אורח חיים בריא ולהמליץ על הפסקת עישון, על הגבלת צריכת האלכוהול ועל תזונה מאוזנת הכוללת מזונות עתירי סידן
- יש לעודד הקפדה על פעילות גופנית סדירה, תוך התחשבות במגבלות התפקודיות. מטרת הטיפול היא מניעת איבוד מסת שריר ומניעת נפילות
- יש להפחית את הסיכון לנפילות (ראה בנפרד)
- יש להבטיח צריכת סידן כוללת של כ-1,200 מיליגרם ליממה לפחות (מתזונה או מתזונה ותוספים)
- יש לתת תוסף ויטמין D בכמות שתבטיח הגעה לרמת יעד של 25(D(OH מעל 30 ננוגרם/מיליליטר או מעל 75 ננומול/ליטר. מינון האחזקה המומלץ הוא 1,000-800 יחידות. במצבי חסר יש להעלות את המינון בהתאם, עד השגת ערך בתחום הרצוי
טיפול תרופתי
ביספוספונאטים - טיפול בתכשירים מקבוצה זו הוכח במחקרים קליניים שנמשכו עד שנתיים כיעיל בהפחתת הסיכון לשברי חוליות בקרב מטופלי ג"ק. אין ניסיון בטיפול ממושך יותר בתרופות אלו. התכשירים שנבדקו מקבוצה זו ונמצאו יעילים הם אלנדרונאט וריזדרונאט בטיפול פומי וזולדרונאט תוך- ורידי.
טריפרטייד - טיפול בטריפרטייד למשך 3 שנים נמצא יעיל יותר באופן מובהק מטיפול בביספוספונאט למניעת שברי חוליות בקרב מטופלים בג"ק. לפיכך, יש לשקול טיפול בטריפרטייד עבור חולים המתחילים טיפול בג"ק ונמצאים בסיכון גבוה לשברים.
נספח מספר 1 - סיבות לאוסטיאופורוזיס שניונית
Genetic
- Ethnicity (Caucasian>African)
- Positive family history
- Small body frame
- Occult osteogenesis imperfecta
Lifestyle
- Smoking
- Inactivity, immobility
- Excessive exercise (producing amenorrhea)
Nutritional factors
- Milk intolerance
- Lifelong low dietary calcium intake
- Excessive Alcohol intake
Endocrine dysfunction
- Thyrotoxicosis
- Hyperparathyroidism
- Cushing's syndrome
- Diabetes, type 1
- Hyperprolactinemia
- Anorexia nervosa
Alterations in gastrointestinal and hepatobiliary function
- Prolonged parenteral nutrition
- Lactase deficiency
- Celiac disease
- Biliary cirrhosis
- Pancreatic insufficiency
- Crohn's disease
- Malabsorption due to gastrointestinal surgery
Hematologic disorders Mastocytosis
Renal disorders
- Tubular calcium leak
- Renal osteodystrophy (adynamic bone disease)
Drugs
- Excessive dose of thyroid hormone
- Glucocorticoid drugs
- Heparin
- Chronic lithium therapy
- Chemotherapy
- Gonadotropin-releasing hormone agonist or antagonist therapy
- Anticonvulsants
- Chronic phosphate-binding antacid use
- Loop diuretics
- Cyclosporine A
- Proton pump inhibitors
- Selective serotonin reuptake inhibitors
ביבליוגרפיה
- Kanis JA, Johnell O, De Laet C, Johansson H, Oden A, Delmas P, Eisman J, Fujiwara S, Garnero P, Kroger H, McCloskey EV, Mellstrom D, Melton LJ, Pols H, Reeve J, Silman A, Tenenhouse A. A meta-analysis of previous fracture and subsequent fracture risk. Bone 2004;35:375.
- Center JR, Bliuc D, Nguyen TV, Eisman JA. Risk of subsequent fracture after low-trauma fracture in men and women. JAMA 2007;297:387.
- ↑ 1.0 1.1 Wainwright SA, Marshall LM, Ensrud KE, Cauley JA, Black DM, Hillier TA, Hochberg MC, Vogt MT, Orwoll ES. Study of Osteoporotic Fractures Research Group. Hip fracture in women without osteoporosis. J Clin Endocrinol Metab 2005;90:2787.
- ↑ 2.0 2.1 Miller PD, Barlas S, Brenneman SK, Abott TA, Chen YT, Barrett-Conor E, Siris ES. An approach to indentifying osteopenic women at increase short-term risk of fracture. Arch Intern Med 2004;164:1113.
- ↑ 3.0 3.1 3.2 3.3 3.4 Kanis JA, Johansson H, Oden A, McCloskey EV. Assessment of fracture risk. Eur J Radiol 2009;71(3):392-397.
- ↑ 4.0 4.1 4.2 Dawson-Hughes B, Looker AC, Tosteson AN, Johansson H, Kanis JA, Melton LJ. The potential impact of new National Osteoporosis Foundation guidance on treatment patterns. Osteoporosis Int. 2009 Aug 25.
- ↑ 5.0 5.1 Kanis J. (2008) Assessment of osteoporosis at the primary health-care level. WHO Collaborating Center, University of Sheffield, Sheffield, UK In Group WHOS.
- ↑ 6.0 6.1 Kanis JA, Johnell O, Oden A, Dawson A, De Laet C, Jonsson B. Ten year probabilities of osteoporotic fractures according to BMD and diagnostic thresholds. Osteoporos Int 2001;12:989.
- ↑ Cumming SR, Nevitt MC, Browner WS, Stone K, Fox KM, Ensrud KE, Cauley J, Black D, Vogt TM. Risk factors for hip fracture in white women. N Eng L Med 1995;332:767.
- ↑ De Laet C, Kanis JA, Oden A, Johansson H, Johnell O, Delmas P, Eisman JA, Kroger H, Fujiwara S, Garnero, P. Body mass index as a predictor of fracture risk: a meta-analysis. Osteoporosis Int 2005;16:1330-1338.
- ↑ Ensrud KE, Cauley J, Lipschutz R, Cummings SR. Weight change and fracture in older women. Arch Intern Med 1997;157:857.
- ↑ Langlois JA, Visser M, Davidovic LS, Maggi S, Li G, Harris TB. Hip fracture risk in older white men is associated with change in body weight from age 50 years to old age. Arch Intern Med 1998;158:990.
- ↑ Villareal DT, Fontana L, Weiss EP, Racette SB, Steger-May K, Schectman KB, Klein S, Holloszy JO. Bone mineral density response to caloric restriction-induced weight loss or exercise-induced weight loss: a randomized controlled trial. Arch Intern Med 2006;166:2502.
- ↑ Ward KD, Klesges RC. A meta-analysis of the effects of cigarette smoking on bone mineral density. Calcif Tissue Int 2001;68:259.
- ↑ Kanis JA, Johnell O, Oden A, Johansson H, De Laet C, Eisman JA, Fujiwara S, Kroger H, McCloskey EV, Mellstrom D. Smoking and fracture risk: a meta-analysis. Osteoporos Int 2005;16:155.
- ↑ Van Staa TP, Leufkens HGM, Abenhaim L, Zhang B, Cooper C. Use of oral corticosteroids and risk of fractures. J Bone Miner Res 2000;15:993.
- ↑ Kanis JA, Johansson H, Johnell O, Oden A, De Laet C, Eisman JA, Pols H, Tenenhouse A. Alcohol intake as a risk facture for fracture. Osteoporos Int 2005;16:737.
- ↑ Berg KM, Kunins HV, Jackson JL, Nahvi S, Chaudhry A, Harris KA, Malik R, Arnsten JH. Association between Alcohol consumption and both osteoporotic fracture and bone density. Am J Med 2008;121:406
- ↑ Delmas PD, Benhamou CL, Man Z, Tlustochowicz W, Matzkin E, Eusebio R, Zanchetta J, Olszynski WP, Recker RR, McClung MR. Monthly dosing of 75 mg risedronate on 2 consecutive days a month: efficacy and safety results Osteoporos Int. 2008 Jul;19(7):1039-45.
- ↑ Ste-Marie LG, Brown JP, Beary JF, Matzkin E, Darbie LM, Burgio DE, Racewicz AJ. Comparison of the effects of once-monthly versus once-daily risedronate in postmenopausal osteoporosis: a phase II, 6-month, multicenter, randomized, double-blind, active-controlled, dose-ranging study. Clin Ther. 2009 Feb;31(2):272-85
- ↑ Black DM, Delmas PD, Eastell R, Reid IR, Boonen S, Cauley JA, Cosman F, Lakatos P, Leung PC, Man Z, Mautalen C, Mesenbrink P, Hu H, Caminis J, Tong K, Rosario-Jansen T, Krasnow J, Hue TF, Sellmeyer D, Eriksen EF, Cummings, S. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. HORIZON Pivotal Fracture Trial. N Engl J Med. 2007 May 3;356(18):1809-22.
- ↑ Eriksen EF, Lyles KW, Colon-Emeric CS, Pieper CF, Magaziner JS, Adachi JD, Hyldstrup L, Recknor C, Nordsletten L, Lavecchia C, Hu H, Boonen S, Mesenbrink P. Antifracture efficacy and reduction of mortality in relation to timing of the first dose of zoledronic acid after hip fracture. J Bone Miner Res. 2009 Jul;24(7):1308-13.
- ↑ Lyles KW, Colon-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C ,Hyldstrup L, Recknor C, Nordsletten L, Moore KA, Lavecchia C, Zhang J, Mesenbrink P, Hodgson PK, Abrams K, Orloff JJ, Horowitz Z, Eriksen EF, Boonen S. Zoledronic Acid in Reducing Clinical Fracture and Mortality after Hip Fracture. for the HORIZON Recurrent Fracture Trial. N Engl J Med. 2007;357.
- ↑ Bone HG, Hosking D, Devogelaer JP, Tucci JR, Emkey RD, Tonino RP, Rodriguez-Portales JA, Downs RW, Gupta J, Santora AC, Liberman UA. Ten years' experience with Alendronate for osteoporosis in postmenopausal women. Alendronate Phase III Osteoporosis Treatment Study Group. N Engl J Med. 2004 Mar 18;350(12):1 189-99.
- ↑ Black DM, Schwartz AV, Ensrud KE, Cauley JA, Levis S, Quandt SA, Satterfield S Wallace RB, Bauer DC, Palermo L, Wehren LE, Lombardi A, Santora AC, Cummings SR. Effects of continuing or stopping Alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension [FLEX): a randomized trial.FLEX Research Group JAMA. 2006 Dec 27;296(24):2927-38..
- ↑ Khosla S, Burr D, Cauley J, Dempster DW, Ebeling PR, Felsenberg D, Gagel RF, Gilsanz V, Guise T, Koka S, McCauley LK, McGowan J, McKee MD, Mohla S, Pendrys DG, Raisz LG, Ruggiero SL, Shafer DM, Shum L, Silverman SL, Van Poznak CH, Watts N, Woo SB, Shane E. American Society for Bone and Mineral Research. Bisphosphonate-associated osteonecrosis of the jaw: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2007 Oct;22(10):1479-91.
- ↑ Odvina CV, Levy S, Rao S, Zerwekh JE, Sudhaker Rao D. Unusual mid-shaft fractures during long term bisphosphonate therapy. Clin Endocrinol [Oxf). 2009 Mar 19 .
- ↑ Schilcher J, Aspenberg P. Incidence of stress fractures of the femoral shaft in women treated with bisphosphonate. Acta Orthop. 2009 Jan 1:1-3.
- ↑ Craig M, Capeci and Nirmal C Tejwani. Bilateral Low-Energy Simultaneous or Sequential Femoral Fractures in Patients on Long-Term Alendronate Therapy. J. Bone Joint Surg. Am. 2009 Nov 1; 91(11) : 2556-2561.
- ↑ Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, Delmas P, Zoog HB, Austin M, Wang A, Kutilek S, Adami S, Zanchetta J, Libanati C, Siddhanti S, Christiansen C. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. FREEDOM Trial. N Engl J Med. 2009 Aug 20;361(8):756-65.
- ↑ Smith MR, Egerdie B, Hernandez Toriz N, Feldman R, Tammela TL, Saad F, Heracek J, Szwedowski M, Ke C, Kupic A, Leder BZ, Goessl C. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. Denosumab HALT Prostate Cancer Study Group. N Engl J Med. 2009 Aug 20;361(8):745-55.
- ↑ Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, Hodsman AB,Eriksen EF, Ish-Shalom S, Genant HK, Wang O, Mitlak BH. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001 May 10;344(19):1434-41.
- ↑ Obermayer-Pietsch BM, Marin F, McCloskey EV, Hadji P, Farrerons J, Boonen S,Audran M, Barker C, Anastasilakis AD, Fraser WD, Nickelsen T. Effects of two years of daily Teriparatide treatment on BMD in postmenopausal women with severe osteoporosis with and without prior antiresorptive treatment. EUROFORS Investigators.J Bone Miner Res. 2008 Oct;23(10):1591-600.
- ↑ Mounier et al. The effects of Strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. NEJM 2004;350:459-68.
- ↑ Reginster JY, Seeman E, De Vernejoul MC, Adami S, Compston J, Phenekos C, Devogelaer JP, Curiel MD, Sawicki A, Goemaere S, Sorensen OH, Felsenberg Meunier PJ. Strontium ranelate reduces the risk of nonvertebral fractures in ostmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab. 2005 May;90(5):2816-22.
- ↑ Lekamwasam S, Adachi JD, Agnusdei D, Bilezikian J, Boonen S, Borgstrom F, Cooper C, Diez Perez A, Eastell R, Hofbauer LC, Kanis JA, Langdahl BL, Lesnyak O, Lorenc R, McCloskey E, Messina OD, Napoli N, Obermayer-Pietsch B, Ralston SH, Sambrook PN, Silverman S, Sosa M, Stepan J, Suppan G, Wahl DA, Compston JE. Joint IOF-ECTS GIO Guidelines Working Group. A framework for the development of guidelines for the management of glucocorticoid-induced osteoporosis. Osteoporos Int 2012 Mar 21. [Epub ahead of print]


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק