גופי קטו - Ketone bodies
הופניתם מהדף גופי קטו לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| גופי קטו | |
|---|---|
| Ketone bodies | |
| שמות אחרים | קטונים בפלזמה; אצטון, אצטואצטאט, ביתא-הידרוקסי-בוטיראט. |
| מעבדה | כימיה בדם וכימיה בשתן |
| תחום | בדיקה להערכת מצבים של חמצת קטוטית (keto acidosis) |
| טווח ערכים תקין | אצטון-בדם, פחות מ-2.0 מיליגרם לדציליטר; בשתן, 0.3 מיליגרם לדציליטר. אצטו-אצטאט-בדם, 0.5-3.0 מיליגרם לדציליטר; בשתן-שלילי. ביתא-הידקרוקסי בוטיראט-בדם, 0.2-3.0 מיליגרם לדציליטר. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
בדיקת גופי קטו מתבצעת כחלק מבירור כוללני להערכת סטייה משווי המשקל בסיס-חומצה בדם. מדידת רמת גופי קטו בדם מתבצעת במטופלים עם סוכרת מראים סימנים של חמצת קטוטית סוכרתית (DKA), והיא תתבצע גם בכל תרחיש שיש בו פוטנציאל להתפתחות DKA, דוגמת עלייה משמעותית ברמת גלוקוז בחולי סוכרת בשעת מחלה או היריון. בין הסימנים והתסמינים של DKA כוללים מתן מוגבר של שתן, צמא מוגבר, התייבשות, איבוד אלקטרוליטים, נשימה מואצת, קוצר נשימה, הבל נשימה עם ריח אצטון או ריח פרי, בחילות, הקאות, עייפות, מצב בלבולי, ולעתים תרדמת אף באלה שאינם סוכרתיים. מצבי חמצת קטוטית יכולים להתפתח לעתים על רקע צום ממושך, או לחילופין באלה שניזונים בקביעות מדיאטה עתירת שומן ודלה בפחמימות או גם במצבי אלכוהוליזם, וממילא יהוו עילה למדידת גופי קטו. בדיקת גופי קטו תידרש גם במקרים של ילדים עם אפילפסיה ואירועי פרכוסים תכופים שאינם מגיבים לטיפול תרופתי מקובל.
בסיס פיזיולוגי
המושג גופי קטו מתייחס בעיקר לשני תרכובות: אצטואצטאט וביתא-הידרוקסי-בוטיראט (להלן βHB), המיוצרים במיטוכונדריה של הכבד מחומר המוצא acetyl-CoA. המושג "גופי קטו" היסטורי שכן למעשה רק אצטו-אצטאט ואצטון הם קטונים, בעוד ש-βHB היא חומצה קרבוקסילית, אצטואצטאט מצטבר בעת מטבוליזם של חומצות שומניות בתנאים של רמת פחמימות נמוכה. βHB נוצר מחיזור של אצטואצטאט במיטוכונדריה. שתי תרכובות אלה נחשבות עתירות-אנרגיה, המעבירות אנרגיה מן הכבד לרקמות אחרות. אצטון, תרכובת הקטו השלישית-אצטון, נוצרת על ידי דה-קרבוקסילציה ספונטאנית של אצטו-אצטאט, והיא אחראית לריח המתוק האופייני בהבל הנשימה של מטופלים במצב של חמצת קטוטית.
בפרקי זמן של חסר הגלוקוז, גופי קטו הם בעלי תפקיד מפתח בניצול השימוש בגלוקוז, ובהפחתת פרוטאוליזה. בניגוד לרוב הרקמות האחרות, המוח אינו יכול לנצל חומצות שומן ליצירת אנרגיה כאשר רמת גלוקוז בדם פוחתת, ואז גופי קטו מספקים למוח מקור אנרגיה חלופי, המהווה בתקופות רעב או צום כ-2/3 מהדרישות האנרגטיות של המוח. גופי קטו מעודדים in vitro הפרשת אינסולין, מייצרים רדיקאלים חופשיים וגורמים לפראוקסידציה של שומנים, תהליכים שעלולים להיות משמעותיים בהתפתחות מחלה וסקולארית בחולי סוכרת.
שלושת תרכובות הקטו הן מסיסות מים המיוצרות כתוצרי ביניים כאשר חומצות שומן עוברות קטבוליזם ליצירת אנרגיה בכבד ובכליות. אצטואצטאט ו-βHB משמשות מקור אנרגיה בלב ובמוח, בעוד אצטון הוא תוצר פסולת המופרש מהגוף. במוח, תרכובות קטו הן מקור חיוני של אנרגיה בעת צום. גופי קטו עוברים טרנספורט מהכבד לרקמות אחרות, שם אצטואצטאט ו-βHB יכולים לחזור ולהפוך ל-acetyl-CoA ליצירת אנרגיה דרך השתלבותו של האחרון במעגל חומצת הלימון.
הלב משתמש באופן מועדף בחומצות שומניות כמקור אנרגיה בתנאים פיזיולוגיים רגילים, אך במצבי קטוזיס יכול הלב לנצל גופי קטו ליצירת אנרגיה. המוח הוא איבר פעיל במיוחד מבחינה מטבולית והוא משתמש כשלעצמו בערך בשני שלישים מכלל דרישת הגוף לגלוקוז לתפקודו הנורמאלי. ברוב המצבים, גלוקוז הוא למעשה מקור האנרגיה היחידי של המוח, כיוון שאינו יכול להשתמש בחומצות שומניות שאינן יכולות לעבור דרך מחסום דם-מוח, ולכן נאלץ המוח להשתמש או בחומצת אמינו או בגופי קטו לצרכי האנרגיה שלו, כאשר אספקת הגלוקוז הולכת וקטנה בעת צום, מאמץ גופני בעצימות גבוהה, רמת פחמימות נמוכה במזון, דיאטה קטוגנית, וכן ביילודים ותינוקות בגיל הרך.
במצבי חסר של גלוקוז רוב רקמות הגוף יכולות לנצל מקורות אנרגיה חלופיים מלבד גופי קטו, בעיקר חומצות שומניות, אך כאמור אין המוח יכול לנצל את האחרונות לייצור אנרגיה. לאחר שינויי דיאטתי המביא להפחתת גלוקוז בדם למשל 3 ימים, המוח מקבל כרבע מהאנרגיה לה הוא זקוק מגופי קטו, אך אם משטר דיאטתי זה נמשך חודש ומעלה המוח יקבל מגופי קטו כ-70% מהאנרגיה הדרושה לו, ובכך קטנה תלות המוח בגלוקוז.
יצירת גופי קטו
גופי קטו נוצרים מ-acetyl-CoA בעיקר במיטוכונדריה של הפאטוציטים כאשר חומצות שומניות הופכות מקור אנרגיה חיוני, הן במצבי רעב או צום והן בחולי סוכרת בהם רמת אינסולין נמוכה ובמצבי היפרגליקמיה קיצוניים בהם גדל שחרור חומצות שומניות מרקמת שומן. כיוון שרמות acetyl-CoA בתאים גבוהות במצב זה, חל עיכוב בפעילות הקומפלקס של pyruvate dehydrogenase, בעוד שחל שפעול של pyruvate carboxylase. בנוסף, בכבד דרישה מוגברת לגלוקונאוגנזה מביאה לצריכה מוגברת של oxaloacetate, ולכן פוחתת פעילות מעגל חומצת הלימון, מה שגורם לעלייה ברמות acetyl-CoA, חומר המוצא ליצירת גופי קטו.
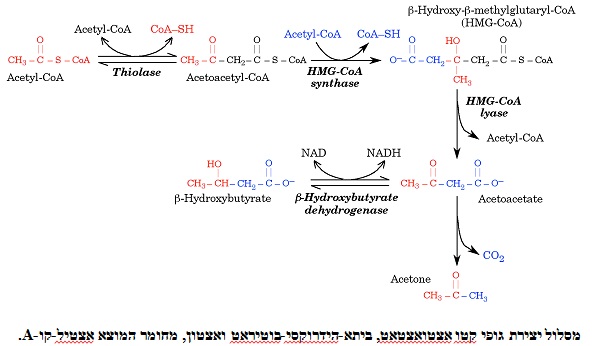
האנזים הראשון בסינתזה של גופי קטו הוא thiolase המקטלז את הדחיסה של 2 מולקולות acetyl-CoA ליצירת acetoacetyl-CoA, והאנזים הבא HMG-CoA synthase, מוסיף מולקולת acetyl-CoA שלישית ליצירת β-hydroxy-β-methylglutaryl-CoA. תוצר אחרון זה הידוע בקיצורו HMG-CoA, שהוא חומר מוצא ביצירת כולסטרול, אך במיטוכונדריה הוא משמש רק ליצירת גופי קטו. האנזים השלישי HMG-CoA lyase, משחרר קבוצת acetyl-CoA מ-HMG-CoA ליצירת אצטואצטאט שהוא "גוף קטו" הראשון שנוצר, כאשר האנזים הסופי ברצף הריאקציות הזה, β-hydroxybutyrate dehydrogenase, מחזר את אצטואצטאט ליצירת β-hydroxybutyrate. (ראה תרשים לסיכום הריאקציות ליצירת גופי קטו).
לאנזים β-hydroxybutyrate dehydrogenase יש 2 תפקידים: הוא מביא לאגירת אנרגיה שוות-ערך ל-NADH, וכן הוא מייצר βHB שהיא מולקולה יציבה יותר מקודמתה, שכן אצטואצטאט מהווה חומצה מסוג β-keto הנוטה לעבור באופן ספונטאני דה-קרבורקסילציה ליצירת אצטון. האחרון הוא למעשה תוצר פסולת נדיף, המופרש ברובו דרך הריאות, עובדה ששמשה שנים כשיטה גסה ("acetone breath") לזיהוי מטופלים עם סוכרת type 1, שאינם נמצאים בהשגחה.
שני גופי קטו, β-hydroxybutyrate ואצטואצטאט, מופרשים לצירקולציה כאשר היחס בין השניים תלוי בכמות NADH הזמינה במיטוכונדריה של הכבד, וכאשר רמת NADH גבוהה, הכבד משחרר יותר β-hydroxybutyrate. הן אצטואצטאט והן HBβ הן חומצות אורגניות המשתחררות בצורה הפרוטונית המחומצנת שלהם, שמשמעותה ששחרורן גורם להורדת ה-pH של הדם. באנשים בריאים מנגנונים אחרים מפצים על הורדת ה-pH, אך בחולי סוכרת type 1, שחרור גופי קטו מתרחש לעתים בכמויות כה גדולות, שאין למנגנוני הבופר האמורים לנרמל את ה-pH את היכולת להשיג איזון של חומציות הדם, ולכן הורדה ניכרת של ה-pH כשהיא מתווספת לאי-סדירויות מטבולית נוספות הנגרמות מחסר אינסולין, מביאים להופעת חמצת קטוטית סוכרתית (DKA) שהוא אירוע מסכן חיים בסוכרת.
אצטו-אצטאט שנוצר ייכנס לתהליך גלוקונאוגנזה ולא למעגל חומצת הלימון, כאשר האחרון יעוכב גם על ידי רמות מוגברות של NADH הנובעות מתהליך ביתא-אוקסידציה של החומצות השומניות. עודף acetyl-CoA שאינו יכול להיות מנוצל במעגל חומצת הלימון, מתועל לכיוון של יצירת גופי קטו. אצטון שנוצר אינו יכול להפוך בחזרה ל- aceyl-CoA, לכן הוא מתנדף בנשיפת האוויר מהריאות.
כאשר חולה בסוכרת type 1 סובל מאירוע של עקה ביולוגית כגון אלח-דם, התקף לב, או כשהוא אינו מטופל באופן ראוי באינסולין, עלול להופיע תרחיש של KDA. תאי כבד יגבירו פירוק חומצות שומניות ליצירת גופי קטו, ויגבירו יצירת גלוקוז במסלול גלוקונאוגנזה או פרוק גליקוגן, כדי לספק אנרגיה לתאים היקפיים שאינם מסוגלים להחדיר לתוכם גלוקוז בחסר אינסולין. תהליכים אלה שיגבירו מאוד רמת גלוקוז וגופי קטו בדם, יוריד את ה-pH ויעודד את הכליות להפרשה מוגברת של גלוקוז וגופי קטו. הפרשה מוגברת זו (osmotic diuresis) של גלוקוז תביא ליציאה של מים ואלקטרוליטים מהדם, מה שעלול לגרום למשבר קטלני של התייבשות, טכיקרדיה ולחץ דם נמוך במיוחד.
בקרה על יצירת גופי קטו
מספר גורמים משפיעים על קצב יצירת גופי קטו, כאשר התנאים מביאים לריכוז גבוה של חומצות שומנית חופשיות בדם. לחומצות שומניות אלה יש 2 מסלולים אפשריים שאחד מהם היא יצירת גופי קטו, והאחר הוא בסיוע ליצירת טריגליצרידים בהיקשרם לגליצרול. יחד עם זאת, כיוון שגליצרול הנדרש ליצירת טריגליצרידים מקורו בתהליך הגליקוליזה, ותהליך זה כידוע מצומצם ביותר בתרחישים שלפנינו, כיוון שחלק מהמשתתפים ברצף הריאקציות של הגליקוליזה נמצא בצמצום, הכבד ייצר בעיקר גופי קטו.
הקצב המטבולי של המוח הוא קבוע באופן בסיסי, ובעוד שרקמות אחרות יכולות להפחית את הדרישות המטבוליות שלהן בשעת רעב, אין המוח מסוגל "להאטת קצב" דומה. לאחר מספר ימי צום, המוח עובר שינויים מטבוליים כדי להתאים עצמו לזמינות הפחותה של גלוקוז, והדבר מתבטא בהגברת הפעילות של אנזימים הנחוצים למטבוליזם של גופי קטו. במיוחד מדובר ב-β-ketoacyl-CoA transferase, שהופך acetoacetate ל-acetoacetyl-CoA. אנזים זה משתמש ב-succinyl-CoA כתורם של יחידות CoA, ליצירת succinate ו-acetoacetyl-CoA. ריאקציה זו עוקפת את השלב של האנזים succinyl-CoA synthetase במעגל חומצת הלימון, ומשמעות הדבר שפעילות מעגל אחרון זה חיונית לאפשר שימוש בקטונים על ידי הגוף.
גופי קטו יכולים להפוך בחזרה ל-acetyl-CoA תוך שימוש באנזים β-ketoacyl-CoA transferase. אנזים אחרון זה חסר במיטוכונדריה של תאי כבד, אך במצבי רעב המוח ומספר רקמות אחרות יכולים להגביר יצירת האנזים β-ketoacyl-CoA transferase, וכתוצאה מכך להגדיל את יכולתם לנצל אנזים זה ליצירת אנרגיה.
במצבים של צום ממושך או אכילה ממושכת של מזון דל-פחמימות, יתחיל תהליך פירוק של מאגרי שומנים בגוף, כשתהליך זה מבוקר בקרה הורמונאלית. חומצות השומן המשתחררות נודדות לכבד שם אנזימים מפרקים אותן ליצירת גופי קטו, המשתחררים לזרם הדם ומשם הם מגיעים לרקמות כמו שרירים, מוח, כליות ותאי מעי, שם גופי קטו עוברים מטבוליזם באופן אנזימטי, אך מספר רקמות אינן מסוגלות להסב תוצרי פירוק של חומצות שומן ולהפכן באופן ישיר ל-ATP, מקור האנרגיה. בנוסף, יש אספקה מוגבלת של גלוקוז במצבים אלה, סוכר שחייב להישמר עבור תאי דם אדומים שיכולים להשתמש רק בו כמקור אנרגיה, ואילו המוח מעדיף להשתמש בגלוקוז כיוון שחומצות שומניות מנועות מלחדור אליו.
גופי קטו , אצטו-אצטאט, אצטון וביתא-הידרוקסי-בוטיראט, הם תוצרי ביניים של מטבוליזם של חומצות שומניות המצטברים בכמות גדולה כאשר מוגבלת יכולת הכבד להתמודד הכמויות הגדולות של אצטיל-קואנזים A, מוצר הקטבוליזם הסופי של חומצות שומניות. מצב זה מתקיים במצבי רעב, מטבוליזם לקוי של פחמימות (כמו בסוכרת), או בצריכה מופרזת של אלכוהול. במצבים אלה פוחתת היכולת החמצונית של הכבד, והיחס NAD/NADH קטן במידה רבה, מה שגורם באי יכולת הכבד לחמצן אצטיל קואנזים A או לבצע טרנספר של תרכובת זו. כדי לאפשר המשך מטבוליזם ומחזוּר של אצטיל קואנזים A, ההפאטוציטים מתחילים תהליך קטוגני בו נוצרים גופי קטו.
בשלבים מוקדמים של קטואצידוזיס סוכרתי חמור או של קטואצידוזיס אלכוהולי, תאי הכבד הם בשלב יותר "מחוזר" (דהינו היחס NAD/NADH קטן יותר), ואז ביתא-הידקוקסי-בוטיראט הוא גוף קטו הדומיננטי. אם במקביל מתרחשת גם חמצת לקטית יכולה אף להתגבר יצירת ביתא-הידרוקסי-בוטיראט מאצטו-אצטאט. אם חלה השתפרות בתרחיש החמצת הקטוטית הסוכרתית, וגדל היחס NAD/NADH, תחול עליה ברמה של אצטו-אצטאט וירידה ברמת ביתא-הידרוקסי-בוטיראט. באופן כללי, היחסי בין שלושת גופי קטו בדם הם 2% אצטון, 20% אצטו-אצטאט ו-78% ביתא הידרוקסי-בוטיראט.
גופי קטו וצום
צום של יומיים או שלושה ימים, יביא להגדלה הדרגתית של סינתזת גופי קטו, וזאת במקביל לעלייה ברמת חומצות שומן חופשיות בדם. שרירי השלד כצפוי ישתמשו ברוב גופי הקטו בימי הצום הראשונים, בסופו של דבר, רמת גופי הקטו בדם תהיה גבוהה דייה כדי שאלה יחדרו לתאי המוח. רמת גופי קטו יכולה לגדול פי-25 כמעט מרמתם הטיפוסית בתקופת צום של שבועיים, מה שמסייע לחלבוני השריר להתפרק באופן מינימאלי וכן שומר על רמת הסוכר בדם.
גופי קטו ודיאטה דלת פחמימות
סינתזה של גופי קטו בכבד (קטוגנזה), היא למעשה תהליך בלתי הפיך שכן האנזים β-ketoacyl-CoA transferase המזרז הפיכה של אצטו-אצטאט ל-acetoacetyl-CoA, אינו קיים בתאי כבד. בניגוד לחומצות שומן, גופי קטו מסיסים במים, לכן הם מועברים בדם מהכבד, ונלקחים על ידי תאי המוח, ושרירי השלד והלב. רקמות שמחוץ לכבד מנצלות גופי קטו על ידי הפיכת βHB בתחילה לאצטו-אצטאט וזה ממשיך ל- acetoacetatyl-CoA, ובסוף התהליך נוצר acetyl-CoA המתחמצן במעגל חומצת הלימון ליצירת אנרגיה. באנשים בבריאות תקינה סינתזה של גופי קטו וניצולם הוא תהליך פעיל ביותר בעיתות צום, באופן שיצמצם את דרישת הרקמות לגלוקוז כמקור אנרגיה.
משמעות תוצאות מדידת גופי קטו
מדידת גופי קטו בדם משקפת תמונת מצב של רמת הקטונים בזמן נטילת הדגימה. לעומת זאת, מדידת קטונים בשתן משקפת את רמתם הקודמת יותר מאשר את הרמה העכשווית. מדידת רמת קטונים בשתן הרבה יותר שכיחה מהבדיקה בדם, עם המגבלה שניתן לקבוע רמת אצטו-אצטאט ואצטון אך לא ניתן לגלות βHB. במצב של DKA הכרוך גם בהיפר-גליקמיה חריפה, חסר חמור באינסולין ושיבוש במאזן בסיס-חומצה בגוף, עודף הקטונים והגלוקוז יופרשו על ידי הכליות לשתן במטרה להרחקתם המהירה מהגוף. פרט להגברת מתן שתן, החולה יחוש צמא רציני, ועלוים להופיע התייבשות ומחסור חמור באלקטרוליטים.
ביתא-הידרוקסי-בוטיראט (βHB) הוא גוף הקטו העיקרי, והוא נותן אינדיקציה מהימנה יותר של המצב הקליני מאשר אצטו-אצטאט במצב של של חמצת קטוטית סוכרתית (DKA). באופן תקין היחס בין βHB לאצטו-אצטאט הוא 3:1, אך יחס זה עולה לערכים של 6:1 או 12:1, בהתרחשות חמצת קטוטית, בעיקר אם התרחיש כולל גם חמצת מטבולית זילוח (perfusion) ירוד של הרקמה או קטבוליזם של הרקמה. רמת אצטו-אצטאט בדם יכולה אף לעלות בשעת תרפיה במצבי DFA שכן βHB מתחמצן לאצטו-אצטאט. אכן, בשעת טיפול מוצלח במצבי DKA, סך רמת קטונים ו- βHBיורדת, לעומת רמת אצטו-אצטאט שעולה.
בבדיקות שגרתיות לגופי קטו כגון Acetest, Chemstrip או Ketostix, לא ניתן לגלות βHB, מדידת βHB במכשור אנליטי-אוטומטי הוא מדד מאוד אמין לניטור של ההתקדמות בטיפול באינסולין במקרים של DKA.
βHB נמצא מוגבר בחמצת קטוטית, במצבי חמצת לקטית עם כשל של הכליות, במחלת כבד, במצבי הדבקה מורכבים, או בעת הרעלה מצריכה לא מושכלת של phenformin או של סליצילאטים. במצב של חמצת קטוטית מצריכת אלכוהול, אנו לא מוצאים עלייה ברמת גלוקוז, כאשר רמת βHB עולה באופן ניכר, אך לא נרשמת עלייה באצטו-אצטאט. לכן מבחני מקלונים לחמצת קטוטית יימצאו תקינים בחמצת קטוטית על רקע אלכוהוליזם.
רמת אצטו-אצטאט עולה ב-DKA, במצבים של מתן מתמשך של אינסולין בעודף בחולי סוכרת, במצבי צום מתמשך (הקרוי גם היפוגליקמיה קטוטית, השכיח במיוחד בילדים מגיל 1-6 שנים), במצבים של הגבלה חמורה של צריכת פחמימות עם צריכה נורמאלית של שומנים (בעיקר בדיאטות להורדת משקל), באנורקסיה נרבוזה, באלכוהוליזם משברי, באי-סדירות של פעילות מעיים, במצבי הקאות ממושכות, במחלות אגירת גליקוגן מסוג I (מחלת von Gierke), וכן מחלת אגירת גליקוגן מסוגים III ו-IV, ב-branched-chain ketonuriabra, ב-methylmalonic aciduria או ב-organic academia מסוגים שונים בילדות, בפעילות גופנית בעצימות גבוהה שלא החלה באופן הדרגתי ומבוקר, בהיריון, במצבי עקה, ולאחר הרדמה.
רמת אצטו-אצטאט תימצא מוגברת במצבים של פעילות מטבולית מוגברת בגוף (כמו בטמפרטורת גוף גבוהה, בתירוטוקסיקוזיס חמור, במצב של אקרומגליה פעילה), בעודף פעילות של הורמון גדילה, עודף של קורטיקו-טרופין, גלוקו-קוריטקו-סטרואידים, היפר-אינסולינמיה, או בעודף של קטכולאמינים הגורמים היפר-גליקמיה, בהפרשה מופחתת של אינסולין הגורמת לעלייה בגופי קטו. כל המצבים הללו במיוחד רלבנטיים להעלאת רמת אצטו-אצטאט כאשר מדובר בחולי סוכרת. רמת אצטון תימצא מוגברת בחמצת קטוטית סוכרתית או כתוצאה מצום ממושך, בהרעלת propanol (אצטון הוא תוצא עיקרי של מטבוליזם של 2-פרופנול), בעת צום או רעב ממושך, או בדיאטה דלת פחמימות.
מדידת קטונים המקובלת היא זו המשתמשת ב-nitroprusside (שם מותג של sodium nitro-ferricyanide), בה בתנאי ריאקציה בתנאים בסיסיים קטון מגיב עם ניטרפרוסיד ליצירת קומפקס שצבעו סגלגל, אך ריאקציה זו רגישה פי 10-20 יותר במדידת אצטואצטאט מאשר אצטון, ואין היא מזהה כלל HBβ. עד 30% מהמקרים של DKA מלווים גם בחמצת לקטית, וחמצת מסיטה את גופי הקטו לכיוון של יצירה מועדפת של βHB. זאת יש לקחת החשבון אם מבצעים מדידה של גופי קטו בשיטת ניטרו-פרוסיד, שאינה מגלה βHB. כאשר מתקבלת תוצאה חיובית חזקה של רמת אצטון, עם תוצאות נורמאליות של anion gap, של ביקרבונאט, ושל רמת גלוקוז בפלזמה, צרוף תוצאות זה מתאים להרעלה עם איזופרופנול.
לגבי מדידת רמת אצטון בשתן, שימוש במקלוני Acetest מאפשר גילוי אצטון ברמה של 25-30 מיליגרם לדציליטר שתן, בעוד מקלוני Chemstrip יגלו אצטון בשתן רק בריכוז של 40-70 מיליגרם לדציליטר. במדידת אצטון בשתן עלולות להתקבל תוצאות שליליות-כזובות אם דגימת השתן לא הייתה מוגנת באופן אטום למנוע נידוף אצטון, או שדגימת השתן לא נשמרה בקור באופן שגרם לדלדול האצטון בשתן על ידי צמיחת חיידקים. מקלוני שתן מסוג Multistix אינם מודדים אצטון.
השפעה של תרופות על רמת גופי קטו: אספירין ברמות רעילות, אלכהול, levodopa ו-streptozotocin יעלו את רמת גופי קטו הנמדדים בדם. בבדיקת רמת גופי קטו בשתן יתקבלו תוצאות מוגברות של גופי קטו בגין השפעת תכשירים הבאים על המדידה האליטית של גופי קטו: אצטילציסטאין, קפטופריל, dimercaprol, החומר המשמר 8-hyrosyquinoline, פנילקטונים, פנול-פתלאין, D-penicillamine ,phenazopyridine ,levodopa, ו-mesna או 2-mercaptoethane sulfonate sodium .
תכשירים שיעלו תוצאה נמדדת של גופי קטו בשתן כתוצאה מהשפעה פיזיולוגית: רעילות מאספירין, אלכוהול, הרדמה באתר, אינוזיטול, איזופרופנול, metformin, חומצה ניקוטינית, phenformin, חומצה ולפרואית.
הוראות לביצוע הבדיקה
דגימת דם במבחנה כימית (פקק אדום או צהוב) או במבחנת פלזמה (פקק ירוק). יש להימנע מדגימה המוליטית, שעלול להפחית את התוצאה של ביתא-הידרוקסי-בוטיראט. דגימה איקטרית עם רמת בילירובין מעל 16 מיליגרם לדציליטר, תפחית באופן משמעותי את הרמה הנמדדת של ביתא-הידרוקסי-בוטיראט. יש לקרר או להקפיא דגימות שאינן נמדדות מיד, ולהקפיד על פקק אטום למניעת נידוף המשמעותי בעיקר לגבי אצטון. דגימות שתן יש לקרר ולשמור סגורות למניעת צמיחת חיידקים, שתביא לתוצאות נמוכות כזובות של גופי קטו. חומרים נוגדי קרישה כאוקסלאט, ציטראט, EDTA או הפארין אינם מפריעים לבדיקה.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק