המדריך לטיפול בסוכרת - האתגר של הזדקנות בריאה עם סוכרת - The challenge of healthy aging with diabetes
הופניתם מהדף הזדקנות בריאה עם סוכרת לדף הנוכחי.
המדריך לטיפול בסוכרת
מאת המועצה הלאומית לסוכרת, משרד הבריאות. עורכים מדעיים: ד"ר עופרי מוסנזון, פרופ׳ איתמר רז
| המדריך לטיפול בסוכרת | ||
|---|---|---|

| ||
| שם המחבר | ד"ר טלי צוקרמן־יפה, ד"ר מיכל עצמון, ד"ר עופרי מוסנזון, פרופסור חוליו ויינשטיין, פרופסור דויד טנה, ד"ר לאה אהרוני, פרופסור אלי מזרחי, ד"ר יהודה באומל, ד"ר דליה שכטר, פרופסור רונית אנדוולט, ד"ר ברוריה שר, איילת בירן, שולה ויטקו, יוספה כחל, פאינה צודיקוב, גילה פיימן, דורית יצחקי, פרופסור אהוד גרוסמן, פרופסור איתמר רז | |
| שם הפרק | האתגר של הזדקנות בריאה עם סוכרת קוים מנחים להערכה וחלוקה תפקודית של האדם המבוגר עם סוכרת לצורך קביעת יעדי האיזון ומתן המלצות לטיפול |
|
| מאת | האגודה הישראלית לסוכרת, האיגוד הישראלי לרפואה פנימית, ההסתדרות הרפואית בישראל, המכון לאיכות ברפואה, המועצה הלאומית לסוכרת האיגוד הישראלי לרפואה דחופה, האגודה הישראלית לאנדוקרינולוגיה, האיגוד הישראלי לאנדוקרינולוגיה פדיאטרית, האיגוד הישראלי לרפואת ילדים, האיגוד לרפואת משפחה באתר doctorsonly |
|
| מועד הוצאה | 2022 | |
| מספר עמודים | 614 | |
- ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – טיפול בסוכרת, הזדקנות
שכיחות מחלת הסוכרת גבוהה באוכלוסייה המבוגרת. בארצות הברית דווח כי 25–33 אחוזים מהאוכלוסייה מעל גיל 65 סובלים מסוכרת[1]. בישראל, על פי דוח מדדי האיכות 2014-2012 מדובר על שכיחות של 28 אחוזים בגילאי 74-65 ו-32 אחוזים בגילאי 75–84. מחקרים מהשנים האחרונות מצביעים על כך שמחלת הסוכרת היא מחלה המאיצה תהליכים של הזדקנות[2]. לאדם עם סוכרת יש סיכוי של פי 2 לפתח דמנציה, לחוות התדרדרות קוגניטיבית מואצת[3][4][5][6] ולפתח פגיעה ביכולות של למידה, זיכרון וחשיבה. כמו כן, לאדם עם סוכרת יש סיכון מוגבר לירידה במסת השריר[7] למוגבלות תפקודית, תלות באחר ותשישות (מצב פיסי ירוד בו מחלה קלה יכולה לגרום לפגיעה תפקודית משמעותית)[8][9][10].
מטרת הטיפול בסוכרת היא מניעת הסיבוכים לטווח הארוך של המחלה. שימור כוח השריר, שיווי המשקל, יכולות החשיבה, הלמידה והזיכרון כמו גם מניעת דמנציה, כחקסיה, סרקופניה ותשישות הופכים להיות המטרות החשובות בטיפול בסוכרת. שימור תפקודים אלו הוא מטרה מרכזית בשמירה על יכולתו של האדם הסוכרתי המבוגר להיות תפקודי, עצמאי ובעל איכות חיים טובה.
אספקט נוסף המדגיש את החשיבות בניטור המצב הקוגניטיבי של החולה הסוכרתי חינו הקשר בין קוגניציה והיענות לטיפול[11][12]. יכולת טיפול עצמי מהווה אבן יסוד בטיפול בסוכרת ובעלת חשיבות עליונה באיזון ומניעת סיבוכים[13]. ההמלצות לטיפול עצמי בסוכרת הן מורכבות וכוללות דרישות בתחום המעקב הרפואי, נטילת תרופות, שמירה על תזונה מאוזנת ומותאמת לשלב המחלה, ביצוע פעילות גופנית, סדר יום. תוספת של הערכה קוגניטיבית ופיזית של המטופל תאפשר בניית תוכנית טיפולית המותאמת באופן אישי למצבו התפקודי של האדם המבוגר עם סוכרת.
דמנציה היא, על-פי רוב, תוצאה של תהליכים רב-סיבתיים ארוכי טווח. חולי סוכרת נמצאים בסיכון מוגבר לדעיכה קוגניטיבית מואצת[14]. המנגנונים העומדים בבסיס זאת הם מורכבים ורב-סיבתיים וכוללים גורמים וסקולאריים, התנהגותיים, מטבוליים, ניווניים וגנטיים. במחקר עוקבה רחב-היקף בקרב חולי סוכרת מסוג 2 בקרב חברי מכבי שירותי בריאות נמצא כי מגמות לאורך זמן בערכי המוגלובין מסוכרר (trajectories) מנבאות את רמת התפקוד הקוגניטיבי וכי קיימת מודולציה של הקשר בנוכחות הגנוטיפ APOE (אשר קשור בסיכון מוגבר למחלת האלצהיימר) והגנוטיפ של הפטוגלובין[15][16][17]. ממחקר עוקבה בישראל בקרב חולים עם מחלה טרשתית (מחלת לב כלילית) עם גורמי סיכון וסקולאריים עולה כי ציון גבוה יותר במדד לבריאות כלי הדם אשר מכמת שמירה טובה יותר על מצבי בריאות ואורחות חיים בריאים, קשור להתדרדרות מתונה יותר בתפקוד הקוגניטיבי כעבור שני עשורים. כמו כן עולה כי הימצאות תנגודת לאינסולין (על פי מדד HOMA - Homeostasis Model Assessment) קשורה בדעיכה קוגניטיבית מואצת וכי התפקודים הקוגניטיביים הם לקויים יותר בקרב אלו עם שבריריות או קדם שבריריות[18][19][20].
קיים בסיס מידע רב יחסית לגבי מניעה ראשונית של שבץ המוח ומניעה באנשים עם מחלת כלי דם מוחיים תת-קלינית[21][22]. מחקרי התערבות למניעה של דעיכה קוגניטיבית מואצת ודמנציה הם ככלל מעטים וברובם קטנים. מחקר קליני התערבותי, מחקר FINGER (Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability) נחשב כפורץ דרך. במחקר זה הוקצו 1,260 גברים ונשים בני 60 עד 77 שנה בסיכון מוגבר ללקות קוגניטיבית לקבוצת ביקורת ולקבוצת טיפול אשר כללה טיפול אינטנסיבי רב-תחומי, אשר שילב הדרכה תזונתית, אימון קוגניטיבי ופעילות פיזית (אימוני כוח, פעילות אירובית ושיווי משקל) ותחלואת הלב וכלי הדם נוטרה ואוזנה בקפידה. נמצא, כי התערבות אינטנסיבית רב-תחומית הביאה לשימור או שיפור בתפקודים קוגניטיביים[23]. לא נמצאו הבדלים ביעילות ההתערבות על פי מאפייני הנכללים וההתערבות נמצאה כיעילה אף בנכללים עם מועדות גנטית לדמנציה בשל הימצאות APOE4[24][25]. יתר על-כן, ההתערבות אף הביאה להפחתה בהתפתחות תחלואה כרונית חדשה[26]. התערבות רב-תחומית על פי עקרונות דומים נבדקת בשורה של מחקרים (http://wwfingers.com).
מספר גופים מקצועיים[27][1] יצאו בהנחיות ספציפיות לטיפול בסוכרת בגיל המבוגר. בהנחיות אלו מדגישים כי הערכה קוגניטיבית ופיזית רוטינית (לצורכי סינון וניטור) בגיל המבוגר צריכה להיות חלק מהמעקב השגרתי אחר האדם המבוגר עם סוכרת.
המלצות אלו, בנוסף לשכיחות הגבוהה של המבוגרים עם סוכרת, מחזקות את חשיבות קידום ההערכה התפקודית (הקוגניטיבית והפיזית) הראשונית בקרב כל חולי הסוכרת מעל גיל 70.
במהלך השנים 2018–2019 נערכו מספר מפגשים עם נציגים של המועצה הלאומית לסוכרת, המועצה הלאומית לגריאטריה, איגוד הנוירולוגים, איגוד רופאי המשפחה והמועצה לקידום בריאות בהנחייתם של פרופ' איתמר רז, פרופ' חוליו ויינשטין וד"ר עופרי מוסנזון.
המסמך הנזכר למעלה הוא תולדה ותוצר של מפגשים אלו. להלן יפורטו הנחיות כיצד למטב את הטיפול באדם המבוגר עם סוכרת תוך התחשבות ברמת הסיכון לירידה תפקודית.
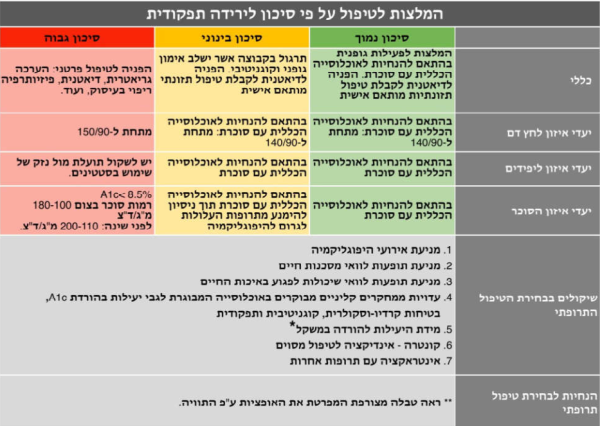
הצעה לסיווג אנשים מבוגרים עם סוכרת על פי רמת הסיכון לירידה תפקודית
סכמת הטיפול באדם המבוגר עם סוכרת תקבע על פי מצבו התפקודי ולא על פי גילו הכרונולוגי. חלוקה לרמת סיכון לירידה תפקודית תהווה בסיס ל:
- קביעת יעדי איזון סוכר, לחץ דם וליפידים וקווים מנחים לסוג הטיפול התרופתי
- שלילה של סיבות משניות לירידה תפקודית
- הפנייה להתערבות לשימור ושיפור המצב התפקודי
- רמת הסיכון לירידה תפקודית תקבע על פי הכרות הצוות המטפל עם האדם המבוגר עם סוכרת ותכלול, בין היתר, היסטוריה של נפילות חוזרות. בנוסף, ניתן להשתמש במבדקים המפורטים מטה
- מבדקים אלו יועברו על ידי אנשי צוות רפואי שהוכשרו לכך (צוות סיעודי, פיזיותרפיסטים, עובדים סוציאליים, תזונאים, מחנכי סוכרת ועוד)
מבדקים קוגניטיביים
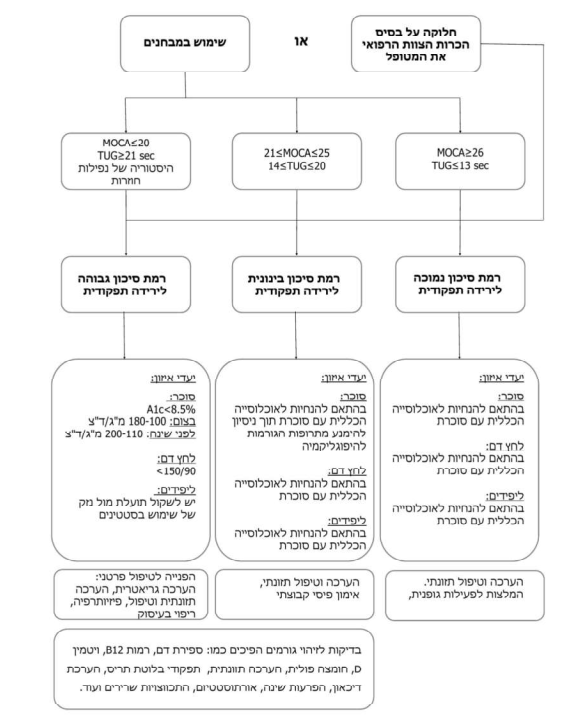
Montreal Cognitive Assessment (MOCA)
MOCA הוא מבחן לסינון קוגניטיבי המעריך זיכרון לטווח קצר, יכולות הבנה ויזואלית, קשב, ריכוז ושפה. זהו מבחן שנמצא בשימוש נרחב הן במחקר והן בקליניקה. ממחקרי תיקוף שבוצעו נמצא כי ציון מתחת ל-20 מעלה מעורר חשד גבוה לליקויים קוגניטיביים חמורים. ציון מעל 26 מוגדר כתקין. משך המבחן כ-10 דקות.
Digit Symbol Substitution (DSS)
DSS הוא מבחן קוגניטיבי הבודק מהירות חזותית, מוטוריקה, קואורדינציה, יכולות למידה, קשב, ריכוז וזיכרון לטווח הקצר. מבחן זה אינו יכול להוות כלי סינון אך מצוין ככלי למעקב תקופתי. משך המבחן כ-2 דקות.
מבדקים פיזיים
Timed Up & Go (TUG)
TUG הוא מבחן הבודק את רוב המיומנויות הנדרשות לניידות. הניקוד הוא מספר השניות הנדרש על מנת להשלים משימה של קימה מכיסא, הליכה למרחק של 3 מטרים, סיבוב במקום וחזרה לישיבה. המבחן מסווג לפי סיכון לנפילות ולהליכה עצמאית. ציון של מעל 13 שניות מעיד על עלייה בסיכון לנפילות. משך המבחן כ-3 דקות.
10 Meter walk test (10 MWT)
10 MWT הוא מבחן הבודק מהירות הליכה למרחק של 10 מטרים. מסלול של 10 מטרים מסומן על הרצפה וכיסא ממוקם שני מטרים מעבר לקו סיום המסלול. הנבדק מתחיל שני מטרים לפני תחילת המסלול והולך 14 מטרים (שני מטרים להאצה בהתחלה ושני מטרים להאטה בסוף). הניקוד שהושג נקבע לפי הזמן שחלף במהלך ההליכה לאורך 10 המטרים האמצעיים. נמצא כי מהירות הליכה נמוכה מנבאת סיכון לנפילות באוכלוסיית המבוגרים ומהווה גורם סיכון לנכות, לליקוי קוגניטיבי, ו/או לתמותה. מהירות הליכה מעל 1.2 מטר לשנייה מעידה על יכולת תפקודית טובה אך תוצאה מתחת ל-0.4 מטר לשנייה מעידה על קושי משמעותי בעצמאות. מבחן 10 המטרים הוא פשוט, קל ומהיר לביצוע ותוצאותיו יכולות לספק מידע רב וחשוב לגבי הנבדק. משך המבחן כ-2 דקות.
Sec sit to stand test (STS) 30
מטרת מבחן זה היא להעריך את כוח השרירים בגפיים התחתונות. ההוראות לנבדק הן לקום לעמידה מלאה מישיבה מספר פעמים שיכול ללא עזרה או דחיפה של הידיים (ידיו משולבות על החזה) במשך 30 שניות. הציון ניתן לפי מספר הפעמים שבהם הצליח הנבדק להגיע לעמידה מלאה. המבחן בודק את כוח שרירי הגפה התחתונה אשר תפקודם קשור לתפקוד היום יומי, לקימה, להליכה, לעליית מדרגות ושיווי משקל. תוצאה מתחת ל-10 חזרות מעידה על כוח ירוד. משך הבדיקה כ-1 דקה.
חלוקה ל-3 קבוצות על פי רמת הסיכון לירידה תפקודית (ראו טבלה 1,2 ותרשים 1)
על פי כל האמור לעיל, אדם מבוגר עם סוכרת יסווג לאחת משלוש הקבוצות הסיכון להתדרדרות תפקודית: רמת סיכון נמוכה, בינונית וגבוהה. החלוקה תעשה על פי הכרות הצוות המטפל עם האדם המבוגר תאו שימוש במבחנים שפורטו מעלה.
השתייכות לקבוצה ברמת סיכון נמוכה היא בתנאי שכל המבדקים נמצאו בטווח הנורמה.
השתייכות לקבוצה ברמת סיכון בינונית היא בתנאי שאחד מהמבדקים לפחות נמצא ברמת סיכת בינונית והשתייכות לקבוצה ברמת סיכון גבוהה היא בתנאי שאחד מהמבדקים לפחות נמצא ברמת סיכון גבוהה.
המלצות לטיפול ברמת סיכון נמוכה
מטופלים אשר ימצאו בטווח הנורמה יופנו לקבוצות תזונה לתמיכה בחולי סוכרת בגיל השלישי, או לייעוץ תזונתי אישי לפי בחירתם ויקבלו הנחיות הכוללות מרשם לאימון גופני, תרגילי שיווי משקל, תרגול קוגניטיבי, הערכה תזונתית מותאמת והמלצות רפואיות ותזונתיות בהתאם לממצאים על מנת לשמר את מצבם.
יעדי איזון הסוכרת, לחץ הדם והליפידים יקבעו בהתאם להנחיות לאוכלוסייה הכללית[27].
המלצות לטיפול ברמת סיכון בינונית
מטופלים אשר ימצאו במבחן אחד או יותר כבעלי רמת סיכון בינונית יוזמנו להצטרף לטיפול קבוצתי לתרגול כוח, שיווי משקל וכן מטלות קוגניטיביות ויופנו לצורך ביצוע הערכה תזונתית פרטנית והתערבות מתאימה. כמו כן יערך בירור לסיבות משניות לירידה תפקודית (ראה פיסקה הבאה).
יעדי איזון הסוכרת יקבעו בהתאם להנחיות לאוכלוסייה הכללית תוך ניסיון להימנע מתרופות העלולות לגרום להיפוגליקמיה. יעדי איזון לחץ דם וליפידים יקבעו בהתאם להנחיות לאוכלוסייה הכללית[27].
המלצות לטיפול ברמת סיכון גבוהה
מטופלים אשר ימצאו במבחן אחד או יותר כבעלי רמת סיכון גבוהה יופנו בהתאם למצבם להערכה גריאטרית, מרפאת זיכרון, טיפול תזונתי, טיפול פיזיותרפיה, ריפוי בעיסוק וכדומה. כמו כן יערך ברור לסיבות משניות לירידה תפקודית (ראה בפיסקה הבאה).
יעדי איזון הסוכרת: A1c מתחת ל-8.5 אחוז, FPG (Fasting Plasma Glucose) בין 180-100 מיליגרם/דציליטר וערכי סוכר לילה בין 110–200 מיליגרם/דציליטר. ההערכה של יתרונות וחסרונות לטיפול תרופתי בליפידים תתבצע על פי מצבו של המטופל. יעד לחץ הדם מתחת ל-150/90[27].
הערכה רפואית לסיבות משניות אשר עלולות לגרום לירידה תפקודית תכלול
- ספירת דם
- בדיקה של רמות B12, ויטמין D וחומצה פולית
- מאגרי ברזל
- הערכה תזונתית הכוללת את הערכת בריאות הפה והערכה פיזיקלית במיקוד התזונתי
- תפקודי בלוטת התריס
- סימפטומים של דכדוך/דיכאון על פי הכרות של הצוות הרפואי את המטופל ו/או באמצעות שאלת 9-PHQ
- בעיות שינה על פי הכרות של הצוות הרפואי את המטופל ו/או באמצעות שאלון MSQ
- אורטוסטטיזם
- כאבי שרירים
בחירת הטיפול התרופתי המומלץ לחולה המבוגר עם סוכרת (ראו נספח ה')
בבחירת הטיפול התרופתי המומלץ לחולה הסוכרתי המבוגר יש להתייחס לתחומים הבאים:
- מניעת אירועי היפוגליקמיה
- מניעת תופעות לוואי מסכנות חיים
- מניעת תופעות לוואי שיכולות לפגוע באיכות החיים
- עדויות ממחקרים קליניים מבוקרים באוכלוסייה המבוגרת לגבי יעילות בהורדת A1c, בטיחות קרדיווסקולרית, קוגניטיבית ותפקודית
- תרופות בעלות השפעה על ירידה במשקל/פגיעה בחוש הטעם הריח ויובש בפה יינתנו רק לאחר הערכה תזונתית על ידי דיאטנית ותוך מעקב תזונתי רציף
- התווית נגד לטיפול מסוים
- אינטראקציה עם תרופות אחרות
- בגיל המבוגר יש לתוסף B12 כאשר הרמות בדם הן מתחת ל-400 פיקוגרם/מיליליטר
- מומלץ גם מתן של מולטי-ויטמין לגיל השלישי לפחות אחת ליומיים
סיכום
הזדקנות בריאה עם סוכרת היא אתגר. יעדי האיזון ואופן הטיפול נגזרים מהגיל "הביולוגי" של האדם ולא מהגיל הכרונולוגי. הקווים המנחים של המועצה הלאומית לסוכרת ממליצים על ביצוע הערכה ועל פי הערכה זו החלטה לאיזו דרגה תפקודית שייך כל אדם מבוגר עם סוכרת. הדרגה התפקודית היא הקובעת את יעדי איזון הליפידים, לחץ הדם והסוכר.
נספח א. הערכה של איכות השינה, אבחון וטיפול בחולה המבוגר עם סוכרת
ד"ר דליה שכטר
חסך שינה והפרעות שינה מהווים גורמי סיכון להופעת סוכרת מסוג 2 במבוגרים. לא ברור אם מדובר בקשר של גרימה או קשר דרך גורם מתווך כמו השמנה או דרך מנגנון של הפרשת מלטונין[28][29][30].
אינסומניה (נדודי שינה) היא הפרעת שינה שכיחה מאוד במבוגרים ועולה עם הגיל, עד כדי 50 אחוזים בקשישים[31]. אינסומניה מוגדרת כקשיי הירדמות ו/או קושי לשמור על רצף השינה ושכיחותה ו/או יקיצות בוקר מוקדמות ו/או שינה לא מרעננת 3 פעמים בשבוע לפחות ולמשך 3 חודשים לפחות[32]. הרקע לאינסומניה בגיל המבוגר מורכב וכולל גורמים סביבתיים, התנהגותיים, רפואיים וסוציאליים[33][34][35].
בירור
כאשר מטופל מתלונן על שינה לא תקינה, או נמצא שהשינה לא תקינה בנטילת אנמנזה מכוונת, יש לברר אם תלונתו העיקרית היא קשיי הירדמות, ראו יקיצות ליליות, ראו יקיצות בוקר מוקדמות, ראו שינה לא מרעננת/עייפות/ישנוניות במשך היום. על פי הסימפטום העיקרי ניתן להמשיך בירור מכוון:
קשיי הירדמות עשויים להיות קשורים בהפרעת חרדה/דיכאון, תסמונות כאב, תרופות מסוימות כמו סטימולנטים, Restless Legs Syndrome, הפרעה בשעון הביולוגי מסוג Delayed Sleep Phase Syndrome ועוד.
יקיצות ליליות עשויות להיות קשורות גם כן בהפרעת חרדה/דיכאון, תרופות מסוימות כמו SSRI’S, הפרעות שינה ראשוניות כמו דום נשימה בשינה ותנועות רגליים מחזוריות בשינה (PLMS) ועוד.
יקיצות בוקר מוקדמות עשויות להיות קשורות בדיכאון, חרדה, הפרעה בתזמון השעה מסוג Advanced Sleep Phase Syndrome ועוד.
שינה לא מרעננת, עייפות ראו ישנוניות במהלך היום עשויות להיות קשורות בשינה לא רצופה ולא יעילה אך אבחנה מבדלת חשובה היא חסך שינה או מיעוט שעות שעה יחסי - Insufficient sleep syndrome.
יש להתייחס לכל מחלות הרקע ולטיפול התרופתי הקבוע כגורמים אפשריים לאינסומניה.
הגישה הטיפולית
חשוב לטפל בצורה אופטימלית ככל הניתן במחלות הרקע ובמקביל לטפל בהפרעת השינה.
אם עולה מהאנמנזה חשד להפרעת שינה אינטרינזית כמו דום נשימה בשינה או תנועות רגליים מחזוריות בשינה או פעילות מוטורית חריגה בשינה יש אינדיקציה להפנות לבדיקת שינה והמשך טיפול בהתאם להוצאות.
אם עולה חשד קליני ל-Restless Legs Syndrome יש מקום לבירור רפואי רלוונטי וטיפול בהתאם, או טיפול סימפטומטי ספציפי[36].
הטיפולים המוצעים למטופלים עם אינסומניה מסיבות אחרות כוללים טיפול התנהגותי-קוגניטיבי ייעודי לאינסומניה CBT-i)), טיפולים לא תרופתיים אחרים וטיפול תרופתי מותאם שניתן לשלב עם CBT-I[34].
טיפול התנהגותי קוגניטיבי באינסומניה (CBT-I)
טיפול זה נמצא יעיל לשיפור השינה גם לטווח קצר וגם לאורך זמן אולם מודעות נמוכה ומיעוט מטפלים המיומנים בשיטה זו מגבילים את השימוש בה[37].
הטיפול משלב מספר מרכיבים:
- Stimulus Control - מטרתו "לחבר" בין המיטה לשינה. ההנחיות הן להיכנס למיטה רק כשעייפים ומוכנים לשינה; המיטה מיועדת רק לשינה ולסקס, לא לפעילויות ומטרות אחרות (צפייה בטלוויזיה, עבודה, אכילה וכדומה); אם לא נרדמים לאחר כ-15–20 דקות יש לצאת מהמיטה לחדר אחר ולשוב כשעייפים ומוכנים לשינה; לקום כל בוקר באותה השעה, כולל סופי שבוע; להימנע משינה במשך היום
- תרגול הרפיה בשיטות שונות
- Sleep Restriction - אנשים שסובלים מאינסומניה לעיתים קרובות הולכים לישון מוקדם יותר כדי לנסות להירדם ובכך מחמירים את הפרעת השינה. כלי טיפולי יעיל מאוד הוא דחיית הכניסה למיטה שעשויה לשפר את ההירדמות על ידי יצירת דחף מוגבר לשינה. עם השיפור בשינה ניתן להגדיל בהדרגה את משך השינה
- טיפול קוגניטיבי - מטרתו לתקן תפיסות מוטעות סביב השינה והתפקוד למחרת
- היגיינת שינה
לעיתים קרובות די בשינויים ההתנהגותיים כמפורט לעיל ובמיוחד צמצום שהייה במיטה (Sleep Restriction) והימנעות משינה במשך היום כדי לשפר את שנת הלילה.
טיפולים לא תרופתיים אחרים
טיפולים נוספים שהראו יעילות מסוימת הם חשיפה לאור בהיר בבוקר, שחיונית במיוחד בגילאים המבוגרים לחיזוק המחזוריות היומית של שינה-ערות[38].
טיפולים תרופתיים
מטרת הטיפול התרופתי באינסומניה הוא לקצר את זמן ההירדמות ולהעלות את יעילות השינה עם מיעוט תופעות לוואי. את הטיפול התרופתי יש להתאים בהתאם לסימפטום העיקרי ולרקע הרפואי ולתרופות נוספות אותן מקבל המטופל. למשל, אם מדובר בקשיי הירדמות בלבד תתאים תרופה עם זמן מחצית חיים קצר. אם מדובר ביקיצות ליליות ללא או עם קשיי הירדמות תתאים תרופה עם זמן מחצית חיים ארוך יותר. אם קיים מרכיב בולט של דיכאון/חרדה תתאים תרופה מקבוצת נוגדי הדיכאון.
הטיפולים התרופתיים המצויים משתייכים לקבוצות הבאות:
- Benzodiazepines
- Non-Benzodiazepines
- Melatonin
- Antidepressants
- Anticonvulsants
- OTC (Over The Counter) medications
בשנת 2017 פורסמו הנחיות קליניות לטיפול תרופתי באינסומניה במבוגרים[39]. ההוכחות החזקות ביותר ליעילות טיפולית נמצאו עבור תרופות ממשפחת ה-Benzodiazepines וה-Non-Benzodiazepines אך עקב תופעות לוואי לא רצויות של תרופות אלו, במיוחד באוכלוסייה המבוגרת, נעשו ונעשים יותר ויותר ניסיונות עם תרופות ממשפחות אחרות, off-label, במידות שונות של הצלחה[40][41].
Benzodiazepines
בארץ מוכרים ממשפחה זו - Brotizolam, Lorazepam, Clonazepam. תרופות אלה מקצרות את זמן ההירדמות ומפחיתות יקיצות ליליות. במבוגרים שימוש ממושך קשור בנפילות חוזרות וסיכון מוגבר לשברים ובירידה בזיכרון. נטילה ממושכת עלולה לגרום להתרגלות לתרופה וצורך להעלות מינון, תלות פסיכולוגית בתרופה ואף התמכרות. לכן מומלץ להימנע ככל שניתן משימוש בתרופות אלו לאורך זמן, ובמקרה של שימוש ממושך יש לשאוף לגמילה הדרגתית מאוד בשילוב עם טיפול אחר[42].
Non-Benzodiazepines
בארץ מוכרות מספר תרופות ממשפחה זו - Zolpidem, Zolpidem extended release, Zopiclone. תרופות אלו מקצרות את זמן ההירדמות (Zolpidem) וגם מפחיתות יקיצות ליליות (Zolpidem extended release, Zopiclone) אולם גם הן קשורות בנפילות וסיכון מוגבר לשברים, התרגלות ותלות וכן עלולות לגרום למצבי בלבול ופעילויות מוטוריות חריגות. בנוסף, נמצא שבנשים ובמבוגרים המטבוליזם של התרופות מקבוצה זו משתנה כך שמומלץ מינון נמוך בלבד באוכלוסייה זו. הטיפול בתרופות אלו מומלץ לפרק זמן קצר בלבד. במטופלים עם ירידה קוגניטיבית ודמנציה מומלץ להימנע כליל מתרופות אלו[43][44][45].
Melatonin
באינסומניה של הגיל המבוגר הטיפול במלטונין בשחרור מיידי אינו יעיל, למעט במקרים בהם מאובחנת הפרעה בתזמון השינה מסוג Delayed Sleep Phase Syndrome.
מלטונין בשחרור ממושך -Circadin- נמצא יעיל כטיפול באינסומניה במבוגרים מעל גיל 55, הן מבחינת איכות השינה והן מבחינת רמת הערנות בבוקר. התרופה נמצאה בטוחה לשימוש וללא ריבאונד של תסמיני אינסומניה לאחר הפסקת הטיפול[46][47]. אין ממצאים חד משמעיים לגבי יעילות הטיפול עם Circadin ככלי עזר לגמילה מכדורי שינה אחרים אך לאור פרופיל בטיחות גבוה ניתן לנסות טיפול זה.
Antidepressants
לאור חסרונות הטיפול באינסומניה לאורך זמן עם Benzodiazepines ו-Non-Benzodiazepines ניסקרו ניסיונות טיפוליים עם תרופות נוגדות דיכאון שונות שהן בעלות אפקט סדטיבי. התוצאות אינן חד משמעיות או שתומכות חלקית בטיפולים אלו. תרופות ממשפחה זו לטיפול באינסומניה הן Amitriptyline, Doxepin במינון נמוך (עד 6 מיליגרם) מקבוצת ה-Tricyclic Antidepressants, Trazodone במינון נמוך (100-25 מיליגרם) ו-Mirtazapine במינון נמוך (15-7.5 מיליגרם). תרופות מקבוצת ה-Tricyclic Antidepressants על פי רוב אינן מומלצות לטיפול בקשישים בשל תופעות הלוואי האנטיכולינרגיות. בכל מקרה יש להתאים את הטיפול התרופתי בהתאם לרקע הרפואי ולטיפולים תרופתיים נוספים.
Antipsychotics
(לא בשימוש בארץ) Orexin Antagonists
Anticonvulsants
נמצא ש-Pregabalin מעלה את כמות השינה העמוקה. מתן Pregabalin כטיפול באינסומניה הראה יעילות מסוימת בחולים עם פיברומיאלגיה או עם Generalized Anxiety Disorder. תופעת לוואי שכיחה היא חוסר יציבות (Dizziness) וישנוניות.
OTC medications
בקבוצה זו נכללים ולריאן, Doxylamine ו-Diphenhydramine. אין עבודות שמראות יעילות חד משמעית של ולריאן כטיפול באינסומניה. חלקן הראה עלייה קלה ביעילות השינה. פרופיל תופעות הלוואי דומה לזה של פלצבו. Diphenhydramine ו-Doxylamine הן תרופות OTC נפוצות וזולות ונראה שהן משפרות מדדי שינה במבוגרים. לתרופות אלו תופעות לוואי אנטי-כולינרגיות שאינן רצויות במיוחד באוכלוסייה המבוגרת וכן ירידה ביעילות עם הזמן עקב התרגלות.
לסיכום
- טיפול אופטימלי במחלות הרקע והתייחסות לטיפול תרופתי קבוע שעלול לתרום לאינסומניה
- אבחון נכון של סוג האינסומניה (קרי קשיי הירדמות/יקיצות ליליות/יקיצות בוקר מוקדמות/שינה לא מרעננת)
- אבחון וטיפול בהפרעות שינה ראשוניות
- ניסיון טיפול התנהגותי-קוגניטיבי, שיפור היגיינת השינה
- בהמשך - ניסיון טיפולי עם סירקדין לפני תרופות שינה אחרות
- טיפול עם Benzodiazepines ו-Non-Benzodiazepines לפרק זמן קצר בלבד או לסירוגין
- התאמת הטיפול התרופתי באינסומניה לפי הסימפטום העיקרי
היגיינת שינה
- יש לקבוע שעות שינה קבועות ולהקפיד על שעות שינה מספיקות. בממוצע נחוצות בין 6 ל-8 שעות שינה בלילה
- להימנע מכניסה למיטה כדי לנסות להירדם. ככל שהמאמץ לישון גדול יותר, רמת העוררות עולה והשינה מתרחקת
- יש לשמור על סביבת שינה נוחה, בטמפרטורה נעימה, ללא גירויי אור ורעש וללא שעון בטווח ראייה
- השהייה במיטה מיועדת לשינה בלבד (ולסקס). במצב של קושי להירדם תוך כ-20 דקות או התעוררות מהשינה יש לצאת מהמיטה ולשוב כשמוכנים לישון
- פעילות גופנית סדירה חיונית לבריאות אך מעוררת. יש להימנע ממנה בשעות שלפני השינה
- יש להימנע מקפאין, ניקוטין ואלכוהול כ-5–6 שעות לפני השינה. חומרים אלה פוגמים באיכות השינה גם כשאין הפרעה לתהליך ההירדמות
- לפני השינה מומלצת ארוחה קלה מורכבת ממזון עשיר בחלבון ודל בשומן וסוכר. כדאי להימנע מללכת לישון רעבים
- יש להימנע משתיית כמות גדולה של נוזלים לפני השינה
- יש להימנע משנת צהריים ממושכת, לאחר השעה 15:00-14:00. די בתנומה צהריים במשך 15–20 דקות כדי לשפר את התפקוד במחצית השנייה של היום
- לאחר לילה ללא שינה או לאחר שעות שינה מועטות, יש להימנע משינה ביום שלמחרת
נספח ב. דיכאון ודכדוך באדם המבוגר עם סוכרת
פרופסור אלי מזרחי, ד"ר יהודה באומל
פחות ממחצית הקשישים הדיכאוניים מאובחנים ופחות מזה מטופלים. בין היתר, זה נובע מכך שאיתור דיכאון אצל קשישים אינו פשוט. בגיל המבוגר קיימים מצבים שונים המדמים או ממסכים דיכאון. לא פעם, אצל הקשיש, "מככבות" דווקא תלונות גופניות שונות, והוא נוטה להמעיט בחשיבות סימני הדיכאון.
סימנים של מצב רוח ירוד לא תמיד בולטים ולא פעם מיוחסים ל"זקנה". יש גם ריבוי של סימנים לא ייחודיים היכולים לטשטש את האבחון היות שהם מופיעים במקביל גם במצבים אחרים כגון עייפות וחוסר ריכוז. בנוסף, פעמים רבות קיים ליקוי קוגניטיבי, על כן הכיוון מוסט מדיכאון לקיהיון. בנושא זה יש להבדיל בין שני מצבים: מחלה דיכאונית ראשונית של הגיל המבוגר, עם מרכיביס/ליקויים קוגניטיביים וקיהיון ראשוני, עם מרכיביס/סימנים דיכאוניים. המדדים לאבחון דיכאון בגיל הקשיש הם אלה של ה-DSM והם עוסקים בתסמינים של מצב רוח, תסמינים קוגניטיביים ותסמינים גופניים.
לשם הערכת האפשרות כי הקשיש במצב דיכאוני, ניתן להשתמש במספר מבחנים, אחד מהם הוא GDS: Geriatric Depression Scale, המורכב מ-30 שאלות (ניקוד שבין 11 ל-20, מתאים לדיכאון קל-בינוני, וניקוד של 21 או מעל, לדיכאון בינוני-חמור). ישנה גם גרסה מקוצרת של 15 שאלות בלבד (ניקוד שבין 6 ל-9, מצביע על דיכאון קל-בינוני, וניקוד של 10 או מעל, מתאים לדיכאון חמור). כן ישנו מבחן ה-PHQ-9: Patient Health Questionnaire, שאלון (דיווח עצמי) המשתמש במדדי אבחון דיכאון של ה-DSM (ניקוד של 5 עד 9, מתאים לדיכאון קל בלבד, וניקוד של 10 או מעל, מצביע על מצב של דיכאון רבא). מבחינת הטיפול התרופתי, הכלל הוא start low; Go slow; Go all the way. דהיינו להתחיל עם מינונים נמוכים; להעלות מינונים באופן הדרגתי/איטי עד למינון המרבי או עד להופעת תגובה טובה או עד להופעת תופעות לוואי. הטיפול אמור להיות מותאם אישית, כאשר לרוב, הטיפול הראשוני הוא עם תכשיר מקבוצת ה-SSRI (כגון Escitalopram). במקרה של כישלון, לרוב הבחירה היא בתכשיר מקבוצת ה-SNRI (כגון Venlafaxine). תסמיני הליבה כוללים מצב רוח/הלך רוח (Mood) ירוד ו/או ירידה משמעותית ביכולת לחוש הנאה (Anhedonia) מהפעילויות הרגילות/היום-יומיות או איבוד עניין בהן. בנוסף לכך, לשם אבחון יש צורך בלפחות ארבעה מהתסמינים הבאים: ירידה או עלייה בתיאבון או ירידה או עלייה במשקל; האטה פסיכומוטורית (מחשבה, תנועתיות) או אי-שקט פסיכומוטורי; הפרעות שינה (מיעוט או עודף שינה); קשיים בריכוז או בקבלת החלטות; ירידה באנרגיות ו/או תשישות; תחושת חוסר ערך או תחושת אשמה מוגזמת; ומחשבות נשנות על מוות ו\או התאבדות. כל זאת, במקביל, ולפחות למשך שבועיים ימים. באם אין השפעה לאחר טיפול של 4 שבועות עם מינון מרבי - לשקול המרה לתרופה אחרת. באם ישנה השפעה חלקית בלבד לאחר טיפול של 8 שבועות עם מינון מרבי - לשקול Augmentation דהיינו הוספת תרופה אחרה.
נספח ג. טיפול ביתר לחץ דם בסוכרת בגיל המבוגר
פרופ' אהוד גרוסמן
יתר לחץ דם נפוץ מאוד בקרב חולי סוכרת מבוגרים. השילוב של יתר לחץ דם וסוכרת מגביר בצורה משמעותית את הסיכון לתחלואה ותמותה ממחלות לב וכלי דם לכן איזון לחץ דם בחולים אלו חשוב במיוחד[48]. יש מעט מידע לגבי יעד לחץ הדם בחולי סוכרת מבוגרים. חולי סוכרת מבוגרים יותר שברירים ולרוב סובלים מיתר לחץ דם סיסטולי, מירידה קוגניטיבית, מתחלואה נלווית עם נזק לאיברים, מפגיעה כלייתית ומנפילת לחץ דם תנוחתית (Orthostatic hypotension). בחולים אלו הגישה חייבת להיות אישית וחייבת לקחת בחשבון את מצב החולה וכל התחלואה הנלווית. במשך שנים היה יעד הטיפול בחולי סוכרת נמוך יותר מאשר בחולים ללא סוכרת. מחקר ה-(ACCORD) Action to Control Cardiovascular Risk in Diabetes blood pressure[49] לא הצליח להראות שהורדה אינטנסיבית של לחץ הדם הסיסטולי לפחות מ-120 מילימטר כספית יעילה יותר מאשר הורדת לחץ דם סיסטולי ל-140 מילימטר כספית, אך מחקר ה-(SPRINT) Systolic Blood Pressure Intervention Trials[50] הצליח להראות שדווקא בחולים ללא סוכרת הורדת לחץ דם סיסטולי לפחות מ-120 מילימטר כספית מורידה תחלואה ותמותה ב-25 אחוזים בהשוואה ל-140 מילימטר כספית. התועלת בהורדה אגרסיבית של לחץ דם סיסטולי במחקר ה-SPRINT נצפתה גם בחולים מבוגרים מעל גיל 75[51].
לאור נתוני ה-SPRINT עלתה השאלה מה צריכים להיות יעדי לחץ הדם בחולי סוכרת מבוגרים.
חולי סוכרת מבוגרים בדרך כלל סובלים מתחלואה נלווית כולל נפילת לחץ דם תנוחתית, מחלת לב איסכמית, אי ספיקת כליות, ולכן הורדת לחץ דם אגרסיבית בחולים אלו יכולה להיות בעייתית.
הגישה, לכן, צריכה להיות אינדיבידואלית על פי מצב החולה תוך התחשבות במצב הקוגניטיבי ובתחלואה הנלווית[52]. מקובל שיעד לחץ הדם בגיל המבוגר נמוך מ-140/90 בתנאי שאין נפילת לחץ דם משמעותית ובתנאי שהחולה סובל את הטיפול.
הערכת חולה סוכרת מבוגר צריכה לכלול מדידות לחץ דם מחוץ למרפאה - עדיף על ידי ניטור אמבולטורי ל-24 שעות. בצורה זו ניתן לאבחן יתר לחץ דם לילי ששכיח במיוחד בחולי סוכרת. כמו כן חשוב למדוד את לחץ הדם בישיבה ובעמידה ולהעריך מצב של אי ספיקת לב. הערכת החולה צריכה לכלול בדיקת הפרשת החלבון בשתן, תפקודי כליות, רמת נתרן ואשלגן, סידן וחומצה אורית ופרופיל שומנים.
הנישה הטיפולית
- בחולים עם ערכי לחץ דם מעל 140/90 מילימטר כספית יש להתחיל טיפול
- בכל החולים מומלץ להתחיל בשינוי הרגלי חיים שכוללים בעיקר צמצום המלח, ירידה במשקל, פעילות גופנית, הפסקת עישון והפסקת שתיית אלכוהול
- בחולי סוכרת מבוגרים יש להתחיל את הטיפול התרופתי במינונים יותר נמוכים ולהעלות את הטיפול בהדרגה בהתאם לתגובה, תוך מעקב אחר ערכי לחץ דם בישיבה ובעמידה
- רוב חולי הסוכרת, גם בגיל מבוגר זקוקים לטיפול משולב. השילוב המומלץ הוא חוסם סידן מקבוצת הדיהידרופירידינים עם ACEI או ARB. רצוי לתת את השילוב בכדור אחד המכיל את 2 המרכיבים
- אין לשלב ACEI עם ARB
- כתרופה שלישית יש להוסיף מינון נמוך של משתנים. כמשתן יש להעדיף את ה-(indapamide (PAMID. יש להמליץ בעיקר בנשים להימנע משתייה מרובה כדי למנוע היפונתרמיה
- בחולים עם מחלת לב איסכמית או בחולים עם דופק מהיר יש להוסיף חוסם בטא
- בחולים עם רמות אשלגן נמוכים מ-4 מילימול/ליטר יש לשקול תוספת של אלדוספירון (ספירונולקטון) במינון נמוך של 12.5 מיליגרם תוך מעקב אחר רמת אלקטרוליטים
- יש לקחת בחשבון שאיזון טוב של לחץ הדם יכול להעלות את ערכי הקריאטינין. עלייה מתונה היא סבירה, אך יש לבצע מעקב לוודא שלאחר ההחמרה הראשונה בתפקודי הכליה ערכי הקריאטינין מתייצבים
- יעד הטיפול הוא לחץ דם סיסטולי פחות מ-140 מילימטר כספית בתנאי שלחץ הדם הדיאסטולי לא נמוך מ-60 מילימטר כספית ובתנאי שהחולה סובל את לחץ הדם ואין לו נפילת לחץ דם תנוחתית[52]
- יעד של לחץ דם סיסטולי 150 עד 160 מילימטר כספית יכול להתקבל כסביר בחולי סוכרת מבוגרים שבריריים[53]
נספח ד. עקרונות הטיפול התזונתי בקשיש עם סוכרת
ד"ר ברוריה שר, איילת בירן, שולה ויטקו, יוספה כחל, פאינה צודיקוב, גילה פיימן, דורית יצחקי, פרופסור רונית אנדוולט
למזון חשיבות רבה, הן לצורכי הקיום והן כמענה לצרכים נפשיים, חברתיים, כלכליים ותרבותיים. לאכילה תפקיד מרכזי בגיל הזקנה והיא מהווה מקור חשוב ביותר להנאה, לבריאות לשימור הקוגניציה ולהיכרות עבור הקשיש.
בתהליך ההזדקנות חלים שנויים במערכת השלד והשרירים (ירידה במסת השריר), במערכת העיכול, הבליעה, הלעיסה, החושים והנשימה. שינויים פיזיולוגיים אלו המתרחשים במהלך ההזדקנות בכל מערכות הגוף, משפיעים על יכולתו של האדם להשיג מזון, להאכיל את עצמו, לעכל ולספוג את רכיבי התזונה ואף פוגעים במגוון המזונות שהקשיש יבחר עבורו.
הירידה בצריכת המזון של הקשיש חלה בשל צריכת תרופות רבות, בעיות כלכליות-חברתיות, בדידות, הפרעות פסיכיאטריות כמו דיכאון או דמנציה - כשזו האחרונה גורמת לשכחה לאכול או לאכילה ללא הפסקה שאינה מבוקרת. בצריכה לא מתאימה של מזון יכול להיווצר מצב של תזונה לקויה המתבטאת בשתי צורות: תת-תזונה (undernutrition) שיכול להיות כולל או של רכיבים תזונתיים ספציפיים וצריכת יתר של אנרגיה (Over nutrition) שגם היא יכולה להיות מלווה בחסרים תזונתיים. הטיפול ואיזון הסוכרת בקשישים מושפעת מכל השינויים הפיזיולוגים, הבריאותיים, הרגשיים והחברתיים שנזכרו ולכן יש חשיבות רבה למעקב וטיפול תזונתי מותאם.
המלצות אופרטיביות
הפנית הקשיש לדיאטנית-תזונאית לביצוע הערכה תזונתית מקיפה וטיפול תזונתי תעשה במקרים הבאים:
- חולה סוכרת מוכר במערכת - בתדירות של לפחות אחת לשנה
- לחולה סוכרת חדש מיד עם אבחון הסוכרת, ובהמשך מעקב לפחות אחת לשנה
- בכל שינוי מצב רפואי, תפקודי, קוגניטיבי או נפשי
- באירועי היפוגליקמיה חוזרים (בנוסף להתאמה תרופתית)
- במצב של היפרגליקמיה קיצונית
- במצבי סיכון תזונתיים:
- כאשר המטופל ירד 5 אחוזים ממשקלו בשלושה חודשים או 10 אחוזים בחצי שנה
- 22>BMI (Body Mass Index) במטופלים בגילאי 74.9-65 23>BMI במטופלים בגילאי +75
- במצב של סיכון תזונתי על פי ציון כלי סיקור (MNA, MUST)
- בכל מצב של שינוי טיפול תרופתי לסוכרת או לגורמי הסיכון הקרדיווסקולריים הנוספים כדוגמת שומני הדם ויתר לחץ דם
- על פי שיקול הדעת של הצוות המטפל
המטרות העיקריות בניהול הטיפול התזונתי בקשיש עם הסוכרת הן לקדם את בריאותו תוך מתן דגש על איכות החיים ומתן כבוד והעצמת המטופל.
הערכה תזונתית
הדיאטנית תבצע הערכה תזונתית מקיפה שתכלול קביעת אבחנה תזונתית ואיתור מצבי תזונה סיכוניים הכוללים: GLIM ,SGA, בדיקה פיזיקלית במיקוד תזונתי.
עקרונות הטיפול התזונתי
- התפריט יהיה מבוסס על תזונה מאוזנת ומגוונת כדוגמת הדיאטה הים תיכונית ויספק את כלל רכיבי התזונה הדרושים (מאקרו ומיקרו נוטריינטים) כולל נוזלים. כל זה בהתאמה אישית למצב הרפואי הכולל, בדיקות דם, טיפול תרופתי וכל מצבי הבריאות הנלווים כמו תפקוד כלייתי או מחלות נוספות
- תוכנית הטיפול התזונתי תותאם אישית ותתחשב במצבו הרפואי, התפקודי-קוגניטיבי, בטיפול התרופתי, הרגלי האכילה והעדפות המזון של הקשיש, מצבו הכלכלי, מוצאו ותרבותו וכן מקום מגוריו (בית מוסד וכדומה)
- הגבלה מזונות המכילים פחמימות פשוטות או כל הגבלה אחרת תעשה על פי סיכום ההערכה התזונתית ועל פי שיקול הדעת המקצועית של הדיאטן ובהתאם למצבו הרפואי והתזונתי הכולל
- מומלץ שהמטופל יגיע לדיאטן בליווי המטפל העיקרי שמסייע בחלק התזונתי
- יש לעודד שמירה על משקל גוף יציב
- יש להתאים את זמני מתן התרופות לארוחות
- יש לעודד קיום פעילות גופנית בהתאם ליכולתו של הקשיש עם הסוכרת
- הרכב התפריט ומרקם המזון יותאמו על פי מצב בריאות הפה, יכולת הלעיסה והבליעה
- במצבי תת-צריכה של אנרגיה וחלבון, מומלץ לתת תמיכה של מזון ייעודי כקו ראשון למניעת חסרים תזונתיים
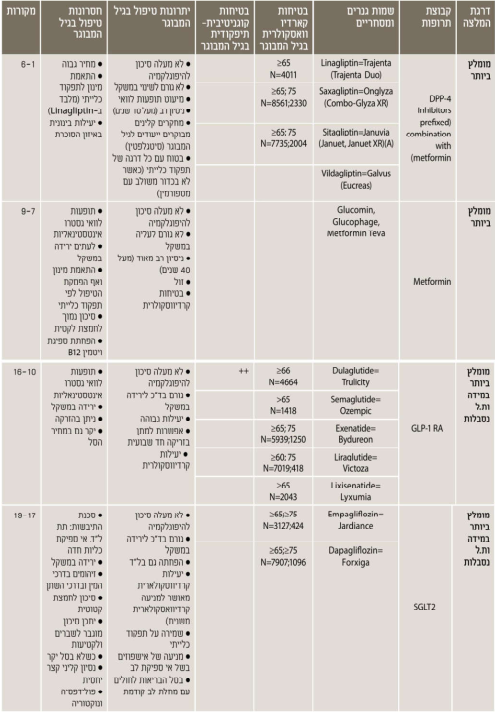
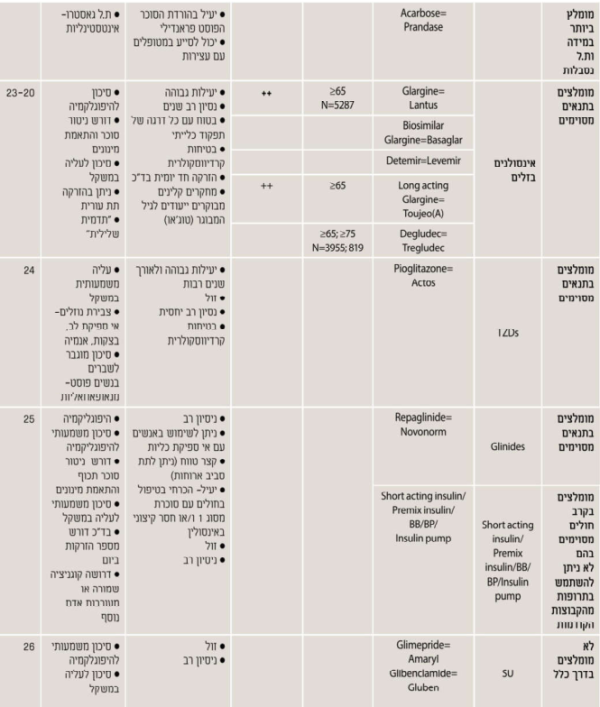
נספח ה. טיפול תרופתי - בחירת הטיפול התרופתי המומלץ לחולה המבוגר עם סוכרת
חשוב לזכור - האתגר עול הזדקנות בריאה עם סוכרת: הצעה להערכה וחלוקה תפקודית עול האדם המבוגר עם סוכרת לצורך קביעת יעדי האיזון ומתן המלצות לטיפול
- ל-25–30 אחוזים מהאוכלוסייה מעל גיל 65 יש סוכרת
- סוכרת היא מחלה של הזדקנות מואצת. לאנשים מבוגרים עם סוכרת סיכון גבוה יותר לליקויים קוגניטיביים וירידה תפקודית
- בגיל המבוגר שמירה על היכולות הקוגניטיביות, הפיזיות והתפקודיות הופכת להיות מטרה חשובה בטיפול בסוכרת
- הטיפול העצמי שהוא אבן יסוד בטיפול בסוכרת נפנע באנשים עם לקות קוגניטיבית
- באדם המבוגר עם סוכרת המתווה הטיפולי צריך להיקבע על פי מצבו התפקודי ולא על פי גילו הכרונולוגי
- החלוקה לפי רמת סיכון לירידה תפקודית תאפשר להתאים את הטיפול על פי יכולותיו של האדם המבונר עם סוכרת ולבנות תוכנית לשימור יכולותיו התפקודיות לאורך זמן
- החלוקה לרמת סיכון לירידה תפקודית תקבע על פי הכרות הצוות המטפל עם המטופל ועל ידי שימוש במבחנים קוגניטיביים ופיזיים
ביבליוגרפיה
- ↑ 1.0 1.1 Kirkman MS, Briscoe VJ, Clark N, Florez H, Haas LB, Halter JB, et al. Diabetes in older adults. Diabetes care. 2012/12;35(12):2650-64
- ↑ Rowe JW, Kahn RL. Human aging: usual and successful. Science. 1987/7/10,•237(4811):143-9
- ↑ Cukierman ד, Gerstein HC, Williamson JD. Cognitive decline and dementia in diabetes systematic overview of prospective observational studies. Diabetologia. 2005/12;48(12):2460-9
- ↑ Exalto LG, Whitmer RA, Kappele LJ, Biessels GJ. An update on type 2 diabetes, vascular dementia and Alzheimer's disease. ExpGerontol. 2012/11;47(11):858-64
- ↑ van den BE, Reijmer YD, de BJ, Kessels RP, Kappelle LJ, Biessels GJ. A 4 year follow-up study of cognitive functioning in patients with type 2 diabetes mellitus. Diabetologia. 2010/1,•53(1 ):58-65
- ↑ Biessels GJ. Sweet memories: 20 years of progress in research on cognitive functioning in diabetes. EurJPharmacol. 2013/7/17
- ↑ Park SW, Good paster BH, Strotmeyer ES, Kuller LH, Broudeau R, Kammerer C, et al. Accelerated loss of skeletal muscle strength in older adults with type 2 diabetes: the health, aging, and body composition study. Diabetes care. 2007/6;30(6):1507-12
- ↑ Volpato S, Ferrucci L, Blaum C, Ostir G, Cappola A, Fried LP, et al. Progression of lower-extremity disability in older women with diabetes: the Women's Health and Aging Study. Diabetes care. 2003/1;26(1):70-5
- ↑ Volpato S, Leveille SG, Blaum C, Fried LP, Guralnik JM. Risk factors for falls in older disabled women with diabetes: the worn- en’s health and aging study. JGerontolA BiolSciMedSci. 2005/12;60(12):1539-45
- ↑ Gregg EW, Mangione CM, Cauley JA, Thompson TJ, Schwartz AV, Ensrud KE, et al. Diabetes and incidence of functional disability in older women. Diabetes Care25(1):61-72002/1
- ↑ Feil DG, Zhu CW, Sultzer DL. The relationship between cognitive impairment and diabetes self-management in a popula- tion-based community sample of older adults with Type 2 diabetes. J Behav Med. 2012;35(2):190-9
- ↑ Sinclair AJ, Girling AJ, Bayer AJ. Cognitive dysfunction in older subjects with diabetes mellitus: impact on diabetes self-management and use of care services. All Wales Research into Elderly (AWARE) Study. Diabetes Research & Clinical Prac- tice50(3):203-12,. 2000/12
- ↑ BodenheimerT, Lorig K, Holman H, Grumbach K. Patient self-management of chronic disease in primary care. JAMA. 2002;288(19):2469-75
- ↑ Ganmore I, Schnaider Beeri M. Magnitude and trajectories of cognitive dysfunction in type 2 diabetes mellitus. Type 2 diabetes and dementia. Edited by:Velandai Srikanth and Zoe Arvanitakis. 2018 Elsevier Inc
- ↑ Ravona-Springer R, Heymann A, Schmeidler J, Moshier E, Godbold J, Sano M, et al. Trajectories in glycemic control over time are associated with cognitive performance in elderly subjects with type 2 diabetes. PL0S One. 2014;9(6):e97384
- ↑ Ravona-Springer R, Heymann A, Schmeidler J, Sano M, Preiss R, Koifman K, et al. The ApoE4 genotype modifies the of long- term glycemic control with cognitive functioning in elderly with type 2 diabetes. Eur Neuropsychopharmacol. 2014;24(8):1303- 8
- ↑ Guerrero-Berroa E, Ravona-Springer R, Heymann A, Schmeidler J, Levy A, Leroith D, et al. Haptoglobin genotype modulates the relationships of glycaemic control with cognitive function in elderly individuals with type 2 diabetes. Diabetologia. 2015;58(4):736-44
- ↑ Lutski M, Weinstein G, Goldbourt U, Tanne D. Cardiovascular health and cognitive decline 2 decades later in men with preexisting coronary artery disease. Am J Cardiol. 2018;121 (4):410-415
- ↑ Lutski M, Weinstein G, Goldbourt U, Tanne D. Insulin resistance and future cognitive performance and cognitive decline in elderly patients with cardiovascular disease. J Alzheimers Dis. 2017;57(2):633-643
- ↑ Weinstein G, Lutski M, Goldbourt U, Tanne D. Physical frailty and cognitive function among men with cardiovascular disease. Arch Gerontol Geriatr. 2018;78:1-6
- ↑ Meschia JF, Bushnell C, Boden-Albala B, Braun LT, Bravata DM, Chaturvedi S, et al. Guidelines for the primary prevention of stroke: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014;45(12):3754-832
- ↑ Smith EE, Saposnik G, Biessels GJ, Doubal FN, Fornage M, Gorelick PB, et al; prevention of stroke in patients with silent cerebrovascular disease: A Scientific Statement for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2017;48(2):e44-e71
- ↑ Ngandu T, Lehtisalo J, Solomon A, Levalahti E, Ahtiluoto S, Antikainen R, et al. A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER): a randomised controlled trial. Lancet. 2015;385(9984):2255-63
- ↑ Rosenberg A, Ngandu T, Rusanen M, Antikainen R, Backman L, Havulinna S. Multidomain lifestyle intervention benefits a large elderly population at risk for cognitive decline and dementia regardless of baseline characteristics: The FINGER trial. Alzheimers Dement. 2018;14(3):263-270
- ↑ Solomon A, Turunen H, Ngandu T, Peltonen M, Levalahti E, Helisalmi S, et al. Effect of the apolipoprotein E genotype on cognitive change during a multidomain lifestyle intervention: a subgroup analysis of a randomized clinical trial. JAMA Neurol. 2018;75(4):462-470
- ↑ Marengoni A, Rizzuto D, Fratiglioni L, Antikainen R, Laatikainen T, Lehtisalo J et al. The effect of a 2 year intervention con sisting of diet, physical exercise, cognitive training, and monitoring of vascular risk on chronic morbidity-the FINGER randomized controlled trial. J Am Med Dir Assoc. 2018; 19(4)355-360
- ↑ 27.0 27.1 27.2 27.3 Standards of Medical Care in Diabetes-2019: Older Adults (chapter 12). Diabetes care. 20!9;42(Suppl !):S139-S147
- ↑ Cappuccio FP, D'Elia L, Strazzullo P, Miller MA. Quantity and quality of sleep and incidence of type 2 diabetes: a systematic review and meta analysis. Diabetes Care 2010; 33:414
- ↑ von Ruesten A, Weikert C, Fietze I, Boeing H. Association of sleep duration with chronic diseases in the European Prospective Investigation into Cancer and Nutrition (EPIC)-Potsdam study. PL0S One 2012; 7:e30972
- ↑ McMullan CJ, Schernhammer ES, Rimm EB, et al. Melatonin secretion and the incidence of type 2 diabetes. JAMA 2013; 309:1388
- ↑ Ohayon MM. Epidemiology of insomnia: what we know and what we still need to learn. Sleep medicine reviews. 2002 Apr;6(2):97-111
- ↑ American Academy of Sleep Medicine. International classification of Sleep Disorders. 3. Darien, IL: American Academy of Sleep Medicine; 2014
- ↑ Li J, Vitiello MV, Gooneratne NS. Sleep in Normal Aging. Sleep Med Clin. 2018 Mar;13(1):1-11
- ↑ 34.0 34.1 Brewster G, Riegel B and Gehrman PR. Insomnia in the Older Adult. Sleep Med Clin. 2018 March; 13(1): 13-19
- ↑ Mai E, Buysse DJ. Insomnia: Prevalence, Impact, Pathogenesis, Differential Diagnosis, and Evaluation. Sleep medicine clinics. 2008; 3(2):167-174
- ↑ Kwatra V, Khan MA, Quadri SA, Cook TS. Differential Diagnosis and Treatment of Restless Legs Syndrome: A Literature Review.Cureus. 2018 Sep 13;10(9)
- ↑ Morin CM, Bootzin RR, Buysse DJ, Edinger JD, Espie CA, Lichstein KL. Psychological and behavioral treatment of insom- nia:update of the recent evidence (1998-2004) Sleep. 2006 Nov;29(11):1398-1414
- ↑ Sloane PD, Figueiro M, Cohen L. Light as Therapy for Sleep Disorders and Depression in Older Adults. Clinical geriatrics. 2008;16(3):25-31
- ↑ Sateia MJ, Buysse DJ, Krystal AD, Neubauer DN, and Heald JL. Clinical practice guideline for the pharmacologic treatment of chronic insomnia in adults: an American Academy of Sleep Medicine clinical practice guideline. J Clin Sleep Med 2017a; 13:307-349
- ↑ Atkin T, Comai S, Gobbi G. Drugs for Insomnia beyond Benzodiazepines: Pharmacology, Clinical Applications, and Discov- ery. Pharmacol Rev. 2018 Apr;70(2):197-245
- ↑ Schroeck JL, Ford J, Conway EL, Kurtzhalts KE, Gee ME, Vollmer KA and Mergenhagen KA. Reviews of Safety and Efficacy of Sleep Medications in Older Adults. Clin Ther 2016,vol 38(1 !):2340-2372
- ↑ Dujardi S, Pijpers A, Pevernagie D. Prescription Drugs Used in Insomnia. Sleep Medicine Clinics 2018 Jun;13(2):169-182
- ↑ Glass J, Lanctdt KL, Herrmann N, Sproule BA, Busto UE. Sedative hypnotics in older people with insomnia: meta-analysis of risks and benefits. BMJ. 2005,331 (7526):1169
- ↑ Chen LF, Lin CE, Chou YC, Mao WC, Chen YC, Tzeng NS. A comparison of complex sleep behaviors with two short-acting Z-hypnosedative drugs in nonpsychotic patients.Neuropsychiatr Dis Treat. 2013:9:1159
- ↑ Moore TJ, Mattison DR. Assessment of Patterns of Potentially Unsafe Use of Zolpidem. JAMA Intern Med. 2018,178(9):1275- 1277
- ↑ Tannenbaum C. Inappropriate benzodiazepine use in elderly patients and its reduction. Journal of Psychiatry & Neurosci- ence. 2015;40(3):E27-E28
- ↑ Lemoine P, Nir T, Laudon M and Zisapel N. Prolonged-release melatonin improves sleep quality and morning alertness in insomnia patients aged 55 years and older and has no withdrawal effects. J. Sleep Res. 2007,16,372-38
- ↑ Grossman E, Messerli FH. Diabetic and hypertensive heart disease. Ann Intern Med. 1996;125:304-10
- ↑ Cushman WC, Evans GW, Byington RP, Goff DC, Jr., Grimm RH, Jr., Cutler JA, Simons-Morton DG, Basile JN, Corson MA, Probst- field JL, Katz L, Peterson KA, Friedewald WT, Buse JB, Bigger JT, Gerstein HC, Ismail-Beigi F. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 2010;362:1575-85
- ↑ Wright JT, Jr., Williamson JD, Whelton PK, Snyder JK, Sink KM, Rocco MV, Reboussin DM, Rahman M, Oparil S, Lewis CE, Kim- mel PL, Johnson KC, Goff DC, Jr., Fine LJ, Cutler JA, Cushman WC, Cheung AK, Ambrosius WT. A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015;373:2103-16
- ↑ Williamson JD, Supiano MA, Applegate WB, Berlowitz DR, Campbell RC, Chertow GM, Fine LJ, Haley WE, Hawfield AT, lx JH, Kitzman DW, Kostis JB, Krousel-Wood MA, Launer LJ, Oparil S, Rodriguez CJ, Roumie CL, Shorr RI, Sink KM, Wadley VG, Whelton PK, Whittle J, Woolard NF, Wright JT, Jr., Pajewski NM. Intensive vs Standard Blood Pressure Control and Cardiovascular Disease Outcomes in Adults Aged >/=75 Years: A Randomized Clinical Trial. Jama. 2016;315:2673-82
- ↑ 52.0 52.1 Cardiovascular Disease and Risk Management: Standards of Medical Care in Diabetes-2019. Diabetes Care. .5123־42:5103',2019
- ↑ Solini A, Grossman E. What Should Be the Target Blood Pressure in Elderly Patients With Diabetes? Diabetes Care. 2016;39 Suppl 2:5234-43
- Leiter LA, Teoh H, Braunwald E, et al. Efficacy and safety of saxagliptin in older participants in the SAVOR TIMI 53 trial. Diabe tes care 2015;38(6):l145-53. doi: 10.2337/dcl4-2868 [published Online First: 2015/03/12]
- Hsieh CJ, Shen FC. The durability of sitagliptin in elderly patients with type 2 diabetes. Clin Interv Aging 2014;9:1905-11. doi: 10.2147/CIA.S72396 (published Online First: 2014/11/26]
- Bethel MA, Engel SS, Green JB, et al. Assessing the Safety of Sitagliptin in Older Participants in the Trial Evaluating Cardio- vascular Outcomes with Sitagliptin (TECOS). Diabetes care 2017;40(4):494-501. doi: 10.2337/dc16-1l35 [published Online First: 2017/01/07]
- Rosenstock J, Perkovic V, Johansen OE, et al. Effect of Linagliptin vs Placebo on Major Cardiovascular Events in Adults With Type 2 Diabetes and High Cardiovascular and Renal Risk: The CARMELINA Randomized Clinical Trial. JAMA 2018 doi: 10.1001/ jama.2018.18269 [published Online First: 2018/11/13]
- Hartley P, Shentu Y, Betz-Schiff P, et al. Efficacy and Tolerability of Sitagliptin Compared with Glimepiride in Elderly Patients with Type 2 Diabetes Mellitus and Inadequate Glycemic Control: A Randomized, Double-Blind, Non-lnferiority Trial. Drugs Aging 2015;32(6):469 76. doi: 10.1007/540266 015 0271 z [published Online First: 2015/06/05]
- Barzilai N, Guo H, Mahoney EM, et al. Efficacy and tolerability of sitagliptin monotherapy in elderly patients with type 2 diabetes: a randomized, double-blind, placebo-controlled trial. Curr Med Res Opin 2011;27(5):1049-58. doi: 10.1185/03007995.2011.568059 [published Online First: 2011/03/25]
- Orkaby AR, Cho K, Cormack J, et al. Metformin vs sulfonylurea use and risk of dementia in US veterans aged >/=65 years with diabetes. Neurology 2017,89(18):1877-85. doi: 10.1212/WNL.0000000000004586 [published Online First: 2017/09/29]
- Griffin SJ, Leaver JK, Irving GJ. Impact of metformin on cardiovascular disease: a meta-analysis of randomised trials among people with type 2 diabetes. Diabetologia 2017;60(9):1620-29. doi: 10.1007/500125-017-4337-9 [published Online First: 2017/08/05]
- Overbeek JA, Heintjes EM, Prieto-Alhambra D, et al. Type 2 Diabetes Mellitus Treatment Patterns Across Europe: A Popu- lation-based Multi-database Study. Clin Ther 2017;39(4):759-70. doi: 10.1016/j.clinthera.2017.02.008 [published Online First: 2017/03/28]
- Feher M, Vega-Hernandez G, Mocevic E, et al. Effectiveness of Liraglutide and Lixisenatide in the Treatment of Type 2 Diabetes: Real-World Evidence from The Health Improvement Network (THIN) Database in the United Kingdom. Diabetes Ther 2017;8(2):417-31. doi: 10.1007/513300-017-0241 -z [published Online First: 2017/03/11]
- Garvey WT, Mechanick JI, Brett EM, et al. AMERICAN ASSOCIATION OF CLINICAL ENDOCRINOLOGISTS AND AMERICAN COLLEGE OF ENDOCRINOLOGY COMPREHENSIVE CLINICAL PRACTICE GUIDELINES FOR MEDICAL CARE OF PATIENTS WITH OBESITYEXECUTIVE SUMMARYComplete Guidelines available at https://www.aace.com/publications/guidelines. Endocr Pract 2016;22(7):842-84. doi: 10.4158/EP161356.ESGL [published Online First: 2016/07/30]
- Gilbert MP, Bain SC, Franek E, et al. Effect of Liraglutide on Cardiovascular Outcomes in Elderly Patients: A Post Hoc Analysis of a Randomized Controlled Trial. Ann Intern Med 2018 doi: 10.7326/M18-1569 [published Online First: 2018/12/07]
- Holman RR, Bethel MA, Mentz RJ, et al. Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2017;377(13):1228-39. doi: 10.1056/NEJMoa1612917 (published Online First: 2017/09/15]
- Pfeffer MA, Claggett B, Diaz R, et al. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. N Engl J Med 2015;373(23):2247-57. doi: 10.1056/NEJMoa1509225 [published Online First: 2015/12/03]
- Cukierman-YaffeT, Gerstein HC, Colhoun HM, Diaz R, Garcia-Perez LE, Lakshmanan M, Bethel A, Xavier D, Probstfield J, Riddle MC, Ryden L, Atisso CM, Hall S, Rao-Melacini P, Basile J, Cushman WC, Franek E, Keltai M, Lanas F, Leiter LA, Lopez-Jara- millo P, Pirags V, Pogosova N, Raubenheimer PJ, Shaw JE, Sheu WH, Temelkova-KurktschievT. Effect of dulaglutide on cognitive impairment in type 2 diabetes: an exploratory analysis of the REWIND trial. Lancet Neurol. 2020 Jul;19(7):582-590. doi: 10.1016/ 51474-4422(20)30173-3. PMID: 32562683.
- Marso SP, Bain SC et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. NEJM. 2016: 375:19. Doi:10.1056/NEJMaa1607141. PMID 27633186
- Goda M, Yamakura T, Sasaki K, et al. Safety and efficacy of canagliflozin in elderly patients with type 2 diabetes mellitus: a 1-year post-marketing surveillance in Japan. Curr Med Res Opin 2017:1-9. doi: 10.1080/03007995.2017.1392293 [published Online First: 2017/10/14]
- Kambara T, Shibata R, Osanai H, et al. Use of sodium-glucose cotransporter 2 inhibitors in older patients with type 2 diabe- tes mellitus. Geriatr Gerontol Int 2017 doi: 10.1111/ggi.13149 [published Online First: 2017/09/02]
- Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2018 doi: 10.1056/NEJMoa1812389 [published Online First: 2018/11/13]
- Investigators OT, Gerstein HC, Bosch J, et al. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012;367(4):319-28. doi: 10.l056/NEJMoa1203858
- Marso SP, McGuire DK, Zinman B, et al. Efficacy and Safety of Degludec versus Glargine in Type 2 Diabetes. N Engl J Med 2017;377(8):723-32. doi: 10.1056/NEJMoa1615692 [published Online First: 2017/06/13]
- Yale JF, Aroda VR, Charbonnel B, et al. Glycaemic control and hypoglycaemia risk with insulin glargine 300 U/mL versus glargine 100 U/mL: A patient-level meta-analysis examining older and younger adults with type 2 diabetes. Diabetes Metab 2018 doi: 10.1016/j.diabet.2018.10.002 [published Online First: 2018/10/27]
- Ritzel R, Harris SB, Baron H, et al. A Randomized Controlled Trial Comparing Efficacy and Safety of Insulin Glargine 300 Units/mL Versus 100 Units/mL in Older People With Type 2 Diabetes: Results From the SENIOR Study. Diabetes care 2018;41(8):1672-80. doi: 10.2337/dc18-0168 [published Online First: 2018/06/14]
- Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovascular events in patients with type 2 diabe- tes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005;366(9493):1279-89. doi: 10.1016/50140-6736(05)67528-9 [published Online First: 2005/10/11]
- Group NS, Holman RR, Haffner SM, et al. Effect of nateglinide on the incidence of diabetes and cardiovascular events. N Engl J Med 2010;362(16):1463-76. doi: 10.1056/NEJMoa1001122 [published Online First: 2010/03/17]
- Control G, Turnbull FM, Abraira C, et al. Intensive glucose control and macrovascular outcomes in type 2 diabetes. Diabeto- logia 2009:52(1 !):2288-98. doi: 10.1007/S00125-009-1470-0
המידע שבדף זה נכתב על ידי
- ד"ר טלי צוקרמן־יפה, המרכז לטיפול וחקר סוכרת בגיל המבוגר, המכון האנדוקריני, המרכז הרפואי ע"ש שיבא, תל השומר. מרצה בכירה, החוג לאפידמיולוגיה, בית הספר לרפואה ע"ש סאקלר, אוניברסיטת ת"א
- ד"ר מיכל עצמון, המחלקה לפיזיותרפיה, אוניברסיטת אריאל ומרפאת סוכרת 3,600 לבני +60, המכון האנדוקריני, המרכז הרפואי ע"ש שיבא, תל השומר
- ד"ר עופרי מוסנזון, מנהלת המרכז למחקר קליני בסוכרת, היחידה לסוכרת, המחלקה לאנדוקרינולוגיה ומטבוליזם, בית החולים האוניברסיטאי הדסה עין כרם והפקולטה לרפואה באוניברסיטה העברית, ירושלים
- פרופסור חוליו ויינשטיין, מנהל היחידה לסוכרת, המרכז הרפואי האוניברסיטאי ע"ש אדית וולפסון, חולון ו-DMC
- פרופסור דויד טנה, מנהל מכון שבץ מוח וקוגניציה, הקריה הרפואית רמב"ם, חיפה. יו"ר האיגוד הנוירולוגי בישראל
- ד"ר לאה אהרוני, מומחית לרפואת משפחה וגריאטריה. יו"ר החוג לגריאטריה בקהילה של האיגוד הגריאטרי בישראל. מנהלת מרפאה מחוזית ליעוץ לחולים עם ירידה קוגניטיבית, קופ"ח מאוחדת, מחוז צפון
- פרופסור אלי מזרחי, מומחה בגריאטריה, פסיכוגריאטריה, מנהל המרכז הרפואי גריאטרי שמואל - הרופא, באר יעקב
- ד"ר יהודה באומל, מומחה בגריאטריה, רופא בכיר במרכז הרפואי גריאטרי שמואל - הרופא, באר יעקב
- ד"ר דליה שכטר, המחלקה לנוירולוגיה, המרכז הרפואי האוניברסיטאי ע"ש אדית וולפסון, חולון
פרופסור רונית אנדולט, מנהלת אנף התזונה, משרד הבריאות. חוקרת ומרצה בפקולטה למדעי הרווחה והבריאות, בית הספר לבריאות הציבור, אוניברסיטת חיפה
- ד"ר ברוריה שר, תזונאית האגודה לסוכרת נעורים (מסוג 1) בישראל, תזונאית מכוני סוכרת ורכזת סוכרת מחוזית בדימוס, מכבי שרותי בריאות
איילת בירן, דיאטנית ראשית, רשת 'בית בלב'
- שולה ויטקו, דיאטנית קלינית, מרפאת סוכרת מבוגרים, המרכז האוניברסיטי סורוקה, באר שבע
- דורית יצחקי, מנהלת המחלקה לתזונה בגיל השלישי, אגף התזונה, משרד הבריאות
- יוספה כחל, מנהלת המחלקה לתזונה בגיל השלישי בדימוס, אגף התזונה, משרד הבריאות
- פאינה צודיקוב, מרכזת בכירה לתזונה לאוכלוסיות עם צרכים מיוחדים, אנף התזונה, משרד הבריאות
- גילה פיימן, דיאטנית במכוני סוכרת, קופת חולים מאוחדת והמועצה הלאומית לסוכרת
- פרופסור אהוד גרוסמן, מנהל האגף הפנימי, המרכז הרפואי ע"ש שיבא, תל השומר
- פרופסור איתמר רז, יו"ר המועצה הלאומית לסוכרת


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק