כולסטרול LDL ודיסליפידמיה - מעודכן ל-2022 - LDL cholesterol and dyslipidemia
הופניתם מהדף המשמעות הקלינית של כולסטרול LDL לדף הנוכחי.
| LDL כולסטרול | ||
|---|---|---|
| LDL cholesterol | ||
| 250px | ||
Sample of Cholesterol
| ||
| שמות נוספים | Low-density lipoprotein | |
| יוצר הערך | פרופסור יעקב הנקין | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפרעה בשומני הדם
ראו גם – LDL כולסטרול - LDL cholesterol
הקדמה
הכולסטרול והטריגליצרידים הם חומרים הידרופובים (Hydrophobes, לא מתמוססים במים) ולכן מתניידים בדם בתוך חלקיקים הנקראים ליפופרוטאינים (Lipoproteins), בהם שני חומרים אלו עטופים במעטפה המכילה בעיקר פוספוליפידים (Phospholipids) וחלבונים (אפופרוטאינים, Apoproteins)[1]. קיימים חמישה ליפופרוטאינים עיקריים הנבדלים אחד מהשני בגודל, צפיפות, ריכוזי הכולסטרול והטריגליצרידים, וסוגי האפופרוטאינים הנמצאים במעטפת החלקיק. שני סוגי ליפופרוטאינים מכילים בעיקר טריגליצרידים עם יחסית מעט כולסטרול כילומיקרונים (Chylomicrons) ו-VLDL (Very-Low-Density Lipoprotein), שניים מכילים יחסית מעט טריגליצרידים והרבה כולסטרול LDL (Low-Density Lipoprotein) ו-HDL (High-Density Lipoprotein), ואחד המכיל כמויות דומות של כולסטרול וטריגליצרידים (IDL, Intermediate-Density Lipoprotein). ה-LDL הוא החלקיק העיקרי המעביר את הכולסטרול מהכבד ליתר אברי הגוף. חלקיק זה חיוני להתפתחות תקינה של האדם, אך במצבי עודף או כאשר הציפוי הפנימי של העורקים (שכבת האנדוטל, Endothelium) נעשה חדיר במיוחד, גם עם רמות "נורמליות" של כולסטרול בדם, עלולים חלקיקי ה-LDL לחדור לתוך דופן העורקים ולגרום לטרשת העורקים.
מחקרים רבים בחיות מעבדה, בחולים עם מוטציות גנטיות (Genetic mutations) הגורמות לעודף או מיעוט LDL בדם ומחקרים אפידמיולוגים הראו קשר חזק בין רמת ה-LDL כולסטרול בדם להתפתחות של מחלות כלי דם טרשתיות כגון אוטם שריר הלב. תעוקת חזה במאמץ, שבץ מוחי ואיסכמיה בגפיים בעקבות טרשת. מחקרי התערבות רבים הראו בצורה חד-משמעית שהפחתת רמת ה- LDL כולסטרול בדם באמצעים שונים (תזונתיים, תרופתיים ואפילו ניתוחיים) יכולה להפחית את שיעור האירועים הקרדיווסקולריים ב-30-20 אחוזים בהתאם לדרגת ההפחתה של רמת ה-LDL כולסטרול בדם. לאור מחקרים אלו מגדירים כל קווי ההנחיה הבינלאומיים את ה-LDL כולסטרול כמדד חשוב לצורך הערכת דרגת הסיכון של אדם ללקות בעתיד במחלת כלי דם טרשתית, וכיעד טיפול חשוב ביותר למניעת מחלות אלו גם באנשים בריאים וגם באנשים שכבר לוקים בטרשת עורקים.
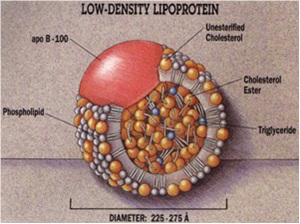
מבנה ה-LDL[2]
LDL מכיל באופן משקלי 80 אחוזים ליפידים ו-20 אחוזים חלבון, מכיל 4,536 חומצות אמינו, ומשקלו המולקולארי 514 אלף דלטון (Dalton)[2]. מכיוון שרמת החלבון בו גבוהה יחסית, החלקיק קטן יחסית [קוטר 21–25 ננומטר (Nanometer)], והוא בעל צפיפות גבוהה יותר (1.006 עד 1.063 גרם למיליליטר) בהשוואה לכילומיקרונים ול-VLDL. בערך 50 אחוזים מהליפיד הכלול בחלקיק LDL הוא כולסטרול. LDL מרכיב כ-50-40 אחוזים מכלל מסת הליפופרוטאינים בבני אדם, והוא הנשא העיקרי של כולסטרול בדם מהכבד לפריפריה. לחלקיק LDL גרעין מרכזי מאוד הידרופובי המורכב מחומצת שומן לינולאית (Linoleic) שהיא חומצת שומן בלתי רוויה, וכן מכיל גרעין ה-LDL בערך 1,500 מולקולות של כולסטרול-אסטר (Ester). גרעין החלקיק מוקף על ידי "קליפה" של פוספוליפידים וכולסטרול חופשי כמו גם עם עותק בודד של החלבון apoB-100. המשקל המולקולארי של LDL הוא כ-3 מיליון דלטון, אך כיוון שחלקיקי LDL מכילים מספר משתנה של חומצות שומן, ייתכנו חלקיקים שונים במסה ובגודל. רק במאה ה-21 ניתן היה לעשות מדידות מבניות של חלקיק LDL בטמפרטורת הגוף במצבו "הטבעי" על ידי שימוש במיקרוסקופ אלקטרוני בתנאי קירור (cryo-EM) בשיטה עם כושר רזולוציה של Å16. להלן תמונה סכמטית של מבנה חלקיק LDL:
החלבון (Apoprotein) העיקרי של LDL הוא apoB-100 ומהווה כ-95-90 אחוזים מכלל ה-apoB-100 בפלזמה. כל חלקיק LDL, כמו גם חלקיקי VLDL ו- IDL, מכיל מולקולת חלבון apoB-100 יחידה. מכיוון ששלושת ליפופרוטאינים אלו מהווים את הגורם העיקרי ליצירת טרשת עורקים, רמת ה-apo B100 בדם היא בקורלצייה ישירה למספר החלקיקים האטרוגנים (יוצרי טרשת עורקים) בדם ולסיכון ללקות בעתיד בטרשת עורקים.
LDL מתחלק לשני תת-סוגים: LDL1 ו-LDL2, על בסיס צפיפותם ומרחק נדידתם בצנטריפוגציה בתווך מתאים. מקטע LDL בעל הצפיפות הנמוכה יותר, בעל משקל סגולי של 1.006–1.109, עשיר יותר בליפידים מאשר מקטע LDL2 שמשקלו הסגולי 1.019–1.063. השוואה של שני תת-החלקיקים LDL1 ו-LDL2, מראה ב-LDL2 העלמות הדרגתית של גליצרידים ושל apoC ו-apoE המאפיינים יותר VLDL, והעשרה ב-apoB-100 ובכולסטרול אסטר. נמצא שחלקיק ה-LDL2 הקטן והצפוף יותר פעיל יותר מבחינה מטבולית, והוא אף יותר אתרוגני מאשר חלקיק LDL הגדול יותר והצפוף פחות. יתרה מזאת, מטופלים הסובלים ממחלת לב כלילית, או שנמצאים בסיכון מוגבר למחלה זו, הם בעלי אחוז גבוה יותר של חלקיקי LDL קטנים או בינוניים בגודלם.
הסיבה להיותם של חלקיקי LDL הקטנים מסוכנים יותר, נובעת מכך שהם מסוגלים בקלות יתר לחדור את שכבת האנדותל, שכן גודל המרווחים הנורמאליים באנדותל הוא של 26 ננומטר, כאשר קוטרם של החלקיקים הקטנים של LDL הוא 20.6–22.0 ננומטר. יש גם מתאם חיובי בין רמות מוגברות של טריגליצרידים ורמה מוגברת של חלקיקי LDL הקטנים והצפופים יותר. לעומת זאת, יש מתאם חיובי בין רמות טריגליצרידים נמוכות יותר, ורמות גבוהות יותר של חלקיקי LDL גדולים יותר ופחות צפופים.
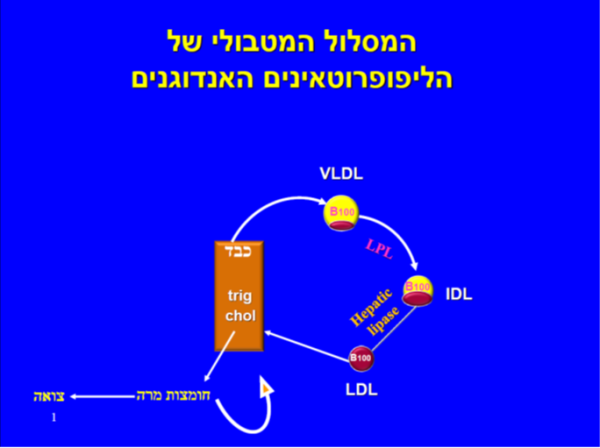
השלב הראשון של המטבוליזם של החלקיקים האנדוגנים (Endogenous) (VLDL, IDL ו-LDL) מתחיל ביצירת VLDL בכבד על ידי החדרה של כולסטרול וטריגליצרידים לליפופרוטאין בעזרת האנזים MTP (Microsomal Triglyceride transfer Protein). חלקיק ה-VLDL משתחרר לדם ומדי פעם נתקל באנזים Lipoprotein Lipase) LPL) אשר גורם לפרוק טריגליצרידים מהחלקיק. כתוצאה מכך ה-VLDL נעשה בהדרגה קטן וצפוף יותר, עם תכולה גדולה יותר של כולסטרול-אסטר עד אשר בשלב מסוים ריכוז הכולסטרול והטריגליצרידים משתווה פחות או יותר. החלקיק, שכעת נקרא IDL, ממשיך לאבד טריגליצרידים על ידי פעולה בכבד של אנזים הקרוי Hepatic lipase, עד שלבסוף נוצר החלקיק הקטן LDL שמכיל בעיקר כולסטרול. באנשים בריאים מהווים חלקיקי ה-LDL כולסטרול בערך 2/3 מסך הכולסטרול בפלזמה, ואילו בנשים צעירות (מתחת לגיל המעבר) רמת LDL נמוכה יותר מאשר בגברים באותו גיל, ואך זהה לאחר המנופאוזה לרמת LDL של גברים בגיל זהה.
חלקיק ה-LDL מעביר כולסטרול לכבד ולרקמות אחרות בגוף, שם הוא מנוצל לצורכי התא השונים, כגון יצירת ממברנות התא וסינתזה (Synthesis) של הורמונים מסוימים. חלק מהכולסטרול מאוחסן בכבד, חלקו ממוחזר חזרה ליצירת VLDL וחלקו משמש ליצירת מלחי מרה המופרשים למעי הדק ומסייעים בספיגת שומנים. חדירת חלקיקי LDL לתוך הרקמות יוצא לפועל כאשר הם נקשרים לקולטנים באמצעות Apo B100. קולטנים אלו מסונתזים על ידי תאי הכבד כאשר ריכוז הכולסטרול בתוך התא נמוך, וממוקמים על ממברנות התא הקולט באזורי גומחה הידועים כ-Coated pits והמרופדים בחלקם הציטופלזמתי (Cytoplasmic) ב-Clathrin. גומחות מצופות אלה עוברות אל תוך ציטופלזמת התא ביחד עם חלקיקי LDL הקשורים לקולטניהם, ונושאות את ה-LDL למבנים תוך תאיים הידועים כאנדוזומים (Endosomes), אשר נושאים אותם לליזוזומים (Lysosomes). בתוך הליזוזומים חל פירוק אנזימטי שמפרק את המרכיב החלבוני ApoB100 לחומצות אמינו בודדות. מרכיב הכולסטרול-אסטר של חלקיקי LDL אלה עובר הידרוליזה (Hydrolysis) על ידי ליפאזה חומצית ליזוזומאלית, ומולקולות כולסטרול חופשיות המשתחררות עוזבות את הליזוזום ומשמשים את צורכי התא. הקולטן עצמו חוזר לממברנת התא וממשיך להחדיר LDL לתוך תא הכבד פעמים רבות עד שנהרס. תאים מחוץ לכבד הם בעלי שיעור נמוך של סינתזת כולסטרול, כאשר הם מסתמכים בעיקר על הכולסטרול המתקבל מההידרוליזה המתוארת של חלקיקי LDL.
ריכוז ה-LDL בדם נקבע בעיקר על ידי כמות ופעילות הקולטנים שעל גבי ממברנות תאי הכבד. כמות הקולטנים מבוקרת על ידי שני מנגנונים עיקריים:
- מאגרי הכולסטרול בתוך תאי הכבד: כאשר ישנו ריכוז גבוה של כולסטרול התא מפחית את ייצור הקולטנים, מאידך, כאשר ריכוז הכולסטרול יורד באופן עצמוני או בעזרת השפעה של תרופות, תאי הכבד מגבירים את הסינתזה של הקולטנים ועל ידי כך מפחיתים את רמת ה-LDL בדם
- הכבד והמעי מייצרים חלבון הנקרא PCSK9 (Proprotein Convertase Subtilisin/Kexin type 9). חלבון זה נקשר לקולטני ה-LDL ומונע את מיחזורם לממברנה. למעשה חלבון ה-PCSK9 מפחית את ריכוזי הקולטן ל-LDL ועל ידי כך מעלה את רמת ה-LDL בדם
מתברר שהקולטנים ל-LDL הם בעלי זיקה לליפופרוטאינים המכילים ApoE ו-ApoB באותה מידה. LDL בפלזמה עובר פירוק ביעילות נמוכה בהרבה מזו שבמסלול התוך-תאי, ורק בריכוזי LDL גבוהים במיוחד בפלזמה, מתרחש תהליך משמעותי לסילוקם. אחד המנגנונים הללו מתרחש על ידי תאים בולענים דוגמת מקרופאגים (Macrophages), של המערכת הרטיקולו-אנדותליאלית (Reticuloendothelial system). כאשר ריכוזי LDL בפלזמה עולים, מקרופאגים אכן נכנסים לפעולה, וכאשר תאים אלה עמוסים בכולסטרול-אסטר הם מותמרים לתאי קצף (Foam cells), שהם מרכיבים קלאסיים של הרובד הטרשתי. בבני אדם, הערכות על כמות LDL בפלזמה המתפרק על ידי מערכת הקולטנים של LDL נעות בין 33 ל-66 אחוזים מכלל ה-LDL, כאשר יתרת ה-LDL מעוכלת על ידי המקרופאגים ומנגנונים בלתי ידועים נוספים.
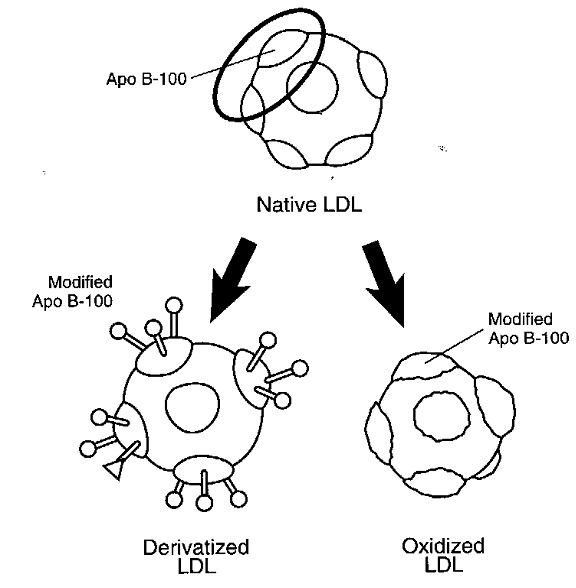
חלקו של LDL ביצירת הרובד הטרשתי[4]
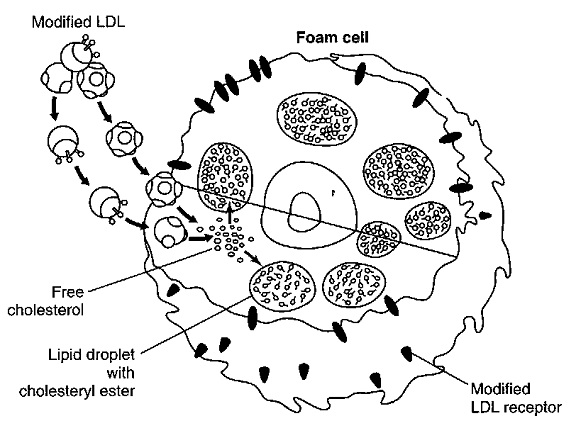
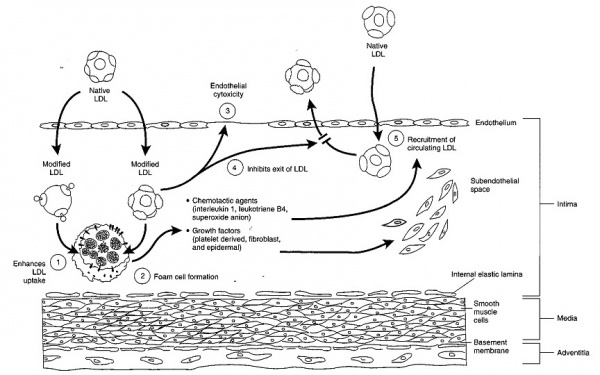
תהליך היצירה של טרשת עורקים מורכב משלבים מרובים שלא כולם עדיין מובנים, אך נתארם בקצרה[3]. במצב הבריא מצופים העורקים בשכבה חד תאית של תאים הנקראים תאי אנדוטל. בנוסף ליצירת שכבת מגן המונעת מחומרים בדם (כולל LDL) לחדור לתוך דופן התא, מייצרים תאי האנדוטל מספר רב של חומרים כימיים המווסתים את קוטר העורק והנטייה ליצור קרישי דם בהתאם לצורכי הגוף. כאשר ניזוקים תאי האנדוטל כתוצאה מהשפעת גורמי סיכון שונים (כגון רמת LDL גבוהה בדם, עישון, רמות גלוקוז גבוהות בדם, לחץ דם גבוה), מאמץ-גזירה מוגבר כתוצאה מזרימת דם מואצת מקומית, או קיום דלקת מקומית, נצמדים חלקיקי ה-LDL לדופן התא בעזרת חומרים הנקראים Adhesion molecules וחודרים לשכבה התת-אנדוטליאלית. כאשר חלקיקי ה-LDL עוברים שינוי כימי, ובעיקר חימצון, מזהה אותם הגוף כחומרים זרים בעלי פוטנציאל לגרום לנזק ומנסה לסלקם באמצעות תאי בולען הנקראים מקרופאגים שמקורם בתאים מונוציטים (Monocytes) מהדם.
תאי המקרופאגים "בולעים" את ה-LDL המחומצן באמצעות קולטנים לא בררניים המכונים Scavenger receptors. בתוך התא מתפרק ה-LDL והכולסטרול מצטבר בתא ויוצר תאי קצף. מכיוון שתאי הקצף מאבדים את כושר הנדידה שלם הם מצטברים בשכבה התת-אנדוטליאלית ומתחילים את תהליך היצירה של הרובד הטרשתי.
יצירת תאי קצף והצטברותם בשכבת ה-Tunica intima, הם הסממן המרכזי של השלבים המוקדמים של טרשת העורקים. מקובל שרוב תאי הקצף מקורם במקרופאגים נישאים בדם, אם כי אחדים מהם יכולים לנבוע גם מתאי שריר חלק, בעיקר אלה המכילים משקעי שומן בציטופלזמה שלהם. תהליך השגשוג של תאי שריר חלק מלווה על ידי סינתזה מוגברת של החלבונים התאיים Elastin, Collagen, וכן פרוטאוגליקנים (Proteoglycans), שתאים אלה מפרישים במתחם החוץ-תאי ברובד הטרשתי המתהווה. תאי הקצף המקרופאגיים המגויסים לדופן העורק, מספקים מקור עשיר של ציטוקינים קדם-דלקתיים (Pre-inflammatory cytokines), כֶמוֹקינים (Chemokines) ותווכים ליפידיים שונים. תאי קצף אלה מרתקים גם פעילות עשירה של מולקולות עתירות חמצן בעלות כושר חמצון גבוה כגון אניונים סופראוקסידיים (Superoxide anions), הצטברות זו של תווכי דלקת, מעודדת תהליכי דלקת ברובד הטרשתי הנוצר.
תוצאה עיקרית של התהליך הדלקתי ברובד הטרשתי המוקדם, היא נדידה של תאי שריר חלק משכבת ה-Tunica media לתוך שכבת ה-Intima. תאי שריר חלק אלה מתרבים וביחד עם תאי אנדותל ומונוציטים הם מפרישים אנזימי MMP (Matrix Metalloproteinases בתגובה לאיתותים חמצוניים, דלקתיים, המודינאמיים ואוטואימוניים (Autoimmune) שונים. מרכיבים אחדים של המשתית (Matrix) החוץ-תאית (Extracellular Matrix ,ECM), בעיקר פרוטאוגליקנים קושרים חלקיקים ליפופרוטאינים כגון LDL, מקבעים אותם ב-Tunica intima והופכים אותם זמינים יותר לשינויים על ידי תהליכי חמצון או גליקציה (Glycation) שתוארו למעלה. בהמשך יצטרפו לתהליך הטרשת טסיות-דם, משקעי Fibrin, גבישי כולסטרול ומרכיבי סידן, משקעי Hemosiderin, וכל אלה יתלכדו סביב גרעין של תהליך נמק בליבת החומר הטרשתי.
אין ספק בחשיבות ובמרכזיות של חלקיק ה-LDL באתחול יצירת הרובד הטרשתי, לכן גם מובנת ההתייחסות אל ריכוזי LDL גבוהים כגורם סיכון משמעותי בתהליך הטרשת העורקית.
המרכזיות של חלקיקי LDL בתהליכי טרשת העורקים, ובדיעבד בשלבים המתקדמים של היפרדות רבדים אלה (Rupture) ליצירת תסחיפים, וכן תהליכי יצירת פקקת בעורקים הכליליים, הופכת מרכיב ליפופרוטאיני זה לגורם סיכון מרכזי בתחלואה קרדיו-וסקולארית ולתמותה הנגרמת. הביטוי המרכזי לחשיבות LDL בפתולוגיה של כלי הדם, היא המרכזיות של משפחת הסטאטינים בטיפולים למניעה שניונית אך לא פחות במניעה פרופילקטית ראשונית, של אירועים קרדיו-וסקולאריים. מאז הופעתם בזירת הטיפולים למניעת מחלות לב וכלי-דם ב-1987, נחשבים הסטטינים (Statins) לתרופות הנצרכות ביותר בעשייה הרפואית, ולסיבה המובהקת לירידה המשמעותית בתחלואה ובתמותה קרדיו-וסקולארית בעולם כולו.
תרופות המפחיתות את רמת ה-LDL כולסטרול בדם[5]
הטיפול התרופתי להפחתת LDL כולסטרול בדם כולל 4 קבוצות של תרופות: סטטינים, Ezetimibe, מעכבי PCSK9 ופיטוסטרולים (Phytosterols). תרופות הסופחות מלחי מרה (רזינים, Resins) וחומצה ניקוטינית (Niacin) שהיו פופולריות בעבר כבר לא נמצאות לשימוש למטרה זו בישראל עקב ריבוי תופעות לוואי.
תרופות הבחירה הראשונות לטיפול בהיפרכולסטרולמיה משתייכות למשפחת הסטטינים. תרופות אלו מפחיתות את ייצור הכולסטרול בכבד על ידי עיכוב האנזים HMGCoA Reductase (3-Hydroxy-3-Methyl-Glutaryl-Coenzyme A) ועל ידי כך גורמות לתאי הכבד לייצר יותר קולטנים המושכים את ה-LDL מהדם לתוך הכבד. הטיפול בסטטינים יכול להפחית את רמת ה-LDL כולסטרול בכ-30–55 אחוזים בהתאם לסוג הסטטין ומינונו. בנוסף להפחתת רמת ה-LDL כולסטרול בדם מעכבות תרופות אלו את הייצור של חומרים כימיים נוספות שחלקם מגבירים תהליכים דלקתיים ונטייה לקרישת הדם. מחקרים מבוקרים רבים הוכיחו את היעילות של הסטטינים בהפחתת אירועים מגוונים הקשורים לטרשת עורקים, כגון אוטם שריר הלב, שבץ מוחי, אירועים איסכמיים בגפיים.
כאשר רמת ה-LDL כולסטרול בדם לא יורדת לערך המטרה על ידי סטטין בלבד ניתן להוסיף Ezetimibe. תרופה זו נקשרת בדפנות המעי לחלבון Nieman Pick C1 like protein) NPC1L1) ועל ידי כך מפחיתה את ספיגת הכולסטרול מהמעי למערכת הדם. אזטימיב לבד מפחית את רמת ה-LDL כולסטרול בדם בכ-15–20 אחוזים בלבד, אך בשילוב עם סטטין רמת ה-LDL כולסטרול בדם יכולה לרדת עד 50–65 אחוזים בהתאם למינון הסטטין. גם פיטוסטרולים (חומרים דמויי כולסטרול היוצרים בצמחים) מתחרים עם הכולסטרול על קשירתו ל-NPC1L1 ומפחיתים את ספיגת הכולסטרול מהמעי לדם, אם כי בעצימות פחותה מאשר Ezetimibe. יתרונם של הפיטוסטרולים הוא בעובדה שהם אינם נספגים מהמעי לדם ולכן הפוטנציאל לתופעות לוואי נמוך ביותר. חסרונם העיקריים הם בשיעור הירידה הנמוך יחסית של הירידה ב-LDL כולסטרול (10–15 אחוזים) ובעובדה שלא בוצעו מחקרים מבוקרים ארוכי-טווח שבדקו את יכולתם להפחית את שיעור התחלואה הקרדיווסקולרית.
מיעוט של המטופלים בסטטינים ו-Ezetimibe לא מגיע ליעד הטיפולי של LDL כולסטרול גם עם השילוב של סטטין ו-Ezetimibe, בין אם עקב העובדה שרמת ה-LDL כולסטרול ההתחלתית הייתה מאוד גבוהה או שהמטופל לא מסוגל לקבל מינון מלא של אחת התרופות בגין תופעות לוואי. במקרים אלו ניתן להוסיף תרופה המעכבת את האנזים PCSK9. אנזים זה מיוצר במעי ובכבד וגורמות לפירוק מוגבר של הקולטנים ל- LDL. התרופות Evolocumab (Repatha) ו-Alirocumab (Praluent) הן נוגדנים מונוקלונאלים (Monoclonal antibodies) כנגד החלבון, ניתנים בזריקה פעם בשבועיים ומסוגלים להפחית את רמת ה-LDL כולסטרול בעוד 50–60 אחוזים. בעזרת השילוב של סטטין, Ezetimibe ומעכב PCSK9 ניתן להפחית את רמת ה-LDL כולסטרול ליעד המטרה במרבית המטופלים.
לארגז הכלים התרופתי נוספו שתי תרופות חדשות: Inclisiran ו-Bempedoic acid. Inclisiran (Leqvio)[6] היא תרופה ממשפחת ה-Small interfering RNA (siRNA) הגורמת לעיכוב הסינתזה של PCSK9 בתאי הכבד. התרופה מכילה שני גדילים של RNA המחוברים למולקולת GalNAc (N-Acetylgalactosamine) אשר מנווטת את המולקולה ישירות לתוך הכבד, כך שתוך שעות ספורות מההזרקה התרופה נעלמת מזרם הדם. בתוך הכבד נקשר הגדיל לאתר הנקרא RISC וגורם לפירוק ה-RNA המייצר את החלבון PCSK9. יתרונה של התרופה הוא במשך הפעולה הארוך שלה, המאפשר מתן של התרופה בזריקה פעמיים בשנה והפחתת רמת ה-LDL כולסטרול ב־50–55 אחוזים. Bempedoic acid[7] היא תרופה המעכבת את הסינתזה של כולסטרול בכבד בדומה לסטטינים, אך מספר שלבים מוקדם יותר בשרשרת הייצור. יתרונה של התרופה בכך שהיא פעילה רק בתאי הכבד ולא בתאי השריר, ולכן אינה גורמת לכאבי שרירים.
במקרים נדירים, בעיקר בחולים עם המחלה הגנטית היפרכולסטרולמיה משפחתית, יש צורך להפחית את רמת ה-LDL כולסטרול בדם על ידי Pheresis של LDL כל שבוע-שבועיים.
מחקרי התערבות להפחתת רמת ה-LDL כולסטרול בדם[8][9]
מחקרי תצפית רבים הדגימו קשר ישיר בין רמת ה-LDL כולסטרול בדם למחלות כלי דם טרשתיות שונות, אך עיקר ההוכחה של חשיבותו של LDL בתהליך טרשת העורקים נובעת ממחקרים רבים שהוכיחו בצורה חד-משמעית שהפחתת רמת ה-LDL כולסטרול בדם באמצעים מגוונים לוותה בירידה ותחלואה ממחלות כלי הדם הטרשתיות השונות בלב, מוח והגפיים. עד שנות השמונים של המאה הקודמת השתמשו במחקרים אלו בתרופות ישנות (שכבר לא נמצאות בשימוש בארץ) כגון רזינים סופחי מלחי מרה וחומצה ניקוטינית (Niacin). אפילו מחקר שהפחית את רמת הכולסטרול בדם על ידי ניתוח לקיצור המעי (שהוביל לירידה בספיגת כולסטרול מהמעי) הדגים ירידה בתחלואה הקרדיווסקולרית. אולם התרופות שהדגימו את הירידה הבולטת ביותר בתחלואה ותמותה ממחלות כל דם טרשתיות היו הסטטינים. המחקר הראשון שהדגים ירידה בתחלואה ותמותה ממחלות אלו, מחקר ה-The Scandinavian Simvastatin Survival Study) ,4S), שפורסם בשנת 1994, השווה טיפול ב-Simvastatin לעומת פלצבו ב־4444 חולים עם מחלת לב כלילית למשך 5.4 שנים[5]. הטיפול ב-Simvastatin הפחית את התחלואה ממחלות לב כליליות ב-36 אחוזים ואת התמותה ב־30 אחוזים. בהמשך פורסמו מחקרים נוספים עם סטטינים שונים (בהשוואה לפלצבו) בקבוצות חולים ובריאים עם מאפיינים שונים שהדגימו תוצאות דומות. מחקרים מאוחרים יותר (דוגמת ה PROOVE-IT מ-2004[3] וה-TNT מ-2005[3]) השוו בין סטטין במינון נמוך לסטטין במינון גבוה, והוכיחו שככל שרמת ה-LDL כולסטרול ירדה יותר, כך ירדה התחלואה והתמותה ממחלות כליליות, שבץ מוחי ומחלות כלי דם טרשתיות אחרות[6][7].
במטה-אנאליזה של 26 מחקרים שכללה 190000 נבדקים שטופלו בממוצע במשך כ־5 שנים נמצא שטיפול בסטטין בהשוואה לטיפול בפלצבו הפחית את האירועים ממחלות כלי דם טרשתיות בכ-21 אחוזים עבור כל הורדת ה-LDL כולסטרול של 48 מ"ג(מיליגרמים)/ד"ל(דציליטר), וירידה נוספת של 28 אחוזים עבור כל הורדת ה-LDL כולסטרול של 48 מ"ג/ד"ל בהשוואה של סטטין בעצימות גבוהה לעומת סטטין בעצימות נמוכה. הטיפול בסטטין נמצא יעיל בגברים ונשים, צעירים ומבוגרים, עם ובלי מחלת כלי דם טרשתית[8].
בשלב הבא נבדק האם תוספת של Ezetimibe או מעכבי PCSK9 תוביל לירידה נוספת בתחלואה הקרדיווסקולרית בחולים המטופלים בסטטין. במחקר IMPROVE-IT נמצא שהשילוב של Ezetimibe עם 40 מ"ג סימבסטטין הוביל לירידה נוספת בתחלואה הקרדיווסקולרית בחולים לאחר אירוע כלילי חד בהשוואה ל-Simvastatin לבד[9]. המחקרים FOURIER ו-ODYSSEY הדגימו שהתוספת של מעכבי PCSK9 לחולים עם מחלת כלי דם טרשתית שטופלו בסטטינים (רובם במינון גבוה) הביאה לירידה נוספת בתחלואה הקרדיווסקולרית בהשוואה לסטטינים לבד[10]. מחקרים אלו גם הראו שככל שרמת ה-LDL כולסטרול ירדה יותר, עד ערכים סביב 25 מ"ג/ד"ל, כך ירד שיעור התחלואה ללא עליה בשיעור תופעות הלוואי.
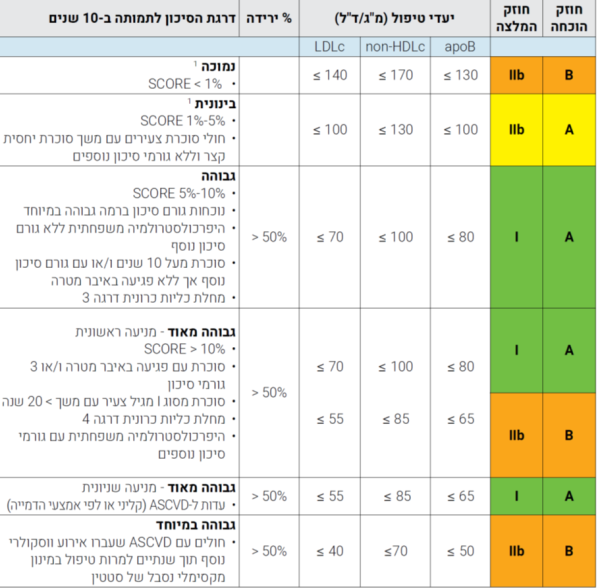
קווי ההנחיה לטיפול בדיסליפידמיה[10]
קווי הנחיה לטיפול במצבים של עודף כולסטרול ו/או טריגליצרידים בדם (להלן דיסליפידמיה) נכתבים בדרך כלל כל 3–5 שנים על ידי קבוצות חוקרים המייצגות את שלל המקצועות הרפואיים המטפלים במצבים הנגרמים על ידי מחלות כלי דם טרשתיות. קבוצות חוקרים אלו סוקרות את המידע הרפואי הרלוונטי שהתווסף מאז קווי ההנחיה הקודמים ומנסחים המלצות לבירור וטיפול בבעיות מטבוליות אלו. קווי ההנחיה הישראלים האחרונים פורסמו בשנת 2020 על ידי ועדה שכללה נציגים מטעם החברה הישראלית לחקר, מניעה וטיפול בטרשת עורקים; האיגוד הקרדיולוגי בישראל; האיגוד הישראלי לרפואה פנימית, האיגוד הנוירולוגי בישראל, איגוד רופאי המשפחה בישראל והעמותה למאבק ביתר כולסטרול משפחתי. הוועדה אימצה את עקרונות קווי ההנחיה של האיגודים הקרדיולוגים האירופאים והאמריקאים וניסתה להתאימן לתנאי הארץ. כעקרון קווי ההנחיה כוללים 3 חלקים עיקריים: חישוב דרגת הסיכון של המטופל לעבור אירוע כלי דם טרשתי עתידי, קביעת יעדי טיפול של LDL כולסטרול במצבים שונים, וקביעת אמצעי הטיפול התזונתיים והתרופתיים במצבים השונים.
חישוב דרגת הסיכון לאירוע כלי דם טרשתי עתידי: היכולת של LDL לחדור לתוך דופן העורק וליצור רבדים טרשתיים מושפעת מקיומם של גורמי סיכון המזרזים (או מפחיתים) יכולת חדירה זו. גורמי הסיכון העיקריים כוללים את גיל הנבדק, מגדר, עישון, לחץ הדם, סוכרת, רמת ה-LDL כולסטרול ורמת ה- HDL כולסטרול (האחרון מהווה גורם "מגן" מפני טרשת עורקים). ניתן לחשב את ההסתברות הסטטיסטית לאירוע קרדיווסקולרי עתידי באמצעות נוסחאות המתרגמות מידע זה לאחוז הסיכון לאירוע ו/או מוות ממחלת כלי דם טרשתית במהלך עשר השנים הקרובות או במהלך חייו של המטופל.[11] בנוסף לרשימת גורמי הסיכון העיקריים ישנה רשימה ארוכה של גורמי סיכון "מסייעים" המגבירים את הסיכון המחושב על ידי הנוסחה. התוצאה מתורגמת לדרגות סיכון בצורה הבאה:
קיימים מספר מצבים רפואיים בהם הסיכון לאירוע עתידי הוא גבוה או גבוה מאוד מלכתחילה ולכן לא דורשים חישוב של הסיכון: קיום טרשת עורקים מוכחת על סמך אירוע קליני בעבר או ממצא הדמייתי, סוכרת, אי-ספיקת כליות בדרגה בינונית או יותר, רמת LDL כולסטרול מעל 190 מ"ג/ד"ל עקב היפרכולסטרולמיה משפחתית או סיבה אחרת, יתר לחץ דם מאוד גבוה ולא מאוזן, ורמת Lipoprotein a מעל פי 6 מהנורמה.
כאשר קיימת התלבטות האם דרגת הסיכון המחושבת מצדיקה טיפול תרופתי, ניתן להיעזר באמצעי הדמיה כגון CT (Computer Tomography) חזה או Ultrasound של עורקי הצוואר לזיהוי טרשת סמוייה. הוכחה לקיום טרשת מגבירה את הסיכון לאירוע עתידי.
קביעת יעדי הטיפול של LDL כולסטרול נקבעת על סמך רמת ה-LDL כולסטרול בדם (לפני טיפול תרופתי) בהתחשב בדרגת הסיכון המחושבת של המטופל. לכן בדרגות הסיכון הנמוכה והבינונית ניתן לשקול (אך לא חובה) להפחית את רמת ה-LDL כולסטרול לפחות מ־140 מ"ג/ד"ל ו- 100 מ"ג/ד"ל בהתאמה. לעומת זאת בדרגת סיכון גבוהה קיימת המלצה ברורה להפחית את ה-LDL כולסטרול לפחות מ־70 מ"ג/ד"ל ובדרגת הסיכון הגבוהה מאוד לפחות מ־55 מ"ג/ד"ל. בשני המצבים האחרונים מומלץ להפחית את רמת ה-LDL כולסטרול לפחות ב-50 אחוזים.
טיפול תזונתי להפחתת LDL כולסטרול בדם: כעקרון כל מאכל המכיל שומן מהחי (שומן רווי) מעלה את רמת ה-LDL כולסטרל בדם, רשימת המאכלים כוללת בשר שמן (בעיקר בשר מעובד) מוצרי חלב עתירי שומן, חמאה וגם מאכלים המכילים ריכוז גבוה של שומן מסוג טרנס, כגון מרגרינה מוקשית. מאכלים עתירי כולסטרול, כגון ביצים ומאכלי ים, מעלים את רמת ה-LDL כולסטרול בדם פחות מאשר שומן רווי בתזונה. פירוט מלא יותר של השפעת מזונות שונים על רמת הכולסטרול בדם (ותחלואה קרדיווסקולרית) ניתן למצוא בנייר העמדה של האיגוד הקרדיולוגי בישראל ועמותת עתיד [12].
הטיפול התרופתי להפחתת LDL כולסטרול בדם כולל 4 קבוצות של תרופות: סטטינים, Ezetimibe, מעכבי PCSK9 ופיטוסטרולים (Phytosterols). תרופות הסופחות מלחי מרה וחומצה ניקוטינית שהיו פופולריות בעבר כבר לא נמצאות לשימוש למטרה זו בישראל עקב ריבוי תופעות לוואי.
תרופות הבחירה הראשונות לטיפול בהיפרכולסטרולמיה הם הסטטינים. כאשר רמת ה-LDL כולסטרול בדם לא יורדת לערך המטרה על ידי סטטין בלבד ניתן להוסיף Ezetimibe. במטופלים הנמצאים בדרגת סיכון גבוהה אשר לא מגיעים ליעד הטיפולי של LDL כולסטרול עם השילוב של סטטין ו-Ezetimibe, בין אם עקב העובדה שרמת ה-LDL כולסטרול ההתחלתית הייתה מאוד גבוהה או שהמטופל לא מסוגל לקבל מינון מלא של אחת התרופות בגין תופעות לוואי, ניתן לשקול תוספת של תרופה המעכבת את האנזים PCSK9. בעזרת השילוב של סטטין, Ezetimibe ומעכב PCSK9 ניתן להפחית את רמת ה-LDL כולסטרול ליעד המטרה במרבית המטופלים. במקרים נדירים, בעיקר בחולים עם המחלה הגנטית היפרכולסטרולמיה משפחתית, יש צורך להפחית את רמת ה-LDL כולסטרול בדם על ידי Pheresis של LDL כל שבוע-שבועיים.
ביבליוגרפיה
- ↑ Peter O Kwiterovich. The metabolic pathways of high-density lipoprotein, low-density lipoprotein, and triglycerides: a current review. The American Journal of Cardiology . 2000; 86 Supplement 1, : 5-10
- ↑ 2.0 2.1 Prassl, R., Laggner, P. Molecular structure of low density lipoprotein: current status and future challenges. Eur Biophys J 38, 145 (2009). https://doi.org/10.1007/s00249-008-0368-y
- ↑ 3.0 3.1 3.2 3.3 Joseph L.Goldstein, Michael S.Brown. Atherosclerosis: The low-density lipoprotein receptor hypothesis. Metabolism 1977; 26: 1257-1275
- ↑ Erling Falk, Pathogenesis of Atherosclerosis. J Am Coll Cardiol 2006;47:C7–12
- ↑ 5.0 5.1 Zeljko Reiner, Alberico L. Catapano et al. ESC/EAS Guidelines for the management of dyslipidaemias. European Heart Journal (2011) 32, 1769–1818 doi:10.1093/eurheartj/ehr158
- ↑ 6.0 6.1 Neil C. Henney, Maciej Banach, Peter E. Penson. RNA Silencing in the Management of Dyslipidemias. Current Atherosclerosis Reports 2021:23: 69
- ↑ 7.0 7.1 Kausik K. Ray et al. Safety and Efficacy of Bempedoic Acid to Reduce LDL Cholesterol. N Engl J Med 2019; 380:1022- 32 DOI: 10.1056/NEJMoa1803917
- ↑ 8.0 8.1 Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90 056 participants in 14 randomised trials of statins. 2005; 366: 1267-1278
- ↑ 9.0 9.1 Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet (London, England), 08 Nov 2010, 376(9753):1670-1681. DOI: 10.1016/s0140-6736(10)61350-5
- ↑ 10.0 10.1 הנחיות ישראליות לטיפול בדיסליפידמיה
- ↑ SCORE Risk Charts
- ↑ המלצות תזונתיות למניעת מחלות קרדיווסקולריות - נייר עמדה
המידע שבדף זה נכתב על ידי פרופסור יעקב הנקין, מנהל המערך האמבולטורי של המערך הקרדיולוגי והשרות לקרדיולוגיה מניעתית וטיפול בכולסטרול ושומני הדם, המרכז הרפואי האוניברסיטאי סורוקה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק