השתלות מח עצם בממאירויות המטולוגיות - Bone marrow transplants in hematological malignancies
הופניתם מהדף השתלות מח עצם בממאירויות המטולוגיות לדף הנוכחי.
| השתלות מח עצם בממאירויות המטולוגיות - עקרונות בסיסיים וכיוונים עתידיים | ||
|---|---|---|
| Bone marrow transplants in hematological malignancies | ||
| 250px | ||
שתל של מח עצם.
| ||
| יוצר הערך | ד"ר רון רם ופרופסור אביחי שמעוני | |
מבוא
השתלת מח עצם היא פעולה בעלת יכולת ריפוי פוטנציאלית למספר רב של ממאירויות המטולוגיות ומחלות המטולוגיות שאינן ממאירות. מקובל לחלק את ההשתלות לשני סוגים:
- השתלת מח עצם עצמית - תאי האב של החולה הם המקור לתאי האב. השתלה זו מבוצעת לאחר טיפול כימותרפי ראשוני, ולאחר השגת תגובה ראשונית של המחלה. אז מתבצע איסוף תאי אב. תאי אב אלה מוקפאים לשימוש עתידי. מטרת הטיפול המכין בהשתלה זו לגרום להרס של תאי מחלה אשר טיפול כימותרפי טרם להשתלה לא גרם להרס מספק שלהם. לפי עיקרון אונקולוגי בסיסי, ככל שמינון הכימותרפיה שיינתן גבוה יותר, כך יש סיכוי רב יותר להרס תאים סרטניים. ברם, פעמים רבות מתן הטיפול הכימותרפי מוגבל ונובע מדיכוי משמעותי וממושך של מח עצם ותופעות לואי הקשורות לדיכוי זה. מכיוון שבהשתלת מח עצם מעורה לאחר הטיפול המכין שתל המכיל תאי אב, הדיכוי של מח עצם הוא מוגבל בזמן - דבר המאפשר שימוש במינונים גבוהים יותר של כימותרפיה עם או בלי קרינה. השתלת מח עצם עצמית מתבצעת לרוב בחולים עם לימפומה אשר נשנתה או הגיבה חלקית לטיפול כימי. בחולים צעירים עם לימפומה מסוג T, לימפומה מסוג Mantle cell או עם מיאלומה נפוצה, במחלות אלו מקובל לבצע השתלת מח עצם עצמית כבר לאחר קו טיפול ראשון
- השתלת מח עצם מתורם - מקורם של תאי האב הוא מבן משפחה או מתורם זר. בהשתלה מסוג זה, נוסף על היתרון של טיפול במינון גבוה טרם ההשתלה, יש שימוש במערכת חיסון עם יכולת פוטנציאלית נגד התאים הממאירים. השתלה זו מתבצעת לרוב בחולים עם לוקמיה חריפה בדרגת סיכון בינונית או גבוהה או בחולים עם מחלות המטולוגיות שונות שאינן מגיבות כהלכה לטיפול כימי סטנדרטי
בשנת 2013 חצה לראשונה מספר מושתלי מח עצם בעולם את סף המיליון. רק בשנת 2014 דווחו לארגון ההשתלות האירופי (EBMT - European Society for Blood and Marrow Transplantation) כ-36,500 השתלות, מהן 21,000 השתלות מח עצם עצמיות ו-15,500 השתלות מח עצם מתורם (www.ebmt.org). במדינת ישראל מבצעים כ-700 השתלות בשנה, מהן כ-300 השתלות מח עצם מתורם.
השתלת מח עצם היא תהליך מורכב אשר מורכב מכמה שלבים:
- בחינת מקרה החולה והחלטה שבמחלתו יש יתרון להשתלת מח עצם על פני טיפולים חלופיים. במקביל, מתבצעת הערכה של מחלות הרקע של החולה ותפקוד האיברים השונים. הערכה הזאת מסוכמת ב-Comorbidity index ומהווה בסיס להחלטות טיפוליות בהמשך [1]
- בחירת הטיפול המכין להשתלה - טיפול היכול לכלול כימותרפיה, קרינה, נוגדנים או שילוב של הנזכר למעלה
- בחירת השתל - ניתן להשתמש בתאי אב שנלקחים מדם היקפי (לאחר טיפול בגורמי צמיחה, GCSF - Granulocyte colony stimulating factor, הגורם להוצאת תאי האב ממח העצם), ממח העצם עצמו ומחבל טבור. כאשר מדובר בהשתלה מתורם, בחירת מקור השתל מתבצעת על סמך בדיקת סיווג רקמות - בדיקה של מספר חלבונים הנמצאים על קרומי התאים של התורם ושל מקבל השתל. התאמה מלאה בין חלבונים אלה קשורה גם לקליטת השתל וגם למניעת סיבוכים הקשורים בפעילות יתר של השתל
- אשפוז החולה, מתן הטיפול המכין, ביצוע ההשתלה עצמה שהיא מתן של תאי האב ישירות לווריד ומעקב אחר סיבוכים מיידיים
- שחרור החולה לביתו והמשך מעקב אמבולטורי כדי להמשיך ולנטר את התגובה לטיפול ואת תופעות הלוואי המאוחרות
בתהליך מורכב זה משתתפים אנשי צוות רבים הכוללים את צוות הרופאים המטפלים והיועצים השונים, מתאמת השתלות והמעבדה לסיווג רקמות, הצוות הסיעודי הדואג לנטר ולטפל בסיבוכים המיידיים והמאוחרים, והצוות לטיפול תומך (עובד סוציאלי, פסיכולוג, מרפא בעיסוק ופיזיותרפיסט) להם תפקיד חשוב ביצירת מערכת תומכת. אך אל לנו לשכוח גם את התפקיד המשמעותי ביותר של החולה ומשפחתו אשר נושאים בעול הטיפול, לעתים במשך חודשים ארוכים. שילוב מוצלח בין כל הגורמים הללו תורם בצורה משמעותית להצלחת ההשתלה.
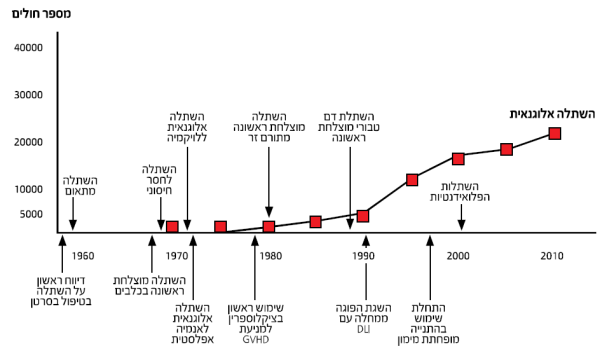
הניסיונות הראשונים בביצוע השתלות מתורם בוצעו בשנות ה-50 של המאה הקודמת. ב-1957 דיווח דונל תומס על התוצאות הראשונות של השתלות מח עצם מתורם בשישה חולים עם לוקמיה חריפה עמידה לטיפול, אשר עברו השתלת מח עצם מתורם. רק חולה אחד מתוך השישה שרד כמה חודשים, ובבדיקת מח העצם שלו נצפו תאי תורם לאורך זמן ממושך [2]. רק לקראת סוף שנות ה-70, כאשר הטכנולוגיה של סיווג רקמות התפתחה, ביצוע ההשתלות הפך להיות בטיחותי יותר. השתלות מח עצם בוצעו לראשונה בישראל בתחילת שנות ה-80 בבית חולים הדסה, בראשותו של פרופסור סלאבין, ומבוצעות במרכזים רבים ברחבי מדינת ישראל[3]. תרשים מספר 1 מתאר את מספרי החולים שעברו השתלת מח עצם מתורם ואת התפתחות השיטות השונות במהלך השנים.
במאמר זה נסקור את העקרונות הבסיסיים וההתפתחות של כל אחד מהשלבים בביצוע ההשתלה ונסקור כיוונים עתידיים ושיטות חדשות.
בחירת הטיפול המכין
השתלת מח עצם עצמית
מטרת הטיפול המכין בהשתלת מח עצם עצמית היא אחת - הרס של מספר רב של תאים סרטניים. ישנם משלבים שונים של טיפול, אולם הטיפול המכין שבמרבית המרכזים מקובל לתת לחולי מיאלומה נפוצה הוא Melphalan (Alkeran) במינון גבוה. בלימפומה הטיפול מבוסס על פרוטוקול BEAM (Carmustine, Etoposide, Cytarabine, Melphalan). במספר עבודות קודמות לא נמצא שפרוטוקולים אגרסיביים יותר (לדוגמה, שילוב של TBI והעלאת מינון Melphalan) שיפרו את תוצאות ההשתלה [4]. עם זאת, במחלות כמו לימפומה של מערכת העצבים המרכזית, השתלות מח עצם עצמיות בעבר לא הראו יעילות גבוהה, אולם שילוב של תרופות חדשות, כמו Thiotepa, שיפרו בצורה משמעותית את התוצאות ארוכות הטווח[5]. מספר קבוצות בעולם מנסות לשלב, בנוסף לפרוטוקולים הסטנדרטיים, טיפול בנוגדנים או ברדיואיזוטופים במהלך הטיפול המכין. נראה ששילובים אלה מיטיבים את התגובה ויש להם יתרון משמעותי, בעיקר בחולים עם תגובה חלקית לטיפול לפני ההשתלה.
השתלת מח עצם מתורם
מטרת הטיפול המכין בהשתלת מח עצם מתורם היא כפולה - ראשית, לגרום להרס של תאי מחלה אשר טיפול כימותרפי לפני ההשתלה לא הרס. לפי עיקרון אונקולוגי בסיסי, ככל שמינון הכימותרפיה גבוה יותר, כך יש סיכוי רב יותר להרס תאים סרטניים. מכיוון שבהשתלת מח עצם מעורה לאחר הטיפול המכין שתל המכיל תאי אב, הדיכוי של מח העצם הוא מוגבל בזמן - דבר המאפשר שימוש במינונים גבוהים יותר של כימותרפיה וקרינה. שנית, הטיפול המכין גורם לעיכוב פעולתם של לימפוציטים של החולה, שפעולתם קשורה בדחיית השתל. לפיכך, בהשתלה של בחור צעיר עם לוקמיה חריפה פעילה שלא הגיבה כהלכה לטיפול כימותרפי קודם, נשתמש בשתי זרועות הטיפול המכין - טיפול זה יכיל גם מינוני כימותרפיה/קרינה גבוהים וגם עיכוב פעולת לימפוציטים של החולה. לעומת זאת, במטופל מבוגר שמחלתו בהפוגה מלאה ואין עדות למחלה שרידית, יש צורך בעיקר בדיכוי הלימפוציטים כדי למנוע את דחיית השתל ופחות צורך בהרס תאים ממאירים, ופעולת ההשתלה מתבססת באופן מוחלט על אפקט השתל נגד המחלה. לפיכך מקובל להפריד בין טיפול מכין שהוא מיאלואבלטיבי (גורם נזק בלתי הפיך לתאי האב במח העצם) לבין טיפול מופחת מינון (RIC, Reduced intensity conditioning)[6].
פיתוח טיפולים מכינים מופחתי מינון איפשר עם השנים ביצוע השתלות מח עצם מתורם גם בגילים מבוגרים. כל חולה, טרם ההחלטה על הטיפול המכין, עובר הערכה של תפקוד המערכות השונות, ולפי תפקודן נקבעת עוצמת הטיפול המכין. בצורה זו ניתן לבצע השתלות מח עצם גם בחולים קשישים, מעל לגיל 70, בצורה בטיחותית וללא עלייה משמעותית בתמותה הקשורה בסיבוכי השתלה[1][7]. מספר מחקרים רטרוספקטיביים הצביעו בעבר על האפשרות שטיפול מכין בעוצמה מלאה שקול לטיפול מכין בעוצמה מופחתת, עובדה שגרמה למרכזים רבים לעבור בצורה הדרגתית למתן טיפול מכין בעוצמה מופחתת גם לחולים צעירים ללא מחלות רקע. אולם הוצג מחקר אשר בו חולי לוקמיה מיאלואידית חריפה הוקצו אקראית בין סוגי הטיפולים המכינים השונים והודגמה בבירור יעילות גבוהה יותר בחולים אשר קיבלו טיפול מכין בעוצמה גבוהה[8].
העובדה שגם לוקמיות וגם לימפומות הן פעמים רבות רגישות לקרינה, הביאה לניסיון לשלב נוגדנים מסומנים באיזוטופים רדיואקטיביים בטיפול המכין. שיטה זו מאפשרת להביא מינון גבוה יותר של קרינה לגידול עצמו, בעוד שאיברים אחרים בגוף אינם נפגעים. דוגמאות לשימוש בנוגדנים מסומנים באיזוטופים הן anti CD20 הקשור ליוד 131I–Tositumomab (Baxxar) או ל-Ibritumomab tiuxetan (90Y) (Zevalin) בחולים עם לימפומות המבטאות anti CD20, anti-l 131I-labeled CD45 בלוקמיות מיאלואידיות חריפות [9][10][11].
תוספת של נוגדנים נגד תאי T לטיפול המכין מאפשרת גם דיכוי והפחתת מספרם ופעילותם של תאי T בשתל. כפי שיוסבר בהמשך, לתאים אלה חשיבות רבה ביותר בהתפתחות מחלת השתל נגד המאכסן. באמצעות שימוש בנוגדנים לתאי T (ATG, Anti Thymocyte Globulins), שימוש בנוגדן ל-CD52 (Alemtuzumab Mabcampath) והוצאה מכאנית של תאי T (T cell depletion), יש ירידה משמעותית בהיארעות וחומרת מחלת השתל נגד המאכסן (2009 Finke Lancet Oncology). בניגוד לעבר, אז היה מקובל לחשוב שעקב דיכוי פעולת תאי T יש סיכוי מוגבר יותר להישנות מחלה לאחר השתלה, נכון למועד כתיבת מאמר זה, נראה שהסיכוי הזה זניח.
בחירת מקור השתל
השתלת מח עצם עצמית
עד תחילת המאה ה-21 מרבית ההשתלות העצמיות בוצעו עם שתל שנקצר ישירות ממח העצם. החולה היה לרוב בהרדמה מלאה עקב הפעולה הארוכה והכאב הכרוך בה. עם השימוש בגורמי צמיחה, כדוגמת GCSF, נמצא שמתן תרופות אלה גורם להזחת תאי האב ממח העצם אל הדם ההיקפי. נכון ל-2016, במרבית ההשתלות המבוצעות במבוגרים, אנו מבצעים איסוף תאי אב מדם היקפי. האיסוף מתבצע באמצעות חיבור החולה למכונה אשר מסננת את תאי האב מהדם ומחזירה את יתרת הדם חזרה לגוף. פעולה זו היא פשוטה, אינה כרוכה בכאב וכמעט נטולת סיבוכים. עם זאת, במיעוט החולים, מתן GCSF בלבד אינו מאפשר הזחת תאי אב, ובמקרים אלה יש להשתמש במעכב ל-CXCR4 Plerixafor (Mozobil) - חלבון הקשור בעיגון תא האב לתאי מח העצם התומכים ואכן במרבית המקרים מתן תרופה זו מסייע בהזחת תאי האב[12].
השתלת מח עצם מתורם
בחירת מקור השתל בהשתלה זו הוא מורכב. ישנם מספר אתרים גנטיים אשר נבדקים בבדיקת סיווג רקמות כדי לוודא התאמה בין החולה לתורם. התאמה זו הכרחית לשם הבטחת בטיחות ההשתלה. ישנם חמישה זוגות של אתרים כאלה, כולם מצויים על כרומוזום 6, וחלקם נמצאים בתאחיזה זה לזה. התאמה מלאה מאפשרת מצד אחד קליטת שתל מוצלחת (היעדר דחיית השתל על ידי גוף המקבל) ומצד שני מפחיתה את השכיחות ואת עוצמת מחלת השתל נגד המאכסן. התורם האידיאלי הוא תורם בו יש התאמה של 10/10 אתרים בבדיקת סיווג רקמות.
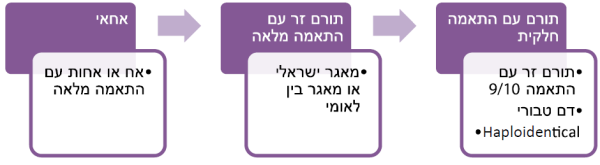
איתור התורם מתבצע קודם בקרב אחאי החולה (אח או אחות) - הסיכוי לאתר אח או אחות עם התאמה של 10/10 הוא 25 אחוזים. אם לא אותר תורם בן משפחה, אנו פותחים בחיפוש בקרב המאגרים הישראליים והבינלאומיים. מאגרים אלה הם בנק של פרופילי סיווג רקמות של מיליוני מתנדבים, והסיכוי למצוא בהם תורם לחולה הוא כ-70 אחוזים. מכיוון שאתרי ההתאמה מצויים בתאחיזה יחסית הקשורה בתורשה בקרב אוכלוסיות שונות ברחבי העולם, הסיכוי למצוא תורם תלוי במידה מסוימת במוצאו של החולה. לפיכך, בקבוצות אתניות אשר אינן מיוצגות מספיק במאגרים, הסיכוי למצוא תורם מתאים יהיה נמוך יותר בהשוואה לקבוצות אתניות שכיחות המיוצגות בצורה מוגברת במאגרים. אם לא נמצא תורם זר עם התאמה מלאה, ניתן להסתפק גם בתורם זר עם התאמה של 9/10 באתרי סיווג רקמות.
כאשר לא נמצא תורם זר עם התאמה מלאה ישנן מספר אפשרויות נוספות לאיתור שתל תורם (כפי שרואים בתרשים מספר 2):
- אם יש נישואי קרובים במשפחה, ניתן לבדוק את בני המשפחה הרחוקים יותר כדי לנסות ולאתר תורם מתאים נוסף
- תאי אב שמקורם בחבל טבור - חבל הטבור עשיר בתאי אב ולפיכך זהו מקור מצוין לתאי אב. ישנם מספר בנקים של חבל טבור בארץ ובעולם. היתרון בשתל זה הוא שאין צורך בהתאמה מלאה של סיווג הרקמות בינו ובין החולה, וזאת משום ששתל זה דל ביותר בתאי T הקשורים במחלת השתל נגד המאכסן. החסרון בשתל זה הוא מספר תאי האב הנמוך, הגורם לקליטה איטית יותר של השתל ולשיעורי דחייה גבוהים יותר. כדי להתגבר על בעיה זו ניתן לבצע השתלה שמקורה משתי מנות חבל טבור או להשתמש בשיטות הגורמות להתרבות תאי האב במנה עוד לפני העירוי לגוף. בניגוד לעבר, אז השתלה זו הייתה קשורה בסיבוכים משמעותיים ובתמותה גבוהה, השתלה זו מתבצעת בצורה בטוחה ובמרכזים מיומנים, והיא אינה כרוכה בשיעור סיבוכים גבוה יותר בהשוואה להשתלות אחרות
- תאי אב שמקורם בתורם עם חצי התאמה (Haploidentical) - במקרה זה מדובר על שתל שמקורו בילדי החולה או בהוריו. היתרון בהשתלה זו הוא בעובדה שכמעט לכל חולה יימצא בן משפחה מתאים. בעבר היה החיסרון קשור בסיבוכי השתלה משמעותיים ובתמותה גבוהה. עם שינוי הטיפול המכין, ובעיקר מתן Cyclophosphamide (Endoxan) לאחר ההשתלה (ובאמצעות זאת דיכוי תאי T אלוראקטיביים שלהם תפקיד חשוב בהתפתחות מחלת השתל נגד המאכסן), סיבוכי השתלה זו פחתו בצורה ניכרת
במרכזים מנוסים תוצאות השתלה זו דומים לתוצאות בהשתלות מתורם זר עם התאמה מלאה. עקב זמינותה הגבוהה של השתלה מסוג זה, יש מאמץ מתמשך לטייב עוד יותר את הפרוטוקולים המכינים לעירוי השתל כדי לאפשר את השימוש בהשתלה בתדירות גבוהה יותר.
מחלת השתל נגד המאכסן
מכל הסיבוכים הקיימים לאחר השתלת מח עצם מתורם, מחלת השתל נגד המאכסן היא הסיבוך המשמעותי ביותר הקשור הן לתחלואה והן לתמותה [13]. בעבר הוגדרה מחלת השתל נגד המאכסן לצורותיה השונות על פי מועד הופעתה, לפני או אחרי 100 יום ממועד ההשתלה. כאשר המחלה הופיעה לראשונה לפני 100 יום היא הוגדרה "חריפה", ואילו כאשר היא הופיעה לראשונה מאוחר יותר היא הוגדרה "כרונית". הצורה הכרונית הוגדרה כמוגבלת או מפושטת על פי מידת מעורבות איברי המטרה. בשנת 2005 התכנסה ועדה של ארגון הבריאות העולמי (NIH - National Institutes of Health) והגדירה מחדש את הצורות השונות על בסיס ההסתמנות הקלינית של המחלה ולא על סמך מועד הופעתה [14]. מחלת השתל נגד המאכסן בצורתה החריפה, הפוגעת בעור, במערכת העיכול ובכבד, חולקה לשתי תתי-קבוצות קליניות: המחלה החריפה הקלאסית, כאשר ההסתמנות הקלינית הופיעה לפני יום 100, ותת-הקבוצה החריפה האחרת כאשר ההסתמנות הקלינית החריפה נמשכת (persistent), מתלקחת מחדש (recurrent) או מופיעה לראשונה לאחר יום 100 (late onset). מחלת השתל נגד המאכסן בצורתה הכרונית חולקה אף היא לשתי תתי-קבוצות: הצורה הכרונית הקלאסית, אשר אינה מלווה בתסמיני המחלה החריפה, ללא תלות במועד התפרצותה, והמחלה המשלבת תסמינים של המחלה החריפה והכרונית ונקראת תסמונת החפיפה (Overlap syndrome).
מניעת הופעת המחלה היא העיקרון המרכזי בקביעת התוכנית הטיפולית. במרבית המרכזים מקובל לתת טיפול בשתי תרופות - מעכבי קלצינוירין, כדוגמת Cyclosporine או Tacrolimus (Protopic) בשילוב עם Methotrexate או Mycophenolate mofetil [15]. למרות טיפול זה, כ-40 עד 60 אחוזים מהחולים יפתחו מחלת שתל נגד המאכסן בדרגה 2-1, וכ-15 אחוזים מהחולים יפתחו מחלת שתל נגד המאכסן בדרגה 4-3. הסיכוי לתמותה בחולים אשר מפתחים דרגה 4-3 הוא כ-70 אחוזים.
קו הטיפול הראשון בחולים אשר פיתחו את המחלה הוא סטרואידים במינון של 2-1 מיליגרם/קילוגרם. בחולים עם מחלת השתל נגד המאכסן בצורתה החריפה, כאשר אין התייצבות או הקלה לאחר 10-5 ימים של טיפול בסטרואידים, יש להוסיף קו טיפול נוסף. תרופות רבות, כדוגמת Mycophenolate mofetil (CellCept), Sirolimus (Rapamune), מעכבי TNF אלפא, Pentostatin (Nipent), נבדקו כקו טיפול נוסף. מרבית התרופות נמצאו יעילות במידה מועטה ותרמו לדיכוי החיסוני ולהופעה של זיהומים משמעותיים.
הולך ורווח השימוש ב-Extracorporal photopheresis בחולים אשר מחלתם אינה מגיבה כהלכה לטיפול בסטרואידים [16]. בטכנולוגיה זו מתבצעת הקרנה של הלימפוציטים של החולה לאחר שהם מסוננים מהדם שלו. הקרנת הלימפוציטים ב-UVA (Ultra Violet A) גורמת לדיכוי פעולתם. לאחר ההקרנה הלימפוציטים מוחזרים לגוף החולה. בניגוד לתרופות אחרות, אין עלייה בשכיחות הזיהומים, ונראה שגם היעילות של טכנולוגיה זו טובה יותר בהשוואה לתרופות אחרות. מספר רב של מחקרי פאזה שנייה מבוצעים בחולים העמידים לטיפול בסטרואידים. מחקרים אלה כוללים, בין השאר, Bortezomib (Velcade), Cannabidiol, Rituximab (Mabthera), alfa 1 antitrypsin ומעכבי ציטוקינים שונים כדוגמת IL-2.
סיכום
השתלות מח עצם עצמיות ומתורם רווחות כיום ברחבי העולם וניתנות למגוון רחב ביותר של חולים. ההבנה שהטיפול המכין אינו חייב להיות במשלבים כימותרפיים אגרסיביים אפשרה ביצוע השתלת מח עצם מתורם גם בחולים מבוגרים יותר. תורמים חלופיים, כדוגמת תורמים עם חצי התאמה ודם טבורי, איפשרו ביצוע השתלות בחולים אשר אין להם בני משפחה תורמים ואשר נמנים עם קבוצות אתניות שאינן מיוצגות במאגרים. הטיפול התומך וגישות חדשות למניעת הישנות מחלה מוקדמת לאחר השתלה וחיזוק אפקט השתל נגד המחלה בהשתלות מתורם יאפשרו ירידה נוספת של התחלואה והתמותה מהשתלות מח עצם, ובכך ישפרו עוד יותר את התוצאות ארוכות הטווח של השתלות מח עצם.
ביבליוכרפיה
- ↑ 1.0 1.1 Sorror ML, Maris MB, Storb R, et al. Hematopoietic cell transplantation (HCT)-specific comorbidity index: a new tool for risk assessment before allogeneic HCT. Blood. 2005 Oct 15;106(8):2912-9.
- ↑ Thomas ED, Lochte HL Jr, Lu WC, et al. Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy. N Engl J Med. 1957 Sep 12;257(11):491-6.
- ↑ Slavin S, Or R, Naparstek E, et al. Allogeneic bone marrow transplantation without graft-v-host disease: true tolerance of graft against the host through depletion of donor T lymphocytes pregrafting in malignant and nonmalignant disorders. Transplant Proc. 1987 Feb;19(1 Pt 3):2614-5.
- ↑ Chen YB, Lane AA, Logan BR, et al. Impact of conditioning regimen on outcomes for patients with lymphoma undergoing high-dose therapy with autologous hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2015 June;21(6):1046-53.
- ↑ Cote GM, Hochberg EP, Muzikansky A, et al. Autologous stem cell transplantation with thiotepa, busulfan, and cyclophosphamide (TBC) conditioning in patients with CNS involvement by non-Hodgkin lymphoma. Biol Blood Marrow Transplant. 2012 Jan;18(1):76-83.
- ↑ Bacigalupo A, Ballen K, Rizzo D, et al. Defining the intensity of conditioning regimens: working definitions. Biol Blood Marrow Transplant. 2009 Dec;15(12):1628-33.
- ↑ Gyurkocza B, Storb R, Storer BE, et al. Nonmyeloablative allogeneic hematopoietic cell transplantation in patients with acute myeloid leukemia. J Clin Oncol. 2010 Jun 10;28(17):2859-67.
- ↑ Scott BL, Pasquini MC, Logan B, et al. Results of a phase III randomized, multi-center study of allogeneic stem cell transplantation after high versus reduced intensity conditioning in patients with myelodysplastic syndrome (MDS) or acute myeloid leukemia (AML): Blood and Marrow Transplant Clinical Trials Network (BMT CTN) 0901. [Abstract]. 2015 ASH Annual Meeting. Abstract LBA-8.
- ↑ Shimoni A, Avivi I, Rowe JM, et al. A randomized study comparing yttrium-90 ibritumomab tiuxetan (Zevalin) and high-dose BEAM chemotherapy versus BEAM alone as the conditioning regimen before autologous stem cell transplantation in patients with aggressive lymphoma. Cancer. 2012 Oct 1;118(19):4706-14.
- ↑ Gopal AK, Guthrie KA, Rajendran J, et al. Y90 Y-Ibritumomab tiuxetan, fludarabine, and TBI-based nonmyeloablative allogeneic transplantation conditioning for patients with persistent high-risk B-cell lymphoma. Blood. 2011 Jul 28;118(4):1132-9.
- ↑ Pagel JM, Gooley TA, Rajendran J, et al. Allogeneic hematopoietic cell transplantation after conditioning with 131I-anti-CD45 antibody plus fludarabine and low-dose total body irradiation for elderly patients with advanced acute myeloid leukemia or high-risk myelodysplastic syndrome. Blood. 2009 Dec 24;114(27):5444-53.
- ↑ Chow E, Rao KV, Wood WA, et al. Effectiveness of an algorithm-based approach to the utilization of plerixafor in patients undergoing chemotherapy-based stem cell mobilization. Biol Blood Marrow Transplant. 2014 Jul;20(7):1064-8.
- ↑ Filipovich AH, Weisdorf D, Pavletic S, et al. National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant. 2005 Dec;11(12):945-56.
- ↑ Ram R, Storb R. Pharmacologic prophylaxis regimens for acute graft-versus-host disease: past, present and future. Leuk Lymphoma. 2013 Aug. 54(8):1591-601.
- ↑ Ram R, Gafter-Gvili A, Yeshurun M, et al. Prophylaxis regimens for GVHD: systematic review and meta-analysis. Bone Marrow Transplant. 2009 Apr;43(8):643-53.
- ↑ Abu-Dalle I, Reljic T, Nishihori T, et al. Extracorporeal photopheresis in steroid-refractory acute or chronic graft-versus-host disease: results of a systematic review of prospective studies. Biol Blood Marrow Transplant. 2014 Nov;20(11):1677-86.
- Finke J, Bethge WA, Schmoor C, et al. Standard graft-versus-host disease prophylaxis with or without anti-T-cell globulin in haematopoietic cell transplantation from matched unrelated donors: a randomised, open¬label, multicentre phase 3 trial. Lancet Oncol. 2009 Sep;10(9):855-64.
- Truelove E, Fox C, Robinson S, et al. Carmustine, etoposide, cytarabine, and melphalan (BEAM)-campath allogeneic stem cell transplantation for aggressive non¬Hodgkin lymphoma: an analysis of outcomes from the British Society of Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2015 Mar;21(3):483-8.
- Goldberg JD, Linker A, Kuk D, et al. T cell-depleted stem cell transplantation for adults with high-risk acute lymphoblastic leukemia: long-term survival for patients in first complete remission with a decreased risk of graft- versus-host disease. Biol Blood Marrow Transplant. 2013 Feb;19(2):208-13
המידע שבדף זה נכתב על ידי ד"ר רון רם - היחידה להשתלת מח עצם, מרכז רפואי תל אביב, אוניברסיטת תל אביב;
פרופסור אביחי שמעוני - היחידה להשתלת מח עצם, בית חולים שיבא, אוניברסיטת תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק