חידושים בהתמודדות עם תסמונת מיאלודיספלסטית - New treatment ideas for myelodysplastic syndrome
הופניתם מהדף חידושים בהתמודדות עם תסמונת מיאלודיספלסטית - Myelodysplastic syndrome לדף הנוכחי.
| חידושים בהתמודדות עם תסמונת מיאלודיספלסטית | ||
|---|---|---|
| New treatment ideas for Myelodysplastic syndrome | ||
| 250px | ||
משטח דם מחולה עם תסמונת מיאלודיספלסטית. ניתן לראות ניוטרופיל היפוגרנולרי עם גרעין pseudo-Pelger-Huet. ישנם גם תאי דם אדומים בעלי צורה לא תקינה, הקשורים בחלקם להסרת הטחול.
| ||
| שמות נוספים | MDS, פרה-לוקמיה | |
| ICD-10 | Chapter D 46. | |
| ICD-9 | 238.7 | |
| MeSH | D009190 | |
| יוצר הערך | ד"ר דרורית מרקל גריזים | |
מבוא
תסמונת מיאלודיספלסטית (Myelodysplastic syndrome, MDS) היא קבוצת מחלות המתאפיינת בירידה בספירת הדם והפרעה בהבשלה במח העצם, הנגרמת כתוצאה מייצור לא אפקטיבי של תאי הדם. במהלך המחלה יכולה להופיע אנמיה עם ירידה ברמת ההמוגלובין, ספירה לבנה נמוכה עם זיהומים או נטייה לדימומים במצב של ספירת טסיות נמוכה. תמונת מח העצם מאופיינת במח עצם עשיר במיוחד, עם הפרעה במבנה ובהבשלה. מטרות הטיפול ב-MDS הן שיפור באיכות ובתוחלת החיים.
פתופיזיולוגיה
תאי הדם נוצרים בעצמות, בחלק הספוגי של מח העצם, שם הם מתפתחים מתאים צעירים הנקראים "תאי אב", ומתבגרים לשלושה סוגים שונים של תאי דם, היוצאים לזרם הדם:
- תאי דם אדומים שנושאים את החמצן לרקמות
- תאי דם לבנים שנלחמים בזיהומים
- טסיות - המשתתפות בתהליך קרישת הדם, למניעת דימומים
ידוע על מספר גורמים המעלים את הסיכון להופעת MDS, למשל חשיפה לקרינה או לחומרים כימיים כמו כימותרפיה, בנזן וחומרי ריסוס, או נטייה גנטית. בתהליך המחלה, שורת תאים שעברו התמרה משתלטת על מח העצם ומדכאת את הייצור של תאי האב הבריאים. בשלבים מוקדמים של המחלה, הסיבה העיקרית לירידה בספירות הדם היא עלייה במוות התאי המתוכנן (Programmed cell death). ככל שהמחלה מתקדמת, מופיעות הפרעות גנטיות נוספות עם שגשוג של תאים שלא מבשילים - "בלסטים". תהליך זה יכול להתרחש באיטיות במשך שנים או באופן מהיר ואגרסיבי, במשך מספר חודשים, תוך מעבר מהיר ללוקמיה.
ניתן לסווג את התסמונת המיאלודיספלסטית כתסמונת ראשונית, דהיינו ללא חשיפה מוקדמת ידועה, או כמשנית לטיפול - סיבוך של טיפול בסרטן שכלל חשיפה לקרינה או לכימותרפיה מסוג Alkylating agents או Topoisomerase II inhibitors.
אפידמיולוגיה
המחלה מאובחנת ב-2–5 מקרים ל-100,000 בשנה, והיא שכיחה יותר בגברים מבוגרים. שכיחות האבחנה, סך הכל כמות החולים, עולה כנראה כתוצאה משיפור בקריטריוני האבחנה אך גם מהזדקנות האוכלוסייה. חציון גיל האבחנה הוא 65, כשטווח הגילים נע בין תחילת שנות השלושים ומעל גיל 80. הישרדות החולים נמוכה - לאחר שלוש שנים נותרים בחיים 35 אחוזים בלבד. מאפייני המחלה דומים בכל העולם.
התבטאות המחלה
השלב הראשוני של המחלה לא מלווה בשינוי בהרגשתו של החולה, ונצפים בו שינוים קלים ברמת תאי הדם. בהמשך, תסמיני המחלה העיקריים נגרמים בשל רמות נמוכות של תאי דם, וכוללים תלונות של חולשה ועייפות כביטוי לאנמיה, ותלות בעירויי דם. כמו כן יש נטייה לדמם תת-עורי, דמם מהחניכיים ומהאף כביטוי לירידה בספירת הטסיות, חום, שיעול וזיהומים קשים בשל זיהום חיידקי או פטרייתי משני לירידה בספירת הדם הלבנה ונויטרופניה. בבדיקת החולה מוצאים חיוורון, דופק מואץ, דימומים תת-עוריים ודימומים מהאף ומהחניכיים. לעיתים שינויים בספירת הדם יכולים להקדים את הופעת התסמונת בכמה שנים.
דרכי אבחון המחלה
האבחנה נעשית באמצעות ספירת דם ובדיקת מח עצם, בדרך כלל על ידי המטולוג.
בספירת הדם נצפית ירידה במרכיבים השונים:
- אנמיה בדרגות חומרה שונות, בדרך כלל מאקרוציטית (נפח תאים אדומים גבוה)
- נויטרופניה בדרגות חומרה שונות - שכיח לראות שינויים מבניים בנויטרופילים. נצפים נויטרופילים עם גרעין שאינו משונץ כלל או משונץ לשתי אונות (pseudo-Pelger-Huet abnormality) או היפר-סגמנטציה של הגרעין 6–7 אונות. נצפות גם הפרעות בגרנולציה בנויטרופילים עם חסר מוחלט בגרנולות או הופעה פתולוגית שלהן (Dohle bodies)
- תרומבוציטופניה - ירידה בספירת הטסיות, לעיתים נדירות נצפית עלייה, עם הפרעות מבניות בגודל ובמראה הציטופלסמה, כמו טסיות ענקיות
בבדיקת מח העצם נלקחת דגימה ממח העצם, בדרך כלל מעצם האגן. הבדיקה נעשית אחרי זריקת הרדמה מקומית והיא נמשכת דקות אחדות. במהלכה מרגישים בדרך כלל תחושת לחץ בלבד. בבדיקה נצפים:
- במרבית המקרים, בהסתכלות במיקרוסקופ, נראה מח העצם עשיר מהרגיל עם שינויים במבנה בשלוש שורות התאים, המכונים "שינויים דיספלסטיים"
- שינויים דיספלסטיים אופייניים בשורה האדומה עם הופעה של הבשלה לא תואמת של הגרעין והציטופלסמה. שינויים אחרים יכולים להיות תאים אדומים דו-גרעיניים או יותר, והופעה של סידרובלדסטים במבנה טבעתי
- שינויים בשורה הלבנה - ריבוי שורה לבנה עם עלייה בספירת התאים הצעירים, בלסטים, אך בשונה מלוקמיה, נצפית עלייה גם בספירת שלבי ביניים בהבשלה עם הפרעות במבנה. מצב זה כונה בעבר "פרה-לוקמיה"
- הפרעות בהבשלת המגהקריוציטים - הופעת מגהקריוציטים עם מיעוט גרעינים
- שינויים ציטוגנטיים - שינויים בחומר הגנטי בתאי מח העצם החולים אינם תורשתיים או מולדים אלא נרכשים כחלק מתהליך המחלה. השינויים נמצאים במחצית מהחולים. השינויים הציטוגנטיים הם קלונליים וכוללים q5-, מונוזומיה 7 או q7-, טריזומיה 8, והפרעות רבות נוספות, פחות שכיחות. הפרעה ציטוגנטית בודדת, פרט לכרומוזום 7, מנבאת בדרך כלל פרוגנוזה טובה. נוספו שיטות רגישות יותר, כמו PCR (Polymerase Chain Reaction), לבדיקת הפרעות בחומר הגנטי בתאים החולים[1].
שלבי המחלה: הופעת המחלה והמהלך הקליני בחולי MDS אינם אחידים. בשלבים הראשונים המחלה מתבטאת בירידה בספירה, לעיתים ללא סימפטומים. בהמשך הספירות יורדות עוד יותר, והחולים נזקקים לעירויים של מוצרי דם. בחלק מהחולים המחלה הופכת אגרסיבית יותר עם הופעה של תאים צעירים, בלסטים, ואף מתרחש מעבר ללוקמיה.
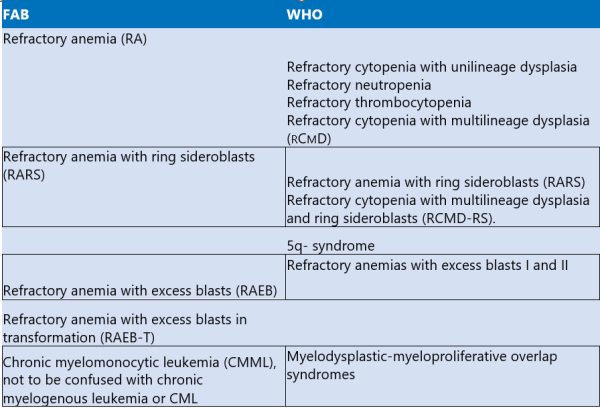
קבוצה בינלאומית של המטולוגים, French-American-British (FAB) Cooperative Group, חילקה את המחלה לחמש תת-קבוצות. נעשה עדכון על ידי ארגון הבריאות העולמי, שהוסיף מדדים נוספים לחלוקה[2]. שתי שיטות האבחנה מפורטות בטבלה מספר 1.
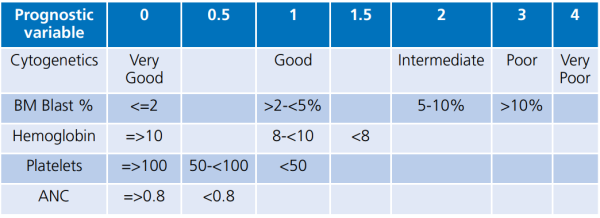
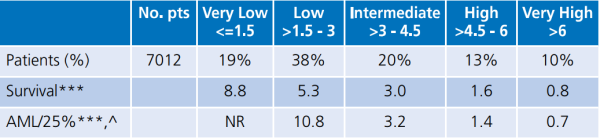
לצורך החלטה על טיפול, נוספו מדדים בינלאומיים שעודכנו ונקראים Revised International Prognostic Scoring System (IPSS-R) for MDS (טבלה מספר 2). מדדים אלו נשענים על סוג השינויים הציטוגנטיים, מספר הבלסטים במח העצם ומדדי ספירת הדם. חישוב כל המדדים יחד לפי הטבלה המפורטת מאפשר הערכת קבוצת הסיכון של החולה ועוזר בהחלטה על הגישה הטיפולית[3].
טבלה מספר 2 - Revised International Prognostic Scoring System for myelodysplasia:
טיפול
הטיפול בחולי MDS השתנה. בעבר הטיפול העיקרי היה תומך, וכלל גורמי גידול, עירוי של מוצרי דם לפי הצורך (תאי דם אדומים וטסיות) וטיפול בזיהומים. קיימות כמה תרופות חדשות המעוררות תקוות לשינוי במהלך המחלה.
טיפול תומך
מטרת הטיפול התומך לטפל בתסמינים ולשפר את איכות החיים:
- ניתן לטפל באנמיה בגורמי גידול באמצעות הזרקה של Erythropoietin שהראה ירידה בצריכת הדם ב-25 אחוזים מחולי MDS בכל קבוצות הסיכון. במחקר בחולים בסיכון נמוך עם רמות נמוכות של אריתרופואטין בסרום, פחות מ-U/L 500 (יחידות לליטר), וצריכה של פחות משתי מנות דם לחודש, דווח על תגובה אפילו ב-60 אחוזים
- עירוי תאי דם אדומים בחולים המתלוננים על חולשה או עם אנמיה קשה, מביא להקלה זמנית בחולשה. הבעיה שיש צורך בעירויים חוזרים קבועים כפעמיים בחודש
- סופחי ברזל: בחולים שקיבלו יותר מ-20 מנות דם נצפה עודף ברזל היכול לגרום נזק לכבד, ללב ולרקמות אחרות. הדעות חלוקות בעולם לגבי הצורך בטיפול בסופחי ברזל. קיימים סופחי ברזל בזריקות ובכדורים
- עירוי טסיות יעיל להפסקת דימום פעיל בחולים עם ספירת טסיות נמוכה. הבעיה היא שאורך חיי הטסיות המעורות הוא 3–7 ימים בלבד. לחולים שאינם מדממים מומלץ לתת עירוי למניעת דימום ספונטני כשערכי הטסיות יורדים מתחת ל-10,000. יש להימנע מעירוי תכוף של טסיות ללא הכרח, כדי שלא תיווצר עמידות לטיפול.
- ניתן להוסיף תרופות המונעות תרומבוליזה, כמו הקסאקפרון (Hexakapron, Tranexamic acid) להפחתת הסיכון לדמם. כמו כן קיימים גורמי גידול לטסיות הנמצאים עדיין בשלב מחקרי במחלה זו.
- זיהומים ונויטרופניה: חולי MDS נמצאים בסיכון מוגבר לזיהומים קשים הדורשים טיפול ספציפי ומהיר. 75 אחוזים מהחולים עם נויטרופניה יגיבו לטיפול בגורמי גידול (Granulocyte Colony Stimulating Factor - Neupogen, Granocyte). חולים הסובלים מחום בנוכחות נויטרופניה, מונחים לחפש עזרה רפואית במהירות.
טיפול מוכוון ל-MDS
החל שימוש במספר תרופות המעוררות תקווה כי נמצא הטיפול שישנה את מהלך המחלה. הגדרות מטרות הטיפול ב-MDS מורכבות, והן כוללות:
- השגת הפוגה במחלה
- דחיית הופעת הלוקמיה
השגת הפוגה עם תגובה מלאה לטיפול (Complete response - CR), מוגדרת כשהחולה אינו תלוי במוצרי דם או בגורמי גידול, והשינויים הדיספלסטיים חולפים עם היעלמות ההפרעות הציטוגנטיות. כיוון שמרבית החולים מגיבים בתגובה חלקית בלבד, נוצרו הגדרות נוספות כמו שיפור המטולוגי, המתבטא בירידה בתלות במוצרי דם. מדד חשוב להגדרת תגובה הוא משך הזמן עד להתפתחות לוקמיה חריפה, ומדד מקובל נוסף הוא שיפור באיכות החיים[4].
לנלידומיד: (Lenalidomide, Revlimid), אנלוג של תלידומיד. הטיפול ניתן בכדורים, והוא יעיל בחולים בסיכון נמוך ובינוני, במיוחד בחולים עם הפרעה גנטית -5q התלויים בעירויי דם. בחולי -5q נצפית ירידה בצריכת הדם ב-75 אחוזים מהחולים, וב-70 אחוזים נצפתה גם היעלמות ההפרעה הגנטית. בחולים ללא ההפרעה הנזכרת למעלה, non5q-MDS, נצפתה תגובה ב-50 אחוזים מהמקרים, ורק 25 אחוזים לא היו תלויים יותר בעירויי דם[5].
תרופות עם השפעות אפי-גנטיות
פריצת הדרך היא גישה טיפולית המתאימה לחולים מבוגרים והוכחה כמאריכת חיים. הטיפול מפעיל מחדש גנים שנלחמים בסרטן. בחולי MDS קיים דיכוי לפעילות גנים שתפקידם להגן מפני התפתחות המחלה. הדיכוי נעשה על ידי קשירת יתר של קבוצות מתיל לאזור ההפעלה של הגנים. בטיפול החדשני, קבוצות המתיל מוסרות, והגנים שוב פעילים בהגנה מפני המחלה.
בקבוצת תרופות זו יש שתי תרופות - Azacytidine (Vidaza) ו-Decitabine (Dacogen). תרופות אלו יעילות יותר בהשוואה לטיפול תומך ב-60 אחוזים מהחולים בסיכון גבוה ובינוני. נצפית הארכת התקופה עד להתפתחות לוקמיה עם שיפור באיכות החיים. אזציטידין אף הראתה הארכת החיים. תגובה לטיפול נראתה לעיתים רק לאחר מספר חודשים, כך שהטיפול דורש מחויבות של החולה והרופא לטיפול ממושך. גם אם לא מושגת הפוגה מלאה, בחולים עם מחלה יציבה צפויה הארכת חיים[6].
נערכים בישראל ומחוץ לה מחקרים רבים עם חולי MDS, בהם נבדקות תרופות חדשות ומשלבי תרופות חדשים. המידע הגנטי שנאסף על המחלה פותח אפשרויות טיפוליות עתידיות חדשות רבות.
טיפול בלוקמיה משנית ל-MDS
בחולה MDS שסובל מהתמרה ל-AML (Acute Myeloid Leukemia) יש צורך להתאים את הטיפול לגילו ולמצבו. לחולה מבוגר עם מחלות רקע ומצב תפקודי ירוד יתאים טיפול תומך בלבד או טיפול באזציטידין. לחולה צעיר יותר אפשר להציע טיפול אגרסיבי יותר כמו בלוקמיה חריפה ראשונית, עם ניסיון להשגת הפוגה מלאה במחלה.
טיפול ללוקמיה שמטרתו להשיג הפוגה מלאה ניתן בעירוי לווריד, באשפוז מלא ומורכב משתי תרופות: סיטרבין (Cytosar, Cytarabine HCL) ודאונורוביצין (Daunorubicin, Cerubidine) או אנטרציקלין אחר. במחצית מהחולים מעל גיל 60 מושגת הפוגה במחלה. הסיבוכים הצפויים בחולי לוקמיה שעברו התמרה מ-MDS הם חוסר תגובה לטיפול, התאוששות איטית של מח העצם וסבילות נמוכה של החולים לתופעות הלוואי של הטיפול. לאורך זמן, נצפית הישרדות של כ-10 אחוזים בלבד.
השתלת מח עצם
השתלת מח עצם מתורם (אלוגנאית) היא הטיפול היחיד המוכח עם פוטנציאל להשגת ריפוי ב-MDS. אך השתלת מח עצם ב-MDS מתאימה רק לחלק קטן מהחולים, כיוון שמרבית אוכלוסיית החולים היא מבוגרת ובעלת מחלות רקע. בשל התחלואה והתמותה הקשורות בהשתלה ובמחלת השתל נגד המאכסן (GVHD - Graft Vs Host Disease), הטיפול נשמר לחולים צעירים יחסית הנמצאים בסיכון גבוה למעבר ללוקמיה. בהשתלה אלוגנאית מדווחים על השגת הפוגה בכ-50 אחוזים מהחולים, וב-25 אחוזים מהנותרים המחלה נשנית. בניסיון להפחית את רעילות הטיפול, הופחתה עוצמת הטיפול הכימי בהתניה להשתלה, אך במחיר של עלייה בהישנות. בשיטות מודרניות של השתלה Reduced Intensity Conditioning and Nonmyeloablative Allogeneic) Stem Cell Transplantation), הטיפול יכול להתאים לחולים עד גיל 75. מועד ההשתלה בחולי MDS מבחינת שלב המחלה, עיתוי ההשתלה, בחירת התורם המתאים וההתניה המועדפת מבחינת מצבו של החולה, מותאמים אישית למצב החולה[7].
חולים הזקוקים לבירור המטולוגי
יש הנוטים לחשוב שאין צורך בבירור מעמיק למבוגרים שקיימת ירידה בספירות הדם שלהם. גישה זו משתנה עם ההתקדמות בטיפולים. הטיפול ב-MDS משפר את איכות החיים ומאריך אותם, ובחלק מהמקרים אף מושגות הפוגות ארוכות טווח.
מומלץ לשקול הפניה לייעוץ המטולוגי בחולים הסובלים מאנמיה מאקרוציטית ממושכת, לאחר שעברו בירור ונשללו סיבות כמו חסרים בברזל, פולאט, וויטמין B12 או אי-ספיקת כליות. הערכה המטולוגית חשובה גם במצבים בהם נמצא שילוב של ערכים נמוכים בשתי שורות תאים או יותר, לאחר שנשללו מחלות רקע כמו מחלות כבד או מחלות אוטואימוניות.
סיכום
תסמונת מיאלודיספלסטית היא קבוצת מחלות המתבטאת בירידה בספירות הדם עם נטייה למעבר ללוקמיה. חלה התקדמות ניכרת בטיפול עם כניסת תרופות חדשות המשנות את מהלך המחלה, וניכר שיפור בטיפול התומך וביכולת לבצע השתלות מח עצם בגיל מבוגר יותר. הבנת הביולוגיה המורכבת של המחלה לצד שיפור ביכולת לאתר הפרעות גנטיות ואפיגנטיות ואף הפרעות ברמת החלבון, עוזרים באבחון המחלה, ובעתיד יביאו לגישה טיפולית יעילה יותר. טיפול בחולה MDS על ידי צוות רב-מקצועי מיומן בשילוב התרופות החדשות, יכול להקל את סבלם של החולים ולהאריך את חייהם.
ביבליוגרפיה
- ↑ Swerdlow SH, Campo E, Harris NL, et al. (Eds). World Health Organization classification of tumours of haematopoietic and lymphoid tissues, Lyon: IARC Press; 2008
- ↑ Schanz J, Tuchler H, Sole F, et al. New comprehensive cytogenetic scoring system for primary myelodysplastic syndromes (MDS) and oligoblastic acute myeloid leukemia after MDS derived from an international database merge. J Clin Oncol. 2012 Mar 10;30(8):820- 9
- ↑ Greenberg PL, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012 Sep 20;120(12):2454-65. Epub 2012 Jun 27
- ↑ Malcovati L, Hellstrom-Lindberg E, Bowen D, et al. Diagnosis and treatment of primary myelodysplastic syndromes in adults: recommendations from the European LeukemiaNet. 2013 Oct 24:122(17):2943- 64
- ↑ Giagounidis A, Fenaux P, Mufti GJ, et al. Practical recommendations on the use of lenalidomide in the management of myelodysplastic syndromes. Ann Hematol. 2008 May;87(5):345-52
- ↑ Fenaux P, Mufti GJ, Hellstrom-Lindberg E, et al. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomised, open-label, phase III study. Lancet Oncol. 2009 Mar;10(3):223-32
- ↑ Della Porta MG, Alessandrino EP, Bacigalupo A, et al. Predictive factors for the outcome of allogeneic transplantation in patients with MDS stratified according to the revised IPSS-R. Blood. 2014 Apr 10:123(15):2333-42
המידע שבדף זה נכתב על ידי ד"ר דרורית מרקל גריזים - מרכזת תחום MDS במערך ההמטולוגי במרכז הרפואי ע"ש שיבא, תל השומר, ראשת חוג MDS באיגוד ההמטולוגי, יו"ר עמותת "תמיד" לחולי MDS
פורסם בכתב העת "במה", ספטמבר 2016, גיליון מס' 21, האגודה למלחמה בסרטן


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק