חלבון פיברילרי חומצי של תאי גליה - glial fibrillary acidic protein
הופניתם מהדף חלבון פיברילרי חומצי של תאי גליה לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| חלבון פיברילרי חומצי של תאי גליה | |
|---|---|
| Glial fibrillary acidic Protein | |
| שמות אחרים | GFAP |
| מעבדה | כימיה בדם ובנוזל שדרה |
| תחום | הערכת נזקים במוח |
| טווח ערכים תקין | בנסיוב - 0.002-0.049 מיקרוגרם לליטר; ב-CSF - פחות מ-5.0 מיקרוגרם לליטר. |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
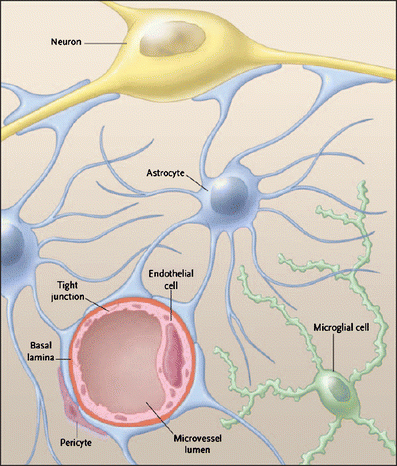
החלבון GFAP שתואר לראשונה על ידי Lawrence Eng וחב' בשנת 1969 במחקרם על מוחות חולים בטרשת נפוצה שהתפרסם שנה לאחר מכן ב-Tran Am Soc Neurochem. חלבון זה הוא חבר במשפחת חלבונים שלדיים ציטופלזמטיים דוגמת vimentin, desmin ו-peripherin, והוא מהווה סיב ביניים (intermediate filament type III) עיקרי בתאים אסטרוציטים בוגרים במערכת העצבים המרכזית (להלן CNS), בנוסף ל-vimentin, nestin ו-synemin. משערים שתפקידו העיקרי של GFAP לסייע לשמירת החוזק המכאני ועל צורת האסטרוציטים (Cullen וחב' ב-Brain Res משנת 2007). האסטרוציטים הם תת-קבוצה של תאי glia ב-CNS, בעלי צורת כוכב המורכב משלוחות רבות העוטפות סינפסות הנוצרות על ידי תאי עצב. ניתן לזהות אסטרוציטים על ידי שימוש באנליזה אימונו-היסטולוגית, תוך שימוש בנוגדנים כנגד GFAP.
חלבון זה שאורכו 8-1.06 ננומטר. הוא בעל מבנה מונומרי שמשקלו המולקולארי מוערך בין 40-53 אלף דלטון, עם נקודה איזואלקטרית של 5.7-5.8. על פי Yen וחב' משנת 1976 ב-Proc Natl Acad Sci USA ל-GFAP משקל מולקולארי של 52 אלף דלטון. ה-GFAP מופיע בעיקר ברקמת המוח, ובנוסף לאסטרוציטים הוא מופיע גם בזמן ההתפתחות של תאי אפנדימה שהם אחד מארבעה סוגי תאי ה-glia, האחראיים על ייצור נוזל ה-CSF (על פי Roessmannוחב' ב-Brain Res משנת 1980).
הגן המקודד ל-FAP מופה באתר 17q21 (על פי Bongcam-Rudloff ב-Cancer Res משנת 1991). מחקרים על הגן המקודד ל-GFAP באדם, בחולדה, ובעכבר גילו שכל הגנים הללו מורכבים מתשעה exons ומ-8 introns המפוזרים לאורכו של DNA שגודלו 10kb, שעל פניו נוצר mRNA בגודל של 3kb.
עם זאת יש עדויות להימצאותו של GFAP גם ברקמות גוף שמחוץ ל-CNS. ניתן למצאו גם בתאי mesangium ובפודוציטים של פקעיות הכליה בחולדות (Buniatian וחב' ב-Biol Cell משנת 1998), בתאי Leydig באשכים של אוגרים (Maunouri וחב' ב-J Neuroimmunol משנת 1991) ושל אדם (Davidiff וחב' ב-Acta Histochem משנת 2002), באוסטיאוציטים וכונדרוציטים באדם (Kasantikul ו-Shuangshoti ב-J Surg Oncol משנת 1989), בקרטינוציטים ופיברובלסטים באדם (Danielyan וחב' ב-J Invest Dermatol משנת 2007), בנוזל מי-שפיר באדם (Von Koskull ב-Acta Cytologica משנת 1984), ובתאי stellate בכבד ובלבלב בחולדות (Apte וחב' ב-Gut משנת 1998).
איזופורמים של GFAP
למרות ש-GFAPα הוא האיזופורם היחיד שיכול להתכנס מבנית כהומומר, יש ל-GFAP שמונה איזופורמים, שניתן למצוא בתת-קבוצות של אסטרוציטים באדם ובמכרסמים. איזופורמים אלה כוללים את GFAPκ, את GFAP+1 ואת GFAPδ, כאשר האיזופורם האחרון נחקר לאחרונה באופן נמרץ, כיוון שנראה שהוא קשור לתאי גזע עצביים, ועשוי להיות מעורב בנדידה של תאים אלה. לגבי איזופורם GFAP+1, למרות שאסטרוציטים המכילים אותו אינם פעילים, יש להם מגוון גדול של מורפולוגיות, כולל שלוחות באורך של עד 0.95 מ"מ שמוצאים במוח אדם, ונראה שהביטוי של אסטרוציטים המכילים את איזופורם GFAP+1 קשור לגיל מתקדם, ויש אף סבורים שהוא עלול להיות קשור לפתולוגיה של מחלת אלצהיימר (על פי Middeldorf ו-Hol ב-Prog Neurobiol משנת 2011).
המבנה של GFAP
סיבי הביניים type III אליהם משתייך GFAP, מכילים 3 מקטעים (domains) המכונים ראש, מוט (rod) וזנב. החלק המרכזי והעיקרי של GFAP, ה-rod הכולל 310-350 חומצות אמינו, מורכב מ-4 סלילים (coils) המסומנים כ-2A, 1B, 1A ו-2B. הרצף הספציפי של DNA המקודד ל-rod המרכזי, יכול להיות שונה באיזופורמים השונים של GFAP, אך המבנה של חלבון זה בכללותו משומר מאוד. מקטע ה"ראש" של GFAP קצר בהרבה בהשוואה למקטע זה בסיבי ביניים אחרים type 3, בכך שהוא מכיל רק 35 חומצות אמינו, והוא גם מכיל פחות חומצות אמינו בסיסיות (ארגינין) וחומציות (חומצה גלוטמית) בהשוואה לסיבי ביניים אחרים ( Geisler ו-Weber ב-EMBO J משנת 1983). כמו סיבי ביניים אחרים, גם GFAP עובר תהליכי זרחון (post translational): אותרו עד כה 6 אתרי זרחון, מהם 5 במקטע ה"ראש" (בחומצות אמינו Ser-17 , Ser-13, Ser-8, Thr-7 ו-Ser-34), ואתר זרחון בודד בקטע ה"זנב" בשייר Ser-389. זרחון זה משפיע על כושר ההתקפלות של מולקולת GFAP.
מקטע Rod המרכזי מתלפף סביב סיב אחר ליצירה של דימר, כאשר ה-N-טרמינאל של סיב אחד נצמד ל-C טרמינאל של הסיב האחר. סיבים type III דוגמת GFAP מסוגלים ליצור הומודימרים אך גם הטרודימרים: GFAO יכול לעבור פולימריזציה עם חלבונים שונים type III או עם חלבון נוירופילמנטי (NF-L) על פי Reeves וחב' ב-Proc Natl Acad Sci USA משנת 1989. יצוין ש-GFAP וחלבוני type III אחרים אינם יכולים להיקשר או להיצמד ל-keratins, שהם סיב מסוג I ו-II.
תפקידי GFAP במערכת העצבים המרכזית
למרות שתפקידו של GFAP ב-CNS אינו ברור במלואו, יש להניח שהוא קשור בפיקוח על צורתם של אסטרוציטים, כמו גם על תנועתם ותפקודם. אסטרוציטים כידוע חיוניים כתאי תמיכה לא רק של נוירונים, אלא גם של תאי סמך אחרים ב-CNS כמו האוליגו-דנדרוציטים האחראיים על יצירת מיאלין.
GFAP מזוהה בראש ובראשונה עם אסטרוציטים (Venkatesh וחב' ב-Neurol India משנת 2013), והוא כרוך בתהליכים חיוניים רבים ב-CNS כולל תשדורת בינתאית ותפקוד ה-BBB. נמצא ש-GFAP משחק תפקיד במיטוזה על ידי התאמת רשת הסיבים הציטופלזמית בתא, וכן ידוע שבתהליך המיטוזה יש הגברה ככמות ה-GFAP המזורחן ונדידה של חלבון מזורחן זה לכיוון החריץ דרכו יתרחש תהליך חלוקת התא (Tardy וחב' ב-Adv Exp Med Biol משנת 1990). נמצא שקינאזות המְזרחנוֹת את GFAP פעילות אך ורק באזור ביקוע התא, ומיקום ספציפי זה מאפשר חלוקה מדויקת של GFAP ל-2 תאי הבת לאחר החלוקה. Liedtke וחב' הראו שעכברי knock-out משוללי GFAP עוברים תהליכים ניווניים רבים כולל פגיעה במיאלינציה ויצירת מיאלין פגום, ניוון של חומר לבן במוח ופגיעה בתפקוד ובמבנה של ה-BBB, מה שמצביע על GFAP כחלבון הכרחי בתהליכים קריטיים של מבנה ה-CNS ותפקודו (Neuron משנת 1996).
הוצע גם ש-GFAP משחק תפקיד באינטראקציה בין אסטרוציטים ונוירונים. בניסויים in vitro של Weinstein וחב' משנת 1991 ב-J Cell Biol, הודגם על ידי שימוש ב-antisense RNA, שאסטרוציטים החסרים GFAP אינם מסוגלים ליצור את השלוחות הקושרות אותם עם נוירונים, וכמו כן נמצא שצורתם של תאי Purkinje בעכברי knock-out לגבי GFAP אינה סדירה, ועכברים אלה מגלים חסכים ביכולת ההתמצאות שלהם. מחקרים ביוכימיים על GFAP הראו שהזרחון התלוי ב-Mg או Ca של שיירי serine או threonine על פני מולקולת GFAP, מתבצע על ידי האנזימים PKC ו-PKA, שהם שני אנזימי kinase החיוניים להעברת סיגנלים בתוך ציטופלזמת תאים, מה שמרמז לחשיבות של GFAP בקומוניקציה הבינתאית (על פי Harrison ו-Mobley ב-J Neurochem משנת 1992). כמו כן נמצא ש-GFAP חיוני בתהליכי ריפוי לאחר נזק ב-CNS, על ידי יצירת glial scars באזורי CNS שונים כולל העין (על פי Tuccari וחב' משנת 1986 ב-Basic and applied histochemistr), והמוח (על פי Peatau וחב' ב-Acta Neuropathol משנת 1985).
מדידת רמת GFAP בנסיוב
בעבר, סמנים אחרים כגון NSE או Neuron-specific enolase כמו גם S100B ו-recoverin הידוע גם כ-protein A, וכןגם VEGF או vascular endothelial growth factor נמצאו ב-CSF של מטופלים עם גליומה (Cochran ו-Wen ב-Pathology משנת 1985 וכן Sampath וחב' ב-Cancer Control משנת 2004). אכן, מדידת רמת GFAP בשיטת ELISA ב-CSF דווחה בספרות כאינדיקטור לפתולוגיה של ה-CNS בהקשרים שונים: Aurell וחב' בחנו רמת חלבון זה ב-CSF לאחר אוטם מוחי (Stroke משנת 1991), ו-Rosengren וחב' עשו זאת בחולים עם טרשת נפוצה (J Neurol Sci משנת 1995). מדידת רמת GFAP ב-CSF נבחנה גם על ידי Ehlers וחב' בילדים עם אנצפלופתיה (הופיע ב-Neuropediatrics משנת 1994), ו-Dotevall וחב' ב-Infection משנת 1996 מצאו רמה מוגברת של GFAP ב-CSF בתרחיש של Lyme neuroborreliosis.
אלא שהמגבלה הטכנית ואי הנוחות לדגום מנוזל השדרה מספר דגימות בפרקי זמן שונים הגבילה את השימוש השגרתי הנרחב של מדידת סמנים ב-CSF. רק סמנים פוטנציאלים מעטים התגלו בנסיוב של מטופלים עם גידולים מוחיים, כולל recoverin, וכן caldesmon הידוע גם כ-I-CaD ו-cathepsin D. רמות cathepsin D היו משמעותית גבוהות יותר בנסיוב של מטופלים עם GBM בהשוואה לאלה במטופלים עם אסטרוציטומה בדרגות נמוכות, מה שהעלה אפשרות להשתמש בסמן זה כמנבא של הישרדות קצרה (Fukuda וחב' ב-Cancer Res משנת 2005). לעומת זאת, recoverin ו-I-CaD לא הראו רמות שונות בנסיוב באלה עם glioma בדרגות נמוכות בהשוואה לדרגות גבוהות.
Missler וחב' במחקר שהופיע בשנת 1999 ב-Clin Chem השתמשו למדידת GFAP בנסיוב במערכת DELFIA או dissociation-enhanced lanthanide fluorescence immunoassay, במקרים של מטופלים עם טראומה חריפה לראש בהשוואה לנבדקים בריאים. הם דגמו דם מ-25 מטופלים שהגיעו לאשפוז עם טראומה קשה בגולגולת (Glasgow Coma Scale≤6), כאשר מכל מאושפז נלקחו 3 דגימות דם: מיד עם קבלתו למיון, ו-24 ו-48 שעות לאחר הקבלה. דגימות נלקחו גם מ-70 תורמי דם בריאים ללא כל היסטוריה של חסך נירולוגי או כל מפגע חמור אחר. במקביל נמדדו בנסיוב רמות חלבון S100B.
התוצר הפלואורסצנטי של מבדק זה נמדד על ידי 1234 fluorometer DELFIA, כאשר סף הריכוז התחתון של GFAP הניתן לגילוי מבחינת רגישות השיטה הוא <0.01 מיקרוגרם לליטר. בניסוי זה התגלה GFAP בדגימות נסיוב של 10 מתוך 70 הנבדקים הבריאים עם ריכוז ממוצע של 0.004 מיקרוגרם לליטר (תחום ריכוזים של 0.002-0.049 מיקרוגרם לליטר). באשר ל-25 המאושפזים עם אירוע טראומה לראש, הממצאים היו כדלקמן: GFAP היה מוגבר ב-12 מתוך 25 המאושפזים הללו, כאשר הרמה הממוצעת של חלבון זה הייתה 0.18±0.10 מיקרוגרם לליטר בשעת הקבלה, 0.026±0.012 מיקרוגרם לליטר 24 שעות לאחר הקבלה, ו-0.052±0.017 מיקרוגרם לליטר 48 שעות לאחר הקבלה. ככל שדגימת הדם הייתה קרובה ליותר לאירוע התאונה, הייתה הסתברות גבוהה יותר לרמת GFAP מוגברת. רמות מוגברות של GFAP נמצאו מוגברות ב-6 מתוך 6 הדגימות שהתקבלו תוך 3 שעות מהפגיעה בראש, ב-5 מתוך 9 הדגימות שנלקחו 4-6 שעות מהפגיעה, ורק ב-1 מתוך 10 דגימות שנלקחו 7-16 שעות מהפגיעה.
נראה אם כן ש-GFAP זולג לדם סמוך מאוד לפגיעה המוחית, אך כמותו בדם פוחתת במהירות תוך פרק זמן קצר יחסית של 6 שעות, בהשוואה לרמת S 100 הנותרת מוגברת למשך מספר ימים. נראה אם כן שריכוזי GFAP בנסיוב עשויים לשמש סמן ראוי רק לפגיעה חריפה ונזק מיידי לרקמת המוח. מחקרים רבים מראים שניתן לגלות GFAP בדם, לאחר הפרשתו מייד לאחר פגיעה מוחית טראומטית, המלווה בנזק משמעותי במוח, מחלה ניוונית, גידול מוחי (על פי Jacque וחב' ב-J Neurol Sci משנת 1978) או נזק טוקסי מחשיפה לחומר כימי. בתגובה למצבים אלה האסטרוציטים מגלים פעילות בתהליך של astrogliosis, המתאפיין על ידי סינתזה מהירה של GFAP. רמתו של חלבון זה עולה בדרגה עם הגיל, וניתן להשתמש בו כסמן אמין לנזק מוחי כגון דימום תוך-מוחי, ואף לשבץ מוחי על רקע איסכמיה.
GFAP במצבים פתולוגיים
ישנם מפגעים רבים הכרוכים בוויסות פגום של פעילות GFAP, כאשר פגיעה ונזק מוחי עלולים לגרום לתאי glia לפעול באופן העלול להזיק. התהליך של glial scarring לדוגמה, הוא פועל יוצא של תרחישי ניווניים במוח, כאשר "צלקת" נוצרת על ידי אסטרוציטים המגיבים עם רקמה סיבית לשחזר מחדש את השוליים סביב מוקד הנזק העצבי, תגובה לה אחראי באופן חלקי GFAP (על פי Smith ו-Eng ב- Basic Applied Histochem משנת 1987).
אסטרוציטים מעורבים במגוון רחב של פתולוגיות ב-CNS, שגורמות לתאים אלה שינוים מורפולוגיים בצורת היפרטרופיה של שלוחות תאים אלה, מה שמוגדר כ-reactive gliosis. שינויים מבניים אלה באסטרוציטים כרוכים ביצירה מוגברת של GFAP, אך גם של vumentin ושל nestin (על פי Pekny ו-Pekna ב-J Pathol משנת 2004). מחלות בהן יש יצירה מוגברת של GFAP כוללות את מחלת אלצהיימר, scrapies ומחלת Creutzfeldt-Jacob. גם במודל בחיות של MS, דהינו ב-EAE או experimental allergic encephalitis יש יצירה מוגברת של GFAP (על פי Eng ו-Ghirnikar ב-Brain Pathol משנת 1994).
מדידת GFAP בנסיוב כמדד אבחוני ל-glioblastoma mutliforme
גליובלסטומה מולטיפורמה (להלן GBM) היא השאת הממאירה ביותר מבין הגליומות המוחיות, ומהווה כ-50% ממקרי שאתות אלו. למרות ששיטות הדמיה ומאפיינים קליניים תורמות לאבחון של GBM, פענוח היסטו-פתולוגי עדיין נחשב מנדטורי לאבחון המוחלט. החלבון GFAP מבוטא על ידי תאי גידולים אסטרו-גליאליים כגון אסטרוציטומה (Hamaya וחב' ב-Acta Med Okayama משנת 1985 ו-Abaza וחב' ב-Anticancer Res משנת 1998), ו-Jung וחב' בחנו את יעילות מדידת רמתו של GFAP בנסיוב כסמן ל-GBM. פרטי מחקרם הפרוספקטיבי שהתפרסם בשנת 2007 ב-Brain הם כדלקמן:
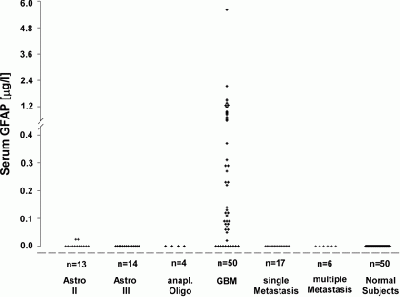
נבחרו 50 מטופלים עם GBM מוכח היסטולוגית (WHO grade IV), מתוכם 14 מטופלים עם אסטרוציטומה אנאפלסטית (WHO grade III), ארבעה מטופלים עם אוליגו-דנדרוגליומה אנאפלסטית, 13 מטופלים עם אסטרוציטומה דיפוזית (WHO grade II), שישה מטופלים עם מספר גרורות מוחיות, 17 מטופלים עם גרורה מוחית אחת ממקור קרצינומה, וכקבוצת ביקורת נלקחו דגימות דם מ-50 תורמים בריאים. דגימות הדם נלקחו מהמטופלים לפני ביצוע ניתוח להרחקת הגידול או לפני נטילת ביופסיה סטראוטקטית. מדידת GFAP נעשתה עם ערכה מסחרית של ELISA, ורמתו הייתה ברת גילוי ב-40 מתוך 50 המקרים של GBM, עם רמת חלבון ממוצעת של 0.18 מיקרוגרם לליטר (תחום: 0-5.6 מיקרוגרם לליטר).
רמות GFAP היו גבוהות משמעותית במקרים של GBM בהשוואה לגידולים מוחיים שאינם GBM, או בהשוואה לאנשים בריאים, בהם רמת GFAP הממוצעת נקבעה כ-0 מיקרוגרם לליטר (תחום: 0-0.024 מיקרוגרם לליטר) עם דרגת מובהקות גבוהה (p<0.001).
נמצא מתאם משמעותי בין רמת GFAP שנמדדו בנסיוב לבין נפח השאת המוחית (p<0.001), לבין נפח הנמק שגרמה השאת המוחית (p=0.004), לבין כמות התאים הנמקיים החיוביים ל-GFAP עם מובהקות של p=0.007. רמת GFAP בנסיוב הגבוהה מ-0.05 מיקרוגרם לליטר, שנקבע כסף נורמה עליון על בסיס אנליזת ROC, הייתה בעלת רגישות של 76% וספציפיות של 100% לאבחון של GBM במטופלים עם נגע מסתי סופרה-טנטוריאלי בודד, מה שמציג את מדידת GFAP בנסיוב כמדד אבחוני בעל משמעות בהקשר של GMB.
בחינה אימונו-היסטוכימית לא הצליחה לגלות GFAP בגרורות למוח של קרצינומות שונות, אך כל השאתות שנבחנו של תאי glia ביטאו GFAP שניתן היה להדגמה אימונו-היסטולוגית. במחקר זה, במטופלים עם אסטרוציטומה grade III ניתן היה לגלות GFAP בלמעלה מ-50% מרמת ביטויו ב-GBM, ואילו במקרים של אסטרוציטומה grade II רמת הביטוי של GFAP הייתה של למעלה מ-25% מזו ב-GBM. בשאתות אוליגו-דנדרוגליאליות ואוליגו-אסטרוגליאליות, רמת ה-GFAP הייתה פחות מ-25% מזו שב-GBM. יש לציין שרמות GFAP בנסיוב תואמות את נפח שאת GBM המוחית, כמו גם את נפח הנמק הנגרם משאת זו, כפי שניתן למדוד על ידי סריקת MRI.
כיוון של-GFAP משקל מולקולארי גדול מ-50 אלף דלטון, יש להניח שהמעבר שלו מהמוח לדם דרך מחסום דם-מוח (BBB) בתנאים פיזיולוגיים אינו סביר כלל ועיקר. אך במצב של טראומה מוחית חריפה (Pelinka וחב' ב-J Trauma משנת 2004), במצבי שטף-דם תוך מוחי (Foerch וחב' ב-J Neurol Neurosurg Psychiatry משנת 2006), או באוטם מוחי (Herrmann וחב' ב-Restor Neurol Neurosci משנת 2006), רמות מוגברות של GFAP בנסיוב של מטופלים עם GBM כנראה משקפות זליגת חלבון זה מתאי glia בהיווצרות נמק של השאת, ופגיעה בשלמות ה-BBB.
כמו שתואר על ידי Gottschalk ו-Szymas בשנת 1987 ב-Zentralbl Allg Pathol, ניתן למצוא שוֹנוּת גדולה בביטוי של GFAP ברקמת השאת מסוג GBM, אם כי דרגת הביטוי הרקמתית הזו, לא בהכרח הייתה במתאם עם רמות GFAP שנמדדו בנסיוב. רמת הביטוי של חלבון זה ברקמת השאת, מצביעה כנראה על סטאטוס ההתמיינות (differentiation) של האסטרוציטים. יש מקרים של GBM, בהם דרגת התמיינות התאים גבוהה, ואף על פי כן הם מכילים יותר אסטרוציטים ללא התמיינות, שאינם מבטאים GFAP באופן נמרץ. במקרים אחרים, GFAP בא לביטוי בכמויות דומות כמו ב-anaplastic astrocytomas (על פי Herpers וחב' ב-Acta Neuropathol משנת 1986, או אפילו מבטאים כמויות מוגברות של כל האיזופורמים של GFAP (על פי Blechingberg וחב' ב-Glia משנת 2007).
GFAP במצבי שאתות מוחיות אחרות
היתרון של GFAP הוא בכך שהוא מאוד ספציפי לתאים עם התמיינות אסטרוציטית, ולכן משמש באופן נרחב כסמן אמין באבחון האימונו-היסטוכימי המבדיל בין שאתות מוח שונות (Bonnin ו-Rubinstein ב-J Neurosurg משנת 1984). אכן, בעוד ש-GFAP באה לביטוי באופן עקבי בכל הגליומות כולל גליובלסטומה, לא ניתן למצאו בדרך כלל במקרים של מנינגיומה, מדולו-בלסטומה ובגרורות מוחיות של קרצינומות ממקומות שונים בגוף (Oh ו-Prayson ב-Arch Pathol Lab Med משנת 1999).
במטופלים עם אסטרוציטומה grade II ו-grade III רמות GFAP בנסיוב היו נמוכות מתחת לסף הנורמה העליון של 0.05 מיקרוגרם לליטר, הדומה מאוד לרמות חלבון זה באנשים בריאים לחלוטין בהם הרמה הממוצעת של חלבון זה היא 0.002 מיקרוגרם לליטר, שדווחה גם על ידי Missler וחב' ב-Clin Chem משנת 1999. ראוי לציין ש-Jung וחב' ניסו ללא הצלחה לגלות עקבות של GFAP בנסיוב של מטופלים עם מנינגיומה בודדת, סוּפּרָה-טֶנטוריאלית גדולה (נפח השאת בממוצע 39.3 סמ"ק), מה שמצביע על כך שאין די בדחיסה מוחית ניכרת עקב השאת הגדולה על מנת להביא לדליפת GFAP לנסיוב.
מדידת רמת GFAP בנסיוב לאבחנה מבדלת בין דימום תוך-מוחי (ICH או intracranial hemorrhage) לבין שבץ איסכמי
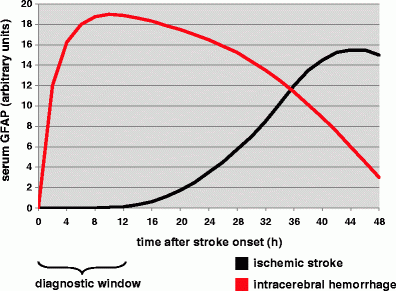
Dvorak וחב' דיווחו בשנת 2009 ב-Cerebrovasc Dis על "חלון הזמן" האבחוני להבדיל בין ICH ושבץ איסכמי. הגישה של מחקר זה הייתה שאבחנה מבדלת מהירה בין 2 התרחישים הללו כמבחן מעבדה עוד לפני ההגעה לאשפוז, עשויה לסייע בהתנהלות עם התרחיש באופן מושכל יותר ואף לחסוך מבחני הדמיה יקרים וגוזלי זמן בעת האשפוז. כיוון שפורסם קודם לכן שרמת GFAP בנסיוב הייתה גבוהה יותר ב-ICH מאשר באירוע שבץ איסכמי, התבקשה בחינה מדוקדקת יותר של רמות GFAP ב-2 התרחישים כפונקציה של פרק הזמן שחלף מהאירוע המוחי.
בניסוי השתתפו 63 מטופלים עם אירוע שבץ שהגיעו לאשפוז תוך 6 שעות מהאירוע: 18 מתוכם על רקע ICH ו-45 על רקע איסכמי. דגימת הדם התבצעה לצורך מדידת GFAP על ידי מבחן ELISA בפרקי זמן של 1, 2, 3, 4, 6, 12, 24 ו-48 שעות לאחר האירוע. תוצאות הניסוי היו כדלקמן: בפרק הזמן של 24 שעות לאחר האירוע, הערכים הממוצעים של GFAP באלה עם שבץ איסכמי נותרו נמוכים מתחת סף הגילוי של שיטת המדידה. בפרק הזמן שבין 2-6 שעות מהאירוע, רמת GFAP בנסיוב הייתה גבוהה משמעותית במטופלים עם ICH בהשוואה לאלה עם שבץ איסכמי (p<0.001 לגבי כל 4 נקודות הזמן). על פי ניתוח עקומת ROC הדיוק האבחוני של מדידת GFAP באבחנה בין ICH לבין שבץ איסכמי היה גדול מ-0.8, בחלון הזמן של 2-6 שעות. שעתיים לאחר תחילת האירוע, ערכי GFAP בנסיוב היו במתאם משמעותי עם נפח הדם שזלג במוח באירוע זה (r=0.755 ו-p=0.007).
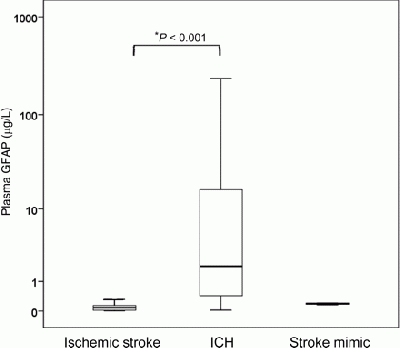
מחקר נוסף של Foerch וחב' שהופיע בשנת 2012 ב-Clin Chem בחן אף הוא את הדיוק האבחוני של רמת GFAP בהבדלה בין ICH לבין שבץ איסכמי. במסגרת ניסוי פרוספקטיבי רב-מוסדי ב-14 מרכזי שבץ בגרמניה ובשוויץ תחת השם BE FAST. במסגרת ניסוי זה 205 מטופלים חשודים לשבץ מוחי בהם תסמניני האירוע התרחשו פחות מ-4.5 שעות לפני הגיעם לאשפוז, נדגמו בבדיקת דם עם האשפוז, ורמת GFAP נמדדה בשיטתCLIA או electrochemiluminisence immunoassay. עם שחרורם מהאשפוז באבחון המסכם התחלק בין ICH, שבץ איסכמי או דמוי-שבץ (stroke mimic).
בדיעבד התברר שהיה מדובר ב-163 מקרי שבץ איסכמי, 39 מקרי ICH ו-3 מקרים דמויי-שבץ. רמות GFAP נמצאו מוגברות משמעותית עם האשפוז במטופלים עם ICH (רמה חציונית של 1.91 מיקרוגרם לליטר עם טווח ריכוזים של 0.41-17.66 מיקרוגרם לליטר) לעומת ריכוזי GFAP (רמה חציונית של 0.08 מיקרוגרם לליטר עם טווח ריכוזים של 0.02-0.14 מיקרוגרם לליטר) (p<0.001). בשלושת הנבדקים עם תרחיש דמוי-שבץ רמות GFAP היו מתחת לסף רגישות שיטת המדידה. הדיוק האבחוני של מדידת רמת GFAP לאבחנה מבדלת בין 2 התרחישים האמורים היה גבוה (השטח מתחת לעקומת ROC נקבע כ-0.915). כאשר נקבעה רמת סף של 0.29 מיקרוגרם לליטר של GFAP, הרגשות האבחונית נקבעה כ-84.2%, והספציפיות האבחונית נקבעה כ-96.3%, לצורך אבחנה מבדלת בין ICH ושבץ איסכמי.
בסקירה של Brunkhorst וחב' משנת 2010 ב-Transl Stroke Res, מתרכזים בעלי הסקירה בקינטיקה של הרס תאים בשבץ על רקע איסכמיה שהוא התרחיש הנפוץ יותר, ושבץ על רקע דימום תוך-מוחי. בשבץ איסכמי מתרחשים 2 סוגים של מות תאי מוח: נמק ואפופטוזיס, המתרחשים בעת ובעונה אחת (Unal-Cevik וחב' ב-Stroke משנת 2004). בתהליך איסכמי, אפופטוזיס מתרחש בעיקר בשולי מוקד הפגע בהם התמעטות אספקת הדם מתונה יותר, ואספקת החמצן גם אם היא מצומצמת, עדיין מאפשרת יצירת אנרגיה שיש בה להשרות תהליך אפופטוטי (על פי Charriaut-Marlangue וחב' ב-J Cereb Blood Flow Metab משנת 1996). מן ההיבט ההיסטו-פתולוגי אפופטוזיס מאופיין כביקוע על ידי אנזימי caspase של פילמנטים של ה-cytoskeleton הגורמים לכיווץ התא. לאחר פרגמנטציה של גרעין התא האפופטוטי, דחיסת כרומטין ופרגמנטציה של DNA כרומוזומלי, התא נדחס לצורה שמאפשרת בליעתו ופינויו על ידי מקרופאגים (על פי Li וחב' ב-Am J Pathol משנת 1995)
לעומת זאת, תהליך של נמק הוא תרחיש של הרס כּאוֹטִי של תאים בתנאים סביבתיים קיצוניים ובלתי נסבלים מצבים כאלה קיימים במוקד של אוטם איסכמי, בו העדר חמצן מוביל לירידה ניכרת ברמות ATP, נגרמת אנוקסיה ודה-פולריזציה של הפוטנציאלים בממברנת התאים. מצב זה מלווה על ידי חדירה של יוני סידן חוץ-תאיים, ומורפולוגית התא מתנפח, יש דגרדציה של DNA בגרעין התא, ויש הרס של ממברנת התא ושל ממברנות האברונים התוך תאיים כמו המיטוכונדריה. מצב זה גורם לליזיס של התא כאשר כל תכולתו משתחררת אל מחוצה לו מה שמשרה תגובה דלקתית (על פי Nicotera וחב' ב-Trends Pharmacol Sci משנת 1999).
נמק הנגרם על ידי איסכמיה במוח מזוהה עם מוקד נוזלי המכיל פסולת של תאים הרוסים. מקובל שנגעי נמק מוחיים מתקבלים לאחר חסימה קבועה של עורקים מספקי חמצן (Kaufmann וחב' ב-Stroke משנת 1999). מבחינה היסטו-פתולוגית, מעט מאוד נוירונים עם מאפיינים מורפולוגיים של נמק, נמצאו במוחות במהלך 4 השעות הראשונות של חסימה עורקית במוח. למעשה, מות תאים בתהליך נמק, מתחיל לבוא לביטוי לאחר 6 שעות מתחילת תהליך הנמק, והוא מגיע לשיאו בין 6-12 שעות לאחר החסימה העורקית. בין 12-24 שעות מתחילת תרחיש זה, 80% מהנוירונים הסמוכים מתים. תהליך נמקי נרחב (pannecrosis) בו מעורבים נוירונים, תאי glia, וכלי דם נצפה לאחר 72-96 שעות (Garcia וחב' ב-Stroke משנת 1995). גם Persson וחב' במאמר משנת 1989ב-Stroke, זיהו ממצאים היסטולוגים של נמק וציטוליזה בעיקר לאחר 18 שעות עד 3 ימים.
מספר קבוצות דיווחו שאסטרוציטים עמידים יותר מאשר נוירונים למות תאים כתוצאה מאיסכמיה (Gurer וחב' ב-Brain Pathol משנת 2009 וכן Panickar ו-Norenberg ב-Glia משנת 2005). בניסויים בחולדות בהם הושרתה חסימה של עורק המוח המרכזי (MCA), ניתן היה לזהות רק 8% מהנוירונים ו-37% מהאסטרוציטים 48 שעות מיצירת החסימה. בשולי מוקד האיסכמיה, ולא במרכזה, אסטרוציטים מתחילים לעבור תהליכי היפרטרופיה תוך מספר שעות מיצירת החסימה, ובשלב זה ניתן כבר לזהות עליה ביצירת mRNA של GFAP. תהליך ה-astrogliosis במושגים של יצירה מוגברת של GFAP, יכול להימשך מספר שבועות לאחר האוטם האיסכמי (Petito וחב' ב-J Cereb Blood Flow Metab משנת 1990).
הרעיון שחלבונים של תאי מוח המופרשים בהרס תאים אלה ומגיעים לדם ההיקפי עשויים לשמש כסמנים אבחוניים של שבץ איסכמי, קיים כבר משנות ה-60. בשנת 1965 זוהה S100B כחלבון קושר סידן הנמצא בריכוז גבוה באסטרוציטים, באוליגו-דנדרוציטים ובתאי Schwann. מאוחר יותר, זוהה S100B בתאים חוץ-מוחיים כגון אדיפוציטים, כאשר באנשים בריאים ריכוזיו בנסיוב הם בטווח של 0.05-0.15 מיקרוגרם לליטר. בשעות הראשונות לאחר אירוע שבץ איסכמי, רמות S100B עדיין נמוכות (Foerch וחב' ב-Arch Neurol משנת 2005 ו-Missler וחב' ב-Stroke משנת 1997). לכן S100B אינו מתאים לשמש כסמן אבחוני לשבץ איסכמי בשלביו הראשונים. לעומת זאת, 24-48 שעות לאחר האירוע האיסכמי רמות S100B בנסיוב עולות משמעותית ומגיעות לשיאן 72 שעות מהאירוע.
הערכה של רמות B100S בנסיוב של מטופלים עם חסימה חריפה של עורק מוחי מרכזי, גלתה היבטים מעניינים של השחרור של חלבון זה לדם. במטופלים עם חסימה עורקית מתמשכת המפתחים מאוחר יותר אוטם גדול כתוצאה מחסימה זו, נמצאה עלייה ניכרת של S100B בנסיוב. לעומת זאת, באלה עם הסרה מוצלחת של החסימה על ידי החדרת תכשירים ממיסי-קרישי דם, רמות S100B שנמדדו בנסיוב היו מזעריות אם בכלל (Foerch וחב' משנת 2003 ב-J Neurol Neurosurg Psychiatry). ממצאים אלה מצביעים על כך שבשלבים המוקדמים של אירוע איסכמי אין שחרור משמעותי של S100B, ורק תרחיש מתמשך הכרוך בנמק תאים בלתי הפיך, מביא להגדלת ריכוזו של חלבון זה בנסיוב.
בניגוד ל-S100B, החלבון GFAP הרבה יותר ספציפי למוח, באופן שאנשים בריאים אינם מכילים בצירקולציה ריכוזים ברי-מדידה שלו. הנתונים שהתפרסמו על ידי מספר קבוצות מחקר, מראים שקינטיקת ההפרשה של GFAP, דומה לזו של S100B. בשלב המוקדם של 6 שעות ראשונות מאז האוטם האיסכמי לא ניתן לגלות GFAP בנסיוב (Foerch וחב' ב-Cerebrovasc Dis משנת 2003 ו-Unden וחב' ב-J Neurol משנת 2009). רק 12-24 לאחר אירוע זה, מתחילות רמות GFAP לעלות בהדרגה ומגיעות לשיאן רק לאחר 48-96 שעות (Herrmann וחב' ב-Stroke משנת 2000), כאשר כמות GFAP המופרשת פרופורציונית לגודל האוטם. בדומה ל-S100B, הפרשת GFAP תלויה ביצירת אוטם של ממש (Wunderlich ב-Eur J Neurol משנת 2006). כלומר, אירוע איסכמי חולף ללא יצירת נמק לא יביא להפרשת כמויות הניתנות לגילוי של GFAP בנסיוב.
תהליכי הרס תאי בדימום תוך-מוחי
בתרחיש של דימום תוך מוחי (ICH) חריף, עקות גזירה הקשורות למסת הדימום גורמים באופן מיידי להרס רקמת מוח ומוליכים לנמק מיידי של נוירונים ותאי glia, כמו גם לפגיעה של מחסום דם מוח (BBB) על פי Qureshi וחב' ב-N Eng J Med משנת 2001 ו-Xi ב-Lancet Neurol משנת 2006). נזקים אלה מאפשרים זליגה של GFAP מהמרווח החוץ-תאי של התאים הניזוקים לדם ההיקפי. כתוצאה מדימום זה עלול להיגרם נזק שניוני כגון בצקת מוחית, מה שמגביר תהליכי נמק ותהליכים אפופטוטיים עם פגיעה נוספת בתאים הסמוכים לדימום. שיא ההתרחשות של אפופטוזיס נצפתה בין 24-72שעות מתחילת הדימום (Qureshi וחב' ב-Neurosurg משנת 2003).
תסמונת Alexander
תסמונת Alexander הנדירה מאוד (כ-550 מקרים מאז תיאורה בשנת 1949) קשורה ישירות ל-GFAP. התסמונת הכוללת פיגור שכלי ומוטורי, שיטיון, מוח וראש מוגדלים, ספסטיות המתבטאת בהתקשחות של הגפיים, ופרכוסים, נגרמת כתוצאה מהצטברות בציטופלזמה של GFAP וכן של heat shock proteinsהידועים כסיבי Rosenthal (על פי Hagemann וחב' ב-J Neurosci משנת 2006). מוטציות בגן המקודד ל-GFAP תורמות להצטברות סיבי Rosenthal (על פי Brenner וחב' ב-Nat Genet משנת 2001), כאשר מוטציות אלו המתרחשות בעיקר בקצה ה-C טרמינאלי של GFAP פוגעות ביצירה תקינה של ה-cytoskeleton וכן מגבירות את פעילות האנזים caspase 3, מה שמגביר אפופטוזיס ותמותה של התאים עם מוטציות אלו (Chen וחב' ב-Exp Cell Res משנת 2011). בכל שלושת הצורות של תסמונת אלכסנדר (infantile, juvenile ו-adult) הוכח שהן נגרמו על ידי מוטציות ב-GFAP. עד כה זוהו 76 מוטציות כאלו, כאשר השכיחה ביותר היא השחלוף של ארגינין בעמדה 79 או 329 על ידי ציסטאין או היסטידין.
מחלת אלצהיימר
התופעות האופייניות במחלה זו של יצירת פלאקים עמילואידיים, סבכים (tangles) נוירופיברילאריים וחלבון tau מזורחן ביתר. אל תהליך של אסטרוגליוזיס גם כן מתאפיין כשינוי נוירופתולוגי במחלה זו שחומרתה כרוכה באופן הדוק לצפיפות של אסטרוציטים המגיבים לתרחיש הפתולוגי (Muramori וחב' ב-Psychiatry Clun Neurosci משנת 1998), מה שגורם ליצירה מוגברת של GFAP הן ברקמה המוחית והן ב-CSF. נתונים ממחקר של Noppe וחב' ב-Clin Chim Acta משנת 1986). ההיפוקמפוס של חולי אלצהיימר נראה מושפע יותר מתהליך האסטרוןגליוזיס מאשר איזור מוח זה בקשישים ללא אלצהיימר (Beach וחב'ק ב-Glia משנת 1989). בשנת 1993 פרסמו La Prince וחב' ב-Neurosci Lett, על קשר חזק בין יצירת GFAP לבין הצפיפות של פלאקים בנאוקורטקס הקדמי של מוחות חולי אלצהיימר. גם Pike וחב' ב-Exp Neurol משנת 1995 מצאו עליה ניכרת ברמות mRNA של GFAP בתלות בתפיפות של משקעי Aβ. יתרה מכך, Ingelsson וחב' הראו ב-2004 ב-Neurology שרמות GFAP במחלת אלצהיימר גדלות עם מסת הסבכים הנוירופיברלאריים וביחס ישר למשך המחלה. Wharton וחב' מציעים שהתגובה של תאי אסטרוגליה ויצירת GFAP, יכןלים לשמש מדד מוקדם לתהליכים נוירו-ניווניים וכן לסייע בניבוי של מהלך המחלה (Dement Geriatr Cogn Disord משנת 2009).
מחלת פרקינסון
במחלה זו עם ניוון של נוירונים דופאמינרגיים ב-substantia nigra, מאפיין בולט היא ההצטברות של גופיפי Lewy בנוירונים הדופאמינרגיים הנותרים וכתוצאה מכך שפעול של תאי מיקרוגליה (McGeer ו-McGeer ב-Alzheimer Dis Assoc Disord משנת 1998). אך הדיווחים שנויים במחלוקת באשר לקשר בין מחלת פרקינסון לבין ביטוי GFAP: בשנת 1998 הראו Benati וחב' ב-Mov Disoed שאין הבדל בצביעה של GFAP במוחות של חולי פרקינסון לעומת מוחות ביקורת, ולעומתם מצאו Damier וחב' ב-Neurosci משנת 1993 באזורים דופאמינרגיים שונים במזנצפאלון, שצפיפותם של תאים נושאי GFAP גדלה עם החמרת האובדן של נוירונים דופאמינרגיים. זאת ועוד, ריכוזים מוגברים של GFAP עם התקדמות מחלת פרקינסון נמצאו בהיפותלמוס של חולי פרקינסון בהשוואה לזה של ביקורת של אנשים בריאים תואמי-גיל (Thannickal וחב' ב-Brain משנת 2007).
GFAP ומפגעים אחרים
יש דיווחים על כך שהביטוי של מספר איזופורמים של GFAP פוחת בתגובה לזיהום חריף או לתהליכים ניווניים, ואפילו בתסמונת Down במצבי סכיזופרניה, תסמונת דו-קוטבית ודיכאון עמוק (Johnston-Wilson וחב' ב-Mol Psychiat משנת 2002). נמצא גם שביטוי GFAP פוחת ב-Wernicke's encephalopathy (על פי Cullen ו-Halliday ב-Alcohol & Alcoholism משנת 1994). נמצא כמו כן ש-gp120, הגליקופרוטאין במעטפת נגיף HIV, יכולים לעכב ישירות את הזרחון של GFAP וכן שרמות GFAP יכולות לפחות כתוצאה מהדבקה כרונית ב-HIV (על פי Levi וחב' ב-Proc Natl Acad Sci USA משנת 1993) או בהדבקה כרונית עם נגיף Varicella-Zoster (על פי Kennedy וחב' ב-Virology משנת 1994).
הוראות לביצוע הבדיקה
דגימת הדם נלקחת במבחנת ספירת-דם (EDTA, פקק סגלגל). יש לסרכז את הדם משך 4 דקות במהירות 10,000g לא יאוחר מ-60 דקות מקבלתו במעבדה ולאחר סרכוז מוקפאת הפלזמה במבחנות Eppendorf. ההקפאה נעשית ללא שיהוי בטמפרטורה של מינוס 30 מעלות צלזיוס. ידוע ש-GFAP יציב בדם מלא למשך ימים אחדים ב-4 מעלות צלזיוס. על פי Missler וחב' ב-Clin Chem משנת 1999, נמצא ש-GFAP יציב עד 4 הקפאות והפשרות.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק