טיפולים מקומיים בסרטן מעי גס גרורתי - Localized treatment of colon cancer metastases
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן מעי גס גרורתי
הגישה הניתוחית לגרורות כבדיות
סרטן המעי הגס והחלחולת הוא המחלה הממאירה השנייה בשכיחותה בישראל, ובשנת 2014 אובחנו כ-3,000 חולים חדשים עם סרטן המעי הגס [1]. בכ-25-15% מחולי סרטן המעי הגס והחלחולת מופיעות גרורות בכבד כבר בזמן האבחנה, ו-50-25% מהחולים מפתחים גרורות בכבד בזמן המעקב. מחלה גרורתית מוגבלת לכבד בלבד ב-50-30% מחולים אלה.
בעידן הטיפולים הכימיים ומכווני המטרה חל שיפור בהישרדות לחמש שנים בקרב החולים בסרטן המעי הגס עם גרורות בכבד. בעבר, בזמן הטיפול הסטנדרטי בכימותרפיה בלבד, עמדה ההישרדות על פחות מ-1%, ואילו בהווה יש דיווחים על שיעורי הישרדות לחמש שנים של 10-5% [2]. למרות ההתקדמות בטיפולים הכימיים, כריתת כבד היא הטיפול היעיל ביותר להשגת הישרדות ארוכת טווח, והיא מציעה אפשרות ריפוי כאשר המחלה מוגבלת לכבד בלבד. בכריתת גרורות בכבד עם שוליים בריאים, שיעור ההישרדות לחמש שנים הוא כ-50% ול-10 שנים כ-25% [3], אך רק חלק מחולים אלה מועמדים לניתוח.
גישת צוות רב-תחומי
חולה סרטן עם גרורות בכבד חייב להיות מטופל על ידי צוות רב-תחומי, שיכלול כירורג כבד, אונקולוג, רופא הדמיה ומומחה ברדיולוגיה פולשנית, במטרה להבטיח שבדיקות האבחון המתאימות יבוצעו במלואן, ותתבצע בחינה מחודשת שלהן. בהמשך יתקיים דיון על מנת להציע מגוון רחב של אפשרויות טיפוליות, כולל טיפולים כימיים ומכווני מטרה, פעולות כירורגיות ורדיולוגיה פולשנית, טיפול קרינתי וטיפול תומך.
לגבי כל מטופל עם גרורות בכבד יש לדון בגישה של ריפוי, תוך התחשבות בשלושה גורמים המתוארים להלן:
המצב הרפואי של המטופל
על החולה להיות במצב רפואי טוב על מנת לעבור את הניתוח בהצלחה. חשוב שלחולה יהיה תפקוד לבבי וריאתי תקין וכן תפקוד כבדי תקין, על מנת שהחלק הנשאר לאחר הניתוח (Future Liver Remnant - FLR) יתפקד בצורה מספקת עד שהכבד יעבור התחדשות (regeneration). בחולים ללא מחלות כבד, די ב-FLR של 20% מנפח הכבד, בחולים לאחר טיפול כימי דרוש FLR של 30%, ובחולים עם מחלת כבד כמו שחמת דרוש FLR של לפחות 40%.
גורמים אונקולוגיים
Fong וחב' פרסמו ב-1999 את תוצאות הטיפול הכירורגי ב-1,001 חולים עם גרורות בכבד מגידול שמקורו במעי הגס והרקטום. החוקרים גילו שבעה גורמים המנבאים הישרדות נמוכה לאחר הניתוח [4]:
- מחלה אקסטרה-הפטית
- שולי כריתה חיוביים (נגועים בגידול)
- נוכחות גרורות בבלוטות הלימפה בזמן כריתת המעי הגס
- מרווח זמן של פחות מ-12 חודשים בין אבחון הגידול במעי הגס ועד להופעת הגרורות בכבד
- קוטר הגרורה גדול מ-5 ס"מ
- הימצאות יותר מגרורה אחת
- רמת CEA מעל 200 ng/ml
על בסיס חמשת הגורמים האחרונים נבנתה שיטת ניקוד, שעל פיה כל גורם סיכון מקבל נקודה אחת. השיטה ידועה בשם הקריטריונים ע"ש Fong או Clinical Risk Score System) CRS). לפי שיטת ניקוד זו סיכויי ההישרדות לחמש שנים של מטופל עם 0 נקודות הם 60% לעומת 14% למטופל עם 5 נקודות [4].
גורמים כירורגיים-טכניים
חל שינוי בגישה הכירורגית האונקולוגית לטיפול בגרורות בכבד. המונח "נתיחות" (resectability) הפך לאבן יסוד בטיפול בחולים אלה[5]. נתיחות נקבעת לפי הקריטריונים הבאים:
- כריתה של כל הנגעים בכבד או מחוצה לו עם שוליים בריאים
- FLR מעל 20% בחולים שלא קיבלו טיפול כימי ו-30% בחולים לאחר טיפול כימי
- שמירה על רצף של שני סגמנטים של הכבד עם אספקת הדם שלהם (עורק הכבד והווריד הפורטלי) וכן הניקוז שלהם (דרכי המרה והווריד ההפטי)
השינוי בגישה הכירורגית מתבסס על העובדה שלא חשוב מה כורתים בכבד אלא איזה חלק מהכבד משאירים, וכן, שמספיק שיהיו שוליים בריאים של 1 מ"מ מבלי שתיפגע ההישרדות, לעומת הגישה בעבר שחייבה שוליים בריאים של 1 ס"מ [6]. שינוי זה הביא לכך ש-50-30% מחולי הסרטן עם גרורות בכבד יכולים לעבור ניתוח לכריתת הגרורות הכבדיות לעומת 15-10% בלבד בעבר הלא רחוק.
בחירת הרצף הטיפולי
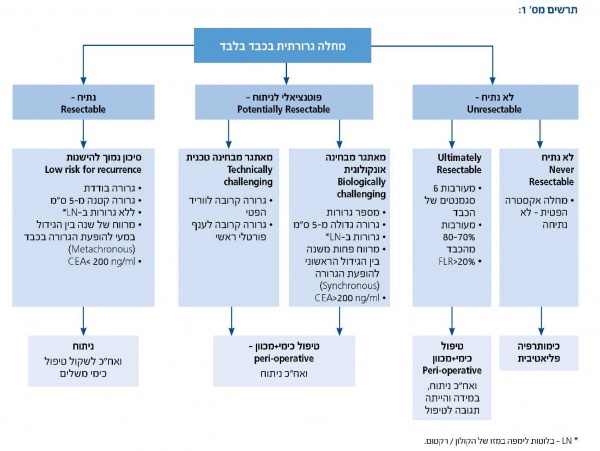
על מנת לקבוע את רצף הטיפול (ניתוח/ כימותרפיה), על הצוות הרב-תחומי להחליט בנוגע לכל מטופל עם גרורות בכבד לאיזו משלוש הקבוצות הבאות הוא שייך (תרשים מס' 1):
- הקבוצה הראשונה כוללת חולים עם גרורות שניתנות לכריתה כירורגית עם שוליים בריאים בסיכון נמוך להישנות לפי חישוב גורמי הסיכון, כלומר 0–2 בשיטת CRS [7]. בקבוצה זו ההמלצה היא כירורגיה בשלב ראשון
- הקבוצה השנייה כוללת חולים בעלי פוטנציאל לניתוח (potentially resectable) עם סיכון גבוה להישנות מחלתם. בחולים אלה כריתה בכבד אפשרית אך קשה מבחינה טכנית, כי הגרורות קרובות לכלי הדם בשער הכבד (קרבה לענפים הפורטליים הראשיים) או לוורידים ההפטיים (מאתגר מבחינה כירורגית), או חולים עם גורמי סיכון משמעותיים להישנות, כלומר עם CRS של 3–5 קריטריונים, (מאתגר מבחינת ההתנהגות הביולוגית של הגידול). הגישה כלפי קבוצה זו היא טיפול כימי ומכוון מטרה לפני ואחרי הניתוח (peri-operative)
- הקבוצה השלישית כוללת חולים עם מעורבות משמעותית של הכבד במחלה גרורתית (מעורבות של 70% מהכבד או של שישה סגמנטים שלו), והטיפול בהם הוא כימי-מכוון מטרה. אם הייתה תגובה טובה לטיפול, ניתן לשקול כריתה כירורגית. קבוצה זו כוללת גם חולים עם מעורבות אקסטרה-הפטית משמעותית שלא ניתנת לכריתה כירורגית. חולים אלה מופנים לטיפול כימי-מכוון פליאטיבי. בחולים המתחילים טיפול כימי-מכוון חובה לחזור על בדיקות ההדמיה ועל דיון צוות לאחר ארבעה טיפולים. אם חלה נסיגה של הגידול או שהמחלה התייצבה, החולים יופנו לניתוח. חולים שיש עדות להתקדמות המחלה יופנו לקו טיפול כימי שני
ניתוח כבד
שיקולים טכניים
הכבד מורכב משמונה סגמנטים, כאשר לכל סגמנט יש אספקת דם מהעורק ההפטי ומהווריד הפורטלי, וכן ניקוז לווריד ההפטי ולעץ הביליארי.
- כריתה אנטומית: קו הכריתה נמצא בקו המפריד בין הסגמנטים, בדרך כלל מנתקים את העורק ההפטי והווריד הפורטלי של אותו סגמנט וכך משיגים קו הפרדה ברור בינו לבין שאר הסגמנטים. מבחינה טכנית אפשר לכרות כל סגמנט לבד או ביחד עם סגמנטים אחרים
- כריתה לא-אנטומית או כריתת יתד (wedge): כריתה של הגרורה ורקמת הכבד הבריאה שסביבה. בסוג זה של כריתה משמרים נפח כבד גדול יותר למקרה של ניתוחים חוזרים בהישנות המחלה בכבד. טכניקה זה הפכה לשיטה המועדפת בכריתת גרורות
טכניקה כירורגית
- כירורגיה פתוחה: בעבר ניתוחי כבד בוצעו בכירורגיה פתוחה, דהיינו, חיתוך של דופן הבטן. היות שהכבד ממוקם בבטן הימנית העליונה, הגישה אליו מחייבת חתך ניתוחי גדול ובכך ניתן לבצע סקירה של חלקו האחורי של הכבד ולשלוט בכלי הדם הנכנסים והיוצאים ממנו
- כריתה לפרוסקופית או רובוטית: בעשור האחרון כריתת כבד בצורה לפרוסקופית תופסת תאוצה בעולם. ניתוח זה דורש שילוב מיומנויות בניתוחי כבד ובטכניקות לפרוסקופיות. ב-10% מניתוחים אלה דווח על מעבר לניתוח פתוח עקב קשיים טכניים בזמן ביצוע ההליך (כולל דימום, חוסר התקדמות בניתוח וכוי). היתרון של כריתה זו הוא צלקות קטנות, פחות כאבים לאחר הניתוח, אשפוז קצר יותר וחזרה מהירה יותר לטיפולים הכימיים ולעבודה
תחלואה ותמותה
יש פרסומים רבים על תוצאות הטיפול הכירורגי בגרורות בכבד התומכים בבטיחות ויעילות הניתוח. התמותה הניתוחית המדווחת נעה בין כ-2% ל-5%. לעומת זאת, התחלואה הניתוחית נעה בין 15% ל-50%. והיא נובעת מגודל הכריתה הכירורגית. הסיבוכים הבתר-ניתוחיים השכיחים ביותר הם דימום, מורסה באזור הכריתה, דליפת מרה ואי-ספיקה כבדית.
אמבוליזציה של וריד שער הכבד (Portal Vein Embolization - PVE)
במטופלים עם FLR הקטן מ-30% המועמדים לכריתת כבד ניתן להגדיל את ה-FLR על ידי חסימת הווריד הפורטלי של אונת הכבד המכילה את המחלה הגרורתית. כך מעלים את הזרימה לאונת הכבד הבריאה וגורמים להיפרטרופיה הן של האונה עם המחלה הגרורתית והן של האונה הבריאה. פעולה זה יכולה להיעשות בניתוח פתוח או לפרוסקופי או בהתערבות מלעורית על ידי צוות הרדיולוגיה הפולשנית. בדרך כלל, שלושה עד ארבעה שבועות לאחר הפעולה מבוצעים CT כבד וחישובי נפח. בכ-20% מהמטופלים לאחר פעולה זו לא תתאפשר כריתת אונת הכבד עקב התקדמות המחלה הגרורתית או חוסר גדילה של ה-FLR.
הגישה הכירורגית למחלה דו-אונתית
- One stage hepatectomy - כריתת כל הגרורות בכבד באותו ניתוח. השיטה קרויה גם cherry-picking surgery. בדרך כלל ניתן לבצע את ההליך במטופלים עם גרורות שטחיות. במקרים בהם יש גם נגע עמוק ניתן בנוסף לצרוב אותו בעזרת אבלציית radiofrequency ablation) RFA) או מיקרוגל (microwave ablation - MWA). שיטה זו משמרת את האנטומיה של כלי הדם הראשיים בכבד, וכך מאפשרת בעתיד לבצע ניתוחים חוזרים כאשר יש הישנות של המחלה. בטכניקה זו התמותה הניתוחית היא כ-0.7%, והתחלואה כ-16%[8].
- Two stage hepatectomy - כריתת נגעים מרובים בכבד בשני שלבים, כאשר בניתוח הראשון כורתים את הנגעים באונה אחת (בדרך כלל מנקים את הגרורות מהאונה השמאלית), ואם נפח האונה השמאלית (ה--FLR) קטן מ-30% מבוצעים חסימה או אמבוליזציה של הווריד הפורטלי הימני. בניתוח השני מבצעים כריתה של האונה הימנית. התמותה הניתוחית היא 0.8% בניתוח הראשון ו-2.5% בניתוח השני, כאשר התחלואה בניתוח הראשון היא כ-14% ובשני כ-33%. ההישרדות לחמש שנים בחולים שעברו את שני הניתוחים היא 44% לעומת 0% בחולים שלא עברו ניתוח שני עקב התקדמות המחלה או חוסר גדילה של ה- FLR [8], [9]
- Associating liver partition and portal vein ligation for staged hepatectomy) - ALPPS) - כריתת הכבד בשני שלבים בחולים עם מחלה גרורתית דו-אונתית וכשה-FLR קטן מ-30% או בחולים שבהם נכשל ה-PVE להביא לגדילה של ה-FLR. בניתוח הראשון מבוצעים ההליכים הבאים: כריתת גרורות באונת הכבד הנשארת כ-FLR, חסימת הווריד הפורטלי של האונה המתוכננת לכריתה בניתוח השני, והפרדת רקמת הכבד בין שתי האונות על מנת לנתק שאנטים (shunts) של ורידים פורטליים בין שתי האונות ולהביא בכך לגדילה מהירה של ה-FLR. בדרך כלל כשבוע עד עשרה ימים ממועד הניתוח מבוצעים CT כבד והערכה של נפחי הכבד ולאחריהם מבוצע הניתוח השני. היתרון בגישה זו הוא השגת אחוז גבוה יותר של השלמת הניתוח השני, אף שהתמותה הניתוחית עומדת על 7.5% והתחלואה על 36%. בהיותה טכניקה כירורגית חדשה יחסית, המעקב אחרי חולים אלה הוא קצר, וההישרדות לשנתיים היא של 41% [9]
כריתת כבד חוזרת - repeat hepatectomy
ב-70-50% מהחולים תהיה הישנות של המחלה בכבד. היום מקובל לבצע ניתוחים בכבד כל זמן שניתן להשאיר נפח כבד (FLR) מעל 30% בשני סגמנטים ברצף. אמנם ניתוחים אלה יכולים להיות מסובכים יותר טכנית, אך ניתן לבצעם הן בשיטה הפתוחה והן בשיטה הלפרוסקופית עם דמיון בשיעורי תחלואה ותמותה, בדומה הניתוח הראשון.
סיכום הגישה הניתוחית לגרורות כבדיות
הגישה לחולי סרטן המעי הגס עם גרורות בכבד היא של צוות רב-תחומי, המבסס את החלטתו על סמך גורמים כירורגיים לנתיחות וגורמים אונקולוגיים היכולים להעיד על הסיכון להישנות המחלה. הצוות הרב-תחומי יקבע את הרצף הטיפולי, כאשר ההחלטה להתחיל בטיפול הכימי/מכוון המטרה יצריך דיון חוזר בעזרת בדיקות הדמיה לאחר ארבעה טיפולים. הגישה האגרסיבית של כירורגיה אונקולוגית הביאה להישרדות לחמש שנים של 60-45% ואפילו להישרדות לעשר שנים של 30-20%.
טיפולים ממוקדים לגרורות כבדיות
כריתה כירורגית היא האפשרות היחידה לטיפול בעל פוטנציאל ריפוי לחולים עם גרורות של סרטן המעי הגס בכבד (colorectal liver metastases - CRLM). עד 80% מהחולים מתייצגים בעת גילוי הגרורות בכבד עם מחלה אשר לא ניתנת לניתוח[10][11], הישרדות של חמש שנים עבור חולים המתאימים לניתוח נעה בין 40% ל-58% [12][13],, ואילו בחולים בלתי נתיחים חציון ההישרדות הכולל נע בין 15 ל-22 חודשים[14]. במהלך 15 השנים האחרונות הפיתוח של כימותרפיה חדשה וטיפולים מכווני מטרה, כמו גם טיפולים אזוריים בכבד הרחיבו את אפשרויות הטיפול אשר עומדות לרשות האונקולוג המטפל בחולים עם גרורות בכבד. הגישה ההיסטורית שהבחינה בין טיפול למטרת ריפוי או טיפול תומך (פליאציה), הוחלפה בתפיסה דינמית יותר של הפיכת סרטן למחלה כרונית הניתנת לניהול דינמי. לצורך כך, על האונקולוג להשתמש בכל הכלים העומדים לרשותו, כולל טיפולים סיסטמיים וטיפולים ממוקדים לכבד.
יש צורך בגישה רב-תחומית כדי להציע טיפול אישי מיטבי. הגדרת הרצף המתאים ושילוב הטיפולים מאתגרים ודורשים מומחיות וניסיון כאחד. מאמר זה סוקר את האפשרויות של טיפול אזורי לכבד בחולים אשר אינם מועמדים לניתוח, ומציע אסטרטגיות ניהול עבור קבוצת חולים זו המהווה אתגר מבחינה רפואית.
הקריטריונים הקלאסיים לכריתה של גרורות בכבד התבססו על מספר, גודל ומיקום הנגעים בכבד. נכון לעכשיו, אפשר לנתח אם ניתן להסיר את הגידול עם שוליים בריאים תוך השארת כמות מספקת של פרנכימת כבד מתפקדת (50-25%). חולים אשר אינם עונים לקריטריונים אלה, מועמדים לטיפול סיסטמי או טיפול ממוקד לכבד. כוונות טיפולים אלו הן או הארכת חיים או הקטנת הגרורות, עם אפשרות לטיפול כירורגי בהמשך.
כ-20% מהחולים עם גידולים לא נתיחים של הכבד יכולים להפוך לנתיחים לאחר מתן טיפול קדם ניתוחי. טיפל זה יכול להיות סיסטמי (כימותרפיה בשילוב טיפול מכוון מטרה) או טיפול אבלטיבי ממוקד בשילוב טיפול סיסטמי. ידוע היטב כי תגובה קלינית מלאה בהדמיה אינה עולה בקנה אחד עם תגובה פתולוגית מלאה. ב-80% מהחולים עם תגובה הדמייתית מלאה נמצאה מחלה מיקרוסקופית חיובית בפתולוגיה לאחר הניתוח[15]. עובדה זו מדגישה את החשיבות של הגישה הרב-תחומית בחולים אלו. בסקירה זו נתמקד בטיפולים האזוריים לכבד.
טיפולים ממוקדים לכבד
טיפולים אבלטיביים לכבד מתחלקים לאבלציות בעזרת חום או אבלציות "קרות". הטיפולים האזוריים לכבד מחולקים לאמבוליזציה בשילוב כימותרפיה או הזרקת איזוטופ רדיואקטיבי. טיפול לא חודרני ניתן לבצע בעזרת קרינה חיצונית ממוקדת (SBRT). בהמשך נסקור בקצרה את הטיפולים השונים.
- טיפולים אבלטיביים מקומיים
- אבלציה בעזרת זרם חשמלי - RFA (Radiofrequency Ablation) גורמת נמק של הגידול על ידי מעבר זרם חשמלי באנרגיה גבוהה בתוך הגרורה, וחימום של האזור עד לטמפרטורות של 50–100 מעלות צלזיוס למשך כ-5 דקות. תופעות הלוואי בעקבות פעולה זו הן לרוב קלות וחולפות, ונצפו בכ-7% מהמטופלים.
- שיעור התמותה נמוך ונמדד בכ-0.5%. הטיפול מתבצע בגישה פתוחה, מלעורית או לפרוסקופית. הגישה האופטימלית תלויה במיקום הגידול ובהעדפת המפעיל. מספר מחקרים הראו שיעור חזרות מקומי נמוך יותר בחולים אשר טופלו בגישה הפתוחה[16][17],[18], חשיפה טובה יותר של הכבד, והיכולת למצוא נגעים על פני הכבד, בשילוב עם השימוש באולטרסאונד תוך-ניתוחי, עשויים להסביר את התוצאות הטובות של הגישה הפתוחה[19]. שיעורי ההישנות המקומית של טכנולוגיית ה-RFA הנוכחית הם כ- 21-9%, ועומדים ביחס ישיר לגודל הגידול ולמיקום הנגע[20][21], מקובל לטפל בגידולים עד גודל של 3 עד 5 ס"מ. ככל שממדי הגידול גדולים יותר שיעור החזרה המקומית גבוה יותר[22]. השימוש ב-RFA בשילוב עם כימותרפיה נחקר במחקר 40004 של הקבוצה האירופית לחקר הסרטן (EORTC). זהו הניסוי הקליני היחידי אשר השווה כימותרפיה סיסטמית ל-RFA בתוספת לכימותרפיה[23]. הנתונים המוצגים עולים בקנה אחד עם מחקרים קודמים קטנים יותר בקבוצה המשלבת RFA וכימותרפיה סיסטמית, שיעור ההישרדות ללא התקדמות המחלה במשך שלוש שנים היה 27.6% לעומת 10% בקבוצת הטיפול הכימי בלבד במחקר זה לא הוצגו נתונים על שיעור ההישרדות הכללית בשתי הקבוצות אשר נחקרו[23].
- אבלציה בעזרת הקפאה (Cryoablation) גורמת לנזק ומוות של התאים על ידי הקפאת הגרורה עד לטמפרטורה של 350C. פעולה זו מוגבלת לגידולים קטנים יותר וגורמת לשיעור תופעות לוואי גבוה יותר בהשוואה לאבלציה בעזרת גלי רדיו (תמותה ב-1.6% מהחולים ותופעות לוואי ב-60-15%).
- אבלציה בעזרת גלי מיקרו (MWA) - נוצרת בעזרת היווצרות שדה אלקטרומגנטי הגורם לתנועת מולקולות המים בגידול ויצירת חום. החום נוצר סביב המוליך אשר מוכנס לתוך הגידול בעזרת הדמיה. בניגוד לאבלציה בעזרת זרם חשמל, אבלציה בעזרת גלי מיקרו מתאימה גם לרקמות בעלת מוליכות חשמלית נמוכה. אזור האבלציה הוא כ-2 ס"מ סביב המוליך. שיטה זו מוגבלת לגידולים בגודל של עד 3 ס"מ אשר לא נמצאים בקרבת כלי דם. לאור מגבלות אלו, השימוש בשיטה זו אינה בשימוש רב בכבד. שיעור תופעות הלוואי בדרגה 3 ומעלה בשיטה זו מגיע לכ-3%, ותופעות לוואי בדרגות נמוכות יותר עומדות על כ-7%.
אמבוליזציה של עורקי הכבד - טיפולי הקרנה פנימית סלקטיבית (SIRT - Selective Internal Radiation Therapy)
רדיואמבוליזציה היא טיפול המבוסס על הזרקה של חלקיקים בגודל מיקרון הטעונים ברדיואיזוטופ. טיפול זה מבוסס על העברה סלקטיבית ומוכוונת של החלקיקים לגרורות בכבד באמצעות פורט-א-קאט (Port-A-Cath) ישירות לעורק הכבד, דרכו ודרך הענפים שלו מקבלות הגרורות את אספקת הדם לה הם זקוקים כדי לצמוח, וזאת מבלי לפגוע ברקמת הכבד הבריאה.
איטריום 90 (90-Y90 - Yttrium) הוא האיזוטופ הנפוץ ביותר המשמש לטיפולי SIRT. שיטה זו יכולה לשמש טיפול יחיד לחולים אשר אינם מגיבים לטיפול הכימי או בשילוב עם כימותרפיה סיסטמית. Y90 הוא איזוטופ הפולט קרני β בלבד. לאיזוטופ זה יש אנרגיה ממוצעת גבוהה (0.936 Mev), חדירות לרקמה מוגבלת (בין 2.5 מ"מ למקסימום 11 מ"מ), ומחצית חיים קצר של 64 שעות - מה שהופך אותו אידיאלי לטיפול מכוונן מטרה. לאחר שילובו לתוך גרגירים זעירים של זכוכית או שרף (Y90 (resin, מוזרק באופן סלקטיבי לתוך עורק הכבד או הענפים שלו[24]. ישנן שתי צורות זמינות מסחרית של טיפול בהקרנה פנימית סלקטיבית (SIR Spheres מסידני, אוסטרליה ו- TheraSphere Nordion, מאונטריו, קנדה). SIR-spheres מבוסס שרף, והגרגירים הם בקוטר -60 20 מיקרון. SIR-Spheres משמשים בעיקר לטיפול בגרורות והם קיבלו את אישור ה-FDA ב-2002. TheraSphere עשויים מזכוכית והם בקוטר 20–30 מיקרון. טיפול זה משמש בעיקר כטיפול בגידולים ראשוניים של הכבד.
כל החולים המועמדים לקרינה פנימית של Y90 חייבים לעבור צנתור מקדים של הכבד עם הזרקת טכנציום 99 מקרו-אגרגט (99-Tch MAA - Technetium-99 macroaggregated albumin). מטרת בדיקה זו היא להדגים את האנטומיה של עורקי הכבד ולמדוד את מידת הדלף לריאות.
טכנטיום 99 מקרו-אגרגט הוא בעל קוטר הדומה לגרגירי האיטריום, והוא משמש להערכת התפלגות הגרגירים במחזור הדם בכבד לפני הטיפול. דליפה לריאות גדולה מ-20% עלולה לגרום להתפתחות של דלקת מסוג פנאומוניטיס ומהווה התוויית נגד לטיפול Y900. הפרעות בתפקודי כבד או פקקת של וריד שער הכבד (הווריד הפורטלי) גם הם מהווים התוויות נגד[25][26].
בשנת 2016 פורסמה עבודה על מחקר אקראי בהשתתפות 530 חולים עם גרורות ממקור מעי גס ומחלה דומיננטית בכבד. עבודה זו משווה את הטיפול הכימי בתשלובת FOLFOX [חומצה פולינית, פלואורואורציל (5-FU) ואוקסליפלטין - Oxaliplatin (אלוקסיטין - Eloxatin) [27] עם אפשרות להוספת טיפול מכוון מטרה בבווציזומאב - Bevacizumab (אווסטין - Avastin)[28] לעומת טיפול דומה משולב עם קרינה פנימית וממוקדת לכבד (SIRT). הזמן הממוצע עד להתמקדות המחלה בקבוצה אשר טופלה SIRT-n היה 10.2 חודשים לעומת 10.7 חודשים בקבוצה אשר קיבלה טיפול תוך ורידי בלבד. הזמן הממוצע עד להתקדמות המחלה בכבד בלבד היה 12.6 חודשים בקבוצה אשר לא טופלה ב-SIRT לעומת 20.5 חודשים בקבוצה אשר קיבלה טיפול ב-SIRT וכימותרפיה. גם שיעור הנסיגה של הגרורות בכבד היה משמעותי יותר בחולים אשר קיבלו טיפול משולב. נתונים חדשים מראים שבחולים אשר קיבלו את הטיפול המשולב, והגרורות היו ממקור מעי גס ימני, היה שיפור גם בהישרדות (22 חודשים לעומת 17.1 חודשים). כאשר מקור הגרורות היה מעי גס שמאלי לא נצפה הבדל בהישרדות.
הספרות עדיין נחלקת לגבי השלב שבו יש להשתמש בטיפול זה במהלך המחלה. הטיפול הוא בטוח, עם תופעות לוואי כגון כאב, בחילה והפרעה בתפקודי כבד בשיעור של 5-1%, אם הוא מבוצע בידי צוות מנוסה. תופעות אלו חולפות לרוב בתוך כשבוע מהטיפול. מחלת קרינה של הכבד (Radiation Induced Liver Disease) היכולה לסכן את החולה נצפתה בפחות מ-1% מהמטופלים. על הטיפול ב-SIRT להיות מוגבל בחולים עם גרורות בכבד בלבד או בחולים המבטאים תסמינים בעקבות מחלה דומיננטית בכבד.
קרינה ממוקדת SBRT - Stereotactic Body Radiation Therapy
הטיפול הקרינתי הממוקד של גרורות בכבד ממקור המעי הגס זכה להבלטה לאחרונה. ההבנה הטובה יותר של סבולת הכבד לקרינה וטכניקות חדשות, מילאו תפקיד חשוב בהפחתת הרעילות ודיוק משופר של ההקרנות.
מחקרים מראים שטיפול זה בטוח ויעיל כטיפול בסרטן המעי עם גרורות בכבד. רמת רעילות בדרגה 2 ו-3 דווחה רק ב-9% ו-4% מהחולים בהתאמה[29]. חמישה מחקרים רטרוספקטיביים ושמונה מחקרים פרוספקטיביים בדקו שיטה זו בחולים עם גרורות בכבד. לא פורסמה אף עבודה מבוקרת בשלב 3. מנת הקרינה הניתנת נעה בין 30 ובין 60 Gy במקטע אחד עד שישה מקטעים[30][31].
ברוב העבודות הגודל המרבי של הגרורות היה 6 ס"מ, ומספר הגרורות אשר טופלו לא היה מעבר לחמש. שיעור הבקרה המקומי לאחר טיפול זה נע בין 70% ל-100% כעבור שנה של מעקב, ובין 60% ל-90% כעבור שנתיים. שיעור ההישרדות למשך שנתיים נע בין 30% ל-83%. כאשר גודל הגרורה מעל 3 ס"מ שיעור ההישרדות גרוע יותר[32].
סיכום טיפולים ממוקדים לגרורות כבדיות
הטיפול בקרצינומה של המעי עם גרורות בכבד מתפתח ללא הרף, עם התקדמות מוכחת בשילוב כימותרפיה וטיפול מכוון. שילוב שיטות אבלציה מקומית שונות עם הטיפול הסיסטמי מעלה את הסיכוי לתגובה. בחירת הטיפול המיטבי עבור כל מטופל צריכה להיות אינדיבידואלית ולהתבסס על דיון רב-תחומי. טיפולים ממוקדים לכבד הם בעלי סיכוי גבוה להורדת העומס הגידולי. עבודות פרוספקטיביות יענו בעתיד על השאלה אם לטיפולים אלו יש השפעה גם על הארכת החיים.
הגישה הניתוחית לגרורות ריאתיות
בסוף המאה ה-20 כריתת גרורות בריאות הפכה לטיפול שגרתי בחולים מתאימים, לאחר תהליך של בירור מקיף.
תהליך כריתת גרורה ריאתית פורסם לראשונה בספרות המקצועית בשנת 1882 על ידי Weinlechner, שניתח גרורה בודדת של סרקומה. אולם רק בשני העשורים האחרונים של המאה העשרים, ורק במרכזים מסוימים, הטיפול נעשה שגרתי בחולים עם גרורות מרובות או דו-צדדיות, על בסיס התוצאות הטובות שהושגו בסרקומה גרורתית[33]. טיפולים כימיים וביולוגיים יעילים למוקדים מיקרוסקופיים, אבל לא תמיד יכולים להתגבר על מחלה קלינית משמעותית. כתוצאה מהטיפולים החדשים, כריתת גרורות מאקרוסקופיות משמשת גם כטיפול להקטנת מסת הגידול או לסירוגין כהוכחה לרמיסיה.
בדיקות שנעשו בנתיחות לאחר המוות בחולים שנפטרו מסרטן, הוכיחו שב-29% מהמקרים הריאות היו המקום השני בשכיחותו בהתפתחות גרורות. ב-1978 Weiss & Gilbert פרסמו שב-20% מן הנתיחות, הריאות היו האיבר היחיד עם גרורות[34].
לרוב החולים עם גרורות ריאתיות, כריתת המחלה היא הדרך היחידה לריפוי, אבל מספר המועמדים הוא קטן יחסית, ותלוי במספר משתנים, דוגמת גרורות באיברים אחרים, תגובה לכימותרפיה ואפשרות לגידולים נוספים.
ב-1944 ביצע Blalock לראשונה כריתה ניתוחית של גרורה ריאתית מסרטן המעי הגס, והסדרה הראשונה פורסמה ב-1947 [35].
מאז, שיעור ההישרדות לחמש שנים לאחר הניתוח הריאתי משתנה מבית חולים אחד למשנהו, ועומד על טווח של 53-9%.
אבחנה, דירוג ובחירת חולים
לפי מחקרים של ארגון UICC (Union for International Cancer Control), הופעה של גרורות בריאות בקרב חולי סרטן המעי הגס משתנה על פי השלב של המחלה הראשונית: 0.6% בשלב 1, 2.2% בשלב 2, 9.8% בשלב 3 ו-24.6% בשלב 4.
פיזור גרורתי של סרטן המעי הגס והחלחולת מערב בלוטות לימפה אזוריות, כבד וריאות, אולם גרורות ריאתיות יכולות להופיע בלי מחלה תת-סרעפתית. גידולים ראשוניים של החלחולת יכולים לעקוף את הכבד דרך ניקוז ורידי אחר. לחולים עם גרורות ריאתיות, הטיפול הכימי יכול להקל על תסמיני המחלה, אך לא לרפא אותה. במאמר שפורסם על ידי חוקרים ממרכז הסרטן Memorial Sloan-Kettering, בקרב 144 חולים נבחרים שטופלו בכריתת גרורות ריאתיות, נמצא כי ההישרדות לחמש שנים הייתה 44%, ול-10 שנים 25%. חולים שקיבלו טיפול כימי בלבד לא שרדו יותר מ-24 חודשים באותה סדרה [36]. הסיכון של גרורות בריאה הוא גבוה בקרב חולי סרטן המעי הגס, עובדה הדורשת מעקב צמוד על ידי בדיקות הדמיה (CT) לעיתים קרובות. רוב הגרורות בריאה מתגלות אצל חולים ללא תסמינים נשימתיים.
כשממצא חדש בודד מופיע אצל חולה, חשוב לדעת אם מדובר בגרורה, בגידול ריאתי ראשוני או באבחנה אחרת. הבירור נעשה באמצעות ברונקוסקופיה או ניקור תחת CT. במידה ומדובר ביותר מנגע אחד, האפשרות הגרורתית גוברת.
בדיקות של רמת CEA, PET-CT, MRI מוח, קולונוסקופיה ואולטרסאונד כבד הן חשובות ביותר להערכה טרום ניתוחית. חולים עם גרורות בכבד יכולים להיות מועמדים לכריתת גרורות בריאה רק לאחר כריתת גרורות כבדיות. חולה עם בלוטות לימפה במייצר שהן חיוביות PEV7, חייב לעבור פרוצדורה אבחנתית כמו מדיאסטינוסקופיה או EBUS, ואם התשובה חיובית החולה לא יהיה מועמד לניתוח ריאתי.
הבחירה בטיפול כירורגי עבור חולים עם גרורות ריאתיות עוברת קודם כל דרך שליטה מוחלטת על המחלה הראשונית. בחולים עם גרורות דו-צדיות בבדיקת CT, כאשר הכריתה המלאה והפרוגנוזה בספק, הופעה של גרורות חדשות בתוך חודשיים תומכת בשלילת החלטה ניתוחית.
המצב הרפואי של החולה הוא קריטי. הוא חייב להיות כשיר להרדמה כללית, עם תפקודים לבביים וכלייתים תקינים ועם רזרבה של נפח נשימתי המסוגל לעמוד בכריתה בודדת או מרובה. חשוב ביותר שכל הנגעים המופיעים ^CT יעברו כריתה עם שוליים נקיים. כריתה לא שלמה תביא רק נזק לחולה.
טכניקה ניתוחית
כריתה שלמה של כל הגרורות בריאה היא הניתוח היחיד שיעזור לחולה. קיימות מספר אפשרויות ניתוחיות כדי להגיע לתוצאה הרצויה: טורקוטומיה אחורית-צדית רגילה עד מידסטרנוטומיה, טורקוטומיה דו-צדית טרנסטרנלית (clamshell thoracotomy) עד VATS (ניתוח חזה מונחה וידאו). כריתה מלאה של בלוטות לימפה אזוריות או של מדגם שלהן חייבת להיות חלק מכל ניתוח.
ניתוח חוזר, פעמיים-שלוש ואף יותר, מותר בחולים עם רזרבה ריאתית, כשהמחלה נמצאת בשליטה בכל הגוף, מלבד הריאות.
כריתת יתד של הגרורות היא הפרוצדורה הניתוחית המועדפת. התמותה היא אפסית במרבית הדיווחים בספרות, וההישרדות דומה לכריתה נרחבת יותר, בהתאם לגודל ומיקום הגרורות.
ידוע כי 10% לערך מחולי סרטן המעי הגס מפתחים גרורות ריאתיות, וכן כי ב-10% מאלה מדובר בגרורות בודדות. אין הוכחה שחולים עם גידול בחלחולת מפתחים יותר גרורות בריאה. חולים עם גרורות דו-צדיות שנותחו בו-זמנית שרדו פחות מאלה שעברו ניתוח בשלבים. משתנים רבים כמו גיל, מין, מיקום הגידול הראשוני, גודל הגרורות, זמן בין הניתוח במעי הגס להופעה של הגרורות, סוג הכריתה וגודל הכריתה - לא השפיעו על ההישרדות.
כריתה של כל בלוטות הלימפה או מדגם של מספר תחנות במיצר, הוא נתון חשוב לפרוגנוזה. הימצאות בלוטות נגועות בבית החזה פוסלת את הכריתה של גרורות ריאתיות. עלייה ^CEA מעל 10 ng/ml הוא נתון שלילי להישרדות [37] [38]. קיימת הישנות יתר של גרורות בחולים אלה.
גרורות בכבד שהן נתיחות אינן פוגעות בפרוגנוזה. Headrik-i Yano ,Regnard פרסמו מחקרים על חולים עם גרורות כבדיות שנותחו גם בריאות ללא הבדל בהישרדות [39]. ידוע בספרות שריבוי טורקוטומיות אינו פוסל כריתת גרורות ריאתיות חוזרות. קיימת אינדיקציה לכריתת גרורות חוזרת בקרב חולים עם תפקוד ריאה סביר ובלי חזרה של המחלה במקום אחר בגוף.
הספרות הרפואית מתארת את מספר הגרורות כנתון חשוב. Mansel הציג שיעור הישרדות של 49% בחולים עם גרורה אחת לעומת 8% בחולים עם יותר משתי גרורות, אבל אין מניעה לנתח חולים עם מספר רב של גרורות [40].
סיכום הגישה הניתוחית לגרורות ריאתיות
כריתת גרורות ריאתיות של סרטן המעי הגס היא טיפול עם תמותה ותחלואה נמוכים מאוד שמעניקים הישרדות משמעותית. מהספרות עולה שהגורמים הרלוונטיים לתוצאה טובה הם מספר הגרורות ורמת ה-CEA. מחקרים נוספים צריכים לבסס את התפקיד הגרורות בבלוטות הלימפה בבית החזה.
הגישה הניתוחית לגרורות בחלל הצפק
הצפק (peritoneum) הוא שכבה העוטפת את רוב האיברים בחלל הבטן, כולל הכבד, כיס המרה, המעי הדק, המעי הגס ועוד, ומהווה עבורם רובד הגנה ותמיכה. בין קפליו מתפתחים כלי הדם והעצבים של חלק גדול מאיברי הבטן.
גרורות בחלל הצפק מתפתחות בכ-10% ממקרי סרטן המעי הגס. בעבר נצפתה שרידות נמוכה לחולים עם מחלה גרורתית בצפק, והשרידות החציונית עמדה על שישה חודשים. עם הזמן התגבשה ההבנה שגרורות אלו מהוות למעשה התקדמות אזורית של המחלה, שבניגוד לגרורות לאיברים מרוחקים (לדוגמה, לריאה), אינה מתפשטת דרך מחזור הדם. הבנה זו הובילה להתפתחות טיפול מקומי משולב: ניתוח להסרת הנגעים הנראים בחלל הצפק (Cytoreductive Surgery - CRS) וכימותרפיה מחוממת לסילוק שארית התאים הסרטניים (Hyperthermic Intraperitoneal Chemotherapy - HIPEC).
בהקשר של מחלה ממאירה גרורתית, אנו מתייחסים לצפק כאל איבר נוסף בחלל הבטן. לכן סילוק המחלה מהצפק משפר שרידות ובמקרים מסוימים יכול להביא לריפוי, כפי שסילוק גרורות מהכבד משפר שרידות ויכול להביא לריפוי המחלה.
טיפול מותאם למחלה מוביל לשיפור השרידות
השימוש בתרופות כימיות, כגון אוקסליפלטין - Oxaliplatin (אלוקסטין - Eloxatin)[27] ואירימטקאן - Irinotecan (קאמפטו - Campto)[27] ושילובן עם תרופות מכווננות כגון בווציזומאב - Bevacizumab (אווסטין - Avastin)[28], הביאו לעלייה משמעותית בשרידות של חולים עם ממאירות מעי גס גרורתית. עם זאת, מחקרים הראו שהשרידות של חולים שלהם גרורות בצפק נשארה נמוכה. בחולים עם מחלה גרורתית ללא מעורבות הצפק, השרידות החציונית הייתה 20 חודשים. בהשוואה אליהם, בחולים עם גרורות בצפק נראתה שרידות חציונית של 15 חודשים בלבד [41], [42]. הפער בין ממצאים אלו משתלב היטב עם ההבנה שמחלה גרורתית בצפק שונה ביולוגית- הנגעים בצפק רגישים פחות לטיפול כימי סיסטמי (מערכתי) ובעלי אופי אלים יותר.
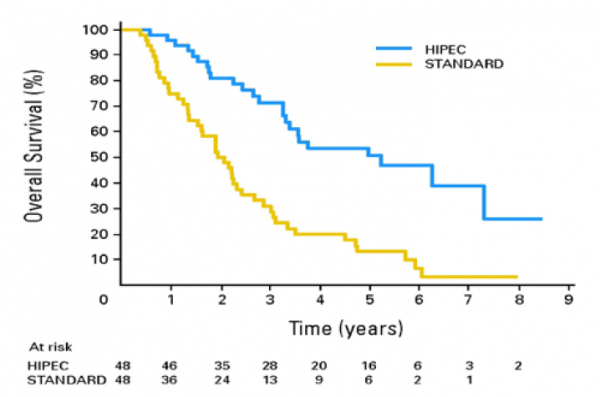
הכרת מאפיינים ייחודיים אלו הובילה לפיתוח מודל של טיפול המשלב ניתוח להסרת מסת הגידול, עם כימותרפיה מחוממת לחלל הצפק בזמן הניתוח וטיפול כימי או מכוונן משלים. תחת הטיפול המשולב אכן נראה שיפור משמעותי בשרידות של חולים עם מחלה ממוקמת בצפק, עם עלייה של כ-40 חודשים בשרידות החציונית (מ-24 חודשים ל-63 חודשים, איור מס' 1) [43]. גם בחולים שלהם מחלה מפושטת בצפק (>2 אזורים) נראה שיפור בשרידות החציונית, והוא עומד על 51 חודשים[44]. השיפור בשרידות נראה בכל תתי הסוגים ההיסטולוגיים של סרטן מעי - במקרים של אדנוקרצינומה חל שיפור ב שרידות החציונית מ-12.9 חודשים עם טיפול סיסטמי ל-32.8 חודשים עם טיפול ניתוחי משולב. במקרים היסטולוגיים של קרצינומה מסוג תאי טבעת חותם (signet ring cell carcinoma), שהוא נדיר יחסית ובעל פרוגנוזה גרועה, נראה שיפור בשרידות החציונית מ-9.3 חודשים בטיפול סיסטמי בלבד ל-20.2 חודשים בטיפול משולב[45].
הבסיס לטיפול משולב של ניתוח להסרת הנגעים בחלל הצפק וטיפול בכימותרפיה מחוממת
מטרת הניתוח היא לחסל ולסלק את המחלה המערבת את הצפק. הנגעים המאקרוסקופיים נכרתים או נצרבים בטכניקות ניתוחיות רגילות. נגעים שטחיים ניתנים לרוב לכריתה מקומית או צריבה. נגעים המערבים איברים אחרים, כגון המעי או השחלות, דורשים לעיתים כריתה של מקטע של האיבר המעורב. טיפול בכימותרפיה מחוממת משלים את הטיפול הניתוחי ונועד לפגוע באותם תאים ממאירים אשר אינם נראים לעין ו"חמקו" מהטיפול הניתוחי. באופן מעט לא צפוי, נמצא שתאים גידוליים רגישים לטמפרטורה גבוהה (בין 41–43 מעלות צלזיוס) ומתים בקצב מואץ בנוכחות חימום. חימום הכימותרפיה מעצים את יעילותה ובמקרה הזה מגביר את הרס התאים הממאירים[46]. מתן הכימותרפיה ישירות לחלל הבטן (שטיפה של החלל בכימותרפיה) מאפשר טיפול בריכוז גבוה יותר של התרופה, ללא תופעות הלוואי הנלוות למתן הסיסטמי. בהתאם, התכשירים בשימוש הם בעלי חדירה גבוהה לרקמה. התכשיר הנפוץ ביותר לגרורות ממקור של סרטן המעי הגס הוא מיטומיצין -Mitomycin (מיטומיצין סי - Mitomycin C)[27].
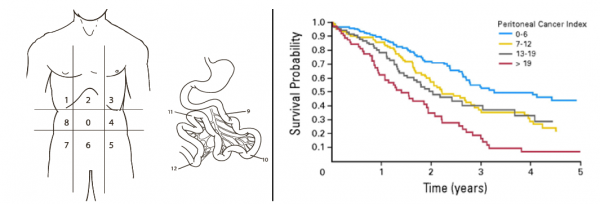
דירוג היקף המחלה הגרורתית בצפק נמדד על ידי חלוקת הבטן לאזורים וספירת כמות הגידול בכל אזור - בשיטה הקרויה מדד סרטן צפקי (Peritoneal Cancer Index - PCI). PCI נמוך קשור באופן ישיר לשרידות לאחר הניתוח. חולים עם מדד נמוך הם בעלי שרידות גבוהה פי חמישה מחולים עם מדד גבוה[47], ועל כן החשיבות הרבה לביצוע הניתוח בשלב מוקדם לאחר גילוי המעורבות של הצפק (איור מס' 2). היכולת להגיע לכריתה מלאה של הגידול נמצאה אף היא קשורה באופן ישיר לשרידות.
28,2010:1808 .Reprin ted with permission. 2010 American Societyof ClinicalOncology. All rights re served. Elias D.et al: JClin On col Vol
מחקרים שבדקו את חדירת החומר הכימותרפי לרקמה מצאו שיעילותו היא עד 3–5 מ"מ עומק, ועל כן קיימת חשיבות מכרעת לטכניקה הניתוחית והיכולת להסיר את הרקמה הגידולית עד לעובי הקטן מ-2.5 מ"מ. מדד שלמות כריתת הגידול (CC score) completeness of cytoreduction score - מעריך את כמות/עובי הרקמה הגידולית שנותרה לאחר הניתוח: ציון 0 מעיד על סילוק מלא של הגידול; ציון 1 - על כך שהרקמה שנותרה היא בעובי קטן מ-2.5 מ"מ; ציון 2 - על כך שהרקמה שנותרה היא בעובי של 2.5 מ"מ עד 2.5 ס"מ; ציון 3 - על כך שהרקמה שנותרה היא בעובי הגדול מ-2.5 ס"מ. רק במצבים שבהם ציון ה-CC הוא 0 או 1, יש אפשרות למתן כימותרפיה תוך ניתוחית. בשאר המצבים הכימותרפיה אינה משפרת שרידות ויכולה לגרום לתחלואה נוספת.
בניתוח הקלאסי שתואר בשנות ה-90 של המאה הקודמת על ידי פול שוגרבייקר (Paul Sugarbaker), כימותרפיה ניתנה בעת הניתוח למשך 90 דקות בטמפרטורה של בין 41–43 מעלות צלזיוס. מחקרים על פעילות הכימותרפיה בניתוח מראים שלאחר כ-30 דקות רוב התרופה נספגה ברקמה, ורמתה בנוזל מינימלית. במקביל, מעבר לנקודת זמן זו, התאים הממאירים מפתחים עמידות לתרופה[48]. בהתאם, שונה הפרוטוקול במרכזים הרפואיים בעולם המשתמשים בשיטה זו לטיפול הנמשך 30 דקות בטמפרטורה של בין 42–44 מעלות צלזיוס. קיים תפקיד חשוב לטיפול הכימי הסיסטמי (כלל גופי) הניתן לפני הניתוח ואחריו. טיפול קדם ניתוחי וטיפול משלים לאחר הניתוח נמצאו שניהם כגורמים חיוביים המאריכים שרידות באופן משמעותי.
בחירת חולים מועמדים לניתוח
מורכבות הניתוח והשילוב של הזלפת כימותרפיה מחוממת מחייבים בחירת חולים קפדנית. התוויות נגד לניתוח כוללות: מחלה גרורתית באיברים מרוחקים (חוץ בטניים), התקדמות המחלה תחת טיפול כימי, חסימת מעיים ומעורבות משמעותית של המעי הדק בגידול. ריבוי גרורות בכבד (>4) ומעורבות שופכנים הם התוויות נגד יחסיות. לכן, בחלק מהמקרים החולים יופנו לניתוחים משולבים, הכוללים כריתה חלקית של הכבד או כריתת שופכן/כליה בהתאם.
כשירות החולה לניתוח נבחנת על ידי צוות רב-תחומי הכולל את הרופא המנתח, מרדים, קרדיולוג או רופא ריאות (אם לחולה מחלה לבבית או ריאתית כרונית) ודיאטנית. חולים מבוגרים - מעל גיל 75 - יעברו בנוסף הערכה תפקודית על ידי רופא גריאטר.
ניתוח צפק
בעבר היה מקובל לבצע כריתה שלמה של קרום הצפק מכל חלל הבטן, כולל אזור הסרעפת, הכבד, הצפק הקדמי, האגן והשלפוחית - גם מאזורים שלא היו מעורבים באופן ישיר בגידול. היום מקובל לבצע כריתה מקומית אך ורק באזורים הנגועים במחלה, דבר המוריד את התחלואה הנלווית לניתוח. במהלך הניתוח מקובל לבצע כריתה של שומן בטני (אומנטום - omentum), כריתת כיס מרה, כריתת תוספתן (למניעת סיבוכים עתידיים) וכריתת שחלות מניעתית בשל הסיכון הגבוה של חזרה גרורתית באיברים אלה.
מינון הכימותרפיה והריכוז שלה נקבעים בהתאם לשטח הגוף, המחושב לפי משקל וגובה החולה. קיימות שתי שיטות עיקריות להזלפת הכימותרפיה בניתוח: השיטה "הסגורה" והשיטה "הפתוחה":
- השיטה הסגורה - לאחר סיום הניתוח לכריתת הגידול מונחים נקזים בבטן, החתך הניתוחי נסגר והכימותרפיה מוזלפת דרך הנקזים.
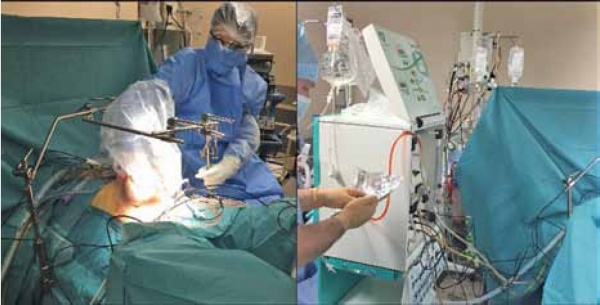
- השיטה הפתוחה - הזלפת הכימותרפיה נעשית במהלך הניתוח (איור מס' 3)
במרכזים עם ניסיון רב בניתוחים מסוג זה, לא נמצאו הבדלים בתוצאות לטווח ארוך בין שתי השיטות. לדעתנו, השיטה הפתוחה עדיפה, שכן היא מאפשרת לוודא שהכימותרפיה מתפזרת באופן אחיד בבטן. בנוסף, השיטה הפתוחה מאפשרת ביצוע השקות מעי לאחר הכימותרפיה, דבר החושף את קצוות המעי לטיפול ומונע חזרה של המחלה באזור ההשקה.
- תוצאות ניתוחיות
במרכזים מתמחים שיעור הסיבוכים והתמותה בניתוחים אלו מתקרב לזה של ניתוחי מעי גס רגיל. ניסיוננו מראה שמתוך 132 ניתוחים לממאירות בצפק שמקורם במעי הגס, לא נרשם אף מקרה תמותה (בתוך 3 חודשים מהניתוח). רק ב-14% מהמקרים התפתחו סיבוכים שדרשו התערבות או ניתוח חוזר. רוב הסיבוכים היו קשורים בדליפות מההשקות, דימום וסיבוכים שקשורים במערכת השתן. משך האשפוז הממוצע לאחר הניתוח (במקרים שבהם לא היו סיבוכים) היה 13 ימים.
ריפוי מחלה גרורתית לצפק
ההגדרה של ריפוי במחלת סרטן גרורתית היא מורכבת. המדד המקובל מתייחס לרוב לחמש שנים ללא עדות למחלה. מיעוטם של המחקרים מבצעים מעקב ארוך טווח של שרידות, אך הנתונים הקיימים מצביעים על כך שב- 22-16% מהחולים שנותחו בגישה המשולבת לא תהיה עדות למחלה במעקב של חמש שנים[49][50]. לפיכך, נראה שניתוח בשילוב כימותרפיה מחוממת וטיפול משלים אכן מאפשרים ריפוי מסרטן גרורתי לחלל הצפק.
מתוך 71 חולים שנותחו על ידינו בשל סרטן מעי גס גרורתי לצפק והיו במעקב של יותר מחמש שנים, נמצא ריפוי ארוך טווח (שרידות ללא מחלה חמש שנים לאחר הניתוח) ב-14.4% מהחולים. בדיקת המאפיינים של אותם חולים, מצאה שאכן העומס הגידולי בבטן (ה-PCI) היה נמוך יותר והמחלה הייתה ממוקמת יותר.
לדעתנו ניתן לשפר תוצאות של טיפול במחלה גרורתית של הצפק. עומס המחלה בבטן והיכולת לבצע כריתה שלמה של הגידול הם גורמים חשובים לניבוי שרידות. הפניית חולה בעת גילוי גרורות של הצפק למרכז המתמחה בטיפול בהן יאפשר לנתחו מוקדם ככל האפשר. כמו כן, במקרים בהם גרורות בצפק מזוהות בזמן הניתוח של הגידול הראשוני במעי, אנו ממליצים שלא להשלים את הניתוח ולהפנות את המטופל למרכז מומחה למחלה.
סיכום הגישה לגרורות בחלל הצפק
טיפול משולב לגרורות בחלל הצפק הביא לעלייה משמעותית בשרידות של החולים ובמקרים מסוימים אף מאפשר ריפוי מלא מהמחלה. קיימת חשיבות גדולה לטיפול בחולים אלה במרכזים בעלי ניסיון מיד לאחר זיהוי המעורבות של הצפק.
נכון למועד כתיבת מאמר זה, מתקיימים שלושה ניסויים קליניים שבודקים את התפקיד של ניתוח למניעת גרורות בצפק בחולים עם סיכון מוגבר לגרורות (לדוגמה, חולים המתייצגים עם התנקבות של הגידול במעי).
פיתוח שיטת PIPAC Pressurized Intra Peritoneal Aerosol Chemotherapy [51] המאפשרת הזלפת כימותרפיה בניתוח לפרוסקופי, מהווה אפשרות טיפול פליאטיבי במחלה לא נתיחה. השיטה מאפשרת טיפולים חוזרים להקטנת כמות המחלה בצפק והיא בעלת פוטנציאל להפוך מחלה לא נתיחה לנתיחה.
טיפול קרינתי לגרורות ממקור מעי גס
קרינה סטריאוטקטית ממוקדת, SBRT (Stereotactic Body Radiotherapy), היא שיטה המבוססת על הקרנה מדויקת עד רמת המילימטרים המסתמכת על מערכת דימות משוכללת (קרני רנטגן, שיקוף ו-CT) המשולבת במאיץ קווי. במסגרת טיפול זה, קרן חיצונית ממוקדת באזור מוגדר בגוף, בליווי אמצעי הדמיה ממוחשב, שמאפשר להגיע למנות קרינה גבוהות שיכולות לעשות אבלציה לגידול תוך כדי שמירה על רקמות בריאות מסביב.
קרינה בשיטת SBRT יעילה בהשגת שליטה מקומית בגידול עם תופעות לוואי מינימליות. טכנולוגיה זו לוקחת בחשבון תזוזות של הגידול בזמן הנשימה, ולכן נחשבת לטיפול מדויק. טרם הטיפול בודקים בזמן אמת את מיקום הגידול באמצעות ביצוע CT על מיטת המאיץ.
SBRT אינה מתאימה לכל החולים, אלא מיועדת בעיקר לחולים עם מחלה גרורתית מוגבלת המוגדרת 'אוליגומטסטטית', שבה בדרך כלל מעורבים עד כחמישה אתרים שבהם גרורה אחת בכל אחד. למעשה, זהו מצב ביניים בין סרטן מקומי למחלה מפושטת מאוד.
בהשוואה לקרינה פליאטיבית קונבנציונלית, קרינת SBRT היא טיפול בעל יעילות גבוהה, במספר קטן של מקטעים (פרקציות), בין 3–5 טיפולים לגרורה.
קרינה זו הפכה לאפשרות זמינה בטיפול בגרורות ממקור מעי הגס בישראל.
יש מספר עבודות רטרוספקטיביות וגם עבודות פרוספקטיביות בפאזה ראשונה ושנייה, שבדקו מנות שונות ומספר טיפולים שונים בגרורות בכבד, בריאות, בבלוטות הלימפה, בחזרות מקומיות באגן, באדרנלים ובחוליות[52]. אין עבודות רנדומליות שמשוות SBRT בטיפול בגרורות מול טיפול מקומי אחר כגון ניתוח או radiofrequency.
גרורות בכבד
הטיפול הסטנדרטי הוא טיפול כימי ומכוון מטרה, משולב עם ניתוח כריתת גרורות בכבד. השרידות לחמש שנים בטיפול זה נעה בין 25% ל-50%. גרורות נתיחות רק בקרב 20% מהחולים.
בוצעו עבודות רטרוספקטיביות אצל חולים לא נתיחים טכנית או עם התוויית נגד לניתוח. שליטה מקומית הושגה SBRT ב-80% ויותר לשנתיים, וההישרדות לשנתיים נעה בין 83-32% [53][54][55][56].
גרורות בריאות
אחרי כריתת גרורות בריאות, שיעור החזרות המקומיות עומד על 28-19%. יש מספר עבודות שבדקו מתן SBRT לחולים שלא ניתן לנתחם. מנות הקרינה היו שונות, השליטה המקומית בגרורות הייתה יותר מ-80% וההישרדות לשנתיים הייתה 86-33%.
מבחינת תופעות לוואי, פנאומוניטיס בדרגה 3 ויותר אובחנה ב-8-0% מהחולים[57].
בעבודה רטרוספקטיבית שהשוותה במרכז אחד תוצאות של ניתוח !-SBRT, נמצא כי למרות שבקבוצת הקרינה החולים היו מבוגרים יותר, עם זמן להופעת גרורות קצר יותר, ועם פרוגנוזה טובה פחות - התוצאות מבחינת ההישרדות היו שוות[58].
גרורות בבלוטות לימפה
חזרת המחלה בבלוטות לימפה רטרופריטונאליות מופיעה ב-15% מהחולים עם סרטן מעי גס. מיקום זה בעייתי לניתוח. קיימים מספר מחקרים שנתנו שלושה טיפולים במנות של 36–51 Gy. ההישרדות הממוצעת לשלוש שנים הייתה 71%, אך עקב קירבה למעי קיים סיכון לתופעות לוואי כגון חסימת מעיים ופרפורציה[53].
גרורות בעצמות
בניגוד לקרינה רגילה שניתנת רק למטרת הקלה בכאב, טיפול ב-SBRT יכול להשיג גם שליטה מקומית. לפי עבודות שונות הושגה שליטה מקומית ב-94-81% מהמקרים[59].
גרורות באדרנל
שכיחות גרורות באדרנל ממעי גס היא 1%. בעבודה שבדקה שלושה טיפולים ב-SBRT למנה של 36 Gy הושגה שליטה מקומית לשנתיים ב-90%, בלי תופעות לוואי משמעותיות.
סיכום גרורות ממקור מעי גס
קיימות מספר עבודות רטרוספקטיביות שבהן ניתן טיפול ב-SBRT בגרורות ממקור מעי גס שכללו מספר קטן של חולים עם מנות ומספר טיפולים שונים של קרינה. בעבודות אלה מתוארות תוצאות טובות של שליטה מקומית ושיפור בהישרדות עם תופעות לוואי מינימליות. עדיין אין מחקרים פרוספקטיביים שמשווים בין ניתוח או טיפול מקומי אחר לקרינה בשיטת SBRT.
אפשר להמליץ על טיפול ב-SBRT בקבוצות חולים אלה:
- חולים עם מספר גרורות מצומצם, 4-3, אשר אינן נתיחות
- חולים עם גרורות לא נתיחות עקב מיקומן
- חולים עם התקדמות גרורה באתר אחד של מחלה ושליטה של גרורות אחרות עם טיפול סיסטמי, כדי לא להפסיק קו טיפול קיים
- חולים שלא מעוניינים בניתוח
היתרון ב-SBRT על פני שיטות טיפול אחרות הוא עצם היותו בלתי פולשני, ויעילותו הגבוהה במטופלים הנמצאים בסיכון מוגבר לסיבוכים כירורגיים וכאלה שמעדיפים טיפול חלופי אשר אינו מצריך אשפוז ממושך.
ביבליוגרפיה
- ↑ הרישום הלאומי לסרטן והמרכז הלאומי לבקרת מחלות משרד הבריאות. סרטן המעי הגס והחלחולת בישראל. [עדכון הנתונים, מרץ 2017 [הודעה לעיתונות מתוך http://www.health.gov.il/PublicationsFiles/ICR_05032017.pdf
- ↑ Sanoff HK, Sargent DJ, Campbell ME, et al. Five-year data and prognostic factor analysis of oxaliplatin and irinotecan combinations for advanced colorectal cancer: N9741. J Clin Oncol. 2008 Dec 10;26(35):57217־.Epub 2008 Nov 10.
- ↑ Gallinger S, Biagi JJ, Fletcher GG, et al. Liver resection for colorectal cancer metastases. Curr Oncol. 2013 Jun;20(3):e255-65.
- ↑ 4.0 4.1 Fong Y, Fortner J, Sun RL, et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg. 1999 Sep;230(3):309-21.
- ↑ Charnsangavej C, Clary B, Fong Y, et al. Selection of patients for resection of hepatic colorectal metastases: expert consensus statement. Ann Surg Oncol. 2006 Oct;13(10):1261-8. Epub 2006 Sep 1.
- ↑ Pawlik T, Scoggins C, Zorzi D, et al. Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases. Ann Surg. 2005 May;241(5):715-24.
- ↑ Haddad R, Ogilvie R, Croitoru M, et al. Microsatellite instability as a prognostic factor in resected colorectal cancer liver metastases. Ann Surg Oncol. 2004 Nov;11(11):977-82. Epub 2004 Oct 15.
- ↑ 8.0 8.1 Alvarez FA, Sanchez-Claria R, Oggero S, et al. Parenchymal-sparing liver sugery in patients with colorectal carcinoma liver metastases. World J Gastrointest Surg. 2016 Jun 27;8(6):407-23.
- ↑ 9.0 9.1 Torzilli G, Adam R, Vigano L, et al. Surgery of colorectal liver metastases: pushing the limits. Liver Cancer. 2016 Nov;6(1):80-89. Epub 2016 Nov 29.
- ↑ Kemeny N. Management of liver metastases from colorectal cancer. Oncology (Williston Park). 2006 Sep;20(10):1161-76, 1179.
- ↑ Van Cutsem E, Nordlinger B, Adam R, et al. Towards a pan-European consensus on the treatment of patients with colorectal liver metastases. Eur J Cancer.2006 Sep;42(14):2212-21 Epub 2006 Aug 10.
- ↑ Fong Y, Fortner J, Sun RL, et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg. 1999 Sep;230(3):309-18.
- ↑ Scheele J, Stangl R, Altendorf-Hofmann A. Hepatic metastases from colorectal carcinoma: impact of surgical resection on the natural history. Br J Surg. 1990 Nov;77(11):1241-6.
- ↑ Grothey A, Sargent D, Goldberg RM, et al. Survival of patients with advanced colorectal cancer improves with the availability of fluorouracil-leucovorin, irinotecan, and oxaliplatin in the course of treatment. J Clin Oncol. 2004 Apr 1;22(7):1209-14.
- ↑ Benoist S, Brouquet A, Penna C, et al. Complete response of colorectal liver metastases after chemotherapy: does it mean cure? J Clin Oncol. 2006 Aug 20;24((24):3939-45.
- ↑ Elias D, Sideris L, Pocard M, et al. Incidence of unsuspected and treatable metastatic disease associated with operable colorectal liver metastases discovered only at laparotomy (and not treated when performing percutaneous radiofrequency ablation). Ann Surg Oncol. 2005 Apr;12(4):298- 302Epub 2005 Mar 14.
- ↑ Amersi FF, McElrath-Garza A, Ahmad A, et al. Long-term survival after radiofrequency ablation of complex unresectable liver tumors. Arch Surg. 2006 Jun;141(6):581-7.
- ↑ Poon RT, Ng KK, Lam CM, et al. Learning curve for radiofrequency ablation of liver tumors: prospective analysis of initial 100 patients in a tertiary institution. Ann Surg. 2004 Apr;239(4):441-9.
- ↑ Wood TF, Rose DM, Chung M, et al. Radiofrequency ablation of 231 unresectable hepatic tumors: indications, limitations, and complications. Ann Surg Oncol. 2000 Sep;7(8):593-600.
- ↑ Gillams AR, Lees WR. Survival after percutaneous, image-guided, thermal ablation of hepatic metastases from colorectal cancer. Dis Colon Rectum. 2000 May;43(5):656-61.
- ↑ de Baere T, Elias D, Dromain C, et al. Radiofrequency ablation of 100 hepatic metastases with a mean follow-up of more than 1 year. AJR Am J Roentgenol. 2000 Dec;175(6):1619-25.
- ↑ Qian J. Interventional therapies of unresectable liver metastases. J Cancer Res Clin Oncol. 2011 Dec;137(12):1763-72. Epub 2011 Sep 11.
- ↑ 23.0 23.1 Ruers T, Punt C, Van Coevorden F, et al. Radiofrequency ablation combined with systemic treatment versus systemic treatment alone in patients with non-resectable colorectal liver metastases: a randomized EORTC Intergroup phase II study (EORTC 40004). Ann Oncol. 2012 Oct;23(10):2619-26. Epub 2012 Mar 19.
- ↑ Garrean S, Joseph Espat N. Yttrium-90 internal radiation therapy for hepatic malignancy. Surg Oncol. 2005 Dec;14(4):179-93. Epub 2006 Mar 9.
- ↑ Carr BI. Hepatic arterial 90Yttrium glass microspheres (Therasphere) for unresectable hepatocellular carcinoma: interim safety and survival data on 65 patients. Liver Transpl. 2004 Feb;10(2 Suppl 1):S107-10.
- ↑ Salem R, Lewandowski R, Roberts C, et al. Use of Yttrium-90 glass microspheres (TheraSphere) for the treatment of unresectable hepatocellular carcinoma in patients with portal vein thrombosis. J Vasc Interv Radiol. 2004 Apr;15(4):335-45.
- ↑ 27.0 27.1 27.2 27.3 או תרופות המכילות חומר פעיל זהה בעלות שמות מסחריים אחרים
- ↑ 28.0 28.1 או תרופות המכילות חומר פעיל דומה בעלות שמות מסחריים אחרים
- ↑ Engels B, Everaert H, Gevaert T, et al. Phase II study of helical tomotherapy for oligometastatic colorectal cancer. Ann Oncol. 2011 Feb;22(2):362-8. Epub 2010 Aug 4.
- ↑ Engels B, Gevaert T, Everaert H, et al. Phase II study of helical tomotherapy in the multidisciplinary treatment of oligometastatic colorectal cancer. Radiat Oncol. 2012 Mar 16;7:34-43.
- ↑ 2Milano MT, Katz AW, Muhs AG, et al. A prospective pilot study of curative-intent stereotactic body radiation therapy in patients with 5 or fewer oligometastatic lesions. Cancer, 2008 Feb 1;112(3):650-8.
- ↑ Hoyer M, Roed H, Traberg Hansen A, et al. Phase II study on stereotactic body radiotherapy of colorectal metastases. Acta Oncol. 2006;45(7):823-30.
- ↑ Martini N, McCormak PM, Bains MS: Indications for surgery for intrathoracic metastases in testicular carcinoma. Semin Oncol. 1979 Mar;6(1):99-101.
- ↑ Weiss L, Gilbert HA. (Eds.) Pulmonary Metastasis. Boston: Springer Netherlands, 1978; 142.
- ↑ Blalock A. Recent advances in surgery. N Engl J Med. 1944 Aug 17;231(7):261-67
- ↑ McCormack PM, Burt ME, Bains, MS, et al. Lung resection for colorectal metastases. 10-year results. Arch Surg. 1992 Dec;127(12):1403-6.
- ↑ Saito Y, Omiya H, Kohono K, et al. Pulmonary metastasectomy for 165 patients with colorectal carcinoma: a prognostic assessment. J Thorac Cardiovasc Surg. 2002 Nov;124(5):1007-13.
- ↑ Baron O, Amini M, Duveau D, et al. Surgical resection of pulmonary metastases from colorectal carcinoma: five-year survival and main prognostic factors. Eur J Cardiothorac Surg. 1996;10(5):347-51.
- ↑ Yano T, Hara N, Ichinose Yet al. Results of pulmonary resection of metastatic colorectal cancer and its application. J Thorac Cardiovasc Surg. 1993 Nov;106(5):875-9.
- ↑ Mansel JK, Zinsmeister AR, Pairolero PC, et al. Pulmonary resection of metastatic colorectal adenocarcinmoma. A ten year experience. Chest 1986 Jan;89(1):109-12.
- ↑ Sadeghi B, Arvieux C, Glehen O, et al. Peritoneal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer. 2000 Jan 15; 88(2):358-63.
- ↑ Franko J, Shi Q, Goldman CD, et al. Treatment of colorectal peritoneal carcinomatosis with systemic chemotherapy: a pooled analysis of North Central Cancer Treatment Group phase III trials N9741 and N9841. J Clin Oncol. 2012 Jan 20; 30(3):263-7. Epub 2011 Dec 12.
- ↑ Elias D, Lefevre JH, Chevalier J, et al. Complete cytoreductive surgery plus intraperitoneal chemohyperthermia with oxaliplatin for peritoneal carcinomatosis of colorectal origin. J Clin Oncol. 2009 Feb 10; 27(5):681-5. Epub 2008 Dec 22.
- ↑ Benizri EI, Bernard JL, Rahili A, et al. Small bowel involvement is a prognostic factor in colorectal carcinomatosis treated with complete cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy. World J Surg Oncol. 2012 Apr 11;10:56-64.
- ↑ Simkens GA, Razenberg LG, Lemmens VE, et al. Histological subtype and systemic metastases strongly influence treatment and survival in patients with synchronous colorectal peritoneal metastases. Eur J Surg Oncol. 2016 Jun;42(6):794-800. Epub 2016 Mar 28.
- ↑ Gonzalez-Moreno S, Gonzalez-Bayon LA, Ortega- Perez G. Hyperthermic intraperitoneal chemotherapy: rationale and technique. World J Gastrointest Oncol. 2010 Feb 15;2(2):68-75.
- ↑ Elias D, Gilly F, Boutitie F, et al. Peritoneal colorectal carcinomatosis treated with surgery and perioperative intraperitoneal chemotherapy: retrospective analysis of 523 patients from a multicentric French study. J Clin Oncol. 2010 Jan 1;28(1):63-8. Epub 2009 Nov 16.
- ↑ rigand C. Etude de pharmaco Mitomycine resultats de Strasbourg. [Oral Presentation in French]. Presented at: 11eme Journee Francophone du trait des carcinoses peritoneales par Chirurgie et Chimiotherapie Intra-Peritoneale. 2017 Jun 16.
- ↑ Goere D, Malka D, Tzanis D, et al. Is there a possibility of a cure in patients with colorectal peritoneal carcinomatosis amenable to complete cytoreductive surgery and intraperitoneal chemotherapy? Ann Surg. 2013 Jun;257(6):1065-71.
- ↑ Cashin PH, Dranichnikov F, Mahteme H. Cytoreductive surgery and hyperthermic intra- peritoneal chemotherapy treatment of colorectal peritoneal metastases: cohort analysis of high volume disease and cure rate. J Surg Oncol. 2014 Aug;110(2):203-6. Epub 2014 May 21.
- ↑ Solass W, Hetzel A, Nadiradze G, et al. Description of a novel approach for intraperitoneal drug delivery and the related device. Surg Endosc. 2012 Jul;26(7):1849- 55. Epub 2012 May 12.
- ↑ Takeda A, Sanuki N, Kunieda E. Role of stereotactic body radiotherapy for oligometastasis from colorectal cancer. World J Gastroenterol. 2014 Apr 21;20(15): 4220-9.
- ↑ 53.0 53.1 Seo YS, Kim MS, Yoo HJ, et al. Stereotactic body radiotherapy for oligo-recurrence within the nodal area from colorectal cancer. World J Gastroenterol. 2014 Feb 28;20(8):2005-13.
- ↑ Wulf J, Guckenberger M, Haedinger U, et al. Stereotactic radiotherapy of primary liver cancer and hepatic metastases. Acta Oncol. 2006;45(7):838-47.
- ↑ Vautravers-Dewas C, Dewas S, Bonodeau F,et al. Image-guided robotic stereotactic body radiation therapy for liver metastases: is there a dose response relationship? Int J Radiat Oncol Biol Phys. 2011 Nov 1;81(3): e39-e47. Epub 2011 Mar 4.
- ↑ Scorsetti M, Arcangeli S, Tozzi A, et al. Is stereotactic body radiation therapy an attractive option for unresectable liver metastases? a preliminary report from a phase 2 trial. Int J Radiat Oncol Biol Phys. 2013 Jun 1;86(2):336-42. Epub 2013 Feb 20.
- ↑ Ricardi U, Filippi AR, Guarneri A, et al. Stereotactic body radiation therapy for lung metastases. Lung Cancer. 2012 Jan;75(1):77-81. Epub 2011 Jul 2.
- ↑ Widder J, Klinkenberg TJ, Ubbels JF, et al. Pulmonary oligometastases: metastasectomy or stereotactic ablative radiotherapy? Radiother Oncol. 2013 Jun;107(3):409-13. Epub 2013 Jun 14.
- ↑ Sahgal A, Ames C, Chou D, et al. Stereotactic Body Radiotherapy Is Effective Salvage Therapy for Patients With Prior Radiation of Spinal Metastases. Int J Radiat Oncol Biol Phys. 2009 Jul 1;74(3):723-31.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר ריאד חדאד - מנהל מחלקה כירורגית, המרכז הרפואי כרמל, חיפה; ד"ר אלכסנדר בני - מנהל שירות גידולי מערכת העיכול, המכון האונקולוגי, המרכז הרפואי רמב"ם, חיפה; ד"ר מילטון סאוטה - מנהל המחלקה לניתוחי ריאות במערך לניתוחי לב וחזה, המרכז הרפואי רבין, קמפוס בילינסון, פתח תקווה; פרופ׳ דניאל בן-שימול, ד"ר רן אורגד, פרופ׳ חנוך קשתן - חטיבה כירורגית, המרכז הרפואי רבין, קמפוס בילינסון, פתח תקווה; הפקולטה לרפואה ע"ש סאקלר, אוניברסיטת תל אביב, ד"ר יוליה קונדל - רופאה בכירה, היחידה לרדיותרפיה, מכון אונקולוגי, מרכז הסרטן ע"ש דוידוף, המרכז הרפואי רבין, פתח תקווה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק