טנסין - Tensin
| מדריך בדיקות מעבדה | |
| טנסין | |
|---|---|
| Tensin | |
| |
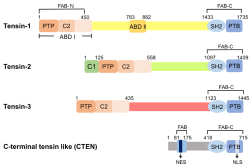
המבנה של ארבעת הטנסינים
| |
| מעבדה | כימיה בדם |
| תחום | אינטראקציה בין מערכות איתות תאיות |
| יוצר הערך | פרופ' בן-עמי סלע |
הפיזיולוגיה של טנסינים
טנסינים הם משפחה של חלבוני ספיחה המורכבת ביונקים מ-4 חלבונים TNS3 ,TNS2 ,TNS1:ו-TNS4. המקטעים הרבים המרכיבים אותם ופעילותם, תורמים לקשר המולקולרי בין המשתית החוץ תאית (ECM) לבין מבנים cytoskeletals כמו גם תורמים להעברת איתותים הקשורים למגוון תהליכים פיזיולוגיים כגון שגשוג, תאים, התקשרות בינתאית ותנועת תאים. טנסינים חיוניים לשמר מבנים רקמתיים נורמליים ותפקודיים, בעיקר בלב בכליות וברגנרציה של שרירים. טנסין דווח לראשונה בשנת 1991 כחלבון הקושר אקטין המכיל מקטע SH2 (או Src homology 2) שהוא motif קישור חדש הספציפי ל-pTyr (או phosphotyrosine) (Davis וחב' ב Science משנת 1991).
טנסין הוא פוספו-פרוטאין ציטופלזמטי הממוקם בנקודות ספיחה המתווכות על ידי integrin. הוא נקשר לפילמנטים של אקטין, ומכיל מקטע הנקשר לפוספו-טירוזין (להלן PTB), המגיב עם הזנבות הציטופלזמטיים של integrin. אינטראקציות אלו מאפשרות לטנסין לקשור פילמנטים של אקטין לקולטנים של integrin. לפיכך, טנסין פועל כפלטפורמה לכִּנּוּס/פיזור של קומפלקסים של איתות בנקודות הספיחה המקומיות על ידי גיוס של מולקולות איתות כגון טירוזין מפוספר דרך מקטע SH2 וכן על ידי אספקת נקודות קישור לחלבונים אחרים המכילים SH2. אנליזה של עכברי knockout, הדגימה תפקידים קריטיים של טנסין בתפקוד הכליות, ברגנרציה של השריר, ובנדידת תאים. לכן טנסין ומולקולות איתות הקשורות אליו יכולים להוות יעד של התערבויות תרפויטיות במחלת כליות, בריפוי פצעים ובסרטן. טנסין ממוקם גם באזורים מסוימים בממברנה הקרויים Lo) focal adhesions וחב' ב-J Biol Chem משנת 1994), הנוצרים סביב גרעין טרנס-ממברנלי של הטרודימר של integrin. המקטע החוץ-תאי של integrin נקשר לחלקיק של ה-ECM, והזנב הציטופלזמטי שלו יוצר את אזור העיגון של הפילמנטים של אקטין (Hynes ב- Cell משנת 1992). טנסין מועבר במהירות לאזורי ה-focal adhesion על ידי ליגציה של integrin (Miyamoto וחב' ב-Science משנת 1995).
הרצף הראשון של cDNA של טנסין בודד בשנת 1991 מתרנגולת על ידי Davis וחב' (ב-Science משנת 1991). הדבר אפשר את האפיון של החלבון, מבחינת המבנה והתפקוד שלו. ברור שטנסין היא מולקולה חיונית בקישור של ה-ECM, אקטין, והעברת איתותים. טנסין הוא חלבון רב-מקטעים המסוגל להיקשר למספר מולקולות איתות. טנסין יכול להתחלק לשלושה אזורים: האזור ה-N-טרמינלי מכיל את המקטע הקושר פילמנטים של אקטין. אזור זה מכיל גם פעילות של focal adhesion-binding (להלן FAB) וכן את הרצף ההומולוגי של PTEN. האזור המרכזי של טנסין מכיל את ABD II המעכב את פילמור אקטין. האזור ה-C-טרמינלי מכיל את מקטעי SH2, PTB, ואזור אחר של FAB.
ה-PTB מגיב עם זנבות integrin. הטנסינים 1, 2 ו-3 של האדם משומרים ביותר באזורים ה-N וה-C טרמינלים. מקטע C1 (או protein kinase C conserved region 1) מצוי רק בטנסין 2. האזורים המרכזיים של חלבוני טנסין השונים חסרי הומולוגיה ברצפים שלהם. מקטע SH2 של טנסין מאפשר לו להיקשר לחלבונים המכילים טירוזין מפוספר כולל ,P13 kinase p130Cas ו-FAK (Auger וחב' ב-J Biol Chem משנת 1996). טנסין מכיל גם מקטע PTB בקצה ה-C-טרמינלי שלו (או phosphotyrosine-binding) שאינו מגיב עם חלבונים המכילים טירוזין מפוספר (Chen ו-Lo ב-Biochem J משנת 2003). במקום זאת, PTB נקשר ל-motifs NPXY בזנבות הציטופלזמטיים של β integrin (Calderwood וחב' ב- Proc Natl Acad Sci USA משנת 2003).
כיוון שהפרגמנטים של טנסין נוקו במקור ביחד עם vinculin מאפרוחי gizzard, הוצע שהוא מסוגל לקשור vinculin, אך אין כל ראיות לכך. שני אתרי FAB נמצאו באזורי ה-N טרמינל וה-C טרמינל של טנסין. שני אתרי FAB אלה קריטיים לתפקודים הביולוגיים של טנסין כגון מעורבותו בנדידת תאים. טנסין מפוספר על שיירי טירוזין, סרין, ו-threonine. הפוספורילציה של טירוזין בטנסין מוחשת על ידי טיפול בתאים עם ה-ECM, ה-PDGF, תרומבין ואנגיוטנסין, כמו גם על ידי אונקוגנים הכוללים Src ו- BCR/ABL (Bockholt ו-Burridge ב-J Biol Chem משנת 1993, Ishida וחב' ב-J Clin Invest משנת 1999, Jiang וחב' ב-Surgery משנת 1996). לטנסין יש הומולוגיה ברצף עם PTEN, GAK ו-auxilin.
מרכיב אחד, calpain II, ממוקם בתוך focal adhesions והוא מסוגל לבקע את מולקולת טנסין לפרגמנטים קטנים שלה. העיכול של טנסין ומולקולות נוספות בתוך ה-focal adhesion, על ידי calpain II, נראה תהליך חשוב בשמירה על המורפולוגיה של התא. טנסין עובר ביקוע במהלך אפופטוזיס, המתבצע על ידי קסקדה של שפעולים רציפים של האנזים caspase. תת-יחידות 3, 6 ו-7 של caspase אחראיות לביצוע האפופטוזיס, על ידי ביקוע של חלבונים מסוימים. טנסין הוא אחד המצעים של caspase 3, מה שמצביע שביקועו הוא שלב קריטי בפגיעה במבנה של focal adhesion במהלך אפופטוזיס.
האינאקטיבציה המכוונת של הגן המקודד לטנסין, מצביעה על תפקידו בעכברים. בעוד שעכברים נטולי טנסין גדלו באופן נורמלי, ורוב הרקמות של העכבר היו בריאות באופן עקבי, ציסטות רבות התפתחו בכליות של עכברים מבוגרים יותר. העכברים מתו בדיעבד מכשל כלייתי, מה שמדגים את חשיבות טנסין בתפקוד התקין של הכליות (Lo וחב' ב-J Cell Biol משנת 1997). בנוסף, הגברה של פי-9 של סיבי שריר שלד מגורענים (בלתי בשלים), נמצאה בעכברים נטולי טנסין (Ishii ו-Lo ב-Biochem J משנת 2001). כאשר נבחן תהליך הרה-גנרציה של תאי שריר שלד שניזוקו באופן ניסיוני בעכברים נטולי טנסין, הודגם שתהליך הרה-גנרציה היה איטי בהרבה בעכברים נטולי טנסין, בהשוואה לסיבי שריר שלד של עכברי-בר, מה שמרמז לכך שטנסין מעורב ברה-גנרציה של שריר השלד. אנליזה של פיברובלסטים שבודדו מעוברי עכברים, הראתה שבעכברים נטולי טנסין הפיברובלסטים נדדו לאט יותר באופן משמעותי בהשוואה לאלה של עכברי-בר (Chen וחב' ב-Proc Natl Acad Sci USA משנת 2002). אפיון נוסף הראה שהמיקום של focal adhesion והפעילות הקושרת פוספו-טירוזין של מקטע SH2 קריטיים בנדידת תאים המבוקרת על ידי טנסין (Chen ו-Lo ב-Biochem J משנת 2003). שלוש מולקולות (טנסין 2, טנסין 3 ו-cten), עם הומולוגיה ניכרת לטנסין הודגמו (Lo ו-Lo ב-Cancer Res משנת 2002). בהתבסס על רצף החלבון והמבנים הגנומיים, שלושת המולקולות האחרונות הן מייצגות בבירור משפחה הנובעת מגן בודד. האזורים המשומרים ביותר הם בקצוות ה-N טרמינלי וה-C טרמינלי. כיוון ש-CTEN הוא פוליפפטיד קצר יותר, וחסר את הקצה ה-N טרמינלי המופיע בטנסינים אחרים, ההומולוגיה מוגבלת ל-C טרמינוס, המכיל את מקטעי SH2 ו-PTB. נראה אם כן, שכל הצורות של טנסין הן בעלות פעילות קישור לאקטין, לפוספוטירוזין ול-integrin, עם יוצא מהכלל של CTEN שאינו מסוגל לקשור אקטין.
CTEN או C-terminal tensin-like ידוע גם כטנסין 4, חבר במשפחת הטנסינים. CTEN, כמו שלושת החברים האחרים במשפחת טנסין, ממוקם באתרי foacl adhesion, אך רק בעל הומולוגיה ברצף חומצות האמינו עם הטנסינים האחרים בקצה ה-C טרמינלי שלו, המכיל את מקטעי SH2 ו-PTB. CTEN מבוטא באופן ניכר בבלוטת הערמונית הנורמלית ובשלייה, אך ביטויו בערמונית פוחת בסרטן של בלוטה זו. עם זאת, ביטוי-יתר של CTEN כרוך לעיתים קרובות עם סרטן השד, הקיבה, המעי הגס, הריאות, העור והלבלב. שדרוג של CTEN מעודד נדידת תאים, מאריך את האיתות דרך הקולטן של epidermal growth factor מעודד טומורוגניות. עדויות חדשות מרמזות לכך ש-CTEN הוא סמן מבטיח ויעד טיפולי סוגי סרטן שונים.
למרות הדמיון הגבוה ברצף חומצות האמינו של הטנסינים השונים, האזורים המרכזיים שלהם הם בעלי מגוון נרחב, מה שמרמז לכך שכל טנסין כשלעצמו הוא בעל תפקידים ביולוגיים ייחודיים. אכן, אספקטים שונים של תפקודי טנסין הם בעלי עניין רפואי. ההיסטולוגיה של כליות בעכברים נטולי-טנסין מגלה את הטריאדה האופיינית של nephronophthisis אנושי עם הרס של הממברנה האבובית, עם ectasis אבובי ועם דלקת אינטרסטיציאלית. לפיכך, עכברים נטולי-טנסין יכלו לשמש כמודל בחיות ל- nephronophthisis אנושי או למחלות כליה דומות. טנסין מכיל רצפי הטרינוקלאוטיד CAG נשנים, כאשר התופעה של CAG repeats התגלתה בחלבונים רבים הרלוונטיים למחלות העוברות בתורשה כמו במחלת Huntington. מספרם של GAG repeats בטנסין של תרנגולות, בקר ואדם הוא 2, 12 ו-9, בהתאמה, מה שמצביע ש-motif זה אינו יציב במהלך האבולוציה. יהיה זה מעניין לדעת האם המתווה של CAG repeats של טנסין משחק תפקיד בפתוגנזה של מחלות באדם. אנליזה של ביטויי טנסין במטופלים עם מחלת הסרטן ובשורות תאים סרטניים מביאה למחשבה שאיבוד של ביטוי טנסין עלול להיות שלב מוקדם של התמרת תאים נורמליים. אם כן, טנסין והאיתותים הקשורים אליו יכולים לשמש סמנים או יעדים להתערבות תרפויטית בסרטן.
המבנה של טנסין
המבנה של מולקולת טנסין אופיין על ידי light scattering ,electron microscopy ופילטרציה בג'ל. התוצאות מראות שטנסין יכול ליצור דימר (Lo וחב' ב-J Biol Chem שנת 1994). חלבון טנסין טבעי או ריקומביננטי נדדו על SDS gel כמולקולות בעלות משקל מולקולרי של 220 קילו-דלטון, אף על פי שהמשקל המולקולרי המחושב הצפוי היה של 185 קילו-דלטון. הסתירה הזו במשקל המולקולרי נובעת מכך שהקטע המרכזי של טנסין הוא בעל תכונות נדידה איטיות על ג'ל (Chen חב' ב-Biochem J משנת 2000).
סינתזה ופירוק של טנסין
טנסין מבוטא באופן נרחב ברקמות שונות כגון לב, שרירי שלד, כליות, ריאות, מעי דק, כבד, מעי גס, ערמונית, אשכים ושחלות. נוכחות נמוכה או אי-נוכחות מוחלטת של טנסין אופיינית למוח, לתימוס, וללויקוציטים בצירקולציה. טנסין הוא מצע לפחות לשתי משפחות של פרוטאזות: calpain ו-caspase. שפעול של calpains מתרחש בתגובה למגוון של גירויים פיזיולוגיים והוא כרוך בפרוטאוליזה של מספר חלבונים תאיים.
תפקוד ביולוגי
התפקוד התברר בעיקר במחקר בעכברים. בה בשעה שעכברים נטולי-טנסין התפתחו באופן נורמלי, כאשר כל הרקמות בעכברים אלו היו תקינות, התפתחו ציסטות רבות בכליות של עכברים מבוגרים יותר. העכברים הנגועים נפטרו בדיעבד בגלל כשל כלייתי, מה שמעיד על כך שיש דרישה לטנסין לתפקוד תקין של הכליות (Lo וחב' ב-J Cell Biol משנת 1997). בנוסף, הגידול פי-9 בסיבים של שרירי שלד נמצא בעכברים נטולי-טנסין.
טנסין במחלות אדם
המעורבות של טנסין בתחלואה אנושית נלמדת מאנליזה של מודלים בחיות, ומ-GWAS או genome-wide association studies. דרך GWAS זוהה TNS1 כאחד מהגנים הגורמים ל-mitral valve prolapse (להלן MVP) (Dina וחב' ב-Nature Genet משנת 2015), תפקוד הריאות (Panasevich וחב' ב-Acta Pedo משנת 2013, ו-Repapi וחב' ב-Nature Genet משנת 2010), ב-COPD (Artigas וחב' ב-Am J Respir Crit Care משנת 2011, ו-Yang וחב' ב-Respirology משנת 2014), ואסתמה עם מאפיינים של קדחת השחת (Ferreira וחב' ב-J Allergy Clin Immunol משנת 2014).
מספר גורמים משרים פוספורילציה של טירוזין בטנסין. לפיכך, טנסין פועל כפלטפורמה של התכנסות או מניעת התכנסות של קומפלקסים המשמשים לאיתותה דרך focal adhesions על ידי גיוס מולקולות איתות כגון טירוזין מפוספר, וכן על ידי אספקת אתרי אינטראקציה עם חלבונים אחרים (Lo ב- Int J Biochem & Cell Biol משנת 2004). Haynie טוען לעומת זאת שהראיות הניסיוניות המצביעות על קשר ספציפי של טנסין עם פילמנטים של אקטין אינן מוחלטות (Haynie ב- Proteins: Structure, Function, and Bioinformatics משנת 2014). ניסוי אחר הדגים ש-TNS3 ו-TNS4 מגויסים למארג של keratin בתאי אפיתל, מה שמדגיש את חשיבותם ב- mechano-transduction (Cheah וחב' ב-Proc Natl Acad Sci USA משנת 2019). אין ספק שכל אחד מהטנסינים 1, 2 ו-3 מכיל מקטע PTP (או protein tyrosine phosphatase) ליד הקצה ה-N-טרמינלי. עם זאת, מקטע ה-PTP אינו פעיל בטנסין 1, בגלל מוטציה בציסטאין נוקלאופילי חיוני ההופכת אותו לארגינין (Haynie וחב' ב-Protein Sci משנת 1996). אף על פי כן, phosphatidylinositol-3,4,5-trisphosphate 3-phosphatase, סמן ידוע של מדכא סרטן הידוע כ-PTEN, מקבל את שמו מההומולוגיה עם PTP וטנסין 1 (Li וחב' ב-Science משנת 1997). השוואות מבניות יותר מפורטות גילו שטנסינים 1, 2 ו-3, PTEN ו-auxilin וכן חלבונים נוספים בחיות, בצמחים ובפטריות. מכילים מקטע-על הידוע כ- Haynie) PTP-C2 ו-Xue ב-Protein Sci משנת 2015). מקטע-על זה נוצר לפני מיליארד שנים, והוא משמש כיחידה מורשת בודדה עד ימינו אלה.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 