לוקמיה לימפובלסטית חריפה - Acute lymphoblastic leukemia
| לוקמיה לימפובלסטית חריפה | ||
|---|---|---|
| Acute Lymphoblastic Leukemia | ||
| 250px | ||
Two girls with ALL demonstrating intravenous access for chemotherapy
| ||
| ICD-10 | Chapter C 91.0 | |
| ICD-9 | 204.0 | |
| MeSH | D054198 | |
| יוצר הערך | ד"ר חזי גנזל, פרופסור יעקב מ' רואו | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה לימפובלסטית חדה (חריפה)
מבוא
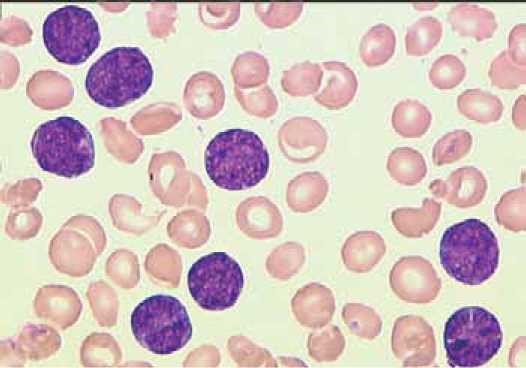
לוקמיה לימפובלסטית חריפה (ALL, Acute Lymphoblastic Leukemia) היא מחלה ממארת המתאפיינת בייצור מוגבר והצטברות עודפת של תאים לימפואידים צעירים - לימפובלסטים, ממקור תאי B או T. התאים הולכים וממלאים את מח העצם, ובשלב כלשהו יוצאים גם לדם הפריפרי (תמונה מספר 1). הצטברות התאים הללו במח העצם גורמת לפגיעה קשה בייצור של תאי דם תקינים מכל השורות (תאים לבנים, תאים אדומים וטסיות) ולתסמינים כלליים. הסקירה הנוכחית תתמקד יותר ב-ALL במבוגרים.
אפידמיולוגיה
שיעור ההיארעות של המחלה בארצות הברית הוא 1.5 ל-100,000. גילאי השיא של המחלה הם 5-2 ואחרי גיל 50. המחלה שכיחה יותר בקרב אוכלוסייה לבנה, עשירה ועירונית.
אטיולוגיה
האטיולוגיה של המחלה אינה ידועה. רמזים למצב גנטי מקדים ניתן למצוא בתיאורי המקרים של התפתחות סימולטנית של המחלה בקרב תאומים זהים ובכך שהמחלה נמצאת בשכיחות גבוהה יותר בקרב הסובלים מתסמונות גנטיות, כגון דאון, קלינפלטר ופנקוני. חשיפה מוקדמת לקרינה או לחומרים כימיים נמצאה כגורם אפשרי להתפתחות המחלה. תתי-סוגים ספציפיים של המחלה קשורים לזיהומים ויראליים, כגון: EBV (Epstein-Barr Virus) ו-HTLV1 (Human T-Lymphotropic Virus 1).
קליניקה
התפשטות התאים במח העצם פוגעת בתפקודו התקין. כתוצאה מכך יסתמן החולה לעתים קרובות עם נויטרופניה החושפת אותו לזיהומים שונים, כולל אופורטוניסטיים. אנמיה תגרום לחולשה, סחרחורת וקוצר נשימה במאמץ קל. טרומבוציטופניה תביא לנטייה לדמם. בנוסף יכולים להופיע תסמינים סיסטמיים כגון: כאבי עצמות, חום, הזעות וירידה במשקל. לעתים יש מעורבות של איברים לימפטיים, כך שהחולה עשוי להופיע עם בלוטות לימפה מוגדלות או כבד/טחול מוגדלים. בכ-10 אחוזים מהמקרים יש מעורבות של מערכת העצבים המרכזית שיכולה להתבטא בשלל תסמינים, כלליים או ממוקדים. בגברים תיתכן מעורבות אשכים. במקרה של ALL ממקור תאי T, מסתמנים החולים הרבה פעמים עם גוש מדיאסטינלי שעלול לגרום לקשיי נשימה, תפליטים פלאורלים ופריקרדיאלים ותסמונת הווריד הנבוב העליון (Superior vena cava syndrome).
קלסיפיקציה - סיווג המחלה
בשנות ה-70 של המאה ה-20 שלטה קלסיפיקציה מורפולוגית, שחילקה את המחלה לשלוש קבוצות (L1-3) בהתאם למראה הלימפובלסטים[1]. צביעות ציטוכימיות עזרו להבדיל בין לוקמיה מיאלואידית אקוטית (AML - Acute Myeloid Leukemia) ל-ALL[2]. בשנות ה-80 החלו לסווג את הלימפובלסטים לכאלו ממקור תאי B וכאלו ממקור תאי T, וכן בהתאם לשלב ההתפתחותי שלהם. קלסיפיקציה זו נשענת בעיקר על טכניקת ה-Flow cytometry (תמונה מספר 2). באמצעות שיטה זו ניתן לזהות חלבונים שונים היושבים על פני התא הממאיר או בתוך הציטופלסמה שלו. לתאי B ו-T ולכל שלב התפתחותי שלהם יש הרכב חלבוני מסוים. כך לדוגמה, CD19 מופיע על פני הלימפוציט מסוג B כבר בשלב מוקדם ביותר, ואילו CD20 נוסף על פני התא רק בשלב מאוחר יותר. באופן זה חולקו הלימפובלסטים מסוג Pro B, Pre B, mature B :B, ואילו אלה מסוג T חולקו ל: Early T, cortical T, mature T.
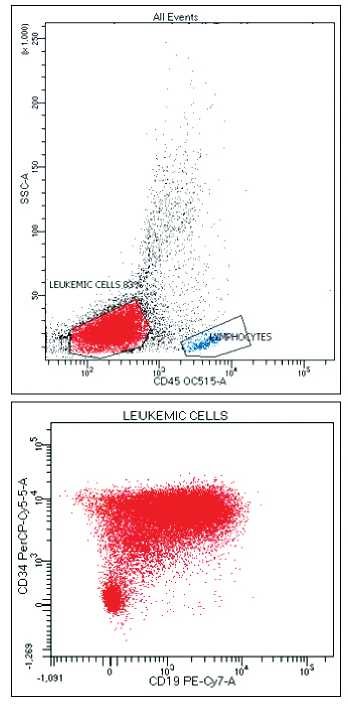
(בוצע בידי אתי ברודי, מעבדת אפיון תאים, המרכז הרפואי שערי-צדק).
במקביל לקלסיפיקציה זו התפתחה קלסיפיקציה הנשענת על הפרעות ציטוגנטיות או מולקולריות. שיטה זו הולכת ומשתכללת ומעפילה בחשיבותה על קודמותיה[3]. חשיבותה היא לא רק ביכולתה לחזות פרוגנוזה של חולה ואולי לגרום לשינוי באגרסיביות הטיפול הניתן לו, אלא גם בכך שהפרעות מסוימות יכולות להוות יעד טיפולי ספציפי. כך קרה לגבי אחת מתתי-הקבוצות הראשונות שהתגלו: חולים עם כרומוזום פילדלפיה (בבדיקת קריוטיפ) או טרנסלוקציה 9,22 (בבדיקת FISH - Fluorescence In situ Hybridization) או מציאות הגן BCR/ABL1 (בבדיקת PCR - Plymerase Chain Reactionֿ). הפרעה זו מופיעה בעד כ-40 אחוזים מחולי ALL בגיל המבוגר[4]. היא הרבה יותר נדירה בילדות, ולחולים שנושאים אותה פרוגנוזה גרועה במיוחד. בהמשך הסתבר שהפרעה זו יכולה להוות דווקא יעד טיפולי אפקטיבי, ועל כך יורחב בהמשך. ישנן הפרעות ציטוגנטיות נוספות בחולי ALL, הכוללות טרנסלוקציות שונות, חסר של חלקי כרומוזומים ועודף או חסר של כרומוזומים שלמים בתא הממאיר.
פקטורים פרוגנוסטיים
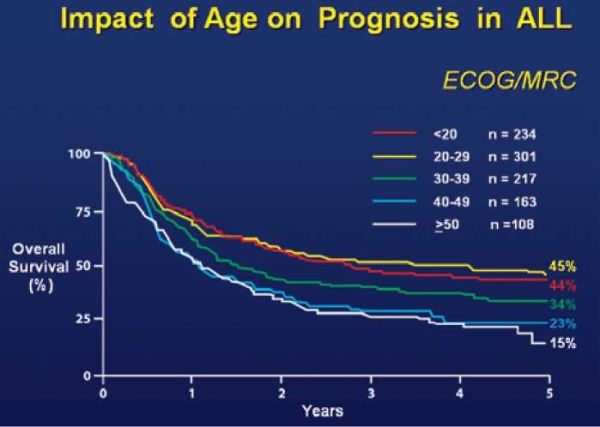
ניתן לחלק את הפקטורים הפרוגנוסטיים לכאלו המתבררים סביב האבחנה ולכאלו הקשורים למידת התגובה. גיל מבוגר וספירה לבנה גבוהה באבחנה התגלו כבר לפני שנים כפקטורים פרוגנוסטיים רעים ב-ALL ונותרו כאלו גם בימינו. לא רק שלמבוגרים פרוגנוזה גרועה משל ילדים, אלא שעם העלייה בגיל - הפרוגנוזה נעשית גרועה יותר[5] (תמונה מספר 3). ספירה לבנה גבוהה נהוג להגדיר, בשרירותיות מסוימת, מעל 30x10^9 ב-ALL ממקור תאי B ומעל 100X10^9 ב-ALL ממקור תאי T. בדיקת אפיון התאים נשארה בימינו חשובה, מבחינה פרוגנוסטית, בעיקר בנוגע ל-ALL ממקור תאי T. תת-הקבוצה המכונה Cortical T ALL טומנת בחובה פרוגנוזה טובה יותר מהסוגים האחרים. ב-B-ALL ישנם מחקרים המצביעים על כך שנוכחות החלבון CD20 על פני התא הינה סמן פרוגנוסטי רע. מבחינה ציטוגנטית/מולקולרית, כבר תיארנו את טרנסלוקציה (9,22) כ'רעה', אך כך גם טרנסלוקציות (4,11), (8,14) ונוכחות קריוטיפ מורכב (Complex karyotype). קריוטיפ היפרדיפלואידי, לעומת זאת, נחשב כמבשר פרוגנוזה טובה[6].
ההגדרה הפורמלית של הפוגה מלאה לאחר טיפול ב-ALL היא התנרמלות ספירת הדם ונוכחות של פחות מ-5 אחוזים בלסטים במח העצם. הגדרה זו הינה גסה ומסתמכת על כך שמעט בלסטים יכולים להימצא גם במח עצם בריא. עם התקדמות הטכנולוגיה והמחקר נמצאו שיטות שונות להערכה עדינה ומדויקת יותר של תגובה לטיפול. השיטות הללו מכונות "שיטות להערכת שארית מינימלית של מחלה״ (Minimal Residual Disease - MRD). הטכניקות השונות כוללות שימוש ב-PCR, Flow cytometry ובאופן מחקרי אף ב-Gene sequencing). לכל שיטה יתרונות וחסרונות מבחינת הרזולוציה שלה, מידת התאמתה לכלל תתי-הסוגים של ALL, יכולת השימוש בעזרים אוניברסליים מול הצורך לבנות כאלו ספציפיים לחולה, משך הזמן עד להנפקת תשובה ויכולת התמודדות עם שינוי שחל בתאי הלוקמיה[7]. מחקרים שונים, בעיקר כאלו העוסקים בטיפול בילדים, הראו שבדיקת MRD, בזמנים כגון יום 11 או יום 24 לתחילת טיפול האינדוקציה (יש עבודות עם לוחות זמנים אחרים לביצוע הבדיקה), מנבאת במידה גבוהה את הפרוגנוזה הצפויה לחולה [8]. השימוש ב-MRD לצורך חיזוי פרוגנוזה וקבלת החלטות טיפוליות, הפך לסטנדרט הטיפולי המקובל בעולם בטיפול בילדים הסובלים מ-ALL. בטיפול במבוגרים חולי ALL או בממאירויות המטולוגיות אחרות, השימוש ב-MRD עדיין נחשב למחקרי.
טיפול
את הטיפולים הקלאסיים ב-ALL ניתן לחלק לשני סוגי פרוטוקולים:
- "BFM (Berlin-Frankfurt-Munster) model": מודל זה פותח היסטורית עבור טיפול ב-ALL של ילדים. בשיטה זו פועלים פרוטוקולים כמו אלו של CALGB (Cancer and Leukemia Group B), GMALL (German Multicenter Study Group for Adult ALL), ECOG (Eastern Cooperative Oncology Group). בפרוטוקולים הללו יש שתי פאזות של טיפול אינדוקציה. הראשונה מבוססת על וינקריסטין סולפאט (Vincristine sulphate), פרדניזון (Prednisone), אדריאמיצין (Adriamycine) ואספרגינאז (L-asparaginase). השנייה מבוססת על שילוב של ציקלופוספמיד (Cyclophosphamide,Endoxan), ARA-C (Cytrabone HCL, Cytarabine) ו-6MP (Puri-Nethol, 6-Mercaptopurine). המשך הטיפול כולל טיפולי קונסולידציה המכילים תרופות מרובות, טיפול מאוחר של "אינדוקציה חוזרת" וטיפול אחזקה. לאורך כל הדרך ישנו שימוש באספרגינאז
- Hyper-CVAD[9]: פרוטוקול זה הוא בעל שני חלקים הניתנים לסירוגין. הוא רעיל הרבה יותר למח העצם, אינו כולל אספרגינאז, וה-6MP כלול בו אך ורק בשלב טיפול האחזקה. בשני המודלים, לאחר כניסה להפוגה יש להחליט אם החולה נשלח להשתלת מח עצם אלוגנאית או שממשיך במספר חודשי טיפול אגרסיביים שלאחריהם טיפול אחזקה ממושך של כשנתיים. הסוגיה של שליחת חולים להשתלת מח עצם בהשיגם הפוגה ראשונה אינה תמיד חד-משמעית. חולים שנחשבים בסיכון גבוה ושנמצא להם תורם מתאים במשפחה - יישלחו להשתלה. לגבי חולים בסיכון רגיל או כאלו בסיכון גבוה, אך רק עם תורם פוטנציאלי מחוץ למשפחה - הנושא שנוי במחלוקת
טיפולים חדשים
Philadelphia chromosome positive ALL (Ph-pos ALL) - כאמור, החולים הללו נחשבו שנים כבעלי הפרוגנוזה הגרועה ביותר בקרב חולי ALL. הדבר התבטא בשיעורים נמוכים יותר של השגת הפוגה מלאה, בשיעורים גבוהים של חזרת המחלה לאחר השגת הפוגה ובשרידות כוללת קצרה יותר. עם גילוי התרופות ממשפחת מעכבי טירוזין קינאז (TKIs, Tyrosine Kinase Inhibitors) מהפכה בטיפול בחולי לוקמיה מיאלואידית כרונית (CML - Chronic Myeloid Leukemia) - מחלה שגם בה מתבטאת הטרנסלוקציה (9,22). הפסיקו לשלוח את חולי CML להשתלת מח עצם אלוגנאית, ובמקום זאת הם טופלו בתרופה אימטיניב (Imatinib, Glivec ממשפחת ה-TKIs. באופן דומה נעשו ניסיונות לטפל בחולי Ph-pos ALL בעזרת תרופות אלו. מחקרים הראו ששימוש בתרופות ממשפחת ה-TKIs בחולים הללו יכול להעלות את מספר החולים שנכנסים להפוגה ושיוכלו להישלח להשתלת מח עצם אלוגנאית[10]. בחולים שאינם מתאימים להשתלה, אם בגלל גילם ומצבם הרפואי הכללי או משום שאין להם תורם מתאים, יכול טיפול כזה להאריך משמעותית את השרידות שלהם[11]. למרות ההתקדמות העצומה שחלה בתחום, עדיין לא ברור איזו תרופה ממשפחת ה-TKIs היא האידיאלית לחולים הללו ומה המשלב הטיפולי המוצלח ביותר שראוי לתת עם ה-TKI.
Philadelphia chromosome negative (Ph-neg ALL) ALL - ההתקדמות במחלה זו קשורה לתחום של האימונותרפיה (Immunotherapy):
- נוגדנים: על פני הלימפובלסט ישנם חלבונים שונים שיכולים להוות יעד לטיפול על ידי נוגדנים. קיימים נוגדנים מסוגים שונים:
- נוגדנים 'עירומים' (Naked antibodies) - נוגדנים הנקשרים לחלבון ומאותתים לתא לעבור אפופטוזיס. דוגמה לנוגדן כזה הוא הריטוקסימאב (Rituximab, Mabthera). נוגדן זה מתחבר לחלבון CD20 על פני הלימפובלסט (אינו קיים בלימפובלסטים צעירים מאוד) וגורם לתא לעבור אפופטוזיס. טיפול זה הוכח כבר לפני שנים כיעיל ומשפר פרוגנוזה כמעט בכל הלימפומות ממקור תאי B, ורק לאחרונה הוכחה יעילותו הרבה גם בחולי B-ALL אשר CD20 נמצא בשיעור של לפחות 20 אחוזים על פני הלימפובלסטים שלהם[12]
- נוגדנים מקושרים (Immunoconjugates) - ישנם נוגדנים הקשורים לתרופה כימית, אחרים מצומדים לחומר רדיואקטיבי המשחרר קרינה מקומית, ויש כאלו המחוברים לרעלן, לרוב ממקור חיידקי, שיכול לפגוע בתאים אליהם הוא חודר. הרעיון הטיפולי הוא להביא את החומר הפעיל ישירות אל תא הלוקמיה, באמצעות נוגדן לחלבון הנמצא על פני התא. דוגמה לנוגדן כזה הוא Inotuzumab ozogamicin אשר נקשר לחלבון CD22 על פני הלימפובלסט, עובר אינטרנליזציה מהירה אל תוך התא ואקטיבציה של החומר הכמותפרי המצומד (calicheamicin) בתוך הליזוזום. החומר הכמותרפי הפעיל נכנס לגרעין התא ומוביל לאפופטוזיס. תרופה זו נבדקה בחולי ALL מתקדמים והוכיחה יעילות מסוימת אך מוגבלת[13]
- BiTE antibodies - אלו נוגדנים מהונדסים שיש להם שני אזורים וריאביליים שונים הנקשרים מצד אחד לתא הגידול ומצד שני ללימפוציט מסוג T. הרעיון הוא להצמיד בין תא הלוקמיה לתא T נורמלי של החולה ולאפשר לזה האחרון לפגוע בתא הלוקמיה ולגרום למותו. הנוגדן מסוג זה, שיש בו לעת עתה את הניסיון הרב ביותר, הוא בלינטומומב (Blinatumomab, Blincyto). נוגדן זה נקשר לחלבון CD19 על פני תא הלוקמיה, אך גם לחלבון CD3 שעל פני תא ה-T. נוגדן זה הראה עד כה יעילות מדהימה, כאשר כ-70 אחוזים מהחולים עם B-ALL שטופלו בו נכנסו להפוגה מלאה או למצב קרוב לכך[14]. היעילות הרבה הובילה לאישור מהיר יחסית של התרופה על ידי ה-FDA (Food and Drug Administration) האמריקני
- Chimeric Antigen Receptors (CARs): טכניקה ייחודית זו מבוססת על הוצאת תאי T של החולה עצמו ועיבודם על מנת שיבטאו עליהם קולטן ספציפי לתאי הגידול של החולה. כאשר התאים מוחזרים לחולה הם בעלי יכולת לזהות את תאי הגידול ולהורגם. CARs הם חלבונים שיש בהם אזור אחד שיכול לזהות אנטיגן על פני תאי הלוקמיה (כגון CD19) ואזור נוסף שיכול לשפעל את תא ה-T. השימוש בטכנולוגיה זו הוא עדיין מחקרי בלבד, אך ניסיונות ראשוניים הראו הצלחה יוצאת דופן[15]. יש לציין ששתי הטכניקות האחרונות שהוזכרו, נוגדני BiTE ושיטת CARs, מנסות להפעיל את מערכת החיסון הטבעית של החולה. בשני המקרים נצפו תופעות לוואי נוירולוגיות קשות הקשורות כנראה לשחרור לא מבוקר של ציטוקינים. לכן, שתי התרופות ניתנות בתחילה בתנאים מבוקרים מאוד, כמו של יחידה לטיפול נמרץ
סיכום
ALL היא מחלה ממארת, השכיחה הרבה יותר בילדים. הקלסיפיקציה של המחלה וגורמי הסיכון הולכים ונסמכים יותר ויותר על פקטורים ציטוגנטיים ו/או מולקולריים. לאלה יש גם פוטנציאל להוות יעד טיפולי אפשרי. היעדים הטיפוליים נסמכים על טכניקות שונות להערכת MRD. תרופות ממשפחת ה-TKIs הולכות ומשנות את פניה של Ph-pos ALL. בה בעת ישנן טכנולוגיות אימוניות חדשות החודרות לעולם הטיפול ב-Ph-neg ALL.
ביבליוגרפיה
- ↑ Pantazopoulos N, Sinks LF. Morphological criteria for prognostication of acute lymphoblastic leukaemia. Br J Haematol. 1974;27(1):25-30
- ↑ Hayhoe FG. Cytochemistry of the acute leukaemias. Histochem J. 1984;16:1051-9
- ↑ Rowe JM. Prognostic factors in adult acute lymphoblastic leukaemia. Br J Haematol. 2010; 150(4):389-405
- ↑ Burmeister T, Schwartz S, Bartram CR, et al. Patients' age and BCR-ABL frequency in adult B-precursor ALL: a retrospective analysis from the GMALL study group. Blood. 2008;112(3):918-9
- ↑ 5.0 5.1 Rowe JM, Buck G, Burnett AK, et al. Induction therapy for adults with acute lymphoblastic leukemia: results of more than 1500 patients from the international ALL trial: MRC UKALL XII/ECOG E2993. Blood. 2005;106(12):3760-7
- ↑ Moorman AV, Harrison CJ, Buck GA, et al. Karyotype is an independent prognostic factor in adult acute lymphoblastic leukemia (ALL): analysis of cytogenetic data from patients treated on the Medical Research Council (MRC) UKALLXII/Eastern Cooperative Oncology Group (ECOG) 2993 trial. Blood. 2007; 109(8):3189-97
- ↑ Bruggemann M, Schrauder A, Raff T, et al. Standardized MRD quantification in European ALL trials: proceedings of the Second International Symposium on MRD assessment in Kiel, Germany, 18¬20 September 2008. Leukemia. 2010;24(3):521-35
- ↑ Bruggemann M, Raff T, Flohr T, et al. Clinical significance of minimal residual disease quantification in adult patients with standard-risk acute lymphoblastic leukemia. Blood. 2006;107(3):1116-23
- ↑ Kantarjian H, Thomas D, O'Brien S, et al. Long¬term follow-up results of hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone (Hyper-CVAD), a dose-intensive regimen, in adult acute lymphocytic leukemia. Cancer. 2004; 101(12):2788-801
- ↑ Ribera JM, Garcia O, Montesinos, P et al. Treatment of young patients with Philadelphia chromosome¬positive acute lymphoblastic leukaemia using increased dose of imatinib and deintensified chemotherapy before allogeneic stem cell transplantation. Br J Haematol. 2012;159(1):78-81
- ↑ Vignetti M, Fazi P, Cimino G, et al. Imatinib plus steroids induces complete remissions and prolonged survival in elderly Philadelphia chromosome-positive patients with acute lymphoblastic leukemia without additional chemotherapy: results of the Gruppo Italiano Malattie Ematologiche dell'Adulto (GIMEMA) LAL0201-B protocol. Blood. 2007;109(9):3676-8
- ↑ Maury S, Chevret S, Thomas X, et al. Addition of rituximab improves the outcome of adult patients with CD20-positive, Ph-negative, B-cell precursor acute lymphoblastic leukemia: results of the randomized Graall-R 2005 study. 2015 ASH Annual Meeting. [abstract]. Abstract 1
- ↑ Kantarjian H, Thomas D, Jorgensen J, et al. Results of inotuzumab ozogamicin, a CD22 monoclonal antibody, in refractory and relapsed acute lymphocytic leukemia. Cancer. 2013; 119(15):2728-36
- ↑ Topp MS, Gokbuget N, Zugmaier G, et al. Phase II trial of the anti-CD19 bispecific T cell-engager blinatumomab shows hematologic and molecular remissions in patients with relapsed or refractory B-precursor acute lymphoblastic leukemia. J Clin Oncol 2014; 32 (36):4134-40
- ↑ Maude SL, Teachey DT, Porter DL, Grupp SA. CD19- targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia. Blood. 2015;125(26): 4017-23
המידע שבדף זה נכתב על ידי ד"ר חזי גנזל ופרופסור יעקב מ' רואו - המרכז הרפואי שערי צדק, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק