לוקמיה מיאלואידית כרונית - Chronic myelogenous leukemia
| לוקמיה מיאלואידית כרונית - עבר, הווה ומה צופן העתיד | ||
|---|---|---|
| Chronic myelogenous leukemia | ||
| 250px | ||
בדיקת היברידיזציה פלואורסצנטית באתר חיובית לכרומוזום פילדלפיה בשלב המטפאזה של התא
| ||
| שמות נוספים | CML | |
| ICD-10 | Chapter C 92.1 | |
| ICD-9 | 205.1 | |
| MeSH | D010677 | |
| יוצר הערך | ד"ר עדי שחם אבולעפיה, פרופסור פיה רענני | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה מיאלואידית#לוקמיה מיאלואידית כרונית
מבוא
לוקמיה מיאלואידית כרונית (CML - Chronic Myelogenous Leukemia) עברה מהפך ממחלה סופנית עם תוחלת חיים של כשש שנים לכזו שתוחלת החיים שלה דומה לזו של שאר האוכלוסייה. אחוזי ההישרדות עומדים על 91 אחוזים ו-84 אחוזים ל-5 ול-10 שנים בהתאמה. סקירה זו תתמקד בעבר, בהווה ובעתיד של מחלת ה-CML.
עבר
מחלת ה-CML נגרמת עקב שינוי בתאי האב ההמטופואטיים במח העצם. המחלה תוארה לראשונה בשנת 1845 על ידי Bennet מגלזגו ו-Virchow מברלין. בשנת 1960 נתגלה כרומוזום פילדלפיה על ידי Nowell ו-Hugerford, ותואר הקשר הנסיבתי בינו לבין המחלה. כעבור עשור מצאו Rowely וקבוצתה כי השחלוף בין הכרומוזומים 9 ו-22 אחראי להתהוות כרומוזום פילדלפיה, ועשור מאוחר יותר נמצא כי הוא האחראי להיווצרות הגן הכימרי המסרטן BCR-ABL1 שמקודד לחלבון BCR-ABL1 tyrosine Kinase.
כרומוזום פילדלפיה קיים ב-95 אחוזים מחולי CML. מרבית החולים (כ-80 אחוזים) מאובחנים בשלב הכרוני, אך ללא טיפול יעיל המחלה מתקדמת לשלב מואץ או בלסטי עם תוחלת חיים צפויה של חודשים אחדים.
הטיפול בחולי CML כלל בעבר ארסן (תמיסת פאולר), קרינה ובהמשך תרופות כמו Busulfan, Hydroxyurea ו-Interferon וכן השתלת מח עצם. מאז תחילת המאה ה-21 הטיפול עבר מהפך ומתבסס בעיקר על תרופות מעכבות טירוזין קינאז (TKIs - Tyrosine Kinase Inhibitors): התרופה Imatinib (Glivec), דור ראשון של TKIs, נכנסה לשימוש בשנות ה-2000 ובעקבותיה נכנסו לשימוש תרופות מהדור השני והשלישי.
הווה
חמישה TKIs משמשים לטיפול ב-CML: Imatinib, Dasatinib (Sprycel), Nilotinib (Tasigna), Bosutinib (Bosulif) ו-Ponatinib (Iclusig). בחירת הטיפול היא הליך מורכב, והאתגר האמיתי הוא התאמת טיפול עם מקסימום יעילות ומינימום רעילות. ההחלטה הטיפולית נעשית על ידי החולה וההמטולוג במשותף.
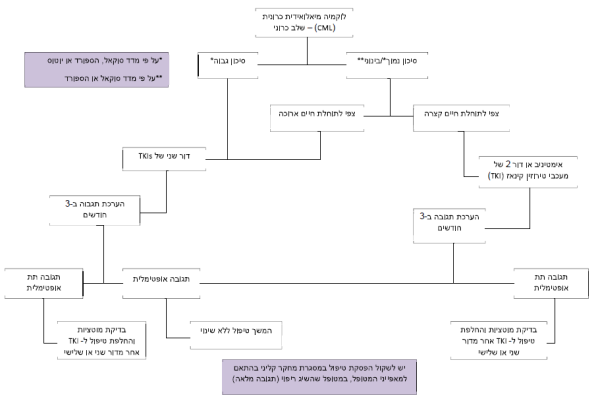
הגישה המוצעת לטיפול בחולה עם CML בשלב הכרוני מפורטת בתרשים מספר 1.
טיפול מותאם אישית -לפי שלב המחלה
במסגרת ההמלצות של ה-European LeukemiaNet (ELN) ושל ה-NCCN משנת 2013, טיפול קו ראשון בשלב הכרוני כולל אחד משלושת ה-TKIs, שאושרו בהתוויה זו, Imatinib, Nilotinib או Dasatinib[1][2]. יעילות הטיפול נקבעת על פי התגובה הציטוגנטית (אחוז כרומוזום פילדלפיה במח העצם) וכן התגובה המולקולרית (שיעור תאים נושאי BCR-ABL1 מכלל התאים).
Nilotinib - תרופה פוטנטית וסלקטיבית יותר מ-Imatinib. במחקר ה-ENESTND נצפתה תגובה ציטוגנטית מלאה בשיעור גבוה ב-15 אחוזים בחולים בשלב הכרוני שקיבלו Nilotinib בהשוואה ל-Imatinib וכן הסתברות גבוהה יותר לתגובה מולקולרית מאג'ורית. אך לא נצפה הבדל בהישרדות[3][4]. חסרונותיה הם הצורך בהתאמה לזמני הארוחות וכן פרופיל תופעות לוואי הכולל הפרעות מטבוליות, פנקראטיטיס ואירועים וסקולריים עורקיים בעיקר בחולים עם גורמי סיכון[5].
Dasatinib - אחראית לעיכוב קינאזות רבות, בהן BCR-ABL1 ו-Src. במחקר ה-DASISION נצפתה תגובה ציטוגנטית מלאה בשכיחות גבוהה יותר בחולים בשלב הכרוני שקיבלו Dasatinib בהשוואה ל-Imatinib לאחר 12 אך לא לאחר 24 חודשי טיפול. שיעור התגובה המולקולרית עם Dasatinib היה גבוה בהשוואה ל-Imatinib ללא הבדל בהישרדות. פרופיל תופעות הלוואי כולל תפליטים פלאורליים ויתר לחץ דם ריאתי[6][7][8].
בשתי מטא-אנליזות שפורסמו על ידי הקבוצה שלנו, בדקנו מה קו הטיפול הראשון המיטבי בחולי CML בשלב הכרוני. הראשונה השוותה בין מינון גבוה של Imatinib לעומת המינון המקובל. בניתוח של ארבעה מחקרים מבוקרים נצפה שיעור גבוה יותר של תגובה ציטוגנטית מלאה ותגובה מולקולרית מאג'ורית ב-12 חודשים עם מינון גבוה של Imatinib, ללא הבדל בשיעור ההישרדות או התקדמות המחלה לפאזות המתקדמות. עם זאת, המינונים הגבוהים לוו ביותר תופעות לוואי שהצריכו הפסקת טיפול[9]. השנייה השוותה בין Imatinib לתרופות מהדור השני. שיעור התגובה הציטוגנטית המלאה לאחר 12 חודשים היה גבוה יותר עם TKIs מהדור השני, ללא הבדל לאחר 24 חודשים. לעומת זאת, שיעור התגובה המולקולרית היה גבוה יותר ושיעור ההתקדמות לשלב מואץ/בלסטי היה נמוך יותר עם תרופות מהדור השני בכל נקודות הזמן: 12, 18 ו-24 חודשים. אף שלא היה הבדל בסך שיעור התמותה, תרופות מהדור השני הפחיתו תמותה הקשורה ב-CML[10]. לפיכך, Imatinib במינון הסטנדרטי היא עדיין אפשרות טיפולית טובה כקו טיפול ראשון, ואילו לתרופות מדור שני יתרון בהשגת תגובה מולקולרית עמוקה ומהירה, אך ללא יתרון הישרדותי[11][12][13]. עם הטיפול ב-TKIs, תוחלת החיים הצפויה בשלב הכרוני דומה לזו של האוכלוסייה הכללית[14].
בחולים שאובחנו בשלב מואץ או בלסטי, האפשרויות הטיפוליות הן Imatinib 800 מיליגרם ליממה או Dasatinib 140 מיליגרם ליממה. השתלת מח עצם מתורם זר מומלצת בחולים בשלב הבלסטי וכן בחולים בשלב המואץ שלא השיגו תגובה אופטימלית. חולים בשלב מואץ או בלסטי, שהתקדמו מהשלב הכרוני תחת טיפול ב-TKI יקבלו טיפול ב-TKI אחר ובהמשך השתלת מח עצם מתורם זר. כימותרפיה לפני השתלה תינתן בחולים שלא השיגו תגובה מספקת עם TKIs[1].
טיפול מותאם אישית - לפי רמת סיכון
בשלב הכרוני ניתן לאמוד את רמת הסיכון על ידי שלושה מדדים מקובלים. מדד Sokal פותח בשנת 1984 ומסווג את החולים לשלוש קבוצות סיכון: נמוך, בינוני או גבוה בהסתמך על נתונים באבחנה הכוללים את גיל החולה, גודל טחול, אחוז הבלסטים בדם ההיקפי וספירת הטסיות. מדד זה בעל תוקף חזק ומקובל מאוד לשימוש[15]. בשנת 1998 פותח מדד Hasford הכולל בנוסף לנזכר למעלה גם את אחוז האאוזינופילים והבזופילים[16]. מדד חדש - Eutos מתבסס על נתונים מ-2,060 חולי CML שקיבלו Imatinib. החולים סווגו לבעלי סיכון נמוך או גבוה בהינתן אחוז הבזופילים בדם ההיקפי וגודל הטחול באבחנה. מודל זה אינו מתוקף[17].
טיפול מותאם אישית - לפי נקודות זמן (months checkpoint 3)
נמצא מתאם בין שיעור התגובה המולקולרית המוקדמת, דהיינו ירידה מוקדמת ברמת טרנסקריפט ה-BCR-ABL1 לאחר שלושה חודשי טיפול ב-Imatinib לפחות מ-10 אחוזים, או ירידה למחצית כמות הטרנסקריפט ביום ה-76 לטיפול[18], לבין הסיכוי להשגת הפוגה ציטוגנטית מלאה, הפוגה מולקולרית, הישרדות והישרדות ללא מחלה. הממצאים אוששו על ידי הקבוצות המובילות מאנגליה, גרמניה ואוסטרליה[13][19][20]. אין להסתמך על בדיקה מולקולרית בודדת ויש לשקול החלפת טיפול בהתאם לרמת BCR-ABL1 בין שלושה לשישה חודשי טיפול.
הגישה לחולה עמיד ל-TKIs
עמידות ראשונית ל-TKIs היא נדירה. עמידות נרכשת נגרמת לרוב על ידי מוטציה באזור ה-ABL tyrosine kinase. תוארו למעלה מ-80 מוטציות לאחר חשיפה ל-Imatinib, ומספר מוטציות נמוך יותר בעקבות שימוש בתרופות מדור שני ושלישי. כישלון של TKI אחד מהווה אינדיקציה לטיפול ב-TKI אחר מדור שני או מתקדם יותר, בהתאם לבדיקת המוטציות.
עתיד - אתגרים בטיפול ב-CML
"ריפוי" והפסקת טיפול בחולי CML
סוגיית הריפוי בחולי CML מתמקדת בשני היבטים עיקריים:
- האם TKIs יכולים להעלים את התא הלאוקמי האחרון
- האם בדיקת PCR שלילית לטרנסקריפט ה- BCR-ABL1 אכן מבטאת החלמה
תגובה מולקולרית מלאה משמעה ירידה של 4.5 לוגים לפחות ברמת טרנסקריפט ה-BCR-ABL1 או 0 מוחלט. קיימות בדיקות מולקולריות בעלות רגישות גבוהה (DNA based PCR) שביכולתן לאתר תאי מחלה שלא זוהו בבדיקות השגרתיות (RNA based real time quantitative PCR) וכן בדיקות כגון ultrasensitive PCR (ultrasensitive Polymerase Chain Reaction) אשר יכולות לזהות תאי מחלה אפילו באנשים בריאים[21][22][23][24].
הפסקת טיפול ב-TKIs נבדקה בחולים שהשיגו תגובה מולקולרית מלאה. מחקר ה-STIM כלל 100 מטופלים בשלב הכרוני שקיבלו Imatinib והשיגו הפוגה מולקולרית מלאה (ירידה ב-BCR-ABL1 ב-5 לוגים) למשך שנתיים לפחות. לאחר 36 חודשים שמרו 39 אחוזים מהחולים על הפוגה מלאה. רוב ההישנויות הופיעו בתוך שישה חודשים, עם תגובה טובה לאחר חידוש הטיפול[25]. הקבוצה האוסטרלית דיווחה על ממצאים דומים ממחקר ה-TWISTER[26]. מתנהלים מחקרים קליניים הבוחנים הפסקת טיפול של TKIs מדורות מתקדמים וכן מופיעים דיווחים על הפסקות טיפול שלא במסגרת מחקר. באופן פורמלי, הפסקת טיפול מתבצעת במסגרת מחקר קליני, בחולה שהשיג הפוגה מולקולרית מלאה למשך שנתיים לפחות. ככל שמשך הטיפול ארוך יותר ומדד הסוקאל נמוך יותר, הסיכוי להפוגה ממושכת גבוה יותר.
היענות לטיפול
חוסר היענות לטיפול היא בעיה מוכרת בקרב מטופלים עם מחלות כרוניות. בקרב 30 אחוזים מחולי ה-CML מדווחת היענות נמוכה לטיפול ב-TKIs, המלווה בירידה משמעותית בתגובה לטיפול[27]. מחקר התערבותי רב מרכזי, TAKE-IT, שעשינו מצא מדדים המנבאים חוסר היענות לטיפול וכן הראה שהתערבות לשיפור היענות לטיפול ב-TKIs עשויה לשפר את התגובה[28].
שליטה בתופעות הלוואי
אחד האתגרים ב-CML קשור בהבנת תופעות הלוואי של הטיפול ובשליטה עליהן, כאשר לגיל החולה, מחלות הרקע ומצבו התפקודי יש משקל חשוב. אחת מתופעות הלוואי המשמעותיות היא סיבוכים וסקולריים ובעיקר מחלת כלי דם פריפרית אשר דווחה עם Nilotinib ובהמשך גם עם Ponatinib. לפיכך, הפגיעה הווסקולרית על ידי TKIs הפכה אחד המוקדים העיקריים במחקר הקליני והמעבדתי בתחום ה-CML. מנגנון אפשרי לפגיעה וסקולרית עקב טיפול ב-TKIs הוצע על ידי קבוצתנו, אשר הראתה במעבדה אפקט מעכב של Ponatinib על אנגיוגנזה של תאי אנדותל[29].
סיכום
סקרנו את השינויים בגישה האבחנתית והטיפולית במחלת ה-CML מן התיאורים הראשונים באמצע המאה ה-19, דרך פריצות הדרך באבחון במהלך המחצית השנייה של המאה ה-20 ועד לטיפול המהפכני הממוקד במעכבי טירוזין קינאז בראשית המאה ה-21. ממחלה חשוכת מרפא הפכה לוקמיה זו למחלה שבה המיקוד הוא על צמצום תופעות הלוואי, הקפדה על נטילת הטיפול, התאמת הטיפול המיטבי לחולה ולבסוף - האפשרות לריפוי שנראית היום קרובה מתמיד להשגה.
ביבליוגרפיה
- ↑ 1.0 1.1 Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013 Aug 8;122(6):872- 84
- ↑ Crossman LC, Druker BJ, Deininger MW, et al. hOCT 1 and resistance to imatinib. Blood. 2005 Aug 1;106(3):1133-4; author reply 1134
- ↑ Larson RA, Hochhaus A, Hughes TP, et al. Nilotinib vs imatinib in patients with newly diagnosed Philadelphia chromosome-positive chronic myeloid leukemia in chronic phase: ENESTnd 3-year follow-up. Leukemia. 2012 Oct;26(10):2197-203
- ↑ Kantarjian HM, Hochhaus A, Saglio G, et al. Nilotinib versus imatinib for the treatment of patients with newly diagnosed chronic phase, Philadelphia chromosome¬positive, chronic myeloid leukaemia: 24-month minimum follow-up of the phase 3 randomised ENESTnd trial. Lancet Oncol. 2011 Sep;12(9):841-51
- ↑ Aichberger KJ, Herndlhofer S, Schernthaner GH, et al. Progressive peripheral arterial occlusive disease and other vascular events during nilotinib therapy in CML. Am J Hematol. 2011 Jul;86(7):533-9
- ↑ de Lavallade H, Punnialingam S, Milojkovic D, et al. Pleural effusions in patients with chronic myeloid leukaemia treated with dasatinib may have an immune-mediated pathogenesis. Br J Haematol. 2008 May;141(5):745-7
- ↑ Porkka K, Khoury HJ, Paquette RL, et al. Dasatinib 100 mg once daily minimizes the occurrence of pleural effusion in patients with chronic myeloid leukemia in chronic phase and efficacy is unaffected in patients who develop pleural effusion. Cancer. 2010 Jan 15;116(2):377-86
- ↑ Kim D, Goh HG, Kim SH, et al. Long-term pattern of pleural effusion from chronic myeloid leukemia patients in second-line dasatinib therapy. Int J Hematol. 2011 Oct;94(4):361-71
- ↑ Gafter-Gvili A, Leader A, Gurion R, et al. High-dose imatinib for newly diagnosed: chronic phase chronic myeloid leukemia patients: systematic review and meta-analysis. Am J Hematol. 2011 Aug;86(8):657- 62
- ↑ Gurion R, Gafter-Gvili A, Vidal L, et al. Has the time for first-line treatment with second generation tyrosine kinase inhibitors in patients with chronic myelogenous leukemia already come? Systematic review and meta-analysis. Haematologica. 2013 Jan;98(1):95-102
- ↑ Marin D, Milojkovic D, Olavarria E, et al. European LeukemiaNet criteria for failure or suboptimal response reliably identify patients with CML in early chronic phase treated with imatinib whose eventual outcome is poor. Blood. 2008 Dec 1;112(12):4437- 44
- ↑ Druker BJ, Guilhot F, O'Brien SG, et al. Five-year follow¬up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med. 2006 Dec 7;355(23):2408-17
- ↑ 13.0 13.1 Marin D, Ibrahim AR, Lucas C, et al. Assessment of BCR-ABL1 transcript levels at 3 months is the only requirement for predicting outcome for patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. J Clin Oncol. 2012 Jan 20;30(3):232-8
- ↑ Sasaki K, Kantarjian HM, Jain P, et al Conditional survival in patients with chronic myeloid leukemia in chronic phase in the era of tyrosine kinase inhibitors. Cancer. 2016 Jan 15;122(2):238-48
- ↑ Sokal JE, Cox EB, Baccarani M, et al. Prognostic discrimination in "good-risk" chronic granulocytic leukemia. Blood. 1984 Apr;63(4):789-99
- ↑ Hasford J, Pfirrmann M, Hehlmann R, et al. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. J Natl Cancer Inst. 1998 Jun 3;90(11):850-8
- ↑ Hasford J, Baccarani M, Hoffmann V, et al. Predicting complete cytogenetic response and subsequent progression-free survival in 2060 patients with CML on imatinib treatment: the EUTOS score. Blood. 2011 Jul 21;118(3):686-92
- ↑ Branford S, Yeung DT, Parker WT, et al. Prognosis for patients with CML and >10% BCR-ABL1 after 3 months of imatinib depends on the rate of BCR-ABL1 decline. Blood. 2014 Jul 24;124(4):511-8
- ↑ Breccia M, Alimena G. "To switch or not to switch: that is the question"- more than 10% of ratio @ 3 months: how to treat chronic myeloid leukemia patients with this response? Leuk Res. 2013 Sep;37(9):995-7
- ↑ Hanfstein B, Muller MC, Hehlmann R, et al. Early molecular and cytogenetic response is predictive for long-term progression-free and overall survival in chronic myeloid leukemia (CML). Leukemia. 2012 Sep;26(9):2096-102
- ↑ Gale RP, Goldman JM. Treating chronic myeloid leukemia in the era of tyrosine kinase inhibitors. Acta Haematol. 2013;130(3):192-5
- ↑ Goldman J, Gordon M. Why do chronic myelogenous leukemia stem cells survive allogeneic stem cell transplantation or imatinib: does it really matter? Leuk Lymphoma. 2006 Jan;47(1):1-7
- ↑ Biernaux C, Loos M, Sels A, et al. Detection of major bcr-abl gene expression at a very low level in blood cells of some healthy individuals. 1995 Oct 15;86(8):3118-22
- ↑ Bose S, Deininger M, Gora-Tybor J, et al. The presence of typical and atypical BCR-ABL fusion genes in leukocytes of normal individuals: biologic significance and implications for the assessment of minimal residual disease. Blood. 1998 Nov 1;92(9):3362-7
- ↑ Mahon FX, Rea D, Guilhot J, et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol. 2010 Nov;11(11):1029-35
- ↑ Ross DM, Branford S, Seymour JF, et al. Safety and efficacy of imatinib cessation for CML patients with stable undetectable minimal residual disease: results from the TWISTER study. 2013 Jul 25;122(4):515-22
- ↑ Noens L, van Lierde MA, De Bock R, et al. Prevalence, determinants, and outcomes of nonadherence to imatinib therapy in patients with chronic myeloid leukemia: the ADAGIO study. Blood. 2009 May 28;113(22):5401-11
- ↑ Leader A, Benyamini N, De Geest S, et al. The effect of adherence-encouraging interventions on adherence to tyrosine kinase inhibitor treatment in chronic myeloid leukemia (TAKE-IT): a pre-post intervention pilot study. [abstract]. 2015 ASH Annual Meeting. Abstact 4034
- ↑ Gover-Proaktor A, Raanani P, Nagler A, et al. Pathogenesis of ponatinib associated vascular disease in chronic myeloid leukemia: an in vitro study. [Abstract]. 2015 ASH Annual Meeting. Abstract 2798
המידע שבדף זה נכתב על ידי ד"ר עדי שחם אבולעפיה, פרופסור פיה רענני - המערך ההמטולוגי, מרכז דוידוף, בית חולים בילינסון, מרכז רבין, פתח תקווה. בית הספר לרפואה ע"ש סאקלר, אוניברסיטת תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק