לימפומה מסוג הודג'קין - Hodgkin's lymphoma
| הערך נמצא בשלבי עבודה: כדי למנוע התנגשויות עריכה ועבודה כפולה אתם מתבקשים שלא לערוך ערך זה בטרם תוסר הודעה זו, אלא אם כן תיאמתם זאת עם מניחי התבנית. בקשה זו מופנית גם לעורכים רפואיים. | |||
| העורכים מבקשים להמתין עם עריכת הערך עד להוספתו לרשימת הערכים ב"ניהול עבודה ויקי". | |||
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לימפומה
מבוא
לימפומה על שם הודג'קין תוארה לראשונה ב-1832 על ידי ד"ר תומאס הודג'קין האנגלי, מענקי הרפואה במאה ה-19. תומאס הודג'קין היה מעורב כל חייו בפעילות פילנתרופית.
הוא היה פעיל חברתי אשר דאג לטיפול רפואי לשכבות החלשות של לונדון, הרצה על צעדים לשיפור הבריאות ולחם למען זכויות אזרח לשחורים ולקבוצות אתניות במזרח קנדה ובאוסטרליה. בביקורו בארץ ישראל הציע להקים בתי ספר מקצועיים והיה מזועזע למדי מהשמרנות הדתית, מחוסר ההשכלה ומהזוהמה ששררו בירושלים באותה תקופה.
תומאס הודג'קין היה חברו ורופאו האישי של משה מונטיפיורי במשך יותר מ-40 שנה, וליווה אותו בשליחויות הומניטריות באירופה, באסיה ובאפריקה. הודג'קין מת בזמן מסעו השני לארץ, ונקבר ביפו באפריל 1866.
הטיפול במחלה היה סימן דרך חלוצי הן בשימוש ברדיותרפיה, שהחל כבר ב-1903 לטיפול במחלת הודג'קין, והן במתן המשלבים הראשונים של כימותרפיה באמצע שנות השישים, שניתנו לחולי הודג'קין.
הגיל הממוצע של חולי הודג'קין הוא כ-30 שנה. רובם המכריע של החולים, כ-95-85 אחוזים, יבריאו ממחלתם. לרופא בקהילה, אבחון מחלת הודג'קין בשלב מוקדם יכול להיות מאתגר. ראשית, החולים הם צעירים, לרוב א-סימפטומטיים, בגיל שבו אין הרופאים רגילים לחשוב על אפשרות של ממאירות במקום גבוה באבחנה המבדלת. לא תמיד מתייחסים לבלוטה שגדלה. יש צורך להתייחס לאנמנזה של מחלת חום או מחלה ויראלית כ-EBV (Epstein–Barr virus) או CMV (Cytomegalovirus) אך בלוטה מעל 1.5 סנטימטר מחייבת מעקב, ואם אינה נסוגה בתוך כחודש ימים יש צורך בבירור. הבלוטות במחלת הודג'קין הן מוביליות, בעלות מרקם של גומי קשה ולעיתים נדירות כואבות לאחר שתיית אלכוהול. צורת האבחנה האופטימלית היא ביופסיה של כל הבלוטה, ובמקרים בהם הדבר כרוך בתחלואה משמעותית ניתן לבצע Truecut biopsy. בכל מקרה, FNA (Fine Needle Aspiration) אינה אמינה ואין לבצע הליך זה לאבחון מחלת לימפומה.
לאור העובדה שמדובר בחולים צעירים אשר תוחלת חייהם הצפויה ארוכה מזו של הרופא המטפל, חובה לאזן בין עוצמת הטיפול הניתן בשלבים השונים והסיכון לסיבוכים מאוחרים לבין השאיפה להגיע לריפוי מלא בקו טיפול ראשון במחלה.
הטיפול במחלה
הטיפול במחלת הודג'קין נחלק לטיפול בחולים עם מחלה מוקדמת בשלב IIA, IA, שבה ניתן לטפל במספר מוגבל של קורסים כימותרפיים עם או ללא קרינה[1], ואילו חולים במחלה מתקדמת (בשלב IV, III, IIB) מטופלים בשישה משלבים כימותרפיים וקרינה הניתנת רק לאתרים בעלי סיכון התלקחות מוגבר.
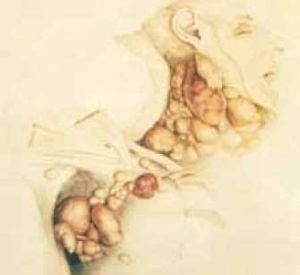
הסתמנות המחלה בשלביה הראשונים יכולה להיות בצבר בלוטות, בדרך כלל מעל הסרעפת, בצוואר, בבלוטות בבתי השחי או בגוש מדיאסטינאלי, ולעתים היא יכולה להיות מלווה בתסמיני B - חום, הזעה לילית או ירידה במשקל של יותר מ-10 אחוזים ממשקל הגוף בתוך פחות משישה חודשים.
בשלבים מתקדמים של המחלה, שלב III שבו קיימת מחלה מעל ומתחת לסרעפת או שלב IV כאשר מעורבים אתרים אקסטרה נודלים באופן מפוזר, יש מעורבות מח עצם או עצמות באתרים שונים, ומעורבות כבד או ריאות. מעורבות טחול אינה נחשבת למעורבות אקסטרה נודלית מאחר והטחול הוא איבר לימפטי.
לצורך האבחון מבוצע PET-CT (Positron Emission Tomography - Computed Tomography), וזאת לאור יכולת גילוי אתרי מחלה על ידי הדמיה זו בקרוב ל-100 אחוזים מאתרי המחלה. השימוש ב-PET-CT ייתר את הצורך בביצוע בדיקת מח עצם.
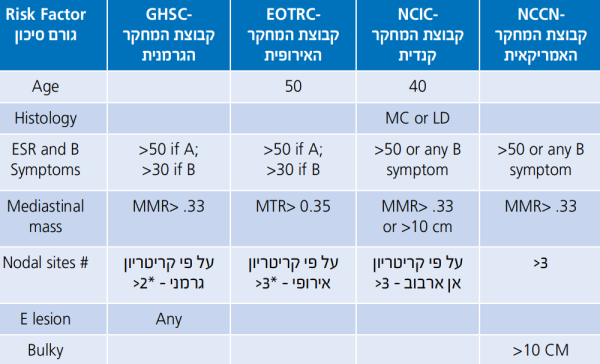
קיימים מספר גורמים פרוגנוסטיים במחלת הודג'קין, המקובלים במחלה מוקדמת ומצביעים על הצורך בטיפול עם יותר מחזורים של כימותרפיה (ארבעה מחזורים עם קרינה או שישה מחזורי טיפול ללא קרינה) כאשר יש גורמי סיכון, לעומת שני מחזורים עם קרינה או ארבעה מחזורי טיפול ללא קרינה כאשר אין גורמי סיכון - גיל 50 ומעלה, גידול של יותר מ-10 סנטימטר או יותר משליש מרוחב בית החזה, מספר אזורים מעורבים גדול משניים על פי המדד של הקבוצה הגרמנית או משלושה על פי קבוצת המחקר האירופית, שקיעת דם מוחשת מעל 50 מילימטר, או מעל ל-30 מילימטר במקרים בהם יש תסמונת B. (טבלאות 1 + 1א)[2].
מקרא לטבלה 1:
- MC = Mixed Cellularity
- LD = Lymphocyte Depleted
- MMR = Mediastinal mass ratio, maximum width of mass / maximum intrathoracic diameter
- MTR = Mediastinal thoracic ratio, maximum width of mediastinal mass / intrathoracic diameter at T5-6
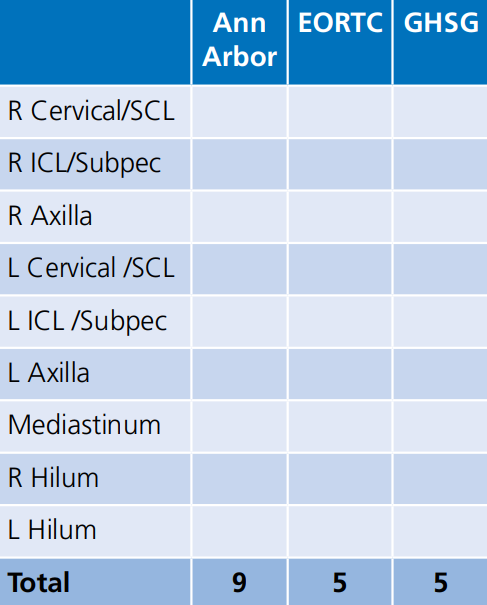
(*) Note that the EORTC (European Organisation for Research and Treatment of Cancer) includes the infraclavicular/ subpectroal area with the axilla while the GHSG (German Hodgkin Study Group) includes it with the cervical. Both EORTC and GHSG combine the mediastinum and both hila as single region
(*) הערה: לקבוצות המחקר השונות הגדרות שאינן חופפות לגבי אזורים מעורבים. מצורפים מטה האזורים על פי ההגדרות של הקבוצות השונות כפי שנלקחו מהנחיות NCCN (National Comprehensive Cancer Network)
במחלה מתקדמת שלב IV, III או שלב IIB עם גוש של 10 סנטימטר ומעלה מקובל להשתמש בסולם של שבעה גורמי סיכון (טבלה 2)[3][4]

על פי קיום גורמי סיכון אחד או יותר יחליט ההמטולוג על מספר קורסי הטיפול במחלה מוקדמת. במחלה מתקדמת יש חשיבות למספר גורמי הסיכון כך שנוכחות שלושה או יותר גורמי סיכון מצדיקה שקילת טיפול אגרסיבי יותר מלכתחילה[5].
בנוסף, גורם חשוב המנבא תגובה לטיפול Predictive value הוא התגובה לטיפול, המתבטאת בהפוגה מטבולית של הגידול כפי שמודגמת בבדיקת PET/CT המתבצעת לאחר שני טיפולים. הבדיקה מתבצעת ביום ה-14 לאחר הקורס הטיפולי השני. אם היא שלילית, כלומר אין עדות לקליטה פתולוגית או שקיימת קליטה שארית בעוצמה מתחת או שווה בעוצמתה לקליטה בכבד, אזי הסיכוי להגיע לרמיסיה מלאה הוא 90 אחוזים. אם PET/CT הוא חיובי (עוצמת הקליטה מעל עוצמת הקליטה בכבד) - יש מקום להעצים הטיפול למשלב אגרסיבי יותר. במחקרים שונים הן של קבוצת המחקר הישראלית והן של קבוצות המחקר הבריטית והאיטלקית, העצמת טיפול בחולים אלו שיפרה את הסיכוי להשיג החלמה[6][7].
לעומת זאת, בחולים עם מחלה מתקדמת שהחלו טיפול בפרוטוקול אגרסיבי כגון Escalated BEACOPP (Bleomycin, Etoposide, doxorubicin hydrochloride - Adriamycin, Cyclophosphamide, vincristine - Oncovin, Procarbazine and Prednisone), ובדיקת PET/CT לאחר שני טיפולים הפכה שלילית, ניתן לשנות טיפול לאגרסיבי פחות (ABVD - Adriamycin, Bleomycin, Vinblastine, Dacarbazine), ובכך להקטין תופעות לוואי של הטיפול[6][7].
בחולים אשר מחלתם היא בשלב ראשוני עם גוש של 10 סנטימטר ומעלה מקובל לשלב גם קרינה למיצר. גם במקרים בהם יש עדיין קליטה לאחר סיום של שישה טיפולים כימיים, יש מקום למתן קרינה אם מדובר באזור יחיד של מעל 2.5 סנטימטר. לחלופין, במקרה כזה שבו ביופסיה חוזרת היא חיובית, יש מקום לטיפול במינון גבוה של כימותרפיה והחזר תאי אב (השתלה עצמית) ולאחר מכן מתן קרינה. הקרינה צריכה להינתן לשדה המצומצם ביותר על מנת לצמצם ככל האפשר חשיפה של איברים שכנים העלולים להיפגע, כגון ריאות, מסתמי הלב או מוצא העורקים הכליליים, וכן להימנע ככל האפשר מחשיפת רקמת שד. טכניקות הקרינה עברו מהפך ניכר עם יכולת לתכנן בדיוק רב יותר את הקרינה וכן להתאים הקרינה למתן רק בזמן נשימה עמוקה המרחיקה את הלב מהאזור המוקרן ובכך לצמצם אפשרות של נזק מאוחר. תקשורת טובה בין ההמטולוג המטפל לבין האונקולוג המקרין היא בעלת חשיבות רבה להתאמת הטיפול המיטבי לחולה.
בסיום הטיפול הכימי מתבצע PET/CT כדי לוודא שהחולה בהפוגה מלאה. בחולים שסריקת ה-PET הייתה שלילית לאחר שני קורסי טיפול אין כל צורך בהמשך מעקב דימות, מאחר וביצוע ההדמיות מלווה בחשיפה לקרינה ומשום שלא הוכח שהדמיה המתבצעת באופן שגרתי כל שישה חודשים משנה את הפרוגנוזה של החולה. גם במקרים בהם המחלה חוזרת, גילוי באיחור של שלושה חודשים, כשהחולה כבר מרגיש את הבלוטה, אינו משנה כלל את הסיכוי להבריא ואין כל טעם כאמור לחשוף חולים רבים להדמיה לא נחוצה ובכך גם לבזבז משאבים במערכת הבריאות. ההמלצה להימנע ממעקב בעזרת PET בחולים שאינם בסיכון גבוה להתלקחות פורסמה גם בהנחיות בין-לאומיות[8].
טיפול בהישנות לאחר השתלת מח עצם עצמית
ב-5 עד 20 אחוזים מחולי ההודג'קין קיימת התלקחות מחלה לאחר סיום הטיפול. במקרים אלו מקובל לטפל בקו שני של טיפולים כימיים שלהם לא נחשף החולה קודם לכן, ובהמשך לבצע איסוף תאי אב והשתלה עצמית. לאחר מכן ניתן לשקול גם תוספת קרינה לאתר מחלה יחיד. בקרב 30 עד 50 מחולי הודג'קין תיתכן הישנות לאחר טיפול בהשתלה עצמית, לרוב בשנה הראשונה לאחר ההשתלה. עד לתחילת המאה ה-21, האפשרויות אשר עמדו בפני המטופל היו טיפול כימי נוסף, ובהינתן תגובה, השתלה מתורם זר או טיפול קרינתי פליאטיבי.
נכון ל-2016, לרשות המטופל והצוות המטפל עומד טיפול כימי מונחה אנטיגן ספציפי. מדובר בנוגדן אשר נקשר למולקולה ספציפית לתאי המחלה - CD30. הנוגדן Brentuximab Vedotin (שם מסחרי Adcetris) קשור לתרופה אשר פוגעת ביצירת השלד התאי של התאים הממאירים. כאשר הנוגדן נקשר לתא הממאיר, מתרחשת אינטרנליזציה (כניסה) שלו לתוך התא, ובהמשך שחרור של התרופה, פגיעה בכישור התאי והרס התא הממאיר. בעבודה אשר הוצגה על ידי גופל וחבריו טופלו 102 חולי הודג'קין אשר מחלתם נשנתה לאחר השתלה עצמית בתרופה זו כתרופה יחידה[9]. 3.5 קווי טיפול בממוצע ניתנו למשתתפים במחקר לאחר הישנות המחלה וטרם הטיפול ב-Brentuximab. אף שמדובר בקבוצת חולים לאחר טיפולים מרובים, הושגו תוצאות יפות ביותר. לאחר תקופת מעקב חציונית של שלוש שנים, חציון ההישרדות הכללית היה 40 חודש ואילו חציון הזמן ללא התקדמות מחלה היה 9.3 חודשים. שיעורים אלו היו ארוכים הרבה יותר במטופלים אשר השיגו תגובה מלאה לטיפול בנוגדן, כאשר השיעור החציוני של הישרדות כוללת או משך הזמן ללא חזרת מחלה היו 73 אחוזים ו-58 אחוזים בהתאמה. מתוך כלל הקבוצה, 14 מטופלים (20 אחוזים) לא חוו חזרת מחלה כלל. תשעה מתוכם לא קיבלו קו טיפול נוסף, וחמישה מטופלים אחרים המשיכו להשתלה אלוגנאית. בעקבות מחקר זה ניתן אישור FDA (Food and Drug Administration) ולאחר מכן נכללה התרופה בסל הבריאות של ישראל למטופלים אשר מחלתם נשנתה לאחר השתלה עצמית או שקיבלו כבר שני קווי טיפול ואינם יכולים לעבור השתלה עצמית מסיבה כלשהי[9][10].
בעקבות עבודה זו ועבודות נוספות אשר הראו תוצאות דומות, יצא לדרך מחקר ה-ATHERA אשר בחן טיפול ב-Brentuximab vedotin כטיפול משמר לאחר השתלה עצמית. במחקר השתתפו חולי הודג'קין אשר עברו השתלה עצמית והיו בסיכון גבוה להישנות מחלתם (מחלה עמידה לטיפול ראשוני, הישנות תוך שנה מטיפול ראשוני או מחלה אשר בהתייצגותה עירבה אתרים מחוץ לבלוטות הלימפה). 329 מטופלים השתתפו במחקר וחולקו לשתי קבוצות. קבוצה אחת טופלה ב-Brentuximab, ואילו השנייה בפלצבו. הזמן החציוני עד להתקדמות היה 42.9 חודשים בקבוצת הטיפול לעומת 24.1 חודשים בקבוצת הביקורת. ההשפעה המיטיבה הושגה בחולים אשר נכנסו לטיפול ההשתלה ברמיסיה חלקית בלבד, לעומת חולים שנכנסו בהפוגה מלאה. בשיעורי התמותה לא היה הבדל מאחר ומטופלים בקבוצת הפלצבו הורשו לעבור לקבוצת הטיפול אם מחלתם נשנתה. תופעות הלוואי השכיחות היו נוירופתיה פריפרית - 56 אחוזים, ונויטרופניה - 35 אחוזים[11].
מחקר נוסף בוחן טיפול ב-Brentuximab vedotin כטיפול לפני השתלה עצמית. מוסקוביץ וחבריו טיפלו בחולים אשר מחלתם נשנתה בשני קורסים של תרופה זו ולאחר מכן בדקו את התגובה לטיפול על ידי PET-CT. מטופלים אשר השיגו הפוגה מלאה המשיכו ישר להשתלה עצמית, ואילו מטופלים עם תגובה טובה פחות קיבלו טיפולים נוספים במשלב ICE (Ifosfamide, Carboplatin, Etoposide phosphate) על מנת להשיג תגובה מלאה ולהגיע להשתלה עצמית. מתוך 42 מטופלים, 12 השיגו תגובה מלאה לאחר טיפול ב-Brentuximab בלבד[12].
טיפולים אימונולוגיים במחלה עמידה
Programmed cell Death Protein 1 - PD1 הוא חלבון המתבטא בתאי T. קישור בין חלבון זה לליגנדים שלו, 1-PDL או 2-PDL גורם לעיכוב בפעילות של תאי T. תאים ממאירים משתמשים במנגנון זה על מנת לחמוק מפעילותה של מערכת החיסון. עבודות פרה-קליניות הראו כי תאי Reed Sterenberg מבטאים ביתר את שני הליגנדים האלו והניחו את היסוד לטיפול על ידי נוגדן הנקשר ומעכב את החלבון 1-PD במחלה זו[13].
פורסם מחקר של אנסל וחבריו אשר בחנו את הטיפול ב-Nivolumab (שם מסחרי Opdivo), נוגדן נגד PD-1 בחולי הודג'קין שמחלתם עמידה לטיפול. במחקר השתתפו 23 חולים. 78 אחוזים מן המטופלים כבר טופלו בהשתלה עצמית ו-78 אחוזים מן המטופלים טופלו בעבר ב-Brentuximab vedotin. לפיכך מדובר בחולים שמחלתם עמידה ביותר.
החולים טופלו ב-Nivolumab אחת לשבועיים עד לתגובה מלאה, להתקדמות המחלה או לרעילות שאינה נסבלת. תגובה הושגה ב-20 מן המטופלים (87 אחוזים), 17 אחוזים בתגובה מלאה. שיעור התגובה ללא התקדמות לאחר 24 שבועות היה 86 אחוזים. המחלה התקדמה אצל ארבעה חולים. שישה חולים השיגו תגובה והמשיכו להשתלה עצמית. שלושה מן המטופלים הפסיקו את הטיפול בשל תופעות הלוואי. תופעות הלוואי השכיחות ביותר היו פריחה ותרומבוציטופניה בכחמישית מן המטופלים[14].
נוגדן נוסף - Pembrolizumab (שם מסחרי Keytruda) - מכוון נגד החלבון 1-PD ויעילותו הוכחה כטיפול במלנומה וממאירויות סולידיות אחרות. מחקר הבודק את יעילותו כטיפול בממאירויות המטולוגיות מתנהל בזמן כתיבת מאמר זה. תוצאות מקדמיות הנוגעות ליעילותו במחלת הודג'קין פורסמו. 15 מטופלים, אשר כולם טופלו בעבר ב-Brentuximab ושני שלישים מתוכם אף עברו השתלה עצמית, טופלו בנוגדן זה. 53 אחוזים מן המטופלים הגיבו לטיפול, מתוכם 20 אחוזים השיגו תגובה מלאה בתוך 12 שבועות. לא היו תופעות לוואי אשר חייבו את הפסקת הטיפול [15].
מעקב אחר מחלימים ממחלת הודג'קין
מעקב המלווה בבדיקה גופנית ובבדיקת ספירת דם, שקיעת דם וכימיה, כולל LDH, מתבצע כל שלושה חודשים בשנתיים הראשונות. לאחר מכן - כל ארבעה חודשים בשנה השלישית, ואחת לשישה חודשים בשנה הרביעית והחמישית. בהמשך מתבצע המעקב אחת לשנה. במטופלים אשר הוקרנו לאזור החזה יש צורך לבצע בדיקת בלוטת התריס T4 ,T3 - (Thyroid stimulating hormone) TSH - אחת לחצי שנה למשך כל חייהם, מאחר שחלק ניכר מהמטופלים יפתחו תת-פעילות של בלוטת התריס (כ-20 אחוזים) במהלך המעקב.
חשוב ביותר לעודד חולים שהוקרנו להפסיק לעשן לנוכח סיכון גבוה מאוד לממאירות ריאתית במעשנים שנחשפו לקרינה, ובתת-קבוצה זו יש לשקול ביצוע CT בקרינה נמוכה לריאה כחלק מהמעקב. כמו כן, מומלץ למנוע חשיפת אזורי עור שהוקרנו לשמש לאורך זמן בשל שכיחות מוגברת של מלנומה. בחלוף שמונה שנים מסיום הקרינה יש להתחיל לבצע בדיקת שד שנתית לנשים שהוקרנו לאזור בתי השחי או החזה, ובחלוף 8–10 שנים יש לבצע גם ממוגרפיה ו-Magnetic Resonance Imaging) MRI) שד.
לאחר כ-10 שנות מעקב ניתן לבצע בדיקת מאמץ ואקו לב כחלק מהמעקב בחולים הסימפטומטיים.
מאחר ש-85 אחוזים מהתלקחויות המחלה יהיו בשלוש השנים הראשונות, וממוצע ההתלקחויות הוא לאחר 13 חודשים, עיקר המעקב מכוון בשנים לאחר מכן לאיתור סיבוכי טיפול, כגון מחלת לב איסכמית, גידולים משניים והתפתחות לימפומה שאינה הודג'קין.
בעיה נפוצה בקרב המחלימים ממחלת הודג'קין היא תחושת תשישות, הפרעה ביכולת הריכוז ולעיתים אף הפרעה בזיכרון. תלונות אלו עלולות להופיע בעד 30 אחוזים מהחולים.
סיכום
הטיפול במחלת הודג'קין הוא אחד מסיפורי ההצלחה של הטיפול ההמטואונקולוגי. כ-80 עד 95 אחוזים מהחולים יבריאו ממחלתם. הטיפול הניתן מבוסס על ניסיון לאזן בין הטיפול המינימלי שיביא לתגובה מלאה והחלמה לבין הסיכון לתופעות לוואי מאוחרות הנובעות מהטיפול.
ביבליוגרפיה
- ↑ Radford J, Illidge T, Counsell N, et al. Results of a trial of PET-directed therapy for early-stage Hodgkin's lymphoma. N Engl J Med. 2015 Apr 23; 372:1598-607.
- ↑ NCCN Clinical Practice Guidelines in Oncology. Hodgkin Lymphomas. Version 2.2015. Available at Kedmi M, Apel A, Davidson T, et al. High-risk advanced-stage Hodgkin lymphoma: the impact of combined escalated BEACOPP and ABVD treatment in patients who rapidly achieve metabolic complete remission on interim FDG-PET/CT scan. Acta Haematol. 2016; 135(3):156-61. Epub 2015 Nov 21.
- ↑ Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin's disease. International Prognostic Factors Project on advanced Hodgkin's disease. N Engl J Med. 1998;339:1506-14.
- ↑ Borchmann P, Eichenauer DA, Engert A. State of the art in the treatment of Hodgkin lymphoma. Nat Rev Clin Oncol. 2012;9:450-9.
- ↑ Dann EJ, Bar-Shalom R, Tamir A, et al. Risk-adapted BEACOPP regimen can reduce the cumulative dose of chemotherapy for standard and high-risk Hodgkin lymphoma with no impairment of outcome. Blood. 2007;109:905-9.
- ↑ 6.0 6.1 Avigdor A, Bulvik S, Levi I, et al. Two cycles of escalated BEACOPP followed by four cycles of ABVD utilizing early-interim PET/CT scan is an effective regimen for advanced high-risk Hodgkin's lymphoma. Ann Oncol. 2010;21:126-32.
- ↑ 7.0 7.1 Kedmi M, Apel A, Davidson T, Levi I, Dann EJ, Polliack A, Ben-Bassat I, Nagler A, Avigdor A. High-Risk, Advanced-Stage Hodgkin Lymphoma: The Impact of Combined Escalated BEACOPP and ABVD Treatment in Patients Who Rapidly Achieve Metabolic Complete Remission on Interim FDG-PET/CT Scan. Acta Haematol. 2015;135(3):156-161. Epub 2015 Nov 21.
- ↑ Cheson BD, Fisher RI, Barringron SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol. 2015;32(27):3059-68.
- ↑ 9.0 9.1 Gopal AK, Chen R, Smith SE, et al. Durable remissions in a pivotal phase 2 study of Brentuximab vedotin in relapsed or refractory Hodgkin lymphoma. Blood. 2015;19;125:1236-43.
- ↑ Younes A, Bartlett NL, Leonard JP, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med. 2010;363(19):1812-21.
- ↑ Moskowitz CH, Nademanee A, Masszi T, et al. Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin's lymphoma at risk of relapse or progression (AETHERA): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2015;385(9980):1853-62.
- ↑ Moskowitz AJ, Schoder H, Yahalom J, et al. PET- adapted sequential salvage therapy with brentuximab vedotin followed by augmented ifosamide, carboplatin, and etoposide for patients with relapsed and refractory Hodgkin's lymphoma: a non¬randomised, open-label, single-centre, phase 2 study. Lancet Oncol. 2015;16(3):284-92.
- ↑ Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012 Mar 22;12(4):252-64.
- ↑ Ansell SM, Lesokhin AM, Borrello, et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin's lymphoma. N Engl J Med. 2015 Jan 22;372(4):311-9.
- ↑ Moskowitz CH, Ribrag V, Michot JM. PD-1 blockade with the monoclonal antibody pembrolizumab (MK- 3475) in patients with classical Hodgkin lymphoma after brentuximab vedotin failure: preliminary results from a phase 1b study (KEYNOTE-013) (Blood. 2014; 124(21). [Abstract] 290.).
המידע שבדף זה נכתב על ידי פרופ' אלדד י' דן, וד"ר נתנאל א' הורוביץ - המערך ההמטולוגי רמב"ם, הקריה הרפואית לבריאות האדם


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק