הבדלים בין גרסאות בדף "מוקופוליסכרידים - Mucopolysaccharides"
| שורה 11: | שורה 11: | ||
|יחידות מדידה=מיליגרם לגרם קראטינין | |יחידות מדידה=מיליגרם לגרם קראטינין | ||
|טווח ערכים תקין=ערכים ממוצעים בתינוקות עד גיל חודש-169.2; בגיל 1-3 חודשים-149.4; בגיל 4-6 חודשים 104.4; בגיל 7-12 חודשים-80.1; בגיל 1-2 שנים-71.1; בגיל 2-5 שנים-55.8; בגיל 5-9 שנים-39.6; בגיל 9-16 שנים-27.9; בגיל 16-60 שנה-14.3. | |טווח ערכים תקין=ערכים ממוצעים בתינוקות עד גיל חודש-169.2; בגיל 1-3 חודשים-149.4; בגיל 4-6 חודשים 104.4; בגיל 7-12 חודשים-80.1; בגיל 1-2 שנים-71.1; בגיל 2-5 שנים-55.8; בגיל 5-9 שנים-39.6; בגיל 9-16 שנים-27.9; בגיל 16-60 שנה-14.3. | ||
| − | |יוצר הערך=[[משתמש:בן עמי סלע|פרופ' בן עמי סלע]], פרופ' גדעון בך | + | |יוצר הערך=[[משתמש:בן עמי סלע|פרופ' בן עמי סלע]], [[משתמש:גדעון בך|פרופ' גדעון בך]] |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| שורה 211: | שורה 211: | ||
| − | {{ייחוס| פרופ' גדעון בך - המחלקה לגנטיקה של האדם, המרכז הרפואי האוניברסיטאי הדסה, ירושלים}} | + | {{ייחוס|[[משתמש:גדעון בך|פרופ' גדעון בך]] - המחלקה לגנטיקה של האדם, המרכז הרפואי האוניברסיטאי הדסה, ירושלים}} |
{{ייחוס בן עמי}} | {{ייחוס בן עמי}} | ||
גרסה מ־06:43, 4 ביוני 2017
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| מדריך בדיקות מעבדה | |
| מוקופוליסכרידים | |
|---|---|
| Mucopolysaccharides | |
| שמות אחרים | MPS, גליקוזאמינוגליקנים (GAG) |
| מעבדה | כימיה בשתן |
| תחום | מחלות תורשתיות הגורמות למוקופוליסכרידוזות |
| יחידות מדידה | מיליגרם לגרם קראטינין |
| טווח ערכים תקין | ערכים ממוצעים בתינוקות עד גיל חודש-169.2; בגיל 1-3 חודשים-149.4; בגיל 4-6 חודשים 104.4; בגיל 7-12 חודשים-80.1; בגיל 1-2 שנים-71.1; בגיל 2-5 שנים-55.8; בגיל 5-9 שנים-39.6; בגיל 9-16 שנים-27.9; בגיל 16-60 שנה-14.3. |
| יוצר הערך | פרופ' בן עמי סלע, פרופ' גדעון בך |
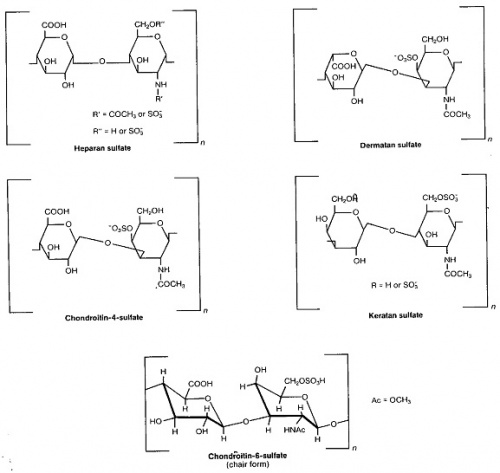
מבנה של מוקופוליסכרידים (GAGs)
המוקופוליסכרידים הם פולימרים סוכריים מסועפים המכילים שרשראות ארוכות של רב-סוכרים ביחידות דו-סוכריות חוזרות, כאשר שרשראות אלה מחוברות לשלד חלבוני. סיווג רב-סוכרים אלה מתבסס על הרכב הסוכרים ביחידות החוזרות, ובנוסף לשלד הסוכרי יש קישור של שיירי סולפט (SO4-). כמו כן, אחד משני הסוכרים מכיל קבוצת קרבוקסיל (-COO), מה שמקנה למוקופוליסכרידים אופי חומצי בתמיסה מימית, ולכן במצב של אגירה מופרזת נראה שאחד הגורמים הפתולוגיים לנזק התאי במוקופוליסכרידוזות נעוץ באגירה המסיבית של חומרים חומציים אלה בריכוז גבוה בליזוזום התאי.
בהתבסס על מבנה היחידות הדו-סוכריות, GAGs מסווגים ל-4 קבוצות: הפארן סולפאט (HS) והפארין, כונדרויטין (chondroitin) ו-דרמאטן סולפאט (DS) מסונתזים ב-Golgi, כאשר השלד החלבוני נוצר ברטיקולום האנדופלזמי הגס (RER), כאשר הקשרים הגליקוזידיים לחלבון מתבצעים בקשרי O-linked על ידי אנזימי גליקוזיל-טרנספראזות ליצירת פרוטאוגליקנים. קראטן סולפאט (KS) ייחודי בכך שהקשרים הגליקוזידים לחלבון הם N-linked או O-linked. קבוצת GAG הרביעית, hyaluronic acid, אינה מסונתזת ב-Golgi אלא על ידי שלושה אנזימי synthase שהם HAS2 ,HAS1 ו-HAS3, המהווים חלק אינטגראלי של ממברנת התא, ומפרישים באופן דינאמי שרשרות דו-סוכריות מאורכות. חומצה היאלורונית שהיא פוליסכריד לינארי, מורכבת מיחידות חוזרות של הדו-סוכר →1)βcANclG(3→1)βAclG(4→, ויש לה משקל מולקולארי מאוד גבוה שיכול להגיע ל-100,000 עד 10,000,000 דלטון. כל אנזים HAS מסוגל לבצע טרנסגליקוזילציה כאשר עומדים לרשותו יחידות UDP-GlcA ו-UDP-GlcNAc. האנזים HAS2 אחראי ליצירת פולימרים ארוכים מאוד של חומצה היאלורונית, ואילו אנזימי HAS1 ו-HAS3 אחראיים ליצירת פולימרים קצרים יותר.
היחידה הדו-סוכרית החוזרת (פרט ל-keratan) מורכת מסוכר אמיני דוגמת או N-acetylglucosamine, ביחד עם uronic sugar כגון glucuronic acid או iduronic acid או עם galactose. גליקוזאמינוגליקנים (GAGs) מאוד קוטביים ולכן נטייתם לרתק מים, ומכאן אופיים כמולקולת סיכה (lubricant) ברקמות. GAGs מאוד הטרוגניים מבחינת גודל המולקולה, היחידה הדו-סוכרית ושייר הסולפאט. מוקופוליסכרידים שונים ביניהם בסוג ה-hexosamine, בסוג ה-hexose או בסוג ה-hexuronic acid, שהם מכילים (לדוגמה, חומצה גלוקורונית, גלקטוזה, גלקטוזאמין, גלוקוזאמין ו-iduronic acid).
מוקופוליסכרידים נבדלים זה מזה בגיאומטריה של הקשרים הגליקוזידים. כונדרויטין סולפאט (CS) הוא המוקופוליסכריד השכיח ביותר; דרמטאן סולפאט (DS) שונה מ-CS בנוכחות של iduronic acid; קראטן סולפאט (KS) מסוג II יכול גם להכיל שייר של fucose; הפארין הוא ה-GAG שמטענו החשמלי השלילי הוא הגדול ביותר בין כל המולקולות הביולוגיות המוכרות; hyaluronan הוא ה-GAG היחיד שאינו מכיר שייר סולפאט. מוקופוליסכרידים דומים במידה מסוימת במבנה שלהם לפוליסכרידים אנימליים או צמחיים ידועים יותר כמו גליקוגן ועמילן.
תפקיד פיזיולוגי של מוקופוליסכרידים (GAGs)
הפארין אנדוגני ממוקם ונאגר בגופיפי ההפרשה (granules) של תאי פיטום (mast cells). היסטאמין מצוי כמולקולה חיובית בתוך הגראנולות הללו שה-pH שלהן חומצי במקצת (5.2-6.0), ולכן נראה שהפארין שמטענו מאוד שלילי קושר באופן אלקטרוסטאטי את מולקולת היסטאמין ואוגר אותה בתוך הגראנולה. להפארין סולפאט (HS) יש מספר פעילויות ותפקידים ביולוגיים, כולל הדבקות (adhesion) של תאים, וויסות שגשוגם של תאים, תהליכים התפתחותיים, קישור לממברנה של האנזים lipoprotein lipase או חלבונים אחרים, אנגיוגניות, חדירת נגיפים לתאים ואף ליכולת הגרורתית של תאי סרטן.
כונדרויטין סולפאט (CS) מגיב עם חלבונים קושרי-הפארין, ודרמאטן סולפאט (DS) מגיב עם גורמי הגדילה הפיברובלסטי FGF-2 ו-FGF-7, ומייחסים לו תפקיד בשגשוג התאים ובריפוי פציעות. האינטראקציה של DS עם HGF/SF או hepatic growth factor/scatter factor, משפעלת את מסלול האיתות של גורם גדילה זה (c-Met) דרך הקולטן שלו. תפקידים ביולוגיים נוספים של CS קשורים לעיכוב צמיחת אקסונים ורגנרציה בהתפתחות מערכת העצבים המרכזית, תפקידים בהתפתחות המוח, ובפעילות הנויריטוגנית.
אחד התפקידים העיקריים של קבוצת ה-GAGs השלישית, קראטן סולפאט (KS), היא לשמר את כושר ההידרציה של רקמות. לדוגמה, בקרנית העין התקינה, DS קשור למים במלואו, בעוד שקראטן סולפאט עובר רק הידרציה חלקית. בתרחישים פתולוגיים, כגון macular corneal dystrophy, בה חלים שינויים ברמות GAGs כמו KS, איבוד כושר ההידרציה בתוך הסטרומה של הקרנית עלול לגרום לערפול הקרנית, מה שמדגיש את חשיבות רמה תקינה של KS בכל הקשור לשקיפוּת הקרנית.
קראטן סולפאט נמצא ברקמות רבות אחרות פרט לקרנית העין, בהן הוא משחק תפקיד בוויסות יכולת הספיחה של מקרופאגים, ביצירת מחסומים לשגשוג נויריטים (neurites), בפיקוח על השרשת עוברים במעטה האנדומטריום במהלך המחזור החודשי, ובהשפעה על יכולת התנועה של תאי אנדותל בקרנית העין. לסיכום, KS ממלא תפקיד נוגד ספיחה מה שמרמז על חשיבותו בתנועת תאים ויכולת הספיחה שלהם, וממילא לחשיבותו בתהליך יצירת גרורות סרטניות.
חומצה היאלורונית היא מרכיב עיקרי ברקמות ובנוזלים סינוביאליים, כמו גם ברקמות "רכות" אחרות, ומקנה לסביבה בה היא מצויה תכונות ראולוגיות משמעותיות. לדוגמה, תמיסות של חומצה היאלורונית ידועות כבעלות אופי "צמיג וגמיש", כאשר הצמיגיות משתנה עם השינוי בעקת הגזירה (shear stress). בעקת גזירה נמוכה, תמיסת חומצה היאלורונית בריכוז 10 גרם לליטר, תהיה בעלת צמיגות הגדולה פי מיליון של הממס עצמו, ואילו כאשר תמיסה זו הנמצאת בעקת גזירה גבוהה, הצמיגות תפחת פי אלף. תכונה ראולוגית זו של תמיסות חומצה היאלורונית הופכת את האחרונה לחומר אידיאלי לסיכה של מפרקים או של משטחים המתחככים זה בזה כמו במקרה של סחוס.
בגוף, חומצה היאלורונית יוצרת מארגים (networks) המונעים דיפוזיה של חומרים שונים דרך חללים בינתאיים: לדוגמה, hyaluronan משתתף בפיזור נאות של חלבוני פלזמה בין חללים וסקולאריים וחוץ-וסקולאריים, מה שמשפיע על מסיסותן של מאקרו-מולקולות באינטרסטיציום, ומייצב את המבנה של סיבי קולאגן. תפקידים נוספים כוללים אינטראקציות של המשתית (matrix) עם חלבונים קושרי-hyaluronan כמו hyaluronectin, קולאגן VI, חלבון הקושר hyaluronan של תאי glia, חלבון המעכב α-trypsin וכן TSG-6. אינטראקציות בין hyaluronan עם CD44, הקשורות להתקדמות גידולים סרטניים, וכן אינטראקציות של hyaluronan עם HAMMR או hyaluronan-mediated motility receptor, שכרוך ביו השאר בגרורתיות סרטנית. פיברובלסטים, תאים מזותליאלים, וסוגים אחדים של תאי גזע (stem cells) עוטים מעטפת המורכבת בחלקה מ-hyaluronan, במטרה להגן על עצמם מפני חיידקים, או מולקולות משתית שונות.
מוקופוליסכרודוזות
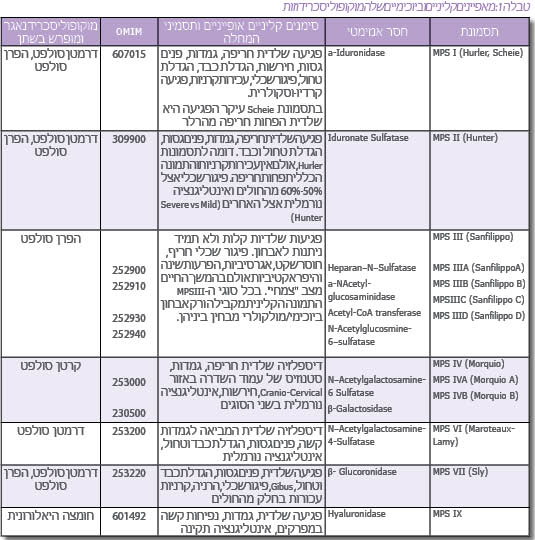
מוקופוליסכרידוזות (מפ"ס, MPS) מייצגות קבוצה של 11 מחלות תורשתיות רצסיביות הנבדלות ביניהן באופי הגן הפגום. המחלות מאופיינות כולן באגירה ליזוזומלית של מוקופוליסכרידים שונים (הידועים גם בשם גליקוזאמינוגליקנים - GAG) בהרכב האופייני לכל אחת ממחלות אלה. אגירת ה-GAG חלה בעיקר ברקמות החיבור, אם כי ברוב המקרים אגירה משמעותית מתקיימת גם ברקמות ובאיברים רבים נוספים בחולים אלה, מה שגורם לפגיעה רב מערכתית[1], [2], [3].
אגירה ליזוזומלית
המוקופוליסכרידים הם סוכרים מורכבים המכילים שרשראות ארוכות של רב-סוכרים ביחידות דו-סוכריות חוזרות ושרשראות אלה מחוברות לשלד חלבוני. סיווג רב-סוכרים אלה נעשה על פי הרכב הסוכרים ביחידות החוזרות, ובדרך כלל, נוסף על השלד הסוכרי יש קשירה גם של שיירי סולפט (SO4-). כמו כן, אחד משני הסוכרים מכיל קבוצת קרבוקסיל (-COO). מבנה זה מקנה למוקופוליסכרידים אופי חומצי ברור בתמיסה מימית, ולכן במצב של אגירה מסיבית אנו מניחים שאחד הגורמים העיקריים לפתולוגיה התאית במחלות אלה הוא האגירה המסיבית של חומרים חומציים אלה בריכוז גבוה בליזוזום.
מוקופוליסכרידים הם מרכיבי ממברנת התא, ופירוקם נעשה במצב תקין בליזוזום התוך-תאי. הרכב המוקופוליסכרידים המצטברים בכל אחת מהמחלות הללו נקבע על ידי הפגם המטבולי הספציפי הנובע מתפקוד לקוי או חסר של אחד מהידרולזות הליזוזומאליות המשתתפות בפירוק סוגים שונים של המוקופוליסכרידים (טבלה 1). אגירה משמעותית מתקדמת לאורך חיי החולה, באופן שעודף מוקופוליסכרידים מופרש מתאים מתים, ולכן מופיע בנוזלים חוץ-תאיים, כפלזמת הדם, נוזל סינוביאלי, במפרקים ועוד. בנוסף, חולים עם מוקופוליסכרידוזות מפרישים בשתן כמויות ניכרות של מוקופוליסכרידים, בכמות ובהרכב האופייני לכל אחת מהמחלות.
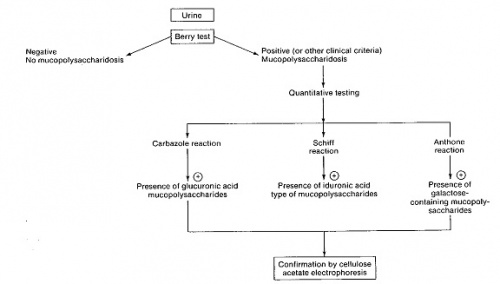
אמצעי האבחון המעבדתי הראשוני של חולים אלה הוא מדידה איכותית וכמותית של עודף המוקופוליסכרידים בשתן[4].
נוסף לאגירה ראשונית של הסוכרים, בפרופיל אופייני לכל מחלה, ניכרת גם אגירה משנית בליזוזומים של רקמות מסוימות של חומרים נוספים בעיקר גליקוליפידים מסוג גנגליוזידים הטעונים שלילית[5]. נראה שתהליך האגירה הראשוני מביא לפגיעה בתהליכי האנדוציטוזה של מעבר חומרים גבה-מולקולריים לתא ולליזוזומים. כתוצאה מכך נאגרים בהמשך התפתחות המחלה שומנים שונים, כאמור בעיקר גנגליוזידים שונים, שקשורים לפגיעה ניכרת במערכת העצבים המרכזית. אפיון חומרי האגירה במוח של חולים אלה מצביע על כך שלעתים עיקר האגירה אינה של המוקופוליסכרידים אלא דווקא של גנגליוזידים שונים.
מוקופוליסכרידוזות, הן מחלות של רקמות חיבור, לפיכך בכולן יש פגיעות בדרגות חומרה שונות בשלד, בעור ובשיער. אך אגירה של MPSs יכולה להופיע גם באיברים אחרים כמו הכבד והטחול, הלב וכלי הדם, ובחלק ניכר מהמחלות יש פגיעה פסיכומוטורית חריפה בגלל הצטברות MPS במערכת העצבים. השוֹנוּת בחומרת מוקופוליסכרידוזות נובעת בעיקר מאופי המוטציות, כאשר מוטציות חֶסֶר (deletion) תגרומנה לתסמינים חמורים יותר, ואילו מוטציות שחלוף חומצה אמינו (missense) עשויות לגרום למחלה קלה יותר. בהתאם, המופע של תסמינים קליניים יכול לבוא לביטוי כרונולוגי שונה, כגון הצורה האינפנטילית/ילדות מוקדמת (Infantile, Early childhood), צורת הנעורים (Juvenile) והצורה המבוגרת, הקלה יחסית (Adult).
במרבית המחלות הללו יש פגיעה חריפה במערכת העצבים המרכזית. אפיון חומרי האגירה במוח של חולים אלה מצביע על כך שלעתים עיקר האגירה אינה של המוקופוליסכרידים הראשוניים אלא גנגליוזידים שונים, ותהליך הפגיעה העצבית, כגון פיגור פסיכומוטורי ועוד, מתרחש כנראה מאגירה משנית זו המזרזת תהליכי דלקת, ולאו דווקא מהאגירה הראשונית [5], [6]. ואכן, בניסיונות טיפול בחלק מהמפ"ס בניסיון לתיקון מצב האגירה במוח, המעקב העיקרי הוא אחר ירידה באגירה ובתכולת הגנגליוזידים במוח החולה[7].
יחסי גנוטיפ ופנוטיפ
תהליך האגירה, הנובע מחסימה מלאה או חלקית של תהליך פירוק המוקופוליסכרידים מתרחש במשך כל חיי התאים שבהם חלה האגירה. כלומר, כמות הסוכרים הולכת ועולה בחולים והדבר מתבטא פנוטיפית בתמונה הקלינית שבה יש החמרה והתקדמות במצב המחלה במשך חיי החולה, המביאות להידרדרות בתפקודי רקמות ואיברים שונים. למעשה בכל המחלות תוחלת החיים קצרה מהתקין. במרבית המחלות התסמינים של המחלה מתבטאים כבר בגיל צעיר ביותר, ותוחלת החיים במרבית המקרים היא העשור הראשון ומקסימום העשור השני לחיים. כאמור, בחלק מהמחלות יש פגיעה חריפה במערכת העצבים המרכזית, ומכאן הקשיים הגדולים בפיתוח אמצעי טיפול מתאימים.
הורשה
המפ"ס מורשות כולן באופן רצסיבי, כלומר נשאי המחלה, כגון הורי הילדים החולים, אינם מראים סימני מחלה כלשהם. בכל המחלות, חוץ מתסמונת הנטר Hunter Syndrome) MPS II) הגנים ממוקמים בכרומוזומים אוטוזומיים, כלומר התסמונת מורשת כאוטוזומלית רצסיבית, כך שילד חולה ייוולד רק אם שני הוריו נשאי מוטציות. תסמונת הנטר עוברת בהורשה בתאחיזה לכרומוזום X ולכן לאם נשאית יש סיכון של 50% ללדת בנים נגועים בתסמונת. הנשאיות בדרך כלל בריאות, אולם תוארו מספר מקרים נדירים של בנות חולות בתסמונת הנטר. מקרים אלה נבעו בדרך כלל מאינאקטיבציה לא אקראית של כרומוזום X לאישה נשאית.
היסטוכימיה ואולטרה-סטרוקטורה
בבדיקות היסטוכימיות של תאים שבהם מתרחשת האגירה אנו רואים וקואוליזציה מרובה בכל שטח התא. בצביעה היסטוכימית בעזרת צבעים קושרי קבוצות חומציות - סולפט ו/או חומצה אורגנית, שניהם ממרכיבי המוקופוליסכרידים - מתקבלת תגובה אופיינית של מטאכרומזיה, צביעה סגולה חזקה. באנליזה בעזרת מיקרוסקופ אלקטרוני נראה כל התא מלא בווקואולות מוגדלות (ליזוזומים מוגדלים מאוד), מוקפות בממברנה יחידה והתוכן בעיקרו הוא חומר אמורפי גרנולרי האופייני לאגירת הסוכרים השונים[3]. תמונה זו היא אינדיקציה ברורה לאבחון מחלות בקבוצה זו. כמוזכר למעלה, במוח ייראו גם למלות ממברנליות של אגירת הגנגליוזידים.
קליניקה
מחלות המפ"ס השונות הן כולן מחלות של רקמות החיבור, ולכן למשל בכולן יש פגיעות משתנות בשלד, בעור, בשיער ועוד. אולם האגירה מתרחשת גם באיברים רבים אחרים ובדרך כלל הכבד והטחול, הלב וכלי הדם פגועים, ובחלק ניכר מהמחלות יש פגיעה פסיכומוטורית חריפה (טבלה 1).
בכל המחלות אנו מוצאים כי המחלה מתבטאת בחומרה משתנה, כלומר - הטרוגניות קלינית - פגיעה באותו גן המביא לביטוי קליני משתנה. וריאביליות זו נובעת בראש ובראשונה מאופי המוטציות, מוטציות חסר וכד' גורמות להסתמנות קשה של המחלה, ואילו מוטציות שחלוף חומצה אמינו (Missense) עשויות לעתים לגרום להופעת מחלה קלה יותר. אמנם ניתן למצוא חולים בכל ספקטרום החומרה, אולם כללית ניתן לחלק את החולים בכל אחת ממחלות המפ"ס לצורה האינפנטילית/ילדות מוקדמת (Infantile, Early Childhood), צורת הנעורים (Juvenile) והצורה המבוגרת, הקלה יחסית (Adult). לדוגמה, תסמונת מפ"ס סוג 1 (MPS I), הצורה הקשה ידועה כתסמונת הרלר (MPS IH, Hurler), והצורה הקלה של התסמונת מוכרת כתסמונת Scheie (MPS IS) וצורת ביניים (Hurler'Scheie, MPS HS). כך, תסמונת הרלר היא תסמונת קשה, פגיעה רב-מערכתית כוללת פיגור שכלי ותוחלת חיים שאינה עולה על 10-7 שנים, ואילו תסמונת שיי היא קלה יחסית, עיקר הפגיעה היא שלדית ותוחלת החיים ארוכה יחסית[2], [3].
קיים גם מצב של הטרוגניות גנטית, כלומר, אותה מחלה ואותו ביטוי קליני כתוצאה ממוטציות בגנים שונים. לדוגמה, תסמונת סנפיליפו MPS III) Sanfilippo) מחולקת ל-4 תת-קבוצות - MPS III ,A ,B ,C ,D (טבלה 1). בכל אחת מהן פגוע אנזים אחר כתוצאה ממוטציות ספציפיות בגן הרלוונטי, אולם כל ארבעת האנזימים הפגועים משתתפים בפירוק הפרן סולפט, אחד מהמפ"ס, וכך חוסר פעילות של כל אחד מהאנזימים מביא לאגירת אותו רב-סוכר - הפרן סולפטן ומכאן לאותה מחלה מבחינת הביטוי הקליני. מצב דומה קיים ב-MPS IV – תסמונת Morquio (B, A) שבה קיימת אגירת המוקופוליסכריד - קרטן סולפט עקב חסר בשני אנזימים המשתתפים בפירוקו (טבלה 1).
בכל המחלות התמונה הקלינית הולכת ומחריפה עם הגיל, תוך הידרדרות במצבו של החולה, ורובם מסיימים במצב וגטטיבי. הצטברות המוקופוליסכרידים ברקמות השונות מביאה במרבית החולים לשקיעתם במפרקים ומכאן לנפיחות מפרקים ונפיחות אצבעות. כמו כן, יש פגיעה ריאתית במרבית החולים עם הזמן, חירשות ופגיעה בראייה.
אבחון
האבחון הראשוני של החולים חייב להיעשות במרפאה, ומכיוון שבכל המחלות הללו חולים בעיקר ילדים, בדרך כלל הרופא המאבחן לראשונה הוא רופא ילדים ו/או רופא גנטיקאי. לאבחון מדויק ומשמעותי קיים צורך בניסיון קודם ובהיכרות מעמיקה עם מחלות אלה, ולכן כשמועלה חשד לנוכחות אחת מהמפ"ס, החולה מופנה בדרך כלל לרופא מומחה בתחום זה. בישראל, המחלקה לגנטיקה של האדם בבית החולים הדסה בירושלים מתמחה בתחום זה יותר מ-30 שנה, ומהווה מרכז אבחנות ארצי למחלות אלה, כמו גם למחלות ליזוזומליות אחרות.
חשד לנוכחות מפ"ס מבוסס בשלב הראשון בבדיקת שתן המצביעה על הפרשה מוגברת של מוקופוליסכרידים אופייניים. אולם, אפיון הפרשת הסוכרים אינו מדויק דיו ואינו מאפשר אבחון מדויק של המפ"ס. לדוגמה, הן בתסמונת הרלר והן בתסמונת הנטר מופרשים אותם מפ"ס בשתן (טבלה 1). כמו כן, קיימת חפיפה גבוהה מאוד בתסמינים הקליניים האופייניים בכל גיל בין התסמונות השונות ולכן האבחון המדויק והמשמעותי מבוסס רק לאחר בדיקות מעבדתיות ספציפיות והדגמת חוסר פעילות האנזים הרלוונטי. יש להעיר שבתסמונת סנפיליפו, הפגיעה העיקרית היא פיגור שכלי חריף ומינימום פגיעות שלדיות וכד', ולכן האבחון הקליני של תסמונת זו קשה במיוחד ועשוי לקחת זמן רב עד להעלאת חשד מתאים.
אבחון התסמונת מבוסס על הדגמה של חסר משמעותי (ירידה של לפחות 90%) בפעילות האנזים מהרמה הנורמלית. לכן למשל, במצב של הטרוגניות גנטית כמו בתסמונת סנפיליפו, רק לאחר האבחון האנזימטי ניתן לשייך את החולה לתסמונת המתאימה[8], [9]. האבחון המדויק הוא בעל חשיבות עליונה שכן ללא שיוך חד-משמעי אין אפשרות למשל להציע אבחון טרום לידתי, אין אפשרות להציע טיפול אם קיים טיפול. האבחון האנזימטי של החולים הוא חד-משמעי, אולם אבחון מצב נשאות (הטרוזיגוטיות) פחות מדויק בבדיקה האנזימטית ועומד על דיוק של 90%. לכן בהמשך לאבחון האנזימטי השלב הבא מחייב איתור המוטציה/מוטציות המאפשר אז זיהוי נשאות במדויק. האבחון האנזימטי נעשה בדגימת דם, והאבחון מבוצע בתמצית תאי דם לבנים (לויקוציטים) לאחר בידודם מהדם המלא. אבחון ניתן לבצע גם בתרביות תאים, כגון תאי פיברובלסטים בתרבית, תאים אמניוציטים בתרבית לאחר בדיקת מי שפר או דגימת סיסי השליה (Chorionic Villi). שני האחרונים מהווים מקור לאבחון טרום לידתי במשפחות בסיכון, ברמת דיוק מרבית. אבחון מוטציות מהווה כלי עזר רב חשיבות הן באבחון הטרום לידתי ועוד יותר בזיהוי נשאות. בישראל מרוכזים חולים בחלק ניכר מתסמונות אלה בחמולות ערביות גדולות ובמקרים רבים המוטציה הספציפית למשפחות מסוימות זוהתה בעבר. מחלות מפ"ס שונות באוכלוסייה הערבית בצפון הארץ מראות לעתים ריבוי מוטציות למרות הימצאות חולים בכפרים סמוכים זה לזה[10].
המניעה היא השירות הרפואי החשוב ביותר המוצע למשפחות בסיכון. אמנם פותחו דרכי טיפול לחלק ממחלות אלה (ראו להלן), אולם טיפולים אלה בחלקם הם עדיין ניסיוניים, האפקט התרפויטי מוגבל, אין אפשרות לתקן פגיעות שלדיות המהוות במרבית המחלות תסמין מרכזי, ואין אפשרות לתיקון הפגיעה במערכת העצבים המרכזית עקב מחסום דם-מוח (Blood Brain Barrier). לכן, זיהוי הפגם האנזימטי וזיהוי המוטציות חשובים ביותר. באבחון הטרום לידתי יש להוסיף טכנולוגיה יחסית חדשה - אבחון טרום השרשה, DGP (Preimplantation Genetic Diagnosis) המבוססת על אבחון התסמונת בעוברים, לאחר הפרייה חוץ-גופית (IVF), ברמת תא בודד המבודד מהעובר המתפתח בשלב של 8-6 תאים. אבחון זה דורש אפיון מוקדם של המוטציה (מוטציות) אצל ההורים, מכיוון שרק בשיטה המולקולרית ניתן להשיג אבחון מדויק ורגיש בכמות חומר כה קטנה. אותם עוברים המאובחנים שאינם הומוזיגוטיים למוטציות המחלה יוחזרו לרחם להמשך ההיריון. בשיטה זו אנו נמנעים מהצורך להפלות של עוברים פגועים.
החשד שמדובר במחלת אגירה של MPSs צריך להתעורר במקרה של נבדקים צעירים עם תווי פנים גסים, כבד וטחול מוגדלים, נסיגה שכלית, קוגניטיבית ומוטורית, התעכרות הקרנית, קישיון מפרקים ו-dystosis multiplex. בבדיקות היסטוכימיות בעזרת מיקרוסקופ אלקטרוני של תאים עם אגירת MPS, ניכרת וקואוליזציה תאית משמעותית, עם ליזוזומים מאוד מוגדלים. צביעה היסטוכימית בעזרת צבעים הקושרים קבוצות חומציות או סולפט, ממרכיבי מוקופוליסכרידים, תתקבל תגובת מטאכרומזיה סגולה חזקה אופיינית. באנליזה מיקרוסקופית התוכן הליזוזומאלי בעיקרו הוא חומר אמורפי גרנולארי האופייני לאגירת הסוכרים השונים.
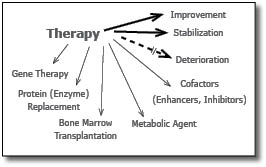
טיפול
אמצעי הטיפול בחולים אלה נמצא במרכז המחקר העולמי בתחום זה. מגוון אפשרויות נחקרות ונמצאות בשימוש בטיפול בחולים אלה והן מסוכמות בתרשים 1 [9], [11], [12].
הזרקת האנזים החסר (ERT) - אמצעי זה פותח לאחר הטיפול היעיל והמוצלח שהתקבל בטיפול חולי גושה סוג 1 (Gaucher Type 1)[13]. פותחו תכשירים מתאימים לטיפול בחלק ניכר מהמפ"ס. כיוון שהאנזים המוזרק אינו יציב זמן ממושך, יש צורך בהזרקות חוזרות, בדרך כלל פעם בשבועיים, או גם הזרקות שבועיות לקבלת אפקט טיפולי. הכנת התכשיר האנזימטי מותנית בזמינות כמויות מספקות הדרושות בכל הזרקה לכל אחת מהמחלות, ובהכנת האנזים כך שיוכל להיות מכוון (Targeting) לרקמות השונות הפגועות אצל החולים. הכנה זו מבוססת על כך שהאנזים יחדור לתא ויגיע לליזוזום רק אם הוא מכיל "אתר הכרה", כלומר מבנה סוכרי מסוים שיתקשר לקולטן המתאים (Receptor) האופייני לכל רקמה. לגבי רקמות חיבור יש צורך בנוכחות מנוז-6פוספט (M6P) טרמינלי כדי להיקשר לקולטן מתאים ולחדור לליזוזום. ברקמות כגון תאי פרנכימה בכבד, יש צורך בנוכחות מנוז או גלקטוז חופשי טרמינלי. ללא נוכחות אתר ההכרה אין לטיפול אפקט תרפויטי. פותחו התכשירים הבאים: Aldurazyme or Laronidase עבור תסמונת הרלר (MPS I), Idursulfase or I2S עבור מחלת הנטר (MPS II), ו-Galsulfase עבור חולים בתסמונת מרטו-למי (MPS VI). תכשירים אלה עברו את שלבי הניסוי הקליני והוכנסו לשימוש בארה"ב, באירופה ובישראל[9], [11].
הבעיה המרכזית בטיפול זה היא העובדה שהאנזים המוזרק אינו מגיע למוח החולים, ומכאן שהאפקט שלו מוגבל לתסמינים הוויסצרליים (סומטיים) בלבד. מתעוררת שאלה אתית בטיפול זה: האם נכון יהיה להקל מספר תסמינים סומטיים לחולים הממשיכים לסבול מפיגור שכלי ומהידרדרות נוירולוגית. לכן, מומלץ לשקול טיפול בעיקר לחולים שאינם פגועים נוירולוגית.
העלויות הכספיות של הטיפולים הללו גבוהות ונדרשת זמינות קבועה של החולה במשך כל חייו להזרקות החוזרות. עם זאת, לגבי שלושת הטיפולים שפורטו לעיל, נמצא שבדרך כלל הטיפול בטוח. אומנם התקבלו בכולם תגובות חיסוניות ברמות שונות בחלק מהחולים, אולם בדרך כלל ניתן לשלוט בתגובות אלה וחלקן חולפות עם הזמן. ללא ספק טיפולים אלה הביאו בכל המחלות הללו שיפור של לפחות חלק מהתסמינים הקליניים ויש להניח שגם להארכת תוחלת החיים של החולים. פותחו תכשירים מקבילים גם לטיפול בחולי סנפיליפו (MPS III) מסוג A וסוג B וכן לתסמונת מורקיו (MPS IV), אולם העובדה שטיפול זה אינו אפקטיבי לגבי מערכת העצבים המרכזית וכן בתיקון מומי השלד האפקט במקרים אלה היה מוגבל מאוד, מעלה את השאלה האם ראוי לפתח תכשירים אלה. בישראל מטופלים כיום חולי מפ"ס I ומפ"ס II, ומאתרים עתה חולי מפ"ס VI לתחילת הטיפול.
טיפול גני - Gene Therapy
עיקר הניסיונות בכיוון זה נעשו בחיות מודל הקיימות לכל אחת מהמפ"ס. ניסיונות לתראפיה גנית מבוססים על הזרקת וקטור מתאים, על פי רוב וקטור ויראלי ספציפי המכיל במקום חלק מהגנום הוויראלי את גן המפ"ס התקין שבו אנו מבקשים לבטא את החלבון הנורמלי. הגן הוא למעשה החלק המקודד בכל גן (cDNA) שכן אין אפשרות להחדיר את הגן כולו עקב גודלו העצום. ניסיונות נעשו הן בתרביות רקמה והן בחיות מודל - עכברים, חתולים וכלבים - שבהן הוזרק הגן התקין בדרך כלל באמצעות וקטור ויראלי מסוג Retrovirus או AAV או Lentivirus. בכל המקרים דווח על חדירה יעילה לתאים וביטוי משמעותי של החלבון המקודד על ידי הגן המתאים. ההזרקות לחיות נעשו או על ידי הזרקות IV או הזרקות פריטונאליות או הזרקת הווקטור לתאי מוח עצם מבודדים והחזרתם לחולה לאחר הטרנספקציה הגנית. הודגמו הן בטיחות נדרשת והן יעילות [9], [11]. לצורך תיקון הפגיעה הנוירולוגית דווח על הזרקות הגן החסר ישירות למוח החיות החולות, לרוב באתרי מוח שונים וגם פה התקבלו תוצאות לתיקון הפגם[7], ומתוכנן (Personal Knowledge) להתחיל בטיפולים בכיוון זה לחולים בחלק מסוגי המפ"ס; בניגוד ל-ERT, בשיטות אלה מספיקה הזרקה יחידה שעשויה להספיק לזמן רב, כלומר ייצור מתמיד ונמשך גם לשנים, של החלבון על ידי הגן המוזרק.
השתלת מוח עצם
השתלת מוח עצם מהווה למעשה שילוב של הזרקות האנזים (ERT) והטיפול בתראפיה גנית (Gene Therapy). מטופלים חולים בתסמונות שונות של המפ"ס באמצעות השתלת מוח עצם או השתלות דם טבורי [14]; יש לזכור את הסיכון הגבוה בטיפול מסוג זה. אולם על פי רוב זו הדרך היחידה לעזור לחולים אלה. טיפול זה נעשה כבר שנים רבות, בעיקר לחולי הרלר (מפ"ס I) בעולם כולו, כולל בישראל. נעשו גם השתלות לחולי מפ"ס II ובתסמונות האחרות, אולם הניסיון כאן יותר מוגבל אף שבדרך כלל נרשמו הצלחות. ההשתלה מבוצעת מתורם בריא, רצוי לא נשא. תאי מוח העצם המתבגרים לתאי דם שונים מגיעים לכל אזורי הגוף, כולל גם העברה למוח (מקרופגים). התאים מהתורם הבריא מייצרים את האנזים התקין המופרש בחלקו מהתא ונקלט על ידי התאים השונים. נוכחות או חדירה של אנזים ברמות העולות על 10% מהרמה הנורמלית מספיקות לתיקון האגירה הליזוזומלית והתאים נראים אז ללא אגירה ולמעשה לא נבדלים מתא תקין[15].
את כל הטיפולים בשלוש הטכנולוגיות שהוזכרו מומלץ לעשות בשלבים המוקדמים ביותר, רצוי לפני שהתפתחו באופן ניכר סימני המחלה השונים, שכן באספקטים שונים של תסמיני המחלה הטיפולים רק עוצרים או מאיטים את התקדמות המחלה, ולאו דווקא מביאים חזרה למצב תקין. לפיכך הועלתה האפשרות לבצע בדיקות אבחנתיות מוקדמות באמצעות סקר יילודים לאיתור חולים כבר מיד לאחר הלידה; אבחון יילודים לאיתור תינוקות חולי מפ"ס מבוצע באוסטרליה ובמדינות מסוימות בארה"ב [16], [17]. טיפול קיים ורלוונטי רק לחלק מהמפ"ס, ולכן איתור תינוקות חולים לא תמיד יסייע להורים ועשוי לגרום ללחצים נפשיים כבר בשלב מוקדם של חיי התינוק.
שיטות טיפול אלטרנטיביות
פותחו שיטות לטיפול במחלות האגירה הליזוזומליות, כולל חולי המפ"ס השונים. שיטות אלה כוללות עיכוב ביצירת הסובסטרט ושימוש בשפרונים כימיים (Chemical Chaperons).
עיכוב יצירת הסובסטרט, TRS (Substrate Reduction Therapy) - בשיטה זו מוסף מבחוץ חומר המגיב עם המערכת הביוסינתטית באופן ספציפי, בעיקר על ידי אינטראקציה ועיכוב של אחד האנזימים במסלול הביו-סינתזה. הכיוון המבטיח ביותר בתחום זה הושג באמצעות החומר Genistein (Trihydroxyisoflavone)[4], [5], [7] שנמצא כמעכב יצירת מפ"ס שונים[18]. הוספת חומר זה הביאה לירידה משמעותית בתכולת מפ"ס שונים בתאים בתרבית. חומר זה נוסה הן במערכת תרביות תאים של חולי מפ"ס שונים והן בחיות מודל, ונמצא שיפור ברור במצב האגירה האבנורמלית עקב הירידה ההתחלתית בתחולת המוקופוליסכרידים. חומר זה הוא בעל משקל מולקולרי נמוך, חודר את מחסום הדם-מוח, ולכן עשוי להיות יעיל גם לגבי הפגיעות הנוירולוגיות. החומר נוסה בתרבית של חולי מפ"ס IIIA ,II ,I ו-IIIB, ובכולם נמצאה ירידה חדה בתכולת האגירה (18). עוד מוקדם לקבוע את השפעת החומר בטיפול בחולים עצמם.
שפרונים כימיים - טיפול זה מתייחס בעיקר למוטציות מסוימות בלבד. למעשה הוא ישים בעיקר למוטציות שחלוף חומצות אמינו אחת באחרת – Missense Mutations. במוטציות מסוג זה ייצור החלבון (המוטנטי) עדיין קיים ובדרך כלל לא נפגעת רמתו, אולם כאשר חלבון מוטנטי מגיע בתהליך ייצורו למערכת הרטיקולום האנדופלזמטי בשלב מעברו לליזוזום קיימת שם מערכת "בקרה" המאתרת חלבון בעל מבנה לא תקין (מוטנטי) ומערכת זו מביאה לכך שהחלבון בעל המבנה הפגום מתפרק על ידי מערכת ה-Proteasome [19]. כך, למרות ייצור החלבון הוא בסופו של דבר אינו מגיע לליזוזום. חומרים מסוימים, על פי רוב מעכבים ספציפיים לאנזים בכמויות קטנות נקשרים באופן ספציפי לחלבון האנזימטי ומביאים בעקבות הקשירה לשינויים מבניים כך שמערכת הבקרה הזו לא מאתרת את הפגם, ועל ידי כך "מתחמק" החלבון מפירוק ומגיע לליזוזום. לחלבון זה יש בדרך כלל פעילות אנזימטית ברמה משתנה, ולמעשה במצב זה ניתן להגיע אכן לתיקון מצב האגירה [20]. היתרון של חומרים אלה הוא שברובם הם קטנים מולקולרית, ולכן גם עשויים לעבור בקלות מהדם למוח ולפעול גם שם.
פרוט המוקופוליסכרידוזות
תסמונת Hurler או MPS I
תסמונת Hurler או MPS I, נובעת מחסר באנזים α-L-Iduronidase, הצטברות דרמטן סולפאט (DS) והפארן סולפאט (HS) בתאי אנדותל, פיברובלסטים, מקרופאגים, תאי שריר חלק, נוירונים, תאי סחוס ועצם, ותאי אפיתל. MPS I הוא מפגע רב-מערכתי מתקדם. בו יש שוֹנוּת פנוטיפית רחבה הבאה לביטוי בשלושה תת-סוגים של MPS I: מחלת Hurler, מחלת Scheie שסימונה MPS I S, ומחלת Hurler-Scheie שסימונה MPS I H-S. הגן המקודד לאנזים האמור IDUA ממוקם בכרומוזום 4p16.3.
תסמונת Hurler היא החמורה מבין שלושת המפגעים במקבץ זה, כאשר האבחון שלה נעשה בדרך כלל לפני גיל 18 חודשים, כאשר תסמונות Hurler-Scheie ו-Scheie מתונות יותר בתסמונות הקליניות, והן תאובחנה בדרך כלל בגיל שבין 3-10 שנים. בלידה, התינוק גדול מהממוצע ושגשוגו מהיר עד גיל שנה, אם כי האטה בשגשוג ניכרת מגיל שנה עד גיל 3 שנים, כאשר בגיל שנתיים ניכרת הרחבה של הצלעות ובית החזה. ברוב המקרים הילדים אינם עוברים את סף הגובה של 120 ס"מ, עם פגיעה שלדית חמורה עד כדי גמדות.
התסמונות הקליניות של תסמונת Hurler כוללות תווי פנים גסים (גשר אף שטוח ומצח בולט), לסת קטנה מאוד (micrognathia), לשון בולטת (macroglossia), שעירוּת-יתר, עכירות קרניות עד כדי עיוורון, ניוון רשתית, בעיות שמיעה בגין דלקות אוזניים חכופות, צרידות ודלקות דרכי נשימה עליונות המתבטאים בנשימה שורקנית. לב, כבד וטחול מוגדלים, בקע טבורי או בקע מפשעתי, פיגור שכלי ופגיעה קרדיו-וסקולארית. ילדים עם תסמונת Hurler מתים בדרך כלל לפני גיל 10 ממחלה חסימתית של נתיבי אוויר, זיהומים בדרכי הנשימה, סיבוכים בלב.
בתסמונת Scheie שהיא הווריאנט הקל יותר, התסמינים מתחילים בדרך כלל לאחר גיל 5, עם אבחון נפוץ ביותר אחרי גיל 10. לילדים עם תסמונת Scheie יש אינטליגנציה רגילה או ייתכן בעלי ליקויי למידה מתונות; וייתכן שיש בעיות פסיכיאטריות. גלאוקומה, התנוונות הרשתית, ולעתים קרנית עכורה. בעיות אחרות כוללות תסמונת מנהרה קרפאלית או דחיסת עצבים אחרים (כגון עצב הגומד-ulna, העלול לגרום לכיפוף אצבעות-claw hand), מפרקים נוקשים, רגליים מעוותות, צוואר קצר, כבד וטחול מוגדלים, מחלת שסתום הוותין. לעתים יש גם מחלה חסימתית של נתיב אווירי בשינה. תוחלת החיים בתסמונת Scheie תקינה.
תסמונת Hurler-Scheie, פחות חמורה יותר מתסמונת Hurler. התסמינים מתחילים בדרך כלל בגיל שבין 3-8 שנים. בילדים ייתכן פיגור בינוני, קשיי למידה. אי סדירות מערכתית, קומה נמוכה, לסת קטנה, קשיחות מפרקים פרוגרסיבית, דחיסות עמוד השדרה, קרניות עכורות, אבדן שמיעה, מחלת לב, תווי פנים גסים, ולעתים בקע טבורי. בעיות נשימה בשינה, מחלות לב עלולה להתפתח בבגרות. תוחלת החיים היא בדרך כלל קצרה, עד תחילת שנות ה-20 לחיים.
שכיחות תסמונת Hurler היא 1:100,000, שכיחות תסמונת Scheie מוערכת כמקרה אחד ב- 500,000 לידות, ואילו שכיחות תסמונת Hurler-Scheie מוערכת כאחד ב-115,000 לידות.
מעבר לאפיון של הפרשת DS ו-HS בשתן על ידי כרומטוגרפיית רובד דק (TLC) או על ידי אלקטרופורזה, אבחון של MPS I ניתן להתבצע על ידי מדידת פעילות האנזים α L-Iduronidase בלויקוציטים המופקים מדגימת דם הנלקחת במבחנת ספירת-דם (EDTA, פקק סגלגל). הדם חייב להישמר בקירור לפני הגיעו למעבדה. בבדיקת FNA ניתן לגלות גופיפי זברה וכן גופיפי מיאלין. אבחון קדם-נטלי מקובל לגילוי המוטציה בגן הרלוונטי.
תסמונת Hunter או MPS II
ערך מורחב – מוטציות בתסמונת Hunter
תסמונת Hunter או MPS II, נובעת מחסר האנזים הליזוזומאלי iduronate-2-sulfatase, המקודד על ידי הגן I2S הממוקם בכרומוזום Xq28, ואכן תסמונת Hunter היא המוקופוליסכרידאזה היחידה המועברת בתאחיזה לכרומוזום X, ולכן לאם הנשאית יש סיכון של 50% ללדת בנים נגועים בתסמונת. הנשאיות בדרך כלל בריאות, אם כי תוארו מקרים נדירים של בנות עם תסמונת Hunter כתוצאה מאינאקטיבציה בלתי אקראית של כרומוזום X באישה נשאית.
החסר האנזימטי מביא כמו ב-MPS I להצטברות DS ו- HS באופן רב-מערכתי. התסמונות בתסמונת זו אינן מופיעות בלידה, אך בדרך כלל מתגלות לאחר השנתיים הראשונות לחיים. לעתים מופיע בקע בטני, דלקות אוזניים ודרכי נשימה, שפעת ונזלת מתמשכת, אם כי הסימנים היותר מובהקים הם ראש גדול ותווי פנים גסים, מצח בולט, גשר אף שטוח ולשון גדולה. במקרים אחדים יש מעורבות של מערכת העצבים המרכזית, המביאה לפיגור שכלי וחריגות התנהגותיות כגון ADHD, אוטיזם, OCD ו-sensory processing disorder.
האגירה המתמשכת של DS ו-HS גורמת בין השאר להתעבות שסתומי ודופן הלב, ולדעיכה מתקדמת בתפקוד הלב. גם דפנות דרכי האוויר מתעבות מה שגורם להפרעות נשימה בעיקר בשינה. הכבד והטחול מוגדלים, הבטן תפוחה, המפרקים מתקשים מה שמגביל את התנועתיות. הקשחה הדרגתית של האצבעות מקשה על יכולת התאחיזה של עצמים שונים, מה שעלול להחמיר כאשר מופיעה לעתים תסמונת המנהרה הקרפאלית. מעורבות העצמות מביאה לקומה נמוכה, והצטברות GAG ברקמת החיבור התת-עורית מביאה לכתמים בצבע שנהב בגפיים ובגב בחלק מהלוקים בתסמונת. הצטברות GAG במוח תביא לפיגור שכלי בדרגות שונות. אין הופעה של התעכרות הקרניות.
חלק מהלוקים ב-Hunter אינם סובלים מפיגור שכלי, וחיים עד גיל 20-35 שנה, וחלקם אף יאריכו חיים עד לשנות ה-50 וה-60 לחייהם. לעומתם, חלק מהחולים יסבלו מפיגור שכלי חמור ותוחלת חייהם רק 15 שנה.
בדרך כלל התסמינים ב-Hunter מתחילים בגיל שבין 2-4 שנים, והאבחון ייעשה בדרך כלל בבחינת השתן לנוכחות GAGs. יש לדעת שלעתים בדיקת השתן תיתן תוצאה תקינה למרות האבחון בדיעבד של התסמונת, לכן קביעה מוחלטת של נוכחות הפגם תיעשה במדידת פעילות האנזים I2S בנסיוב, בלויקוציטים או בפיברובלסטים מביופסיה של העור. בדיקה קדם-לידתית יכולה למדוד רמת האנזים בנוזל מי השפיר, או בסיסי השליה.
אפידמיולוגיה: ההערכה היא שבעולם כולו יש כ-2,000 חולי תסמונת Hunter, כ-500 מהם בארה"ב, כ-70 בקוריאה, כ-30 בקנדה, כ-20 בפולין, ומספרים קטנים יותר בשאר הארצות. שכיחות המפגע מוערכת במקרה אחד ל-250,000 לידות-חי.
ארבעת הוואריינטים של תסמונת Sanfillipo types A-D
ארבעת הוואריינטים של תסמונת Sanfillipo types A-D מתאפיינים על ידי הצטברות של HS: תסמונת Sanfillipo A או MPS IIIA נגרמת מפגם באנזים heparan N-sulfatase, המקודד על ידי הגן SGSH הממוקם בכרומוזום 17q25.3 ; תסמונת Sanfillipo B או MPS IIIB נגרמת מפגם באנזים α-N-acetylglucosaminidase המקודד על ידי האנזים NAGLU הממוקם בכרומוזום 17q21.2; תסמונת Sanfillipo C או MPS IIIC נגרמת מפגם באנזים heparan-α-glucosaminide N-acetyltransferase המקודד על ידי הגן HGSNAT הממוקם בכרומוזום 8p11.21; תסמונת Sanfillipo D או MPS IIID נגרמת מפגם באנזים N-acetylglucosamine-6-sulfatase המקודד על ידי הגן GNS הממוקם בכרומוזום 12q14.3.
מקבץ תסמונות Sanfillipo הוא מפגע אוטוזומאלי רצסיבי נדיר הנובע מכשל בפירוק הפארן סולפאט המצטבר בעיקר במערכת העצבים המרכזית. יש לציין שלמרות שלא נמצא כל פגם באנזימים הקשורים למטבוליזם של גנגליוזידים, ניתן למצוא ב-Sanfillipo גם הצטברות של גליקוליפידים נושאי מטען חשמלי שלילי אלה. השכיחות של המלחלה משתנה על פי פיזור גיאוגרפי באופן שבצפון אירלנד נמצא מקרה אחד ל-280,000 לידות-חי, באוסטרליה 1 ל-66,000, ובהולנד 1 ל-50,000. השכיחות בעולם של כל אחד מ-4 הסוגים של מחלה זו היא כדלקמן: Type A-מקרה אחד ל-100,000 לידות-חי; Type B-מקרה אחד ל-200,000; Type C-מקרה אחד ל-500,000; Type D- מקרה אחד למיליון.
תסמונת Sanfillipo נגרמת מפגם באחד מ-4 אנזימים הדרושים להסרת שיירי glucosamine מ-heparan sulfate. פגם זה גורם להצטברות HS בתאים וברקמות מה שיגרום במהלך הזמן להופעת תסמינים קליניים. הלוקים בתסמונת זו סובלים מפיגור התפתחותי עם דעיכה פרוגרסיבית בסטאטוס השכלי. כן יופיעו תווי פנים גסים, קשיון מפרקים, ובעיות בהתנהגות ובשינה. ארבעת סוגי תסמונת זו אינם ניתנים להבדלה קלינית למרות שמוטציות בגנים שונים אחראיים לכל אחד מסוגים אלה. לכן מומלץ למדוד את פעילות ארבעת האנזימים הרלוונטים כאמצעי אבחוני התחלתי.
התסמונת באה לביטוי באופן מאוד איטי והדרגתי בילדים בגיל 2-6 שנים, בדרך כלל בהופעת שינויים דיסמורפיים בתווי הפנים. תסמינים אחרים כמו קשיון מפרקים או שעירות-יתר מופיעים רק בשלב מאוחר יותר. בגיל 2-3 שנים מתחילים להבחין בפיגור בהתפתחות, כמו גם בבעיות התנהגות, ולאחריהם דעיכה אינטלקטואלית פרוגרסיבית, המגיעה עד כדי שיטיון חמור ופגיעה מוטורית פרוגרסיבית. רכישת מיומנות דיבור איטית ולא מושלמת. השלב הבא של המחלה מתאפיין בהיפראקטיביות אוח אגרסיביות, חוסר מנוחה, אכילת דברים בלתי-אכילים (pica), שינה טרופה פעילות יתר וחוסר שקט, נטייה להרס. לעתים יש איבוד שליטה על הצרכים.
בשלב מאוחר יותר של המחלה, יש בעיות יציבה ונטייה ליפול תוך כדי הליכה או ריצה, ובהמשך נטייה לאי-תנועה וחסר תגובתיות המחייבים שימוש בכיסא גלגלים. יכולות להופיע בעיות בליעה, ופרכוסים. אין התעכרות הקרנית, או שהיא מתונה ביותר. למרות שהתסמינים הקליניים בעיקרם נוירולוגיים, תיתכן גם הופעה של שלשולים, בעיות שיניים, וכבד וטחול מוגדלים. יש מקרים של ילדים עם MPS III עם בעיות קרישה ונטייה לדימומים לאחר פעולות כירורגיות. תוחלת החיים של בדרך כלל עד סוף שנות העשרה או תחילת שנות ה-20 לחיים. אלקטרופרזה של דגימת שתן תזהה הצטברות של הפארן סולפאט. ניתן לבצע אבחון טרום-לידתי. אנליזה מולקולארית של הגנים SGSH ו-NASGLU המקודדים לתת סוגים A ו-B ניתנת לביצוע וגילוי מוטציות. לצורך מדידת רמת האנזימים בכל 4 סוגי Sanfillipo ניתן לקבל פיברובלסטים מדם היקפי הנלקח במבחנת סודיום הפארין (פקק ירוק). לצורך קביעת רמת האנזימים הרלוונטיים לסוגים A, C ו-D, ניתן להשתמש בלויקוציטים, כאשר לקביעת רמת האנזים להערכת Type B של Sanfillipo, ניתן גם להשתמש בפלזמה.
תסמונת Morquio או MPS IV
תסמונת Morquio או MPS IV, מתחלקת ל-2 תת-סוגים: א. Type A או MPS IVA בו יש הצטברות של keratan sulfate ו-chondroitin-6-sulfate, נגרם מפגם באנזים galactose-6-sulfate sulfatase או N-acetykgalactosamine-6-sulfatase המקודד על ידי הגן GALNS הממוקם על כרומוזום 16q24.3. ב. Type B או MPS IVB בו יש הצטברות של keratan sulfate, נגרם מפגם באנזים β-galactosidase המקודד על ידי הגן GLBI הממוקם בכרומוזום 3p22.3.
תסמונת Morquio על 2 תת-סוגיה אובחנה לראשונה על ידי הרופא Morquio סמך התעכרות קרניות, מחלת מסתם הוותין, והפרשה מוגברת בשתן של keratan sulfate. הוא אבחן תסמונת זו בארבעה ילדים של משפחה ממוצא שוודי. השכיחות של תסמונת זו 1:75,000 עד 1:200,000 באוכלוסיות שונות. תינוקות עם תסמונת זו נראים תקינים בלידה, אך לאחר חודשים אחדים מתגלה עיוות בעמוד השדרה, פיגור בגדילה והופעת "ברכי X" או genu valgum בגיל 2-3 שנים. תסמונות אופייניות ל-Morquio הם כדלקמן: התפתחות בלתי תקינה של השלד, פגיעה בסחוס (dysostosis multiplex), ברכיים גדולות ובלתי יציבות, מרפקים גדולים, ראש גדול, צוואר ירכיים דיספלסטי, חופש תנועה מוגזם ורפיון במפרקים, אצבעות גדולות, רווח בין השיניים, חזה בולט (pectus carinatum), דחיסה של עמוד השדרה, לב מוגדל ואוושת לב, גמדות.
תסמינים נוספים יכולות לכלול: צוואר קצר במיוחד, היפופלזיה של חלק הפנים המרכזי ולסת בולטת, התעכרות הקרניות, סקוליוזיס או kyphosis מתונים, היפופלזיה אודונטואידית ושכבת enamel דקה במיוחד, אי-יציבות אטלנטו-אקסיאלית, איבוד הדרגתי של יכולת הליכה המתחילה בהליכה מקרטעת "דמויית ברווז", כבד וטחול מוגדלים באופן מתון, ובקע מפשעתי. קוגניציה ומצב שכלי תקינים. תוחלת החיים יכולה להיות קצרה במיוחד במקרים חמורים (2-3 שנים) אך גם להגיע במקרים מתונים לגיל 60-70 שנה. אבחון המחלה נעשה על ידי אלקטרופורזה של שתן לאיפיון רמה מוגברת של KS. רמת האנזים β-galactosidase בלויקוציטים או בפיברובלסטים שמגדלים בתרבית ניתנת לביצוע תוך שימוש ב-4methylumbelliferyl כמצע. יש לקחת בחשבון שמדידת רמת האנזים בטיפת דם מיובשת על נייר Guthrie עלולה לסטות בתוצאה נמוכה כזובה בגלל טריות הדגימה או שמירת הנייר הסופג בתנאי לחות או טמפרטורה לא נאותים.
תסמונת Maroteaux-Lamy או MPS VI
תסמונת Maroteaux-Lamy או MPS VI בה מצטבר dermatan sulfate, בגלל פגם באנזים N-acetylgalactosamine-4-sulfatase (הידוע גם כ-arylsulfatase B), המקודד על ידי הגן ARSB הממוקם בכרומוזום 5q14.1. זו תסמונת נדירה שם שכיחות מוערכת בין 1:240,000 ל-1:1,250,000. ילדים עם תסמונת זו הם בעלי יכולת שכלית וקוגניטיבית תקינה. התסמינים הפיזיולוגיים יכולים להיות בדרגת חומרה המתקדמת מהר וניתנים לגילוי כבר בגיל 6-24 חודש, לעומת צורתה האיטית של התסמונת בה התסמינים יופיעו בגיל מאוחר.
המאפיינים הקליניים כוללים דיספלזיה שלדית וקומה נמוכה מאוד, תווי פנים גסים (אף רחב, מצח ועיניים בולטים, לשון מוגדלת), גולגולת מעובה, אוכף טורקי (sella turcica) בצורת J, התעכרות קרניות אם כי לא בגיל מוקדם, כבד וטחול מוגדלים, אי-סדירות של פעולת הלב, וממצאים שלדיים כגון dysostosis multiplex, ופרקי ידיים כפופים. תסמינים נוספים כוללים: עצם בריח קצרה ומעובה, עקמומיות האפיפיזה של העצם הרדיאלית, דיספלסטיות של עצמות האגן, חוליות שדרה עגלגלות ודמויות מקור, kyphosis, דיאפיזה מוגדלת ומטפיזה חריגה של העצמות הארוכות, צלעות בצורת משוט עם היצרות באזור החוליות והתרחבות באזור עצם החזה, רווח גדול בין השיניים ודיספלזיה של השן.
אבחון: בשלב ההתחלתי נלקחת בדיקת שתן להרצה אלקטרופורטית להערכת הפרשה מוגברת של DS. לכן, קבלת תוצאה חיובית, תחייב ביצוע בדיקה אנזימטית של פעילות ארילסולפטאזה B בתאי עור או בלויקוציטים. בדיקה גנטית לנשאוּת מתבצעת בבני משפחה בריאים של אנשים המאובחנים כלוקים בתסמונת. אבחון טרום-לידתי מתבצע במקרה של הורים נשאים.
תסמונת Sly או MPS VII
תסמונת Sly או MPS VII, בה מצטברים heparin sulfate ו-dermatan sulfate וכן chondroitin-4,6-sulfate, נגרם בגלל פגם באנזים β-glucuronidase, המקודד על ידי הגן GUSB הממוקם בכרומוזום 7q11.21. מחלת אגירה זו מופיעה בשכיחות של פחות מ-1 ל-250,000 לידות-חי. הילדים נולדים עם בצקת כללית (hydrops fetalis), ורוב התסמינים דומים לאלה של תסמונת Hurler, והם כוללים: תופעות נוירולוגיות ופיגור שכלי החל מגיל 3 שנים, אובדן ראיית לילה וראייה היקפית.
תסמינים אחרים כוללים אי סדירות השלד, קשיחות מפרקים, תנועה מוגבלת, בקע מפשעתי או טבורי. באזור הראש, הצוואר והפנים: תווי פנים גסים ומאקרוצפלוס, בולטות המצח, אוכף טורקי דמוי J, איחוי מוקדם מדי של התפרים (sutures) הסגיטליים. בעיניים: עכירות הקרנית ומפגע באישון (iris coloboma). באף: גשר אף שטוח ונחיריים מוסטות קדימה (anteverted nostriols). בפה: לעתים חך שסוע (cleft palate). בעצמות: dysotosis mutiplex. בעמוד השדרה: kyphosis, סקוליוזיס, עיוותים דמויי-חכה בחוליות החזה והמותן של עמוד השדרה. בבית החזה: בולטות של בית החזה (pectus carinatum) או שקיעה כלפי פנים (pectus excavatum). בולטות של הבטן לעתים בגלל בקע טבורי או של המפשעה. באברי קצה: רגל קלובה (clubfoot או talipes), עצם האגן (ilium) לא מפותחת, נמק של ראש הירך. בגפיים התחתונות: נמק של צוואר הירך, ועצמות טובולאריות קצרות. נטייה לדלרת ריאות חוזרת בשנות החיים הראשונות, כבד וטחול מוגדלים.
תסמונת Natowicz או MPS IX
תסמונת Natowicz או MPS IX מתאפיינת בהצטברות חומצה היאלורונית (Hyaluronic acid) בגלל פגם באנזים hyaluronidase, המקודד על ידי הגן HYALI, הממוקם בכרומוזום 3p21.31. עד שנת 2001 דווח רק על מקרה אחד בספרות הרפואית של MPS IX. התסמינים כוללים פגיעה שלדית, קומה נמוכה, שינויים מתונים בתווי הפנים, תנועת מפרקים תקינה, אינטליגנציה תקינה. רדיוגרפיה של האגן הראתה הצטברות מסות רבות של רקמה רכה, עם שחיקה (erosion) מסוימת של העצם. תסמינים כוללים גם הצטברות נודולארית של מסות רקמה רכה סביב המפרקים, עם אפיזודות של נפיחות מכאיבה המתפוגגת מעצמה תוך ימים אחדים.
אנליזה של מוקופוליסכרידים
דגימת שתן אקראית או דגימה הנלקחת מאיסוף של 24 שעות, יכולות לשמש לבחינה איכותית או כמותית של רמת MPS בשתן. אם השתן מהול מדי עם משקל סגולי של פחות מ-1.005, או עם רמת קראטינין נמוכה מ-0.2 גרם לליטר, תיתכן תשובה שלילית כזובה. יש להקפיד על שמירת דגימת השתן בקירור לפני הבדיקה.
אנליזה איכותית של MPSs מתבצעת על ידי כרומטוגרפיה של רובד דק (TLC) או על ידי אלקטרופורזה של דגימת שתן, כאשר במקביל יש להריץ דגימות ביקורת חיובית ושלילית. אנליזה כמותית של MPSs מתבצעת בשיטה קולורימטרית עם ריאגנט 1,9dimeyhylene blue או DMB, כאשר הצבע המתפתח נמדד בספקטרופוטומטר באורך-גל 656 ננומטר.
בעבר היו נוהגים לקבוע איכותית נוכחות של GAGs בשתן על ידי השקעה שלהם בעזרת מלחים רביעונים (quaternary) של אמוניום כגון cetylpyridinium chloride ו-cetyltyrimethylammonium bromide. מלחים אלה הטעונים חיובית משקיעים מולקולות GAG הטעונות שלילית. שיטה זו גרמה לתוצאות חיוביות כזובות כתוצאה מעכירות של דגימות השתן.
שיטה אחרת שהיא השיטה האיכותית המקובלת ביותר היא זו של Barry spot test, שהיא ריאקצית צבע מטה-כרומטית בה צבע כ-toluidine blue עם שייר קוטבי מגיב עם השיירים החומציים של GAG ליצירת קומפלקס, באופן שהצבע מתחלף מכחול לסגול במתאם עם ריכוז GAG. הריאקציה התבצעת על נייר סופג (Whatman No.1), כאשר עודף צבע הרקע נשטף עם תמיסת חומצה אצטית. הדגימה נחשבת חיובית לעודף GAG אם ריכוז המוקופוליסכריד בשתן עולה על 100 מיליגרם לליטר. יש לציין שהשימוש בצבע toluidine blue אינו נותן תגובה חיובית כזובה, שעה שהשימוש שהיה רווח בעבר עם alcian blue היה נותן אמנם תוצאות כזובות חיוביות.
שיטה כמותית אחרת להערכת MPS בשתן היא לאחר ניקוי מקטע ה-MPS בעזרת כרומטוגרפיה על עמודה של מחליף יונים אניוני (ACTEOLA cellulose) כאשר MPSs הנפלטים מן העמודה נמדדים כ-uronic acid על ידי ריאקצית Dische עם carbazole, נמדדים כ-iduronic acid בעזרת ריאגנט Schiff, או נמדדים כ-galactose בריאקצית anthrone.
ראו גם
ביבליוגרפיה
- ↑ Mukusick VA. The genetic mucopolysaccharidoses. Medicine 1965;445-483
- ↑ 2.0 2.1 Neufeld EF, Muenzer J. The mucopolysaccharidoses. In; The Online Metabolic and Molecular Bases of Inherited Diseases. Eds. Scriver CR, Beaudet Al, Sly WS, Valle D. Chapter 136, McGraw Hill. http:genetics.accessmedicine.com/vmbid/public
- ↑ 3.0 3.1 3.2 Neufeld EF, Muenzer J. The mucopolysaccharidoses In; The Metabolic and Molecular bases of Inherited Diseases. 8th Eds. Scriver CE Beaudet AL. Sly WS, Valle D. McGraw Hill, NY 2001;3421-3452
- ↑ 4.0 4.1 Berman ER, Vered J, Bach G. A reliable spot test for mucopolysaccharidoses. Clin Chem 1971;17:886-890
- ↑ 5.0 5.1 5.2 Walkley SU, Zeruas M, Wiseman S. Gangliosides as modulators of dendtritogenesis in normal and storage disease – affected pyramidal neurons. Cereb Cortex 2000;10:1028-1037
- ↑ Taylor EK, Gallo RC. Glycosaminoglycans and their proteoglycans: host associated molecular pattern for initiation and modulation of inflammation. Faseb J 2006;20:9-22
- ↑ 7.0 7.1 7.2 Ciron C, Dermaris N, Colle MA, et al. Gene therapy of the brain in the dog model of Hurler's Syndrome. Ann Neurol 2006;60:204-213
- ↑ Bach G. Prenatal diagnosis of disorders of mucopolysaccharide metabolism. In; Genetic disorders and the Fetus. Diagnosis, prevention and treatment. Ed. Milunsky A, John Hopkins University Press 1998;429-444
- ↑ 9.0 9.1 9.2 9.3 Clarke LA. The mucopolysaccharidoses: a success of molecular medicine. Expert reviews in Molecular Medicine 2008;10:1-18
- ↑ Bach G, Moskowitz SM, Tieu PT, et al. Molecular analysis of Hurler syndrome in Druze and Muslim Arab patients in Israel. Multiple allelic mutations of the IDUA gene in a small geographic area. AM J Hum Genet 1993;33:330-338
- ↑ 11.0 11.1 11.2 Beck M. New therapeutic options for lysosomal storage disease: Enzyme therapy, small molecules and gene therapy. Hum Genet 2007;121:1-22
- ↑ Ponder KP, Haskins ME. Gene therapy for mucopolysaccharidosis. Expert Opinion Biological Therapy 2007;7:1333-1345
- ↑ Grabowski GA, Leslie N, Wenstrup R. Enzyme therapy in Gaucher disease: the first 5 years. Blood Rev 1998;12:115-133
- ↑ Staba SL, Escolar ML, Poe M, et al. Cord blood transplants from unrelated donors in patients with Hurler's Syndrome. NEJM 2004;350:1960-1969
- ↑ Elihau R, Sekeles E, Cohen R, et al. The correction of Hunter fibroblasts by exogenous iduronate sulfatase: Biochemical and ultrastructural studies. Am J Hum Genet 1981;33:576-583
- ↑ Meikle PJ, Grasby DJ, Dean CJ, et al. Newborn screening for lysosomal disorders. Mol Genet Metab 2006;88:307-314
- ↑ Gelb MH, Turecek F, Scott CR, et al. Direct multiplex assay of enzyme in dried blood spots by tandem mass spectrometry for newborn screening of lysosomal storage disorders. J Inherit Metab Dis 2006;29:397-404
- ↑ Piotrowska E, Jacolkiewicz-Banecka J, Branska S, et al. Genistein-mediated inhibition of glycosaminoglycan synthesis as a basis for gene expression – targeted isoflavone therapy for mucopolysacchardes. Eur J Hum Genet 2006;14:846-852
- ↑ Bernier V, Lagace M, Bichet DG, et al. Pharmacological chaperons : Potential treatmental for confromational diseases. Trends Endocrinol Metab 2004;15:222-228
- ↑ Tropak MB. Pharmacological enhancement of beta hexoaminidase activity in fibroblasts from adult Tay Sachs and Sandhoff patients. J Biol Chem 2004;279:13478-13487
המידע שבדף זה נכתב על ידי פרופ' גדעון בך - המחלקה לגנטיקה של האדם, המרכז הרפואי האוניברסיטאי הדסה, ירושלים
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק