מיאלופיברוזיס ראשונית - Primary myelofibrosis
הופניתם מהדף מיאלופיברוזיס ראשונית לדף הנוכחי.
| מיאלופיברוזיס ראשונית | ||
|---|---|---|
| Primary Myelofibrosis | ||
| 250px | ||
| שמות נוספים | מיילופיברוזיס ראשונית, PM או PMF, מיילופיברוזיס אידיופתית, Idiopathic Myelofibrosis, מטאפלזיה מיילואידית אגנוגנית, Agnogenic Myeloid Metaplasia | |
| ICD-10 | Chapter C 94.4, Chapter D 47.4 | |
| ICD-9 | 289.83 | |
| MeSH | D055728 | |
| יוצר הערך | ד"ר מאיר פרייס | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלות מיאלופרוליפרטיביות
הקדמה
מיאלופיברוזיס ראשונית (Primary Myelofibrosis) היא אחת מקבוצת המחלות המיאלופרוליפרטיביות הכרוניות שהן שליליות לטרנסלוקציה BCR-ABL1. קבוצת מחלות זו מתאפיינת בריבוי תאי גזע המטופויטיים חד-שבטיים (clonal), הגורמת להגדלת איברים, אנמיה, טרומבוציטופניה ותמונת דם המתאפיינת בהימצאות תאים צעירים (leukoerythroblastic). במיאלופיברוזיס ראשונית נוצר שינוי בתאי הגזע הפוגע ביכולת לייצר את תאי הדם התקינים. מיאלופיברוזיס ראשונית היא המחלה הפחות השכיחה בקבוצת המחלות המיאלופרוליפרטיביות ומאובחנת בכ-50 עד 100 אנשים בישראל מדי שנה.
מיאלופיברוזיס מאובחנת בעיקר בעשור השביעי לחיים, ורק מיעוט מהחולים מאובחן מתחת לגיל 50. נדיר מאוד לאבחן את המחלה בילדים.
התייצגות קלינית
התסמין העיקרי שחולי מיאלופיברוזיס ראשונית מתלוננים עליו הוא עייפות קיצונית המתרחשת בקרוב לשני שלישים מהחולים. במחצית מהחולים ישנם תסמינים הנובעים מהגדלת הטחול. כרבע מהחולים מתלוננים על היעדר תיאבון וירידה במשקל. לעיתים החולים מתלוננים על חום נמוך, כאבי עצמות, גרד והזעות לילה. תסמינים אלו עלולים להחמיר עם הזמן, ומעקב אחר התסמינים לאחר התחלת הטיפול מהווה מדד ליעילות הטיפול. כשליש מהחולים אינם מתלוננים כלל על תסמינים, והמחלה מתגלית במהלך בירור שנעשה עקב טחול או כבד מוגדלים או בירור שנעשה עקב ספירות דם שאינן תקינות.
הגדלת הטחול היא אחד מהאירועים המשמעותיים ביותר המתרחש בחולים עם מיאלופיברוזיס ראשונית. הגדלת הטחול מתרחשת ככל הנראה עקב מעבר של רקמה המטופויטית ממח העצם לטחול. התסמינים הנובעים מהגדלת הטחול הם בעיקר כאב בבטן שמאלית עליונה שלעיתים מקרין לכתף שמאל, וכן תחושת מלאות בבטן ותחושת שובע מוקדמת הגורמת לירידה בכמות המזון וירידה במשקל. גודל הטחול מהווה מדד משמעותי בעת הערכה של הטיפול למיאלופיברוזיס. פרט להגדלת טחול במחצית מהחולים יש גם הגדלת כבד שלעיתים מלווה בעלייה בלחץ הדם במערכת הפורטלית. כתוצאה מכך יש סיכון מוגבר להיווצרות דליות בוושט, דימומים ומיימת.
לעיתים קרובות מתרחש תהליך של יצירת תאי דם והבשלתם ברקמות מחוץ למח העצם (Extramedullary hematopoiesis). התהליך הזה יכול להתרחש בכל איבר בגוף ולגרום להגדלתו בדיוק כפי שמתרחש בטחול או בכבד. בחלק מהמקרים התהליך מתרחש בחללים בגוף ומתאפיין על ידי יצירת נוזל, לדוגמה נוזל מיימת. פרט לכבד ולטחול, בחלק ניכר מהמקרים התהליך הזה מתרחש סביב חוליות עמוד השדרה ובלוטות לימפה.
הפרעה בספירות הדם אופיינית למחלה זו. ההפרעה נגרמת כתוצאה מהיווצרות רקמת הצלקת (Fibrosis) במח העצם, הגורמת להפחתת האזורים שבהם יכולה להתרחש הבשלה תקינה של תאי הדם. הפגיעה בתאי הגזע גורמת לירידה בייצור תאי הדם, ובמקביל הגדלת הטחול גורמת לכליאה ולהרס מוקדם של תאי דם תקינים. אנמיה (ירידה בהמוגלובין) קיימת במרבית החולים, ולכן חלק ניכר מהם נזקק בשלב מסוים לקבלת עירויי דם. לעומת האנמיה, בחלק מהחולים ההתייצגות הראשונית יכולה לכלול דווקא עלייה בספירה הלבנה או בטסיות הדם. בחלק מהמקרים התאים הלבנים הם תאים צעירים ולא בשלים. אולם עם התקדמות המחלה חלה ירידה בספירת הכדוריות הלבנות וירידה בספירת הטסיות.
האבחנה
על אף העובדה שההתייצגות הקלינית בחלק מהמקרים מרמזת על האבחנה של מיאלופיברוזיס, את האבחנה עצמה עושים אך ורק על ידי ביופסיית מח עצם. תמונת מח העצם האופיינית למחלה כוללת נוכחות של רקמת צלקת. רקמת הצלקת מלווה לעיתים קרובות במבנה לא תקין של התאים המייצרים את מרכיבי הדם ובמיוחד המגהקריוציטים (Megakaryocytes) - התאים המייצרים את טסיות הדם. הקריטריונים לאבחנה נקבעו על ידי ארגון הבריאות העולמי, והם כוללים את התמונה האופיינית בביופסיית מח העצם, נוכחות של שינויים גנטיים ייחודיים, בדיקות מעבדה אופייניות וטחול מוגדל.
בחלק מהמקרים ניתן לזהות שינוי גנטי פתולוגי בתאי הדם. השינוי השכיח ביותר הוא מוטציה בגן ל-JAK2 (60 אחוזים מהחולים). מוטציות שכיחות נוספות שתוארו במחלה זו כוללות: Calreticulin (25-20 אחוזים מהחולים), MPL (5 אחוזים מהחולים). ההבנה של הבסיס המולקולרי למחלה העמיקה, וכך גם הבנת המשמעויות של השינויים שנמצאו מבחינת התגובה לטיפול והתקדמות המחלה. זוהו מוטציות נוספות בעלות חשיבות רבה בהבנת מהלך המחלה, כגון ASXL1, IDH1/2, EZH2. הימצאות מוטציה באחד מהגנים הללו מלמדת על מחלה בדרגת סיכון גבוהה[1].
נוכחות רקמה צלקתית במח העצם אינה בהכרח מעידה על מיאלופיברוזיס או על בעיה המטולוגית ראשונית. מצבים אחרים בהם ניתן לראות נוכחות של רקמה צלקתית כוללים מחלות אוטואימוניות, יתר לחץ דם ריאתי, מחלת כליות, וגרורות עקב מחלה ממאירה אחרת למח העצם.
הגדרת מטרות הטיפול ואפיון המחלה
השתלת מח עצם מתורם זר (Allogeneic stem cell transplant) היא האפשרות היחידה לרפא את המחלה. כל שאר הטיפולים המוצעים אינם מרפאים את המחלה אלא מאפשרים הקלה של התסמינים מהם סובלים החולים. שיחה עם המטופל ובני משפחתו בשלב הזה חיונית על מנת להגדיר את מטרות הטיפול ומה ניתן יהיה להשיג בכל אחת מהדרכים המוצעות. בשלב הזה יש צורך לבצע גם הערכה של מידת הסיכון מהמחלה (Risk Stratification). כלי מרכזי בהערכה הוא ה-DIPSS (Dynamic International Prognostic Scoring System) (טבלה מספר 1).
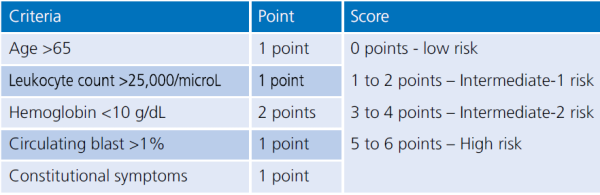
Gangat N, Caramazza D, Vaidya R, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count and transfusion status. J Clin Oncol. 2011 Feb 1; 29(4):392-7.[2]
כלי נוסף, שמביא בחשבון גם את השינויים הציטוגנטיים, הוא ה-DIPSS plus (טבלה מספר 2) [2].
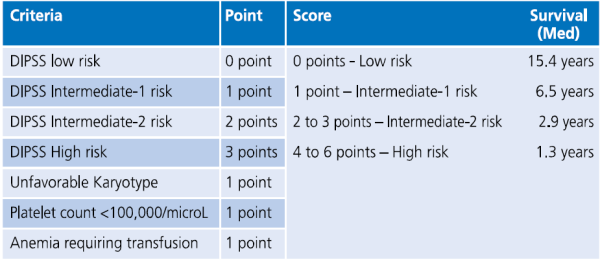
Gangat N, Caramazza D, Vaidya R, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count and transfusion status. J Clin Oncol. 2011 Feb 1; 29(4):392-7.[2]
הטיפול במחלה בדרגת סיכון נמוכה (low risk)
קבוצת החולים הללו כוללת חולים המוגדרים עם 0–1 - DIPSS plus, וללא מוטציות בגנים בעלי סיכון גבוה (ASXL1, IDH1/2, EZH2). בחולים ללא תסמינים ניתן להמשיך במעקב קליני ומעבדתי אחת לכמה חודשים. כאשר החולים הללו מפתחים תסמינים סיסטמיים, צורך במתן מוצרי דם או תסמינים הנובעים מגודל הטחול, יש צורך לשקול מתן טיפול.
בחולים סימפטומטיים בדרגת סיכון נמוכה, מטרת הטיפול היא לשפר את איכות החיים ולהימנע מתופעות לוואי לא רצויות מהטיפול עצמו. בחולים אלו הטיפול המועדף הוא עם Hydroxyurea (Hydrea) ומטרתו להקטין את גודל הטחול ולטפל בתסמינים הסיסטמיים. טחול מוגדל יכול להוות גורם משמעותי בתסמיני המחלה. כריתת טחול אפשרית במטופלים שבהם הטחול גורם לכאב ניכר, לאוטמים חוזרים בטחול, לאנמיה או לטרומבוציטופניה משמעותיים או ליתר לחץ דם פורטלי. התמותה מניתוח כריתת טחול בחולים אלו משמעותית - 10 אחוזים - כך גם התחלואה לאחר הניתוח. כריתת הטחול גורמת לשיפור מסוים בתסמיני המחלה, אבל בחלק מהחולים תתפתח הגדלה של הכבד (20 אחוזים). כריתת טחול לא השפיעה על משך חיי החולים. הקרנה של הטחול עשויה להקל באופן זמני את התסמינים למשך כמה חודשים, והיא מתאימה לחולים שאינם מועמדים לניתוח עקב סיכון ניתוחי מוגבר.
השתלת מח עצם מתורם זר בחולים בדרגת סיכון נמוכה גרמה לעלייה בתמותה של 20 עד 30 אחוזים, כאשר השוו את אחוז החולים שנשארו בחיים לאחר חמש שנים למטופלים שקיבלו טיפול להקלת התסמינים. לכן השתלת מח עצם בחולים אלו אינה מומלצת[3].
הטיפול במחלה בדרגת סיכון בינונית עד גבוהה (Int-high risk)
על פי ה-DIPSS plus, חולים בדרגת סיכון בינונית עד גבוהה חיים בממוצע פחות משלוש שנים. לכן בחולים אלו עולות אפשרויות טיפוליות נוספות, כגון השתלת מח עצם מתורם (Allogeneic).
השתלה אלוגנאית היא האפשרות היחידה להגיע לריפוי בקבוצת חולים זו, אולם במחיר של תחלואה ותמותה משמעותיים הנובעים מההשתלה עצמה. בחולים מעל גיל 45 בדרך כלל משתמשים בפרוטוקול כימותרפי מכין בדרגת עצימות נמוכה יותר (Reduced intensity conditioning). השתלת מח עצם בקבוצת חולים אלו הקטינה את התמותה ב-10 עד 20 אחוזים כאשר השוו את אחוז החולים שנשארו בחיים לאחר חמש שנים למטופלים שקיבלו טיפול סימפטומטי בלבד (ללא מעכב JAK2). עם זאת, גם לאחר השתלת מח עצם מתורם זר ההישרדות הממוצעת לאחר חמש שנים היא כ-30 עד 50 אחוזים. הגורמים שנמצאו ככאלה המיטיבים עם התוצא הסופי של ההשתלה היו: השתלה מתורם שהוא קרוב משפחה, מחלה שנמצאת בשלב כרוני, גיל מתחת ל-55, גברים שעברו כריתת טחול.
במטופלים סימפטומטיים שאינם מועמדים להשתלה ניתן להשתמש במעכב JAK2 - Ruxolitinib (Jakavi). בעבודות רחבות היקף נמצא כי השימוש ב-Ruxolitinib גרם לירידה משמעותית בגודל הטחול (כ-40 אחוזים מהמטופלים), שיפור בתסמינים הסיסטמיים ושיפור באנמיה. התגובה ל-Ruxolitinib לא הייתה תלויה בנוכחות המוטציה בגן JAK2. אף שבחלק ניכר מהמטופלים הייתה תגובה לטיפול ב-Ruxolitinib, שכללה הקטנת הטחול והפחתה בתסמיני המחלה, לא נרשם שינוי משמעותי בתמונת מח העצם. לעומת זאת, מעקב ארוך טווח אחר המטופלים ב-Ruxolitinib במחקרים אלו הדגים ירידה בתמותה בהשוואה לטיפול אחר (פרט להשתלת מח עצם)[4].
מעבר ללוקמיה חריפה
המעבר ממיאלופיברוזיס ללוקמיה חריפה מתרחש בכ-20-10 אחוזים מהחולים עם מיאלופיברוזיס ראשונית בעשור הראשון לאחר האבחנה. עקב התמונה הייחודית של מח העצם קשה לעתים לגלות את העיתוי המדויק שבו התרחשה ההתמרה ללוקמיה. הפרוגנוזה של חולים שבהם התרחשה ההתמרה ללוקמיה היא גרועה ביותר, ויש קושי רב במציאת טיפול אפקטיבי שיגרום לנסיגה של המחלה.
טיפולים חדשים
תובנות חדשות והבנה מעמיקה יותר של תהליך המחלה גרמו לפיתוח טיפולים ניסיוניים, שחלקם הדגימו יעילות מסוימת במחקרים קליניים.
תרופה הנבדקת במחקרים קליניים היא Imetelstat שגורמת לעיכוב האנזים טלומראז (Telomerase). בשבעה חולים מתוך 33 שטופלו בתרופה זו באופן ניסיוני הייתה נסיגה של המחלה, ובארבעה מתוכם הייתה נסיגה מלאה של המחלה[5]. ייתכן כי תרופה זו, כמו תרופות אחרות הנמצאות בשלבי פיתוח, תהווה את השינוי המיוחל לו אנו מצפים בטיפול במחלה זו.
ביבליוגרפיה
- ↑ Tefferi A, Guglielmelli P, Lasho TL, et al. CALR and ASXL1 mutation-based molecular prognostication in primary myelofibrosis: an international study of 570 patients. Leukemia. 2014; 28:1494.
- ↑ 2.0 2.1 2.2 Gangat N, Caramazza D, Vaidya R, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol. 2011 Feb 1;29(4):392-7.
- ↑ Kroger N, Giorgino T, Scott BL, et al. Impact of allogeneic stem cell transplant on survival of patients less than 65 years of age with primary myelofibrosis. Blood. 2015 May 21;125(21):3347-50.
- ↑ Verstovsek S, Mesa RA, Gotlib J, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis. N Engl J Med. 2012 Mar 1;366(9):799-807
- ↑ Tefferi A, Laso T, Begna KH, et al. A pilot study of the telomerase inhibitor Imtelistat for myelofibrosis. N Engl J Med. 2015 Sep 3;373(10):908-19.
המידע שבדף זה נכתב על ידי ד"ר מאיר פרייס - מנהל המכון ההמטולוגי, מרכז רפואי כרמל, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק