ממאירויות עצם ראשוניות בילדים - Primary bone malignancies in children
הופניתם מהדף ממאירויות עצם ראשוניות בילדים לדף הנוכחי.
| ממאירויות עצם ראשוניות בילדים - מגמות בטיפול | ||
|---|---|---|
| Primary bone malignancies in children | ||
| ||
| ICD-10 | Chapter C 40.-Chapter C 41. | |
| ICD-9 | 170.9 | |
| MeSH | D001859 | |
| יוצר הערך | ד"ר דודי ניקומרוב, ד"ר דרור לוין | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן
סרקומה היא קבוצה הטרוגנית של מחלות ממאירות שמקורן ברקמת החיבור, כלומר, תא המקור במחלה זו הוא התא המזנכימלי. שכיחותה של הסרקומה נמוכה בהשוואה לסוגים אחרים של מחלות ממאירות.
היא מופיעה לעיתים כמחלה ממקור גרמי ולעיתים ממקור רקמה רכה. בעוד שבמבוגרים, מקורם של מרבית מקרי הסרקומה הוא ברקמה הרכה, בילדים, סרקומה ממקור רקמת עצם היא שכיחה יותר. ממאירויות העצם הראשוניות השכיחות ביותר בילדים הן סרקומה אוסטאוגנית (osteogenic sarcoma) וסרקומה על שם יואינג (Ewing sarcoma). חיבור זה מתמקד בשינויים החלים בטיפול בממאירויות עצם ראשוניות בילדים.
עד אמצע המאה ה-20, הטיפול בסרקומה גרמית התבסס על שליטה מקומית בניתוח, בעיקר באמצעות קטיעה של הגף המעורב. למרות זאת, שיעורי ההישרדות היו נמוכים ביותר. התמותה נותרה גבוהה ביותר, וההישרדות לאחר 5 שנים עמדה סביב 20 אחוזים, עד להתחלת הטיפול הכימי במשלבים מרובי תכשירים, בתחילת שנות ה-80 של המאה ה-20. הטיפול במשלבים הללו הביא לשיפור ניכר של עד ל-65–70 אחוזים בשיעורי ההישרדות לאחר 5 שנים. עם זאת, בעוד שבממאירויות ילדות אחרות חל מאז שיפור רב בשיעורי ההישרדות, בסרקומה גרמית לא חל שינוי משמעותי. הטיפול התרופתי, יחד עם השיפור בטכנולוגיות הדימות ובטכניקות השחזור הניתוחיות, הביאו ליכולת הקיימת, המאפשרת לבצע ניתוחים מצילי גף ברוב המכריע של המטופלים, עם תוצאות תפקודיות טובות יותר מאשר קטיעה של הגף המעורב, וזאת מבלי להפחית את שיעורי ההישרדות.
עקרונות הטיפול
ישנם מספר שלבים בסיסיים בטיפול הרפואי במחלת הסרקומה של העצם.
בשלב ראשון ניתן טיפול כימי (טיפול מקדים או נאו-אדג'ובנטי), אשר מטרתו המרכזית לבלום ולעצור את התפשטות התהליך הממאיר בגופו של הילד. מלבד מטרה זו ייתכנו מטרות משנה הקשורות לגידול הראשוני - הקטנתו של הגידול וחיסול תאי הסרטן שבו כדי למנוע פיזור תאים כאלו בזמן הניתוח הצפוי. בשלב השני ניתן טיפול מקומי אשר יכול להתבסס על כריתה ניתוחית או על טיפול בקרינה. יש מצבים שבהם בוחרים להשתמש בשני הכלים הללו במשולב. השלב השלישי כולל טיפול כימי נוסף (טיפול משלים או אדג'ובנטי) אשר מטרתו להשלים את הטיפול בתאי הסרטן לאחר שהגידול הראשוני נכרת או טופל בקרינה, במטרה לטפל במוקדי מחלה אפשריים נוספים.
תמורות בטיפול התרופתי
בעבר, כאשר רק החלו בהוספת טיפול כימי לניתוח, הטיפול היה מצומצם וכלל מספר מועט של תרופות. בשנות ה-90 של המאה ה-20 בוצעו מספר מחקרים, במיוחד בסרקומה על שם יואינג, שבחנו מתן תרופות כימיות ששימשו כקו שני (קו הצלה למי שנכשל בטיפול קו ראשון) במשולב עם טיפול קו ראשון. מתן משולב של מספר תרופות רב יותר, ומיקוד כל המאמץ האונקולוגי בשלב זה, הביאו לשיפור משמעותי בתוצאות. בממאירות השנייה של העצם בילדים, אוסטאוסרקומה (osteosarcoma), לא נמצאו תוצאות דומות, ותוספת של תרופות מעבר למשלב הבסיסי לא הניב שיפור בתוצאות.
בהמשך לתהליך זה של הוספת תרופות, נבדקה השפעת צמצום משך הזמן בין טיפול לטיפול. הוכח, שככל שישנה עלייה משמעותית בכמות המצטברת של הכימותרפיה הניתנת בפרק זמן מסוים, נרשם שיפור נוסף ביעילות הטיפול ובשיעורי המחלימים מהמחלה.
בסרקומה על שם יואינג ניתן לבצע השתלת מח עצם עצמית, תהליך אונקולוגי אשר נכון יותר להתייחס אליו כמתן כימותרפיה במינון גבוה בשילוב עם הצלה של תאי אב, משום שמטרת הטיפול אינה ההשתלה עצמה, אלא מתן כימותרפיה במינון מוגבר מאוד. ההשתלה של מח העצם מאפשרת התאוששות מהטיפול בזמן קצר ובכך מונעת סיבוכים קשים. עיקר המחקר הרפואי בתחום זה מתמקד בבחירת המשלב הכימותרפי המועדף, ולא פחות חשוב מכך, איתור החולים אשר יפיקו תועלת מיוחדת מכך. בתחילה, הטיפול בהשתלת מח עצם עצמית היה שמור למצבים גרורתיים, אולם נכון למועד כתיבת מסך זה, ידוע שהקבוצה העיקרית שמפיקה תועלת מטיפול זה היא קבוצת החולים עם מחלה מקומית בסיכון גבוה (חולים עם גידול מקומי בנפח גדול מאוד או חולים אשר הגיבו באופן לא מספק לטיפול בשלב הראשון).
בעשור השני של המאה ה-21 נעשה שימוש משמעותי בטיפולים ביולוגיים (מכווננים) אשר מתבססים על שינויים גנטיים ייחודיים בגידול של החולה או על מידע שנאסף לגבי קבוצות חולים. הדבר נכון במיוחד לגבי חולי אוסטאוסרקומה. דוגמה לתרופות אלו היא תרופות המעכבות את האנזים טירוזין קינאז (tyrosine kinase inhibitors). בדרך כלל מדובר במעכבים הפועלים על מספר אנזימים במקביל.
בניגוד לתחומים רבים באונקולוגיה, תרופות הפועלות דרך מערכת החיסון (אימונותרפיה) אינן יעילות או משמעותיות בממאירויות ראשוניות של העצם. באוסטאוסרקומה נמצאה תרופה אשר גורמת להפעלת מערכת החיסון, אם כי לא באופן ממוקד נגד תאי הסרקומה. הפעלה זו של מאקרופאגים (macrophages) משפרת בעיקר את היעילות של תקיפת מיקרו-גרורות בריאות ומניעת התפתחות מחלה גרורתית.
תמורות בטיפול הקרינתי
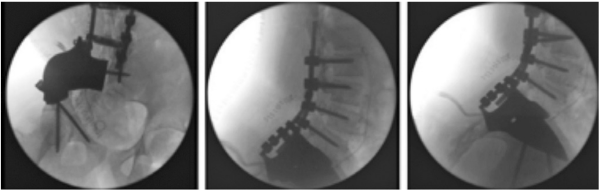
הטיפול הקרינתי משמש חלופה או תוספת לטיפול הניתוחי. גם בסרקומה על שם יואינג וגם באוסטאוסרקומה, יש אפשרות לטיפול קרינתי כאשר לא ניתן לכרות את הגידול בצורה יעילה ומשמעותית מבחינה אונקולוגית. מצב כזה מתרחש לעיתים באתרים אופייניים, בעיקר בראש-צוואר ובעמוד השדרה. במצבים כאלו נבחר להשתמש במינוני קרינה מוגברים כדי להבטיח טיפול מספק בגידול הממאיר.
אפשרות אחרת היא כאשר בוצעה כריתה של הגידול אבל עדיין נותר יתרון להוספת טיפול קרינתי - מצב אשר תואר בעיקר בסרקומה על שם יואינג באגן.
המהפכה המשמעותית בטיפול קרינתי בגידולים ממאירים היא במעבר מקרינה בחלקיק הפוטון (photon particle) לחלקיק הפרוטון (proton particle). שינוי זה, שהיריעה כאן קצרה מלדון בו לעומק, הוביל ליכולת הקרנה טובה ויעילה, כמו בשיטות קודמות, תוך הקטנה משמעותית של הקרינה הסביבתית, אשר גורמת נזק ופוגעת באיברים שכנים. ישנם מחקרים אשר מוכיחים שחלופה זו יעילה ובטוחה, ולתחושתנו, בשנים הקרובות הרוב המכריע של החולים יקבל קרינה בצורה זו.
תמורות בטיפול הניתוחי
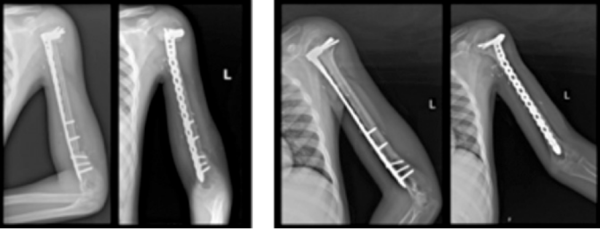
כאמור, בעוד שבעבר הטיפול הניתוחי בסרקומה גרמית היה ברובו קטיעת הגף המעורב, מאז שנות ה-80 של מאה ה-20, ברוב המכריע של המקרים מבוצעים ניתוחים משמרי גף, והתוצאה התפקודית היא בדרך כלל טובה יותר. השינוי הזה הגיע בזכות התפתחות התפיסה של מושג "שולי הכריתה" (marginal resection). הודות להתקדמות בטיפול התרופתי, ניתן היה לראות תוצאה אונקולוגית זהה בניתוח לקטיעה או בניתוח משמר גף, בתנאי שהתקבלו שולי כריתה בטוחים מבחינה אונקולוגית. התהליך הזה מזכיר את השינוי שעבר הטיפול הניתוחי בממאירות שד, כאשר התגבשה ההבנה שניתוח לכריתה של המסה הגידולית עם הקרבה של שולי כריתה בטוחים, מביא במקרים מתאימים לתוצאה אונקולוגית זהה לניתוח לכריתה שלמה של השד. מטבע הדברים, מאמץ רב הושקע בניסיון להגדיר מהם "שוליים בטוחים אונקולוגית", ובמידה רבה זהו עדיין מוקד דיון חשוב.
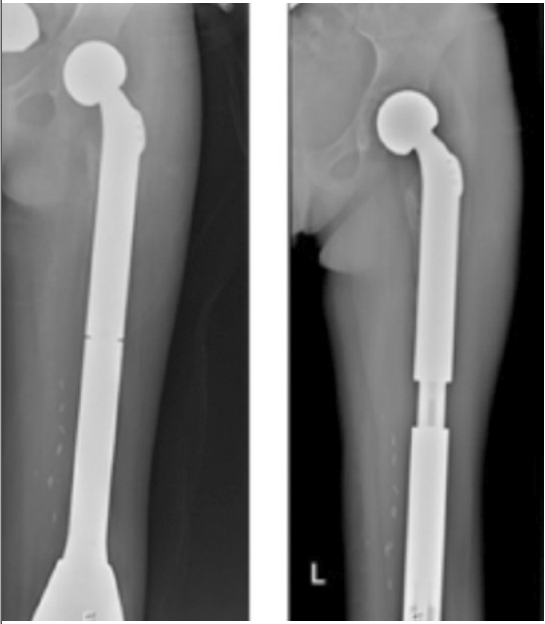
באופן טבעי, במקביל לשינוי המגמה לכיוון ניתוחים משמרי גף, עלתה חשיבות השחזור של חסר הרקמה אשר נותר אחרי הכריתה של הגידול. חלקו השחזורי של הניתוח הוא במידה רבה מורכב יותר בילדים מאשר במבוגרים. בעוד שבמבוגרים, במרבית מקרי הממאירות בעצמות הארוכות של הגפיים אפשר לבצע שחזור בעזרת משתל, אשר מחליף את מקטע העצם שנכרת, בילדים, משתל רגיל אינו מתאים, בגלל הצמיחה הצפויה בגף הנגדי. הצורך לשמור על שוויון באורך הגפיים, בין הגף המנותח לגף הנגדי, כאשר הגף הבריא של הילד ימשיך לצמוח בממדיו, מחייב פתרון אחר.
אחד החידושים בתחום הטיפול הניתוחי בממאירויות גרמיות בילדים, הוא שימוש במשתלים מתארכים. המשתלים המתארכים הראשונים הצריכו ניתוחים רבים לשם ביצוע הארכות חוזרות של המשתל. עם העלייה במספר הניתוחים, גדל גם הסיכון לסיבוכים. ישנה אפשרות לשימוש במשתלים הניתנים להארכה באופן לא ניתוחי, בעיקר באמצעות שדה מגנטי חיצוני.
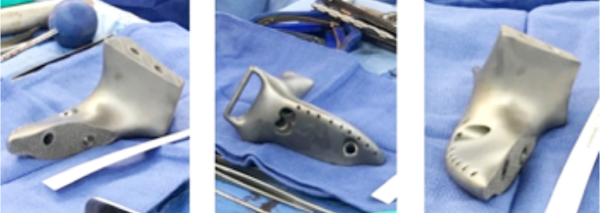
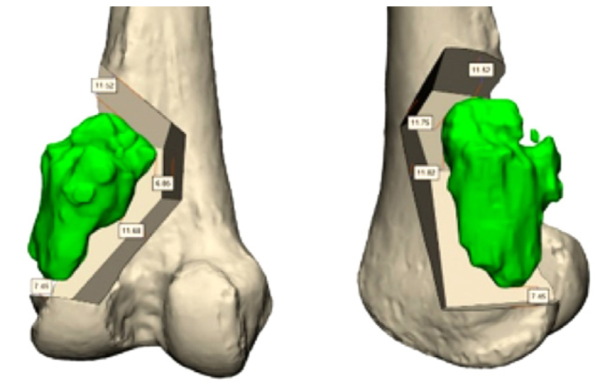
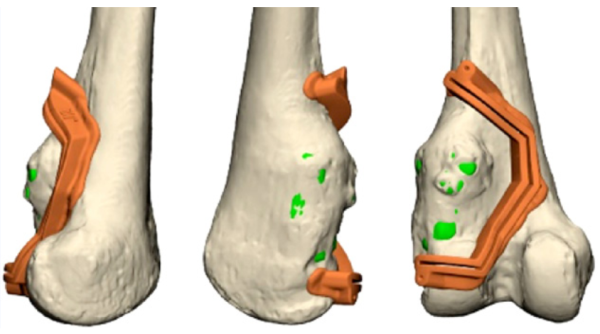
חידוש נוסף הוא השימוש במשתלים המותאמים אישית למטופל. לעיתים לא ניתן לשחזר את חסר העצם שנותר אחרי הכריתה בעזרת משתל רגיל, לדוגמה כאשר המחלה מערבת את עצמות האגן, חוליות עמוד השדרה או כשמדובר במטופלים צעירים מאוד עם ממדי גוף קטנים במיוחד. במקרים אלה לא הייתה בעבר יכולת לבצע שחזור כלשהו, ולכן פעמים רבות המטופלים נותרו עם מגבלה תפקודית קשה. ניתן לייצר משתל המותאם אישית למצב הקליני הייחודי של המטופל, לעיתים בשיטות ייצור מסורתיות, ולעיתים בהדפסה תלת-ממדית.
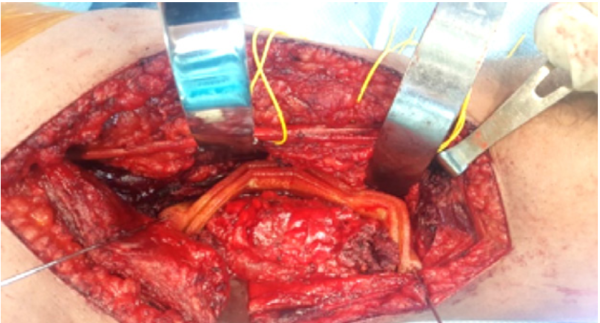
פעמים רבות, טכניקות המיקרוכירורגיה מאפשרות לבצע שחזור ביולוגי, כלומר שחזור שאינו עושה שימוש במשתל תותב. לדוגמה, שחזור גרמי בעזרת שתלי עצם עצמי עם אספקת דם, שתלי עצם מסוגים אחרים, מתלי רקמה רכה עם או בלי אספקת דם, העברות גידים ואפילו העברות עצבים או שתלי עצב.
יתרונו של השחזור הביולוגי בולט במיוחד בילדים, לאור העובדה שמשך הישרדותם של משתלים תותבים הוא בדרך כלל מוגבל בהשוואה לאורך החיים הפוטנציאלי הארוך של המטופל. פעמים רבות, שחזורים בעזרת משתל מצריכים ניתוחים נוספים, לדוגמה לטיפול בסיבוכים, כגון התרופפות של המשתל, שחיקה, ולעיתים זיהום סביב משתל. שיעור הניתוחים החוזרים בשחזורים הביולוגיים הוא על פי רוב נמוך באופן משמעותי בהשוואה לשחזורים בעזרת משתל.
חידוש חשוב שבא לידי ביטוי בניתוחים לטיפול בממאירויות עצם ראשוניות, הוא בשיטות לניווט תוך ניתוחי. באופן מסורתי, המנתח מעריך את מיקום החיתוך הנדרש, כדי לכרות את הגידול עם שולי כריתה בטוחים מבחינת אונקולוגית, מבלי להקריב רקמה בריאה מעבר לנדרש, כדי לא לגרום לפגיעה תפקודית מיותרת. קיים הבדל גדול בין מנתחים שונים ביכולתם להעריך את מיקום החיתוך בצורה מדויקת. ישנם כלי עזר שמסייעים למנתח במשימה זו, החל בבדיקות דימות תוך ניתוחיות, דוגמת CT תוך ניתוחי, עם הצגה של מיקומם בפועל של כלי הניתוח בהשוואה לתכנון הניתוחי, וכלה בתבניות חיתוך מותאמות אישית בהדפסה תלת-ממדית, אשר מכוונות את כלי הניתוח אל המסלול המתוכנן.
סיכום
הטיפול בממאירויות ראשוניות של העצם בילדים מחייב ליווי צוות סרקומה רב-מקצועי, וכולל טיפול כימותרפי ולעיתים ביולוגי, ניתוחי וקרינתי. חיבור זה סוקר את התמורות בכל אחד מהיבטי הטיפול במחלות הללו.
המידע שבדף זה נכתב על ידי ד"ר דודי ניקומרוב - מנהל היחידה לאורתופדיה אונקולוגית, המערך האורתופדי, הקריה הרפואית רמב"ם וד"ר דרור לוין - סגן מנהל המחלקה להמטואונקולוגיה ילדים ושירות גידולי עצם ורקמה רכה, המרכז הרפואי תל-אביב על שם סוראסקי


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק