מעקב ארוך טווח בילדים חולי סרטן - Long-term follow-up in children with cancer
| מעקב ארוך טווח בילדים חולי סרטן | ||
|---|---|---|
| Long-term follow-up in children with cancer | ||
| ||
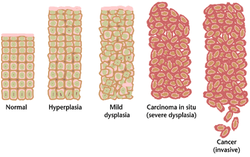
תהליך הפיכת תא לסרטני
| ||
| יוצר הערך | ד"ר מוניק פרץ-נחום וד"ר טרייסי גולדברג | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן
תחום האונקולוגיה בילדים התקדם בפרק זמן קצר. בשנת 1950 אבחנה של סרטן בילד הייתה קטלנית כמעט באופן אחיד. עד 1975, עם יישום שיטות הטיפול המודרניות, שיעור הריפוי של סרטן בילדים טיפס ל-60 אחוזים. עם המשך ההתקדמות במשטרי הטיפול, סרטן הילדות נושא שיעור הישרדות כולל של 85 אחוזים[1]. להצלחה זו היה מחיר - בעוד שטיפולים לסרטן הורסים לעיתים קרובות תאים ממאירים ביעילות, הם עלולים גם להשפיע על תאים שאינם ממאירים. כך, הוכרו תופעות לוואי מאוחרות הקשורות לטיפול. כאשר נערכו מחקרים כדי להבין טוב יותר את התצפיות הללו, נוצר תחום רפואי העוסק בהשלכות ארוכות הטווח של הטיפולים בסרטן בילדים.
מחקר CCSS (The Childhood Cancer Survivor Study) ניתח בדיעבד את מצב הבריאות, התמותה והתחלואה של קבוצה של 20,000 מחלימי סרטן ילדים שאובחנו בין השנים 1970 ל-1986. כמעט מחצית מהמחלימים דיווחו על השפעה בינונית או קשה לפחות בתחום אחד במצב הבריאותי, כולל בריאות כללית ונפשית, מצב תפקודי, הגבלת פעילות, כאב וחרדה[2]. 30 שנים לאחר הטיפול נמצא כי התמותה המצטברת היא 18 אחוזים, בעיקר כתוצאה מגידולים משניים (יחס תמותה סטנדרטי - SMR - Standardized Mortality Rate - 15.2), מוות לבבי (7.0 SMR) ומוות ריאתי (8.8 SMR)[3]. נמצא כי מחלימים מגלים תחלואה מוגזמת, בעיקר ממאירות שנייה, מחלות לב וכלי דם, הפרעות בתפקוד הכליות, בעיות שלד-שריר ואנדוקרינופתיות; נמצא כי שכיחותן של בעיות בריאותיות עולה באופן דרמטי עם הזמן[4].
מחקר אחר בדק תחלואה בקבוצה של 3,000 מחלימי סרטן ילדות. בגיל 45 שנים המחלימים דיווחו על נטל כפול פי שניים מהנטל המצטבר של מחלות כרוניות בהשוואה לאוכלוסייה הכללית. כ-95 אחוזים דיווחו על בעיה רפואית כרונית אחת לפחות, ו-80 אחוזים דיווחו על בעיה אחת לפחות המסכנת חיים או מפריעה לאורח החיים באופן משמעותי. ממאירות שנייה, הפרעות בעמוד השדרה ומחלות ריאות היו התורמים העיקריים לנטל המצטבר הכולל הגבוה בקבוצת המחלימים[5]. מחלימים צעירים (גיל ממוצע 33 שנים) מאותה קבוצה נמצאו עם שכיחות גבוהה של Frailty (שבריריות) בדומה לזו המדווחת באוכלוסייה הכללית בקרב מבוגרים שגילם 30 שנים יותר מקבוצה זו, נתון המרמז על כך שלמחלימי סרטן ילדות יש הזדקנות מואצת. אכן, הפנוטיפ של Frailty נמצא כמנבא תמותה ותחלואה מוחמרת[6].
באמצעות מחקרים אלה התברר כי ריפוי אינו סוף המסע עבור חולי סרטן ילדות. עבור רבים מהמחלימים, הטיפול הדרוש להשגת ריפוי גרם לבעיות רפואיות ופסיכולוגיות ניכרות, שהביאו להפחתת איכות החיים. החשיפה לטיפולים השונים, גיל בזמן החשיפה ומין המטופל נמצאו כקובעים את הסיכון להתפתחות רעילות. כימותרפיה, המכוונת לתאים המתחלקים במהירות, עלולה לפגוע בתאי הגוף הבריאים, ומובילה להפרעות במערכות מרובות, כולל מערכות הלב, הריאות, הרבייה, השלד והעצבים, וכן לעלייה בסיכון ללוקמיה מיאלואידית חריפה משנית[7][8][9][10][11][12][13]. השפעות מאוחרות מקרינה תלויות במקור הקרינה, בשדה ובמינון, וכוללות רעילות איברים, הפרעות אנדוקריניות, בעיות בשלד, פגמים נוירו-קוגניטיביים וממאירות שניונית[9][10][11][12][13][14][15][16][17][18]. השלכות מאוחרות של ניתוח, התלויות באתר הניתוח, יכולות לגרום לתופעות לוואי ייחודיות, כמו מצוקה פיזית ופסיכולוגית בעקבות קטיעת גפיים או ירידה קוגניטיבית בעקבות נוירוכירורגיה[19][20]. טיפול ביולוגי, הנמצא כעת בשימוש בתדירות הולכת וגוברת בסרטן בילדים, עשוי לחשוף להשפעות מאוחרות ייחודיות בעתיד.
מרפאות מעקב לילדים
מרפאות מעקב לטווח ארוך (LTFU - Long Term Follow Up) הוקמו כשירות לאוכלוסייה ההולכת וגדלה של מחלימי סרטן ילדות, שהבעיות הרפואיות המורכבות שלהם דורשות לרוב תיאום של צוות מומחים. השפעות מאוחרות של טיפול דורשות מעקב וטיפול ממוקד סיכון. קיימים מודלים שונים של תוכניות ל-LTFU. מודל מבוסס בית חולים הוא מודל המעניק טיפול באמצעות מומחה או צוות מומחים ייעודי לתופעות לוואי מאוחרות בסרטן בילדות במסגרת בית החולים, לרוב באותה מחלקה אונקולוגית בה המטופל קיבל טיפול. מרפאה רב-תחומית של LTFU, שעשויה להיות מבוססת בבית חולים, מארגנת התייעצויות של מספר מומחים בתחומים שונים באותה מרפאה באותו יום. מודל טיפול משותף הוא מודל המחייב שיתוף פעולה בין הרופא המטפל בקהילה, שמשמש כמטפל עיקרי, ובין אונקולוג ילדים שמשמש יועץ. באופן אידיאלי, המטרה של כל מודל של מרפאת LTFU היא להיטיב את בריאותם ורווחתם של מחלימי סרטן ילדות באמצעות חינוך, תוכנית ניטור אישית, תמיכה חברתית והפניות מומחים מתאימות[21].
פיתוח הנחיות המעקב לטווח הארוך סייע לסטנדרטיזציה של הניטור למחלימים על ידי מתן כלים בהם נותני שירותי הבריאות יכולים להשתמש לגילוי תופעות מאוחרות בזמן נאות, דבר שהוביל להתערבויות מוקדמות להפחתת התחלואה והתמותה. בארצות הברית, ה-(COG) Children’s Oncology Group פרסמה לראשונה הנחיות מעקב לטווח ארוך למחלימי סרטן ילדות בשנת 2003, עם עדכונים כל 2–5 שנים (www.survivorshipguidelines.org). באירופה מספר קבוצות אונקולוגיה ילדים, כולל בריטניה, סקוטלנד והולנד, פרסמו הנחיות משלהן. בשל הבדלים בהמלצות בין המדינות, הוקמה בשנת 2010 ה-International Late Effects of Childhood Cancer Guidelines Harmonization Group במטרה להגיע לקונצנזוס בינלאומי (https://www.ighg.org).
שינוי בטיפול
מאז ההכרה בהשפעות מאוחרות הקשורות לטיפול בסרטן, נעשו מאמצים לשפר את מצבם הבריאותי של המחלימים באמצעות שינוי הטיפול, והדבר הוביל בהמשך לירידה בתמותה. על פי השוואה בין מטופלי קבוצת CCSS שאובחנו בשנות השבעים לאלה שאובחנו בשנות התשעים, התמותה ב-15 שנים לאחר טיפול כתוצאה מהשפעות מאוחרות ירדה מ-3.5 אחוזים ל-2.1 אחוזים; שינוי זה יוחס בעיקר לירידה בתמותה כתוצאה מממאירות שנייה וגורמים לבביים וריאתיים. שינויים בטיפול בתקופה זו כללו בעיקר ירידה בשיעורי קרינה גולגולתית בלוקמיה לימפובלסטית חריפה, קרינה בטנית בגידול על שם ווילמס וקרינה מדיאסטינלית בלימפומה מסוג הודג'קין, וכן ירידה בחשיפה לאנתרציקלינים והתקדמות בטכניקות חדשות של שימור פוריות, במיוחד בבנות[22]. למרות השיפור, ההשפעות המאוחרות עדיין שכיחות מאוד בקרב מחלימים. בעזרת ניטור וניהול מתאים על ידי מטפלים מנוסים בתחום, ניתן לשנות את ההשפעה והחומרה של תופעות לוואי מאוחרות באמצעות גילוי מוקדם של סיבוכים וניהול גורמי סיכון אפשריים.
סקר תופעות לוואי מאוחרות לאחר טיפולים אונקולוגיים במרפאת מעקב ארוך טווח של המערך להמטו-אונקולוגיה והשתלת מח עצם בילדים, בית החולים רות רפפורט לילדים, הקריה הרפואית רמב"ם, חיפה:
שיטות
בעבודה זו נסקרו מטופלים במעקב ארוך טווח לאחר טיפול כימותרפי ו/או קרינתי ו/או השתלת מח עצם עקב מחלת סרטן, היסטיוציטוזיס, מחלה המטולוגית או חסר אימונולוגי בילדות, אשר החלימו ממחלתם ונמצאים במעקב חמש שנים או יותר מתאריך אבחנתם. נבדקו שכיחות וסוג תופעות הלוואי המאוחרות בהתאם לטיפולים בעבר.
תוצאות
נאספו נתונים ביחס ל-758 מחלימים במעקב ארוך טווח בין השנים 1996–2020, 56 אחוזים בנים, 44 אחוזים בנות, יחס זכר/נקבה 1.27, זמן חציוני של מעקב 17 שנים (45-5), גיל חציוני במעקב 26 שנים (47-6) (טבלה מספר 1). ארבעה מטופלים נפטרו במשך שנות המעקב מסרטן שני או הישנות המחלה.
| TOTAL PTS | 758 |
|---|---|
| MALE | 424 (56%) |
| FEMALE | 334 (44%) |
| MEDIAN AGE | 26 Y (6-47) |
| MEDIAN AGE ON DIAGNOSIS | 7 Y (0-25) |
| MEDIAN Y of FOLLOW UP | 17 Y (5-45) |
טיפול כירורגי, קרינתי, כימותרפי, השתלת מח עצם באופן יחיד או משולב, ניתנו בעבר ל-751 מתוך 758 מחלימים, 4 היו במעקב בלבד ללא טיפול, 3 טופלו ביוד מסומן והסרה כירורגית של בלוטת התריס. בסך הכל ניתן באופן יחיד או משולב טיפול קרינתי ל-38 אחוזים (291), טיפול כימי ל-82 אחוזים (623), השתלת מח עצם בוצעה ב-14 אחוזים (105), בכמחצית מהמקרים (51) השתלה עצמית, ובכמחצית מהמקרים (54) השתלה מתורם.
פילוג הסוגים השונים של המחלה הראשונית במחלימים מופיע בתמונה מספר 2. סוגי סרטן ילדות השכיחים היו לוקמיות (168), לימפומות (163), גידולי מוח (84), וגידולי עצמות (74).
ב-433 (57 אחוזים) מתוך 758 מחלימים (תמונה מספר 3). התופעות המאוחרות השכיחות ביותר היו: בעיות אנדוקריניות (17 אחוזים), בעיות שריר- שלד (13.5 אחוזים), הפרעה בפוריות (11 אחוזים) ובעיות נוירו-קוגניטיביות (18.5 אחוזים). במשך שנות המעקב הופיעו 16 מקרים של סרטן שני, רובם לאחר טיפול קרינתי או משולב קרינתי/כימי (12/16). רוב הבעיות האנדוקריניות והנוירו-קוגניטיביות נצפו במחלימים אשר טופלו בהקרנות לראש בשילוב כימותרפיה או עברו השתלת מח עצם (ללא טיפול קרינתי). הפרעה בפוריות הופיעה ביותר מ-60 אחוזים מהמטופלים שקיבלו טיפול משולב קרינתי/כימי/השתלת מח עצם וביותר מ-30 אחוזים מהמטופלים בהשתלת מח עצם לאחר טיפול כימי או קרינתי.
| LATE EFFECTS =867 | PTS (%PTS) = 758 pts |
%TOT LATE EFFECTS | RADIOT = 58 pts |
CHEMOT = 362 pts |
RADIOT + CHEMOT = 192 pts |
HSCT = 36 pts |
HSCT+ CHEMOT = 27 pts |
HSCT+ RADIOT = 21 pts |
HSCT +RADIOT +CHEMOT = 21 pts |
|---|---|---|---|---|---|---|---|---|---|
| ENDOCRINE | 129 (17%) | 15% | 22 | 10 | 64 | 11 | 5 | 8 | 4 |
| MUSCULO-SKELETAL | 102 (13.5%) | 12% | 9 | 38 | 46 | 2 | 1 | 2 | 3 |
| INFERTILITY | 86 (11%) | 9% | 3 | 30 | 27 | 4 | 9 | 8 | 13 |
| NEUROLOGIC | 78 (10%) | 9% | 21 | 19 | 32 | 0 | 2 | 1 | 1 |
| COGNITIVE | 65 (8.5%) | 7.5% | 20 | 14 | 25 | 0 | 2 | 2 | 2 |
| OCULAR | 54 (7%) | 6% | 13 | 5 | 25 | 1 | 1 | 0 | 5 |
| PSYCHOLOGIC | 48 (6%) | 5.5% | 9 | 15 | 20 | 0 | 0 | 2 | 2 |
| LOW BONE DENSITY | 44 (6%) | 5% | 4 | 16 | 10 | 4 | 4 | 2 | 1 |
| DENTAL | 43 (6%) | 5% | 14 | 0 | 27 | 1 | 1 | 1 | 0 |
| ABNORMAL WEIGHT | 40 (5%) | 5% | 4 | 21 | 12 | 0 | 2 | 2 | 1 |
| HEARING LOSS | 32 (4%) | 4% | 4 | 10 | 22 | 1 | 0 | 0 | 1 |
| RENAL-URINARY | 27 (3.5%) | 2.5% | 1 | 11 | 12 | 3 | 0 | 0 | 1 |
| CARDIOVASCULAR | 23 (3%) | 3% | 1 | 10 | 7 | 3 | 1 | 2 | 1 |
| CHRONIC HEPATITIS | 23 (3%) | 3% | 2 | 10 | 8 | 2 | 4 | 2 | 1 |
| GASTRO-ENTEROLOGY | 21 (3%) | 2.5% | 0 | 5 | 12 | 0 | 0 | 1 | 0 |
| SECOND CANCER | 16 (2%) | 2% | 3 | 1 | 9 | 1 | 0 | 1 | 2 |
| LOCAL ALOPECIA | 12 (1.5%) | 1% | 7 | 0 | 6 | 0 | 0 | 0 | 0 |
| PULMONARY | 12 (1.5%) | 1% | 1 | 4 | 4 | 0 | 0 | 3 | 0 |
| KELOID SCAR | 9 (1%) | 1% | 2 | 0 | 27 | 0 | 0 | 0 | 0 |
סיכום
כ-450–500 ילדים מאובחנים כחולים בסרטן מדי שנה בישראל. בעקבות שיעור ריפוי של 85 אחוזים, מעל 300 מחלימים חדשים מתווספים בכל שנה לאלפי המחלימים מסרטן ילדות בישראל: ילדים, נערים ומבוגרים צעירים.
למחלימים שיעור גבוה (מעל 50 אחוזים) של הופעת תופעות מאוחרות למשך מעל 25 שנה לאחר תום הטיפולים, ושיעור גבוה של חולי ותמותה ביחס לאוכלוסייה הרגילה. כמו כן, נדרש מעקב צמוד וממושך של מחלימי סרטן ילדות, והכרה בצורכיהם הייחודיים הרפואיים, חברתיים ותעסוקתיים. בעקבות פרסום סקרים רבים על תחלואה במחלימים מסרטן ילדות, נעשו שינויים בפרוטוקולים הטיפוליים, ונצפתה ירידה בשכיחות התופעות המאוחרות, ובעתיד יעלה שיעור המחלימים מסרטן ילדות ה"בריאים" שעומד על כ-43 אחוזים.
ביבליוגרפיה
- ↑ Surveillance Epidemiology and End Results (SEER). SEER Cancer Statistics Review 1975-2017. Released April 15, 2020. Available from: seer.cancer.gov/csr/1975_2017/ [Accessed Jan. 2021].
- ↑ Hudson MM, Mertens AC, Yasui Y, et al. Health status of adult long-term survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. JAMA. 2003 Sep 24;290(12):1583-92.
- ↑ Armstrong GT, Liu Q, Yasui Y, et al. Late mortality among 5-year survivors of childhood cancer: a summary from the Childhood Cancer Survivor Study. J Clin Oncol. 2009 May 10;27(14):2328-38. Epub 2009 Mar 30.
- ↑ Oeffinger KC, Mertens AC, Sklar CA, et al. Chronic health conditions in adult survivors of childhood cancer. N Engl J Med. 2006 Oct 12;355(15):1572-82
- ↑ Bhakta N, Liu Q, Ness KK, et al. The cumulative burden of surviving childhood cancer: an initial report from the St Jude Lifetime Cohort Study (SJLIFE). Lancet. 2017 Dec 9;390(10112):2569-82. Epub 2017 Sep 8
- ↑ Ness KK, Krull KR, Jones KE, et al. Physiologic frailty as a sign of accelerated aging among adult survivors of childhood cancer: a report from the St Jude Lifetime cohort study. J Clin Oncol. 2013 Dec 20;31(36):4496-503
- ↑ Bjornard KL, Gilchrist LS, Inaba H, et al. Peripheral neuropathy in children and adolescents treated for cancer. Lancet Child Adolesc Health. 2018 Oct;2(10):744-54. Epub 2018 Sep 1
- ↑ Nottage K, Lanctot J, Li Z, et al. Long-term risk for subsequent leukemia after treatment for childhood cancer: a report from the Childhood Cancer Survivor Study. Blood. 2011 Jun 9;117(23):6315-8
- ↑ 9.0 9.1 Mulrooney DA, Armstrong GT, Huang S, et al. Cardiac outcomes in adult survivors of childhood cancer exposed to cardiotoxic therapy: a cross-sectional study. Ann Intern Med. 2016 Jan 19;164(2):93-101. Epub 2016 Jan 5
- ↑ 10.0 10.1 Huang TT, Hudson MM, Stokes DC, et al. Pulmonary outcomes in survivors of childhood cancer: a systematic review. Chest. 2011 Oct;140(4):881-901. Epub 2011 Mar 17
- ↑ 11.0 11.1 Metzger ML, Meacham LR, Patterson B, et al. Female reproductive health after childhood, adolescent, and young adult cancers: guidelines for the assessment and management of female reproductive complications. J Clin Oncol. 2013 Mar 20;31(9):1239-47. Epub 2013 Feb 4
- ↑ 12.0 12.1 Kenney LB, Cohen LE, Shnorhavorian M, et al. Male reproductive health after childhood, adolescent, and young adult cancers: a report from the Children's Oncology Group. J Clin Oncol. 2012 Sep 20;30(27):3408-16. Epub 2012 May 29
- ↑ 13.0 13.1 Kadan-Lottick NS, Dinu I, Wasilewski-Masker K, et al: Osteonecrosis in adult survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. J Clin Oncol. 2008 Jun 20;26(18):3038-45. Epub 2016 Sep 21
- ↑ Armstrong GT, Stovall M, Robison LL. Long-term effects of radiation exposure among adult survivors of childhood cancer: results from the Childhood Cancer Survivor Study. Radiat Res. 2010 Dec;174(6):840-50. Epub 2010 Sep 17
- ↑ Green DM, Zhu L, Wang M, et al. Pulmonary function after treatment for childhood cancer. a report from the St. Jude Lifetime Cohort Study (SJLIFE). Ann Am Thorac Soc. 2016 Sep;13(9):1575-85
- ↑ Morris B, Partap S, Yeom K, et al. Cerebrovascular disease in childhood cancer survivors: a Children's Oncology Group Report. Neurology. 2009 Dec 1;73(22):1906-13
- ↑ Friedman DL, Whitton J, Leisenring W, et al. Subsequent neoplasms in 5-year survivors of childhood cancer: the Childhood Cancer Survivor Study. J Natl Cancer Inst. 2010 Jul 21;102(14):1083-95. Epub 2010 Jul 15
- ↑ Wengenroth L, Rueegg CS, Michel G, et al. Concentration, working speed and memory: cognitive problems in young childhood cancer survivors and their siblings. Pediatr Blood Cancer. 2015 May;62(5):875-82. Epub 2015 Feb 2
- ↑ Bekkering WP, Vliet Vlieland TPM, Koopman HM, et al. Functional ability and physical activity in children and young adults after limb-salvage or ablative surgery for lower extremity bone tumors. J Surg Oncol. 2011 Mar 1;103(3):276-82. Epub 2010 Dec 28
- ↑ Carpentieri SC, Waber DP, Pomeroy SL, et al. Neuropsychological functioning after surgery in children treated for brain tumor. Neurosurgery. 2003 Jun;52(6):1348-56
- ↑ Heirs M, Suekarran S, Slack R, et al. A systematic review of models of care for the follow-up of childhood cancer survivors. Pediatr Blood Cancer. 2013 Mar;60(3):351-6. Epub 2012 Jul 27
- ↑ Armstrong GT, Chen Y, Yasui Y, et al. Reduction in late mortality among 5-year survivors of childhood cancer. N Engl J Med. 2016 Mar 3;374(9):833-42. Epub 2016 Jan 13
המידע שבדף זה נכתב על ידי
- ד"ר מוניק פרץ-נחום - אחראית מרפאת מעקב ארוך טווח, המערך להמטו-אונקולוגיה והשתלת מח עצם בילדים, בית החולים רות רפפורט לילדים, המרכז הרפואי רמב"ם, חיפה
- ד"ר טרייסי גולדברג - המערך להמטו-אונקולוגיה, מרכז שניידר לרפואת ילדים בישראל, פתח תקווה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 