פרטקסין - Frataxin
| מדריך בדיקות מעבדה | |
| פרטקסין | |
|---|---|
| Frataxin | |
| שמות אחרים | FXN, FRDA, FARR, X25, FA, CyaY, MGC57199, Human Friedreich ataxia. |
| מעבדה | כימיה בדם או אימונולוגיה בדם |
| תחום | זיהוי פרטים עם Friedreich ataxia. |
| טווח ערכים תקין | ילדים ונערים עד גיל 18 שנה-מעל 15 ננוגרם/מ"ל; מבוגרים מעל גיל 18 שנה-מעל 21 ננוגרם/מ"ל. |
מטרת הבדיקה
אבחון נבדקים עם Friedreich ataxia, וניטור רמות frataxin בלוקים במחלה זו.
הבסיס הפיזיולוגי של Friedreich's ataxia
Friedreich's ataxia (להלן FRDA) הוא מפגע אוטוזומאלי-רצסיבי המאופיין על ידי ניוון של עצבי עמוד השדרה ועצבים היקפיים מה שגורם לחולשת שרירים, פגיעה בשיווי המשקל ובקואורדינציה וכן לפגיעה קרדיאלית, ושכיחותו 1 ל-50,000 באוכלוסייה הלבנה. המחלה מאופיינת על ידי תהליכים מחמירים של עוויתיוּת (spasticity), שׂיגשׂון (ataxia), פגם בדיבור (dysarthria), איבוד רפלקסים ברגליים, חסר תחושתי, ועקמת עמוד השדרה (scoliosis). קרדיומיופתיה היפּרטרופּית מופיעה בשני שלישים מהלוקים ב-FRDA, והיא הסיבה השכיחה ביותר למוות טרם-עת. ברוב הלוקים במחלה תסמינים ראשונים מתחילים להופיע בגיל 10-15 שנה, אם כי יש צורות לא אופייניות של המחלה עם התרחשות מאוחרת בהם התסמינים מופיעים לאחר גיל 25 שנה. המחלה נגרמת על ידי מוטציות בגן FXN המקודד לחלבון המיטוכונדריאלי frataxin, המביאות להפחתת רמת חלבון זה.
המפגע נובע מאי היכולת לייצר את החלבון frataxin, מה שגורם לפגיעה קשה בהומאוסטאזיס התאי של ברזל (Delatycki וחב' ב-J Med Genet משנת 2000). רוב הלוקים ב-FRDA (בערך 96% מתוכם) מכילים ב-intron הראשון בגן שלהם המקודד ל-frataxin הרחבה של repeat טרינוקלאוטידי שאינו מקודד, בעוד שאחוז קטן מבין הלוקים ב-FRDA הם כתוצאה ממוטציות נקודתיות או משמט (deletion) בגן זה (Campuzano וחב' ב-Science משנת 1996). הרחבות ה-GAA repeat גורמים למבנים לא-נורמאליים של DNA הפוגעים בשעתוק של frataxin (על פי Baralle וחב' ב-Am J Hum Genet משנת 2008, ו-Kim וחב' ב-Nucleic Acids Res משנת 2011), וככל שה-repeat ארוך יותר כן ניכר יותר החסר ב-frataxin, המפגע בא לביטוי בגיל צעיר יותר, והדבר בא לביטוי גם במהלך מחלה חמור יותר. לעומת זאת אלה בהם מספר החזרות של הסגמנט GAA אינו עולה על 300, המחלה תופיע אצלם בגיל שמעל 25 שנה (Bidichandani וחב' ב-Am J Hum Genet משנת 1998, ו-Ohshima וחב' ב-J Biol Chem משנת 1998).
באופן נורמאלי 2 האללים מכילים בין 5-33 של GAA repeats, כאשר אללים פגומים הגורמים ל-FRDA, מכילים בין 66-1,700 של אותם repeats, אם כי רוב החולים מכילים repeats בסדר גודל של 600-1,200. בעבר, היו נוהגים לאבחן FRDA על ידי מבחן מולקולארי כדי לזהות נוכחות של ההרחבה ב-DNA של אותם GAA repeats. אך שיטה זו אינה יעילה לניטור הטיפול, ואינה יכולה לשמש למטרה של בדיקות סקר אוכלוסייה. לעומת זאת, מדידה ישירה של ריכוזי frataxin כן מתאימה הן לאבחון המחלה, וכן לגילוי ואריאנטים נדירים של המחלה, כמו גם לניטור הטיפול בחולים עם FRDA. יש לציין יחד עם זאת שמבחן מדידת רמת frataxin אינו מתאים לזיהוי נשאים הטרוזיגוטים של המחלה (Deutsch וחב' ב-J Neurol Neurosurg Psychiatry משנת 2014).
החלבון frataxin
בבני אדם frataxin הוא חלבון חומצי קטן בעל משקל מולקולארי של 17,000 דלטון (בעל נקודה איזואלקטרית בסביבות pH 4.9), שהשתמר היטב במהלך האבולוציה החל בחיידקים ועד ליונקים (Gibson וחב' ב-Trends Neurosci משנת 1996, ו-Adinolfi וחב' ב-Biochemistry משנת 2004). החלבון מקודד באדם על ידי הגן FXN הממוקם על הזרוע הארוכה של כרומוזום 9 במיקום 9q21.11 (על פי Carvajal וחב' ב-Nat Genet משנת 1996, ו- Montermini וחב' ב-Am J Hum Genet משנת 1995). באופן מדויק יותר, הגן FXN ממוקם בין bp 69,035,563 לבין bp 69,100,178. הגן מבוטא בכל סוגי התאים אם כי ברמות ביטוי שונות ברקמות השונות.
Frataxin באדם, מקודד בגרעין התא כקדם-פפטיד בעל 210 חומצות אמינו, אך הוא מכיל רצף N-טרמינאלי המכוון את החלבון למיטוכונדריה, ורצף זה מבוקע ומוסר במהלך עיבוד החלבון. תוצאות של מחקרים אימונו-ציטופלואורסצנטיים מראים שלאחר השלמת יצירת frataxin, הוא ממוקם בעיקר בתוך המיטוכונדריה, והוא קשור לממברנות המיטוכונדריאליות, אך גם מופיע כחלבון חופשי במטריקס המיטוכונדריאלי. ה-mRNA של frataxin בא בעיקר לביטוי ברקמות עם פעילות מטבולית גבוהה דוגמת הכבד, כליות, לבלב, רקמת שומן-חום, נוירונים, והלב (Koutnikova וחב' ב-Nat Genet משנת 1997). במחקר האחרון הודגם שפגיעה בגן ל-frataxin בשמרים, גרמה בהם לאי-תפקוד של המיטוכונדריה, מה שהיווה אחד הרמזים הראשונים לכך ש-FRDA באדם היא מחלה מיטוכונדריאלית,
הפפטידאז המשתתף בביקוע של צורת הקדם-frataxin במיטוכונדריה זוהה כ- mitochondrial-processing peptidase subunit β, המקודד על ידי הגן PMPCB. גן זה חבר במשפחת ה- peptidase M16, והאנזים פפטידאז תוצר הקידוד האמור, הוא בעל motif הקושר אבץ (Koutnikova וחב' ב-Hum Mol Genet משנת 1998).
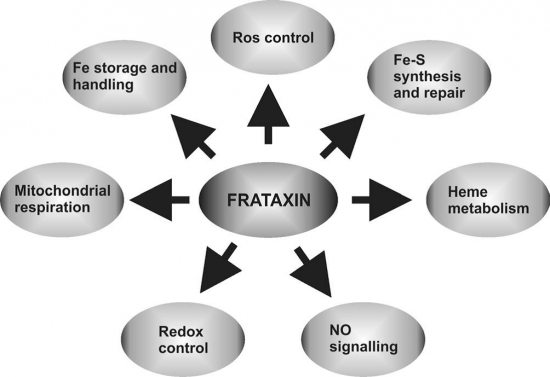
פנוטיפים הנגרמים כתוצאה מחסר של frataxin כוללים הצטברות של ברזל במיטוכונדריה (Babcock וחב' ב-Science משנת 1997, ו-Foury ו-Cazzalini וחב' ב-FEBS letters משנת 1997), פגיעה ביצירת heme וביצירת של צברים (clusters) של Fe-S הקשורים לחלבוני Iron-Sulfur (על פי Rotig וחב' ב-Nat Genet משנת 1997, ו- Stehling וחב' ב-Hum Mol Genet משנת 2004), ופגיעה מואצת בהומאוסטאזיס הברזל בתאים. הצטברות של ברזל במיטוכונדריה, גורם להפחתה ברמת הברזל בחלקיקים אחרים בתא, להגברת ברמת תרכובות עתירות חמצן (ROS), ולנזק הדרגתי לתאים עד מותם. כתוצאה מכך אלה עם מחלת FRDA, מראים התקדמות איטית של תסמינים ברקמות השריר והעצב, כגון איבוד תפקוד מוטורי, שיגשון (אטקסיה) ההולך ומתקדם, עד למוות הנגרם מאבדן השליטה על מטבוליזם של ברזל, וסיבוכים הנגרמים מקרדימיופתיה (Orth ו-Schapira ב-Am J Med Genet משנת 2001).
הומולוג של fraxatin זוהה גם בטפיל Trichmonas vaginalis, ממצא מפתיע שכן טפילים חד-תאיים אלה אינם מכילים מיטוכונדריה, אך מכילים הידרו-גנוזומים שהם חלקיקים בעלי דמיון מסוים למיטוכונדריה. כאשר משווים את רצף חומצות האמינו של משפחת הפרטקסינים, מוצאים שני אזורים ייחודיים: שייר N-טרמינאלי המכיל 70-90 חומצות אמינו, שחסר לחלוטין ביצורים פרוקריוטים ומשומר באופן חלקי ביותר בקרב יצורים אאוקריוטים (Huynen וחב' ב-Hum Mol Genet משנת 2001), כאשר לרצף של אזור זה מאפיינים האופייניים לחלבונים פּרוּשׂים (unfolded). הקצה ה-C-טרמינאלי של frataxin, מכיל 100-120 חומצות אמינו שהשתמרו ברוב האורגניזמים. באזור ה-C-טרמינאלי 25% מרצף חומצות האמינו זהה לחלוטין בין יצורים שונים, בעוד ש-40 עד 70% מהרצף הוא בעל דמיון בין יצורים שונים, מה שמעיד על חשיבותו של הקצה ה-C טרמינאלי בהיבט של תפקידה הפיזיולוגי של המולקולה. בין השיירים שהשתמרו ביותר ניתן למצוא 3 שיירי tryptophan שהם לא שכיחים בדרך כלל בחלבונים. עוד רצף שהשתמר באופן חלקי במולקולת frataxin במינים שונים, הוא זה של חומצות אמינו טעונות שלילית.
רמזים באשר למיקום התאי של frataxin מופיעים בבחינת ההתפלגות של הגן FRDA בגנומים שונים, ומבחינת מספר זהויות קליניות בין FRDA לבין סוגי ataxia אחרים, הקשורים בין השאר לחסר ויטמין E, ולנוירופתיות בהן יש אי-יציבות מיטכונדריאלית, בהן מוצאים גם כן מוטציות גרעיניות, מה שמרמז לכך שגם frataxin "מיוצא" מהגרעין למיטוכונדריה. כיום משערים שחלבון זה המקודד בגרעין, מבוטא בציטופלזמה ומיובא על ידי המיטוכונדריה על ידי signal המצוי בחלק ה-N-טרמינאלי של החלבון.
ההבשלה (maturation) של frataxin במיטוכונדריה
הצורה הבשלה של frataxin של שמרים (להלן Yfh1), מתחילה בשייר 52 של החלבון ( Branda וחב' ב-J Biol Chem משנת 1999)אם כי לגבי ההבשלה של frataxin הומני הייתה אי-הסכמה ממושכת: חלבון זה באדם מסונתז כקודמן (precursor) בן 210 חומצות אמינו, המיוצא למיטוכונדריה, שם הוא עובר תהליך הבשלה לאחר ביקוע על ידי פפטידאז (MMP) בתהליך דו-שלבי המביא ליצירת תוצר ביניים בעל משקל מולקולארי של 19,000 דלטון, כתוצאה מביקוע בין שיירים G41 ו-L42 (שיירים 42-210), וליצירת תוצר בשל בעל משקל מולקולארי של 14,000 דלטון, בין השיירים 81 ו-210 (על פי Koutnikova וחב' ב-Hum Mol Genet משנת 1998, ו-Schmucker וחב' ב-Hum Mol Genet משנת 2008). תוצר זה בין השיירים 81-210 הוא השכיח ביותר באנשים בריאים אך גם המאובחנים עם FRDA (על פי Gakh וחב' ב-J Biol Chem משנת 2010).
Frataxin הוא חלבון קושר ברזל
קבוצת המחקר של Isaya הייתה הראשונה להציע ש-frataxin של שמרים מסוגל ללכוד ברזל באופן דומה למה שמוצאים עם פריטין (Adamec וחב' ב-Am J Hum Genet משנת 2000), אם כי בתחילה לא היה ברור אם אינטראקציה זו היא בעלת אופי קולואידאלי, או שהיא מייצגת התקשרות ספציפית וסטויכומטרית. בהמשך התברר שמדובר אמנם בקשירה ישירה של ברזל, כאשר frataxin של שמרים (Yhf1) וחלבון זה ממקור E. Coli (הידוע כ-CyaY) נמצאו קושרים 2 יונים של +Fe3 עם קבועי דיסוסיאציה (Kd) דומים (Bou-Abdallah וחב' ב-J Mol Biol משנת 2004, ו-Cook וחב' ב-Biochemistry משנת 2006). ה-frataxin המונומרי של E. Coli יכול לקשור 6 יונים של +Fe3, אם כי אתרי קישור נוספים בעלי זיקה נמוכה יותר לברזל יכולים להביא לקישורם של 20-25 יוני ברזל לכל מונומר. מונומר של מולקולת frataxin ממקור אדם מסוגל לקשור 6-7 מולקולות של +Fe2 או +Fe3 (על פי Yoon וחב' ב-J Biol Inorg Chem משנת 2007, ו-Huang וחב' באותו כתב עת משנת 2008).
מוטציות של frataxin
במשפחת ה-frataxin, שיירים שהשתמרו חלקית של חומצות אמינו טעונות שלילית, הצטברו בעיקר בגדיל (helix) הראשון של החלבון וכן ב-β-sheet (על פי Musco וחב' ב-Fold Des משנת 2000). בין שיירים אלה יש לציין את השייר החשוף והמשומר היטב של aspartate (שייר D31 ב-E. Coli), וכן את השייר החשוף והמשומר לחלוטין של tryptophan (המופיע בעמדה 61 ב-E. Coli, ובעמדה 155 ב-frataxin מאדם). מחלת FRDA נגרמת בדרך כלל על ידי נוכחות של הרחבת ה-GAA repeats באזורים הלא מקודדים של 2 האללים של הגן FXN מה שמביא לרמות נמוכות של ביטוי חלבון זה. כאמור, כ-4% מהחולים נמצאו הטרוזיגוטים להרחבה של GAA על אלל אחד, ולמוטציות נקודתיות של frataxin באלל השני. לפחות 15 מוטציות נקודתיות (missense) זוהו עד כה, חלקן הגורמות לפנוטיפ הקלאסי של FRDA (מוטציות כגון I154F ו-W155R), או לפנוטיפים א-טיפיים של המחלה (מוטציות כגון G130V ו-D122Y). יצוין שכל המוטציות החשובות קלינית משפיעות על השיירים המשומרים של חומצות האמינו (Cossée וחב' ב-Ann Neurol משנת 1999,ו-Labuda וחב' ב-Hum Mutat משנת 1999).
מחקרים in vitro הדגימו שמוטציות אלו שומרות אמנם על ההתקפלות (folding) המקורית של החלבון בתנאים פיזיולוגיים, אם כי יש להן יציבות טרמודינאמית מופחתת על פי הסדר הבא: Wild type>W155R> I154F>D122Y>G130V (על פי Correria וחב' ב-Biochem J משנת 2006, ו-FEBS J משנת 2008). המוטנטים שונים ביניהם גם בדינאמיות של החלבון, בנטייתם לעבור צימות (aggregation) וכן ברגישותם לביקוע פרוטאוליטי. ממצאים אלה מרמזים שההתפתחות של FRDA במטופלים הטרוזיגוטים יכולה לנבוע מההשפעה המשותפת של הפחתה ביכולת ההתקפלות של החלבון וברגישותו לפרוטאוליזה in vivo, האחראית חלקית לרמת החלבון המופחתת. בנוסף, חלק מהמוטנטים, כולל W155R ו-N146K, משפיעים גם על יכולת frataxin להיקשר לחלבונים איתם הוא נוטה להיקשר (Leidgens וחב' ב-Hum Mol Genet משנת 2010, ו-Schmucker וחב' ב-PLos ONE משנת 2011). בשנת 2000 דווחו Al-Mahdawi וחב' ב- Hum Mutat על מוטציית missense נוספת- L198R שבודדה מחולה עם FRDA.
תפקידו של frataxin
היפותזת ה-chaperone של ברזל: כאמור, הייתה זו Grazia Isaya וחב' שהיו הראשונים לאפיין את יכולת הקישור של frataxin וברזל, והם אף שהציעו ש-frataxin בדומה ל-ferritin הוא מעין scavenger של ברזל בדומה לפריטין השומר על הזמינות של ברזל (Adamec וחב' ב-Am J Hum Genet משנת 2000, ו- Cavaldini וחב' ב-J Biol Chem מאותה שנה). היפותזה זו נתמכה על ידי ראיות שפריטין מסוגל באופן חלקי למלא תפקיד במצבי חסר של frataxin (על פי Zanella וחב' ב-Biochem Biophys Acta משנת 2008). אך נראה מעדויות בלתי-תלויות שקישור ברזל אינו תפקידו העיקרי של frataxin: ראשית, ההשפעה של יונים נוספים על האוליגומריזציה היא כזו שגם ריכוזים פיזיולוגיים של מלחי מגנזיום וסידן בתוך המיטוכונדריה יכולים לייצב את CyaY ואת Yfh1 במצב מונומרי קושר ברזל, ולגרום לאי-ייצוב של אוליגומריזציה (Adinolfi וחב' ב-Hum Mol Genet משנת 2002). שנית, נמצא באופן בלתי תלוי שאוליגומריזציה אינה חיונית כאשר frataxin משמש כ-chaperone של ברזל במהלך של יצירת הקשר בין heme לבין ה-Fe-S cluster (על פי Aloria וחב' ב-EMBO Rep משנת 2004).
למרות שאין ספק שלא הובהרו עדיין מכלול תפקידיו הפיזיולוגיים של frataxin, מעורבותו במטבוליזם של ברזל מוכחת, וזאת בדרך השלילה: כבר במחקרים בשמרים נמצא שחסר הגן ל-frataxin מביא להצטברות ברזל במיטוכונדריה ופגיעה קשה בתהליכי יצירת אנרגיה. גם באדם, שימוש ב-frataxin רקומביננטי הצביע על כושרו לקשור ברזל במערכות in vitro, כאשר הצטברות של ברזל במיטוכונדריה היא סממן מובהק בחולים עם FRDA. כמו כן, מעורבותו של frataxin ביצירת הצברים (clusters) של ברזל וגופרית, היא קריטית לתפקודם של חלבונים רבים, כולל אלה החיוניים ליצירת אנרגיה. תאים עם חסר frataxin רגישים הרבה יותר למולקולות פעילות נושאת חמצן (רדיקלים חופשיים) מה שעלול להרוס תאים אלה. לכן ניתן להתייחס ל-frataxin כאל חלבון נוגד אפופטוזיס.
שימוש ב-vectors נגיפיים נמצא מקל באופן חלקי על פנוטיפ המחלה בתאים שנלקחו מחולים עם FRDA, כמו גם במודלים בעכברים. כך לדוגמה נעשה שימוש ב-amplicon vectors של herpes simplex virus type 1 שהכילו את הגנום השלם שלFXN (הידוע כ- iBAC-FXN),ונמצא שניתן היה לשחזר את הרמה הפיזיולוגית התקינה של ביטוי frataxin, את נוכחותו לטווח ארוך וכן את התפקוד התקין של תאים הלקוחים מחולי FRDA, כמו גם תאים שנלקחו ממודלים של עכברים.
במחקר זה הושם דגש על יכולת הביטוי של האיזופורמים השונים של frataxin, הן בתאים בתרבית והן על ידי הזרקה תוך-גולגולתית של iBAC-FXN בעכברים. נמצא שמניפולציה זו הביאה לביטוי של האיזופורמים השונים של frataxin, ועלתה המחשבה שמא גישה זו תהא ישימה בוסטרטגיה טיפולית של חולי FRDA. מסקנת החוקרים הייתה שייתכן ונדרש ביטוי של כל האיזופורמים הללו לשחזור מלא של פעילות frataxin ושיקום התפקוד העצבי.
אינטראקציות תפקודיות של frataxin
רמזים על תפקודם של חלבונים במחקר הרפואי, מגיעים לעתים מהזיהוי של אינטראקציה שלהם עם חלבונים אחרים. גישה זו נוסתה גם לגבי frataxin. הראייה הראשונה על אינטראקציה תפקודית כזאת עם חלבונים אחרים הגיעה ממחקר ביו-אינפורמטיקה, שבחן האם הגן FXN מופיע במקובץ עם גנים אחרים. נמצאו תוך סריקה של 56 גנומים שהיו זמינים בשעתו, 2 גנים, hscA ו-hsc/JAC1, שהם בעלי תפוצה פילוגנטית עם הגן frataxin/CyaY. ואכן, תוצרי הקידוד של 2 הגנים האחרונים הם 2 חלבונים, hscA ו-hscB, המעורבים בסינתזה של Fe-S clusters בחיידקים, מה שמרמז לתפקידו של frataxin בתהליך זה.
מחקר אלגנטי זה הביא לסדרת מחקרים למציאת הקשר בין frataxin למסלול המטבולי האמור, מחקרים במודל של עכברים עם לקות של קרדיו-מיופתיה הדומה ל-FRDA, שהצביעו אף הם על מעורבות ראשונית של frataxin בביוגנזה של Fe-S clusters (על פי Puccio וחב' ב-Nat Genet משנת 2001). נמצא שבחסר של Yfh1, הפעילות של אנזימים הנכללים ב-Fe-S cluster כגון aconitase ו-succinate dehydrogenase, כמו גם האינקורפורציה של cluster זה לתוך apo-ferredoxin פוחתות באופן ספציפי (Chen וחב' ב-Proc Natl Acad Sci USA משנת 2002, ו-Mühlendoff וחב' ב-J Biol Chem משנת 2002).
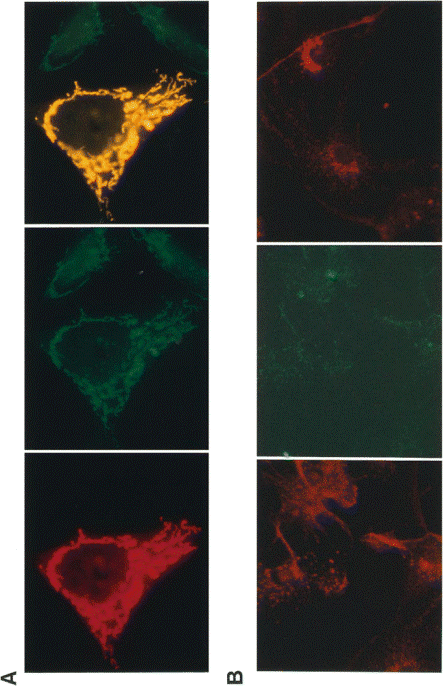
(A) תאי HeLa שעברו טרנספקציה עם הגן של frataxin, ונצבעו עם הנוגדן החד שבטי 1 G2 הספציפי לחלבון האמור (אדום), וכן נצבעו עם נסיוב המכוון כנגד המיטוכונדריה (ירוק). צביעה משותפת עם 2 הנוגדנים נותנת צבע צהוב המדגים את המיקום המשותף של 2 הצביעות במיטוכונדריה. (B) שמאל-אנליזה אימונופלואורסצנטית של תאי astroglia של עכבר ושל תאי עצב, המדגימים שהצביעה של frataxin אנדוגני (אדום), דומה למתווה המתקבל על ידי צביעה ב-Mito Tracker (ירוק). ימין-המיקום המגורגר של frataxin אנדוגני בשלוחות של תאי astroglia (מרכז) וכן באקסונים של תאי העצב .
הוראות לביצוע הבדיקה
שיטת המדידה של רמת frataxin היא על ידי Luminex immunoassay. יש לדגום את הדם במבחנת ליתיום הפארין (פקק ירוק) ללא סרכוז, ולהעביר למעבדה כדם מלא או כ-2 טיפות דם מיובשות על נייר Whatman #903 או על נייר Ahlstrom#226. ניתן לבצע את הבדיקה בדם מלא (מועדף) או כטיפות דם מיובשות לא יאוחר מ-30 יום מנטילת הדם. טיפות הדם המיובשות חייבות להיראות הומוגניות בצבען, ויש לפסול דגימות המראות "טבעות" או נראות רב-שכבתיות. אין לחשוף את הטיפות המיובשות לתאורה ישירה כלשהי, ויש לשמרן במקום יבש.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק