רטינובלסטומה בילדים - Retinoblastoma in children
הופניתם מהדף רטינובלסטומה בילדים לדף הנוכחי.
| רטינובלסטומה - גידול ממאיר של העין | ||
|---|---|---|
| Retinoblastoma in children | ||
| 250px | ||
סריקה של רשתית עם רטינובסלטומה, לפני (למעלה) ואחרי (למטה) טיפול בכימותרפיה
| ||
| ICD-10 | Chapter C 69.2 | |
| ICD-9 | 190.5 | |
| MeSH | D012175 | |
| יוצר הערך | ד"ר גל גולדשטיין, פרופסור שחר פרנקל, פרופסור יעקב פאר | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – רטינובלסטומה
אפידמיולוגיה
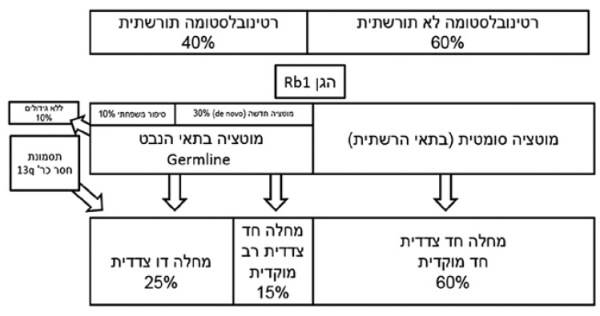
מדי שנה מאובחנים בישראל 10–15 ילדים עם גידול בעיניים מסוג רטינובלסטומה. זהו גידול העיניים השכיח בילדים, שמהווה כ-3 אחוזים מכלל הגידולים הסרטניים בילדים. אף על פי שזהו גידול ממאיר, אשר אם אינו מטופל עלול להביא למוות, הרי שבעולם המערבי שיעורי ההחלמה גבוהים מ-90 אחוזים (בניגוד ל-30 אחוזים שרידות בעולם המתפתח). הגידול מופיע כמעט תמיד עד גיל 5. במקרים בהם יש גידול בודד בעין אחת (כ-60 אחוזים מכלל מקרי הרטינובלסטומה) גיל ההסתמנות החציוני הוא שנתיים עד 3 שנים, בעוד שהסתמנות של מחלה דו-צדדית או חד-צדדית רב- מוקדית אופיינית לילדים צעירים יותר, עם גיל הסתמנות חציוני של כשנה[1].
גנטיקה
השוני בגיל ההסתמנות בין המחלה החד-צדדית לזו שבשתי העיניים מוסבר בגנטיקה האופיינית לרטינובלסטומה (תרשים מספר 1). תינוקות אשר נולדים עם מוטציה בגן Rb1 בכל תאי הגוף, הנובעת מתאי הנבט (germline mutation) יחלו לרוב במחלה דו-צדדית. תאוריית "שתי המוטציות" שהגה בשנות השבעים החוקר קנודסון מסבירה כי תאים הנושאים מוטציה באחד מהאללים של הגן הם בסיכון להפיכתם לסרטניים, אולם הדבר יקרה רק לאחר שבאותו תא תתרחש מוטציה נוספת, באלל השני[2][3].
מאחר שכמו כל התאים בגוף, במחלה התורשתית גם תאי הרשתית נושאים מוטציה ב-Rb1, הרי שמוטציה נוספת, או מוטציות נוספות בכמה תאים, יביאו ליצירה של גידולים בגיל צעיר יחסית. ככל הנראה מחלה חד- צדדית תסתמן בגיל מאוחר יותר, מכיוון שלרוב אין לילדים אלו מוטציה בכל תאי הגוף, אלא רק בתאי העין (מוטציה סומטית), והתפתחות הגידול תלויה בסיכון להתרחשות שתי מוטציות באותו תא. הסבירות להתרחשות שתי התקלות הגנטיות הללו באותו תא - נמוכה מאוד, וכן סביר שתיקח זמן רב יותר.
אף שסביר לחשוב כי ילדים הנושאים מוטציה בתאי הנבט ב- Rb1 ירשו זאת מהוריהם, הרי שרקע משפחתי של רטינובלסטומה אינו שכיח (רק 10 אחוזים מכלל מקרי רטינובלסטומה, תרשים מספר 1), ולרוב המוטציות נרכשות (de novo) בילדים אלו. חדירות המוטציה, כלומר הסיכון להתפתחות רטינובלסטומה או גידולים אחרים בילד עם מוטציה בתאי הנבט ב-Rb1, היא כ-90 אחוזים. אולם קיימות משפחות עם רטינובלסטומה תורשתית שיש להן מוטציות בעלות חדירות נמוכה יותר. העובדה שיש מוטציה מתאי הנבט חושפת גם תאי רקמות אחרות, פרט לתאי הרשתית, לסיכון לסרטן. ילדים אלו מצויים בסיכון לגידולי עצמות מטיפוס אוסטיאוסרקומה, סרקומות של רקמות רכות, לוקמיה, מלנומה, ופינאלובלסטומה במוח[4].
הסתמנות רטינובלסטומה
לרוב הגידול מתגלה בשל תופעת ה״אישון הלבן״ (leucokoria). מאחר שיש חשיבות לגילוי מוקדם של המחלה, רופאי ילדים מבצעים בדיקות החזר אור אדום מעיני כל הילודים, וכן מומלצת בדיקת רופא עיניים במחצית השנייה של שנת החיים הראשונה לחיי תינוק. בחלק מהמקרים תשומת לב המשפחות מביאה את הילדים לבדיקת רופא עיניים, בעיקר כאשר בתמונות עם מבזק (Flash) אחד האישונים בגוון לבן. סיבה שכיחה נוספת כהסתמנות רטינובלסטומה היא פזילה[1]. בשונה ממרבית הגידולים, אבחנה של רטינובלסטומה לא מצריכה ביופסיה. רופא עיניים המתמחה בגידולי עיניים בילדים יאבחן את המחלה בהסתכלות ישירה בקרקעיות העיניים. כמו כן קיימת הנחה כי ביופסיה עלולה להעלות את הסיכון להתפשטות המחלה מחוץ לגלגל העין. שלבי המחלה (staging) של רטינובלסטומה יכולים להתבסס על מספר שיטות, אולם השיטה הבינלאומית של ICRB) staging) היא השימושית מכולן. השיטה מתייחסת למחלה המערבת את העין בלבד (intra ocular) ומחלקת את הגידולים לחמש קבוצות (A-E) המייצגות את גודל ופיזור הרטינובלסטומה בעין. מטרת חלוקה זו היא להעריך את הסיכון לעקירת עין בהינתן שהילד יקבל כימותרפיה תוך-ורידית.
הטיפול במחלה
מטרות הטיפול במחלה הן הצלת חיים, שימור גלגל העין, ושימור הראיה השיירתית. הטיפול במחלה מתבסס על שילוב בין טיפול מקומי, וטיפול סיסטמי. זהו טיפול מורכב אשר באופן מיטבי נעשה על ידי צוות רפואי של מומחים ברפואת עיניים, אונקולוגיה של ילדים, רדיולוגיה פולשנית, ולעיתים גם מומחי קרינה, אולם כולל גם אנשי מקצוע מתחומי הסיעוד, הפסיכולוגיה והעבודה הסוציאלית. יש מתאם בין גודל ופיזור הגידולים בעין ובין סיכויי ההצלחה בטיפולים השונים[5].
הטיפול עד סוף המאה ה-20
מאז סוף המאה ה-20 חלו שינויים מפליגים באופן בו מטפלים ברטינובלסטומה. עד העשור האחרון של המאה ה-20, קרינה חיצונית וכריתה כירורגית של העין (אנוקלאציה - enucleation) היו טיפולי הבחירה ברטינובלסטומה. במקרים חד-צדדיים, אנולקאציה הייתה הטיפול הנבחר, כמעט תמיד. אף על פי שאנוקלאציות מתבצעות במרכזים מנוסים גם נכון למועד כתיבת מאמר זה, השימוש בכימותרפיה סיסטמית ומקומית, הביא להפחתה הדרגתית בבחירה בטיפול זה. כריתה כירורגית עדיין נחשבת טיפול בחירה במקרים בהם להערכת הצוות המחלה מפושטת במידה כזו שלא ניתן יהיה להציל את גלגל העין או הראייה בה, גם בעזרת טיפול כימי, ובמקרים של הישנויות חוזרות למרות טיפולים שונים.
הטכניקות השונות של שימוש בכימותרפיה כמעט והעלימו גם את השימוש בקרינה חיצונית, כטיפול ראשוני במחלה דו-צדדית. מחד, רטינובלסטומה רגישה מאוד לקרינה, ומאידך טיפול זה מעצים את הסיכון לסרטן משני (היארעות של כ-30 אחוזים בשדה הקרינה לעומת 2.6 אחוזים, בילדים שהוקרנו ולא הוקרנו, בהתאמה) ועלולה לגרום לעיוות עצמות הגולגולת.
כימותרפיה סיסטמית
לרוב נהוג לטפל בכימותרפיה סיסטמית (בדרך כלל 3–6 מחזורי טיפול של Vincristine (אונקובין[6]), Carboplatin (פאראפלאטין[6]), Etoposide (ופסיד[6]), במצבים בהם יש חשש כי המחלה נובעת ממוטציה בתאי הנבט, ובשל כך יש סיכון למספר רב של גידולים ברשתית, פרט לאלו שנראים בהסתכלות ישירה. מקרים של ילדים עם מחלה רב-מוקדית, חד או דו-צדדית, כאלו עם סיפור משפחתי ותינוקות מתחת גיל 3 חודשים, עלולים לרמז על מחלה תורשתית. הטיפולים הללו נסבלים באופן טוב יחסית, גם על ידי תינוקות, ניתנים כל 3–4 שבועות ולרוב אינם מצריכים אשפוז. כימותרפיה יכולה להציל עיניים מאנוקלאציה וממתן קרינה גם כאשר המחלה מתקדמת. יש סיכוי טוב לשליטה בגידולים מקבוצות הסיכון A, B או C בעזרת כימותרפיה, אולם קבוצות D ו-E יזדקקו פעמים רבות לאנוקלאציה[7].
טיפולים מקומיים
קיימות מספר שיטות לטיפול מקומי בגידולים: תרמותרפיה (חימום באמצעות לייזר - thermotherapy), הקפאה, ברכיתרפיה (קרינה מקומית - bracytherapy) באמצעות לוחית רדיואקטיבית, מתן כימותרפיה בצנתור לעורק האופתלמי ומתן כימותרפיה בהזרקה ישירות לתוך זגוגית העין. בשל גיל המטופלים, כל הטיפולים המקומיים ניתנים בהרדמה מלאה. טיפול בלייזר נבחר לרוב לגידולים שקוטרם מספר מילימטרים בחלק האחורי של הרשתית ללא זריעה בזגוגית. שיעור ההצלחה של שליטה בגידולים - גבוה יחסית. קריותרפיה (cryotherapy) - טיפול בהקפאה, היא דרך נוספת לטפל בגידול קטנים ללא זריעה הנמצאים בהיקף הרשתית. פגיעות שונות ברשתית נדירות, אולם הן תופעות לוואי העלולות להתרחש מטיפולי לייזר וקריותרפיה.
אם יש הישנויות חוזרות של הגידולים לאחר טיפולים מקומיים אלו, ניתן לטפל בעזרת ברכיתרפיה. בטכניקה זו מצמידים לוחית רדיואקטיבית לקיר העין, והיא נבחרת לרוב כטיפול שניוני לאחר כישלון כימותרפיה או טיפולים מקומיים בשליטה על גידולים שקוטרם עד כסנטימטר וחצי. לעיתים רחוקות ברכיתרפיה משמשת לטיפול ראשוני. בשיטה זו הלוחית מוצמדת ללובן העין (הסקלרה), ולאחר 2–4 ימים מוסרת, לאחר שכמות הקרינה שסופג שיא הגידול היא כ-4500 cGy. טיפולים מקומיים עלולים לגרום לתופעות לוואי מקומיות ברשתית.
כימותרפיה בצנתור העורק האופתלמי
כימותרפיה בצנתור עורקי (intra arterial chemotherapy) הפכה, מאז דווחה לראשונה, לטיפול ראשוני נפוץ בעיניים עם גידולים מתקדמים וכן בהישנויות של המחלה. תחת ידי צוות מיומן זהו טיפול עם פרופיל בטיחות גבוה, ושיעורי ההצלחה בהצלת עיניים, אשר בעבר היו מטופלות בכריתה או בקרינה - נעים בין 80 אחוזים ל-90 אחוזים. הצנתור מתבצע דרך עורק המפשעה הפנימי. לעורק האופתלמי מוזרקת כמות קטנה של Melphalan (אלקראן[6]), Topotecan (היקמטין[6]) או Carboplatin. טכניקה זו מצריכה צוות מיומן הנשען על יכולות הצנתור של מומחה בנוירו-רדיולוגיה. אף על פי שלעיתים זוהי האפשרות האמיתית היחידה להצלת חלק מהעיניים, עדיין לא ברורה ההשפעה ארוכת הטווח של טיפול זה על הרשתית, המוח ושאר הגוף[8][9].
כימותרפיה בהזרקה לגלגל העין
בזגוגית העין אין כלי דם, וכאשר יש בתוכה זריעה של רטינובלסטומה, הזרקה ישירה של כימותרפיה לתוכה עשויה להיות הדרך היחידה לשליטה במחלה. זריקות של מלפלן או טופוטקאן הוכחו כבטוחות, ניתנות מדי שבוע עד שבועיים. שיעור ההצלחה בטיפול בזריעה לזגוגית - גבוה מאוד[10].
פריצת רטינובלסטומה מחוץ לגלגל העין ומחלה גרורתית
גידול שלא יטופל ימלא את גלגל העין, יהרוס את המבנה הפנימי שלו ולבסוף יפרוץ מחוץ לעין. במצב כזה הגידול יחדור דרך סיבי עצב הראייה לחלל התת-עכבישי לנוזל השדרה, למוח ולחוט השדרה. אפשרית גם חדירה ישירה דרך השכבה הדמית של העין ישירות דרך הסקלרה. גרורות מרוחקות יכולות להתפשט כתוצאה מפריצת הגידול אל מחוץ לגלגל העין דרך עצב הראייה, או דרך דפנותיו, אך גם מהתפשטות של תאי גידול בודדים דרך עצב הראייה לעצב הנגדי או לנוזל השדרה ולמערכת העצבים המרכזית.
הגידול גם יכול לשלוח גרורות דרך מערכת הדם כאשר הוא חודר לארובה, או דרך ניקוז הלימפה. פיזור לקשרי הלימפה עשוי להתרחש אם הגידול יגיע לחלקה הקדמי (אנטריורי) של העין, ללחמית או לעור העפעפיים, שהם האזורים היחידים בעין עם ניקוז לימפטי. גרורות רטינובלסטומה עשויות להימצא בריאות, בעצמות, במח העצם ובמוח. רטינובלסטומה המערבת את בלוטת האצטרובל (pineal gland) במוח - קרויה פינאלובלסטומה. היא יכולה להיות גידול בודד ראשוני או, נדיר יותר, במקביל לגידולים בשתי העיניים, ואז ייקרא רטינובלסטומה תלת-צדדית (trilateral). בשונה מפיזור גרורתי למערכת העצבים המרכזית, לגידולים הראשוניים בבלוטת האצטרובל יש מאפיינים היסטולוגיים ייחודיים הזהים לרטינובלסטומה תוך-עינית. לרוב המחלה הטרי-לטרלית טומנת בחובה תחזית גרועה.
הטיפול במחלה חוץ-עינית ובמחלה גרורתית
במחלה שפרצה אל מחוץ לגבולות גלגל העין נהוג לטפל בשילוב של קרינה ופרוטוקולי טיפול כימי שונים מאלו הניתנים במחלה תוך-עינית ראשונית. במחלה גרורתית מטפלים בעזרת כימותרפיה במינון גבוה, לרוב עם השתלה עצמית של תאי אב המטופויטיים, עם או בלי קרינה. התחזית בחולים עם גרורות תלויה בנוכחות או היעדר גרורות במערכת העצבים המרכזית. סיכויי ההחלמה גרועים במיוחד כאשר יש גרורות במוח או בחוט השדרה.
בחירת התוכנית הטיפולית, הבירור הגנטי, והמעקב ארוך הטווח
לצוות הטיפול בילדים עם רטינובלסטומה במרכז הרפואי הדסה עין כרם ניסיון בן עשרות שנים בטיפול בגידול זה, ובמהלכו טופלו כ-400 ילדים. הצוות כולל אופתלמולוגים המתמחים בגידולי עיניים, אונקולוג ילדים, אחות מתאמת, עובדת סוציאלית, נוירו-רדיולוג ולעיתים גם אונקולוג המתמחה בקרינה.
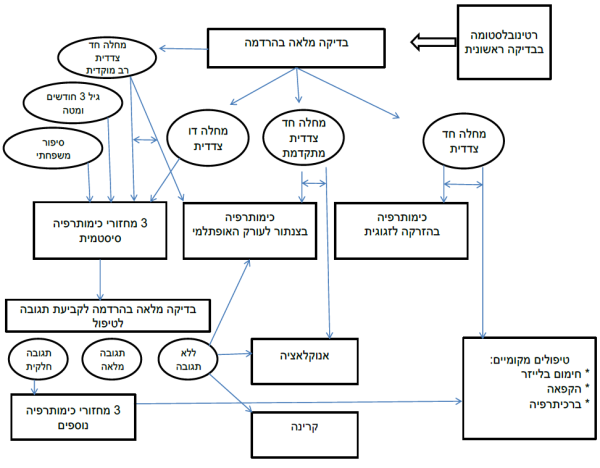
תוכנית הבירור לילד החשוד כלוקה במחלה (תרשים מספר 2) כוללת בדיקה אופתלמולוגית ראשונית שלרוב תוביל לבדיקה יסודית בהרדמה כללית. בדיקה זו תאפשר קביעת קבוצת הסיכון על פי ICRB-n, ובמקביל לה, במקרים בהם יש סיכון לחדירה לראש עצב הראייה, יתבצע ניקור מתני לבירור גרורתי.
על פי גיל החולה, מספר העיניים המעורבות, קבוצת הסיכון, והסיפור המשפחתי - מתקבלת ההחלטה על תוכנית הטיפול. בכל החולים תתבצע בדיקת MRI מוח. בחולים עם חשד למחלה דו-צדדית החולה יעבור ניתוח להכנסת צנתר מרכזי, ויוחל בטיפול כימי סיסטמי. בהדסה נהוג לתת שלושה מחזורי טיפול ולבצע הערכה אופתלמולוגית חוזרת.
תגובה לא מספקת לרוב תצריך שלושה מחזורים נוספים של כימותרפיה, אולם מרבית הילדים יעברו בשלב זה לטיפול מקומי בשיטות שהוזכרו (תמונה מספר 1).
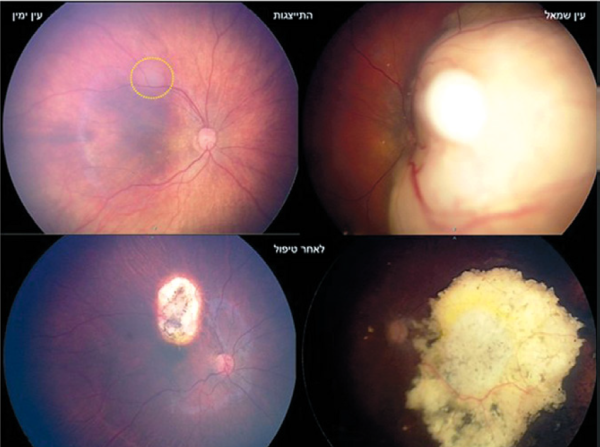
בת 9 חודשים הסתמנה עם מחלה דו-צדדית לאחר שהוריה שמו לב לאישון לבן בעין שמאל. בבדיקה בהרדמה ניתן לראות שמקור האישון הלבן הוא בגידול גדול התופס את כל מרכז הראייה השמאלי, ואף מסתיר את חלקו של ראש עצב הראייה (חשש לחדירה לעצב הראייה ומשם למוח). בעין ימין ישנו גידול קטן אחד על גבול מרכז הראייה (מסומן בעיגול צהוב). לאחר 3 מחזורי כמותרפיה סיסטמית, דווקא הגידול הגדול משמאל הגיב היטב והפך לגוש מסויד. הגידול הקטן, בעין ימין, היה יחסית עמיד לטיפול, והצריך שימוש במספר טיפולי לייזר עד להשגת שליטה בו (מחצית תחתונה של התמונה). למרות התגובה הטובה לטיפול בעין שמאל, הפגיעה ברשתית הותירה, יש להניח, רק ראייה היקפית בעין זו.
גידולים חד-צדדיים בחולים ללא חשד למחלה גנטית יטופלו רק בשיטות מקומיות, ללא כימותרפיה סיסטמית. בניגוד לגידולי גיל הילדות האחרים, הישנויות תוך-עיניות של גידול זה אינן מהוות גורם סיכון משמעותי להתפתחות גרורות מרוחקות. בשל כך לעיתים מושגת החלמה לאחר סדרות ארוכות של טיפולים מקומיים שונים, ללא צורך במתן סדרות נוספות של כימותרפיה סיסטמית. במקרים הנדירים של מחלה חוץ-עינית מקומית, משולבת קרינה, ובמחלה גרורתית - גם השתלה עצמית. בכל המקרים מבוצעת בדיקה הגן 1Rb. במקרים שנמצאה מוטציה מתבצע ייעוץ גנטי, והמעקב ארוך הטווח כולל, פרט לבדיקה שנתית של אונקולוג ילדים, גם בדיקת רופא עור.
סיכום
הטיפול במחלה שינה את אופיו בעשורים האחרונים, והשיטות החדשניות הביאו לכך שפרט לשיעור שרידות גבוה פחת הצורך באנוקלאציה ובקרינה. אולם מתן טיפול איכותי בילדים עם רטינובלסטומה מצריך צוות רב-מקצועי, בעל ניסיון בקבלת החלטות טיפוליות ומיומנויות גבוהות.
ביבליוגרפיה
- ↑ 1.0 1.1 Pizzo PA, Poplack DG. Principles and Practice of Pediatric Oncology. Philadelphia, PA: Lippincott Williams & Wilkins; 2020.
- ↑ Knudson AG Jr. Mutation and cancer: statistical study of retinoblastoma. Proc Natl Acad Sci USA. 1971 Apr;68(4):820-3.
- ↑ Sagi M, Frenkel A, Eilat A, et al Genetic screening in patients with retinoblastoma in Israel. Fam Cancer.2015 Sep;14(3):471-80.
- ↑ Fletcher O, Easton D, Anderson K, et al. Lifetime risks of common cancers among retinoblastoma survivors. J Natl Cancer Inst. 2004 Mar 3;96(5):357-63.
- ↑ Frenkel S, Weintraub M, Rot I, et al. Advances in the treatment of retinoblastoma at Hadassah in the last three decades. [Hebrew]. Harefuah. 2018 Mar;157:149-53.
- ↑ 6.0 6.1 6.2 6.3 6.4 או תרופות המכילות חומר פעיל דומה או זהה, בעלות שמות מסחריים אחרים
- ↑ Shields CL, Kaliki S, Al-Dahmash S, et al. Management of advanced retinoblastoma with intravenous chemotherapy then intra-arterial chemotherapy as alternative to enucleation. Retina. 2013 Nov-Dec;33(10):2103-9.
- ↑ Yamane T, Kaneko A, Mohri M. The technique of ophthalmic arterial infusion therapy for patients with intraocular retinoblastoma. Int J Clin Oncol. 2004 Apr;9(2):69-73.
- ↑ Abramson DH, Dunkel IJ, Brodie SE, et al. A phase I/II study of direct intraarterial (ophthalmic artery) chemotherapy with melphalan for intraocular retinoblastoma initial results. Ophthalmology. 2008 Aug;115(8):1398-404. Epub 2008 Mar 14.
- ↑ Munier FL, Gaillard M-C, Balmer A, et al. Intravitreal chemotherapy for vitreous seeding in retinoblastoma: recent advances and perspectives. Saudi J Ophthalmol. 2013 Jul;27(3):147-50.
המידע שבדף זה נכתב על ידי
- ד"ר גל גולדשטיין - המחלקה להמטולוגיה ואונקולוגיה בילדים, המרכז הרפואי הדסה, ירושלים
- פרופסור שחר פרנקל - השירות לאונקולוגיה של העין, המרכז הרפואי הדסה, ירושלים
- פרופסור יעקב פאר - השירות לאונקולוגיה של העין, המרכז הרפואי הדסה, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק