תסמונות אוטואינפלמטוריות - Autoinflammatory syndromes
הופניתם מהדף CAPS לדף הנוכחי.
| תסמונות אוטואינפלמטוריות | ||
|---|---|---|
| Autoinflammatory syndromes | ||
| ICD-10 | Chapter E 85.0 | |
| ICD-9 | 277.31 | |
| MeSH | D056660 | |
| יוצר הערך | פרופ' פנחס השקס | |
התסמונות האוטואינפלמטוריות (Autoinflammatory syndromes) מתייחסות לקבוצה של מחלות דלקתיות המערבות מערכות גוף שונות, כאשר הדלקת נגרמת בדרך-כלל ללא גירוי (Trigger) מוגדר[1]. אב הטיפוס, והתסמונת האוטואינפלמטורית הראשונה לה נמצא מקור גנטי (ב-1997), הוא הקדחת הים תיכונית המשפחתית (FMF, Familial Mediterranean Fever)[2],[3].
Kaslner ו-McDermolt חיברו את הכינוי אוטואינפלמטורי ב־1999, כאשר מצאו את הגן האחראי לתסמונת נוספת עם קווי דמיון חלקיים לקדחת הים תיכונית המשפחתית - TRAPS (Tumor necrosis factor Receptor Associated Periodic Syndrome) - וסברו שמדובר בקבוצת מחלות נרחבת בהרבה[4].
בעבר כונו מחלות אלה תסמונות חום מחזורי (Periodic fever), מכיוון שחלק גדול מתסמונות אלו אופיינו בהתקפים חוזרים של חום. כיום ברור שחום אינו תנאי הכרחי לתסמונות אלו, ובנוסף, בחלק מהמחלות התסמינים מתמידים ואינם התקפיים. המשותף לתסמונות הוא שהדלקת נגרמת בעיקר על ידי המערכת החיסונית הטבעית (Innate) ולא הנרכשת (Adaptive). התאים הפעילים במחלות הללו הם בעיקר מקרופאגים (Macrophages) ונויטרופילים (Neutrophils) ופחות לימפוציטים (Lymphocytes). בניגוד למחלות אוטואימוניות (Autoimmune diseases), יצירת נוגדנים אינה החלק העיקרי בפתוגנזה[5],[6],[7],[8]. לעומת זאת המתווכים העיקריים של דלקת בתסמונות הללו הם ציטוקינים (Cytokines) כגון אינטרלויקין 6 (6 Interleukin), אינטרלויקין 18 (18 Interleukin), אינטרלויקין 1 (1 Interleukin) ואינטרפרון גאמא (Interferon γ).
חלק גדול מהתסמונות הן בעלות תורשה מנדליאנית (Mendelian) אך יש תסמונות רבות ללא תורשה ברורה. כיום ידוע על למעלה מ-25 תסמונות עם תורשה חד-גנית (Monogenic) ועוד מחלות רבות, כולל מחלות נפוצות ביותר כטרשת עורקים (Atherosclerosis), סכרת מסוג 2 (Type II diabetes) ושיגדון (Gout), שמתווכות על ידי תהליכים דלקתיים הקשורים למערכת החיסון הטבעית[8].
תחום התסמונות האוטואינפלמטוריות מתפתח במהירות, עם גילויים של מספר מחלות חדשות בכל שנה. אמנם רוב התסמונות הגנטיות (מלבד הקדחת הים תיכונית המשפחתית בחלקים מסוימים של העולם) הן נדירות, אך הכרה וזיהוי של המחלות האלה בשלב מוקדם יכולה להביא ברוב המקרים לטיפול יעיל ולמניעת נזקים. מרשם (Registry) בינלאומי נרחב (בהשתתפות מספר מרכזים מישראל), הוא כלי עזר חשוב ביותר באיסוף מקרים לחקר מחלות נדירות אלה[9]. מעבר לכך, הידע הנצבר מהמחלות הנדירות על תפקוד המערכת החיסונית הטבעית בבריאות ובחולי הוא בעל השלכות רחבות גם על מחלות שכיחות מאוד כמו סוכרת, טרשת עורקים ואולי אפילו מחלת אלצהיימר, הנוגעות כמעט לכל תחום של הרפואה.
תסמינים וממצאים
יש לחשוד בתסמונת אוטואינפלמטורית במקרים הבאים:
- התקפים חוזרים של חום (עם עלייה במדדים דלקתיים), שאינו מוסבר על ידי זיהומים
- מעורבות דלקתית של מערכות גוף שונות (עם ובלי חום), בייחוד פריחות, תסמינים במערכת העיכול, כאבי חזה, תסמינים במערכת השלד ושריר, מעורבות של הפה והלוע ותופעות נוירולוגיות, בייחוד כאבי ראש וירידה בשמיעה
- צבר של תסמינים וממצאים כרוניים במערכות גוף שונות עם בדיקות המראות סימני דלקת, בהיעדר הסבר אחר, במיוחד אם אין נוגדנים עצמוניים ובפרט אם התסמינים החלו בגיל צעיר
- סיפור משפחתי של מחלה דומה ו/או מוצא מתאים, כגון יהודים יוצאי צפון אפריקה ועיראק, ארמניה וערבים, לגבי קדחת ים תיכונית משפחתית
- בדיקות דם המראות סימני דלקת ללא הסבר
- מציאת עמילואידוזיס (Amyloidosis) ללא הסבר
הגישה הקלינית לתסמונות
החלק חשוב ביותר בבירור הוא באנמנזה (Anamnesis), בעיקר כשהיא מלווה ביומן של החולה והמשפחה ו/או צילומים של ממצאים גופניים (לא תמיד אפשר להגיע לרופא בעת התקפים קצרים). כל פיסת מידע עוזרת להרכיב תמונה מלאה ולהתקרב לאבחנה הקלינית. הבדיקה הגנטית באה בדרך כלל לאשר את האבחנה הקלינית ולתת מידע פרוגנוסטי ויש לשקול היטב מתי ואיזו בדיקה לשלוח[10],[11],[12]. קיימת בעייתיות רבה בפענוח הבדיקות הגנטיות, מכיוון שיש לא מעט תשובות שהן חיוביות כוזבות (False positive) [למשל תשניות (Mutations) שהן רב-צורתיות (Polymorphism) שכיחות ואינן פתוגניות] או שליליות כוזבות (False negative) (למשל חולי קדחת ים תיכונית משפחתית עם תשנית בודדת או אף ללא תשנית), ולפענוח נכון יש להפנות את החולים למומחים בתסמונות האלה. באנמנזה חשוב לברר את גיל התחלת המחלה, מוצא אתני, סיפור (ולעתים עץ) משפחתי, משך כל התקף, תדירות ההתקפים והאם הם מופיעים במרווחים סדירים, גירויים להתקפים (למשל חיסונים, קור, מחזור חודשי, פעילות גופנית מאומצת, דחק, זיהומים), ומעורבות של מערכות גוף. בכל מערכת מעורבת יש לשאול לאופי התסמין, למשל בחלק גדול מהתסמונות האוטואינפלמטוריות יש פריחה אופיינית (טבלה 1). בדיקות המעבדה תורמות פחות לאבחנה מכיוון שכמעט בכל התסמונות יש עלייה במדדי הדלקת בעת ההתקפים. חשובים יותר אולי (גם לגבי הסיכון להיווצרות עמילואידוזיס) הם מדדי הדלקת בין ההתקפים ובדיקות שתן לחלבון בשתן (Proteinuria), שהוא כמעט תמיד הסימן הראשון לעמילואידוזיס. לעתים גם התגובה לטיפול עוזרת באבחנה, למשל תגובה מצוינת ל-Colchicine ייחודית (Specific) למדי לקדחת הים תיכונית המשפחתית.
פתוגנזה
ככל שידוע יותר על התסמונות הללו ברור כי הפתוגנזה מורכבת וניתן לחלק את התסמונות בהתאם לפתוגנזה (טבלה 1). הפתוגנזות העיקריות הן[5],[6],[7],[8]:
- פגם בבקרה על האינפלמזום (Inflammasome). האינפלמזום הוא קבוצה של חלבונים, חלקם כוללים אתר פירין (Pyrin domain), שכאשר הם חוברים אחד לשני בתגובה לגירוי חיצוני (למשל פתוגנים, קריסטלים, כולסטרול, דחק) הם מפעילים את החלבון קאספאז 1 (1 Caspase) שהופך פרו-אינטרלויקין 1-בטא (proIL-1β, pro Interleukin-1β) לאינטרלויקין 1-בטא פעיל. חלבון פירין, הפגום בקדחת הים תיכונית המשפחתית, וחלבון קריופירין הפגום בקבוצת התסמונות המחזוריות הקשורות לקריופירין (CAPS, Cryopyrin Associated Periodic Syndromes) חשובים בפעילות ובבקרה של האינפלמזום, ולכן פגמים בחלבונים אלה עלולים לגרום לשפעול יתר של אינפלמזום, אף ללא גירוי חיצוני ולגרום לעלייה ברמות אינטרלויקין 1 ולהיווצרות של דלקת. מחלות בקבוצה זו מגיבות היטב לטיפולים נוגדי אינטרלויקין 1
- פגמים בחלבונים החשובים ביצירה ושפעול של NF-κB (Nuclear Factor kappa-light-chain-enhancer of activated B cells) שבין תפקידיו משפעל גנים האחראים להיווצרות ציטוקינים וחלבונים אחרים פרו־דלקתיים. דוגמאות קלאסיות למחלות במסלול זה הן מחלות גרנולומטותיות (Granulomatous) כגון מחלת קרוהן (Crohn's disease) ותסמונת בלאו (Blau) [שילוב של פריחה, דלקת מפרקים ודלקת הענבייה (Uveitis)] הקשורים לתשניות בגן שאחראי להיווצרות החלבון 15CARD/2NOD. מחלות אלה אינן מגיבות היטב לטיפול בנוגדי אינטרלויקין 1
- חסר של נוגד לקולטן (Receptor antagonist), למשל לאינטרלויקין 1 ואינטרלויקין 36 (שלו מבנה דומה לאינטרלויקין 1), גורם לפעילות יתר של הציטוקין בגלל חוסר איזון ובקרה של נוגדים. דוגמה למחלה מקבוצה זו היא DIRA (Deficiency of Interleukin 1 Receptor Antagonist). ב-DIRA מתפתחת מהלידה פריחה פוסטולרית (Pustular) ונגעים דלקתיים בעצם שאינם זיהומיים. המחלה כרוכה בתמותה רבה. מתן נוגד לקולטן לאינטרלויקין 1 המלאכותי Kineret (Anakinra) מציל ילדים אלה ומאפשר חיים תקינים[13]
- דחק תוך תאי הנובע בחלקו מיצירה עודפת של חומרים מחמצנים (Reactive oxidative species) ושפעול מנגנוני דלקת. יש מסלולים רבים שיכולים לגרום לשפעול מנגנון זה. שתי דוגמאות קלאסיות הן:
- מבנה הקולטן הלא תקין של גורם נמק הגידול (TNF, Tumor Necrosis Factor), שנוצר במחלת TRAPS, אינו מאפשר קיפול ושינוע תקין של החלבון ולכן הוא "נתקע" בתא במקומות שאינו צריך להימצא בהם וגורם לדחק תוך תאי וליצירת דלקת[8],[14]. חלק גדול מהדלקת במנגנון זה מתווך על ידי אינטרלויקין 1
- במחלה הנקראת CANDLE (Chronic Atypical Neutrophilic Dermatosis with Lipodystrophy and Elevated temperature) נמצא פגם גנטי הפוגע בתת יחידה 8 של הפרוטאוזום (Proteosome), האחראי לפירוק פסולת חלבונית בתא. אי לכך יש הצטברות של חלבונים בתאים המגרים תגובה דלקתית קשה, המתווכת במקרה זה על ידי אינטרפרון גאמא, ולא אינטרלויקין 1[15]
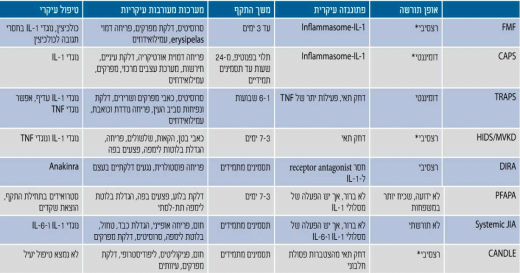
*לא תמיד נמצא תשנית במחלות השולטניות (Dominant) או שתי תשניות במחלות הנסגניות (Recessive)
IL: Interleukin;
CAPS: Cryopyrin Associated Periodic Syndrome;
TNF: Tumor Necrosis Factor;
TRAPS: TNF Receptor Associated Periodic Syndrome;
HIDS/MVKD: Hyperimmunoglobulin D Syndrome/Mevalonic Kinase Deficiency;
DIRA; Deficiency of IL-1 receptor Antagonist;
PFAPA: Periodic Fever, Aphthous stomatitis, Pharyngitis, Adenitis;
CANDLE: Chronic Atypical Neutrophilic Dermatosis with Lipodystrophy and Elevated temperature;
JIA: Juvenile Idiopathic Arthritis
תסמונת פי-פאפא (PFAPA, Periodic Fever, Aphthous stomatitis, Phayngitis, Adenitis)
תסמונת פי-פאפא, שתוארה לראשונה ב-1987[16], היא התסמונת האוטואינפלמטורית השכיחה ביותר בעולם. אמנם לא נמצאה אטיולוגיה גנטית, אך לעתים תכופות יש סיפור משפחתי של פי-פאפא[17].
הפתוגנזה של המחלה קשורה לשפעול יתר של אינטרלויקין 1[18]. כ-40% מחולי פי-פאפא בישראל הם נשאים של מוטציה בגן MEFV (Mediterranean Fever) של קדחת הים תיכונית המשפחתית[19]. בדרך כלל גיל ההופעה הוא לפני 5 שנים, אך תוארו מקרים גם במבוגרים[20]. התקפים מתרחשים לרוב כל 21-28 יום, ולעתים ההורים יכולים לנבא את מועד התחלת ההתקף הבא. ההתקפים נמשכים 3-7 ימים וכוללים חום גבוה, אודם ולעתים תפליטים בלוע, שנראה כמו דלקת גרון סטרפטוקוקלית (Streptococcal), הגדלת קשריות הלימפה בצוואר ובכ-60% פצעים בפה. לעתים יש כאבי בטן, בחילה והקאה, כאבי מפרקים וכאבי ראש. בין ההתקפים הילדים בריאים וגדלים היטב. בדיקות מעבדה מראות עלייה במדדים דלקתיים בזמן ההתקף עם חזרה לנורמה בין ההתקפים. הטיפול המקובל הוא מתן מנה חד פעמית של סטרואידים (בדרך כלל Prednisone במינון 0.6-2 מיליגרם לקילוגרם) בתחילת ההתקף (יש לזכור לקחת משטח גרון בכל מקרה), שלרוב "מחסל" את ההתקף, אך לעתים הטיפול מגביר את תכיפות ההתקפים[20],[21]. במקרה כזה ניתן לשקול הוצאת שקדים [ואולי גם אדנואידים (Adenoids)] עם ריפוי של למעלה מ-90% מהמקרים[22],[23], או לשקול מתן תרופה מניעתית כ-Cimetidine או Colchicine[21],[24], אך אלה יעילים רק בכ-30-40% מהחולים. הפרוגנוזה טובה ובדרך כלל ההתקפים חולפים בעשור השני של החיים, אך בכמעט 20% מהחולים יש התקפים, אם כי פחות תכופים, גם אחרי סיום ההתבגרות[25].
TRAPS - Tumor Necrosis Factor Receptor Associated Periodic Syndrome
התסמונת, שתוארה לראשונה ב-1982 במשפחה סקוטית-אירית[26], היא התסמונת האוטואינפלמטורית עם תורשה שולטנית השכיחה ביותר. הפגם הגנטי מצוי בזרוע הקצרה של כרומוזום 12 המקודד את אחד הקולטנים בקרומי התא (55 kDa) של גורם נמק הגידול[4]. תשניות הפוגעות במבנה הקולטן, לרוב בשיירי ציסטאין (Cysteine), גורמים למחלה קשה יותר. הפתוגנזה של המחלה כוללת גם פעילות יתר של גורם נמק הגידול בעקבות חסר קשירה של קולטנים המנטרלים את גורם נמק הגידול[27], וגם תהליכי דלקת תוך תאיים הנובעים מקיפול ושינוע לא תקין של קולטנים פגומים מתוך התא לקרום ושפעול תהליכים דלקתיים תוך תאיים[8],[14]. ההתקפים מתחילים לרוב בעשור הראשון של החיים, אך בכ-25% ההתקפים מתחילים אצל מבוגרים. התקפים קלאסיים הם ממושכים, נמשכים בין 1-6 שעות וכוללים חום, כאבי בטן, שלשולים, כאבי חזה, אודם ונפיחות סביב העיניים, כאבי מפרקים ושרירים ופריחה אופיינית אדומה וכואבת הנודדת ממרכז הגוף להיקף (Periphery) הגפיים[28]. עמילואידוזיס מתפתח בכ-14-25% מהחולים, בעיקר אלה עם תשניות בשיירי ציסטאין. הטיפול בהתקפים קלים כולל שימוש בתרופות נוגדות הדלקת שאינם סטרואידים (NSAID's, Non Steroidal Anti Inflammatory Drugs). התקפים קשים יותר מגיבים לטיפול בסטרואידים אך לעתים קרובות יש צורך לתת מינונים גבוהים ולא ניתן לגמול את החולים מסטרואידים. בחולים אלה או בחולים עם סיפור משפחתי של עמילואידוזיס יש לתת תרופות ביולוגיות. הטיפול היעיל ביותר הוא טיפול בנוגדי אינטרלויקין 1[29], אם כי יש חולים המגיבים לנוגדי גורם נמק הגידול[30]. יש דיווחי מקרים על הצלחת הטיפול בנוגדי אינטרלויקין 6[31].
תסמונות מחזוריות הקשורות לקריופירין - CAPS, Cryopyrin Associated Periodic Syndromes
תסמונות מחזוריות הקשורות לקריופירין הן בעלות תורשה שולטנית וכוללות 3 פנוטיפים (Phenotypes) עיקריים על טווח (Spectrum) של חומרה[32]. הגורם לתסמונות הוא פגמים בזרוע הארוכה של כרומוזום 1, המקודד את החלבון קריופירין, שהוא מרכיב חיוני באינפלמזום[33],[34],[35]. תסמונות מחזוריות הקשורות לקריופירין הן אבות הטיפוס של תסמונות אוטואינפלמטוריות המתווכות על ידי אינטרלויקין 1. שכיחות תסמונות מחזוריות הקשורות לקריופירין היא כ-1 ל-500,000 אנשים. התסמונת היותר קלה נקראת תסמונת התקררות אוטואינפלמטורית משפחתית (FCAS, Familial Cold Autoinflammatory Syndrome). התקפים מתחילים מהלידה או בסמוך ללידה. חולים מפתחים לאחר חשיפה לקור התקפים קצרים (פחות מ-24 שעות) של פריחה הדומה לסרפדת (Urticaria) שמתפשטת מהגפיים לגוף, חום (בדרך כלל סביב 380), הזעה, כאבי מפרקים, אודם בעיניים, כאבי ראש ובחילה. הפריחה אינה מגיבה לטיפול נוגד היסטמין ולמעשה לא מדובר בסרפדת טיפוסית אלא בהסננה נויטרופילית של שכבת העור האמצעית (Dermis) ותת העור. התסמונת הבינונית נקראת תסמונת מאקל-וולס (Muckle-Wells syndrome). ההתקפים הם יותר ארוכים, עד 72 שעות, מלווים בחום גבוה, כאבים יותר עזים בראש ובמפרקים, ודלקה הענבייה. בגיל ההתבגרות רוב החולים (עד 70%) מפתחים איבוד שמיעה עד חירשות וכרבע מהחולים מפתחים עמילואידוזיס. הפנוטיפ הקשה ביותר נקרא בארה"ב NOMID (Neonatal-Onset Multisystem Inflammatory Disease) ובאירופה CINCA (Chronic Infantile Neurologic, Cutaneous, Articular syndrome). בתסמונת זו מופיעים מהלידה חום ופריחה כרונית, ובעיקר יש דלקת כרונית של קרום המוח הגורמת ללחץ תוך גולגולתי מוגבר, אי שקט, הקאות, הִידְרוֹקַן הָרֹאשׁ (Hydrocephalus), היקף ראש מוגדל, פיגור התפתחותי ופיגור שכלי, פרכוסים, חירשות ועיוורון (גם מדלקת בעצב הראיה). כ-50% מהחולים מפתחים תוך השנתיים הראשונות של החיים עיוותי מפרקים קשים, שאינם נובעים מדלקת בתוך המפרק ובקרום הסינוביאלי (Synovium), אלא מגדילה לא תקינה ומוגזמת של הסחוס במרכזי הגדילה של העצם, במיוחד בברכיים ובירכיים. המחלה כרוכה בנכות קשה, תמותה מוקדמת ובהיווצרות עמילואידוזיס בשורדים.
הטיפול בכל שלושת הפנוטיפים הוא בנוגדי אינטרלויקין 1, כאשר יש 3 טיפולים מאושרים:
- Kineret (Anakinra) שהיא נוגד לקולטן לאינטרלויקין 1 בעל מחצית חיים קצרה של מספר שעות ולכן ניתן בזריקה תת עורית יומית. התרופה מאושרת לטיפול ב-NOMID/CINCA[36]
- Arcalyst (Rilonacept) שהוא קולטן מלאכותי (Synthetic) לאינטרלויקין 1 עם מחצית חיים של כשבוע, וניתן בזריקה תת עורית שבועית (לא מצוי בישראל)[37]
- Ilaris (Canakinumab) שהוא נוגדן ייחודי על בסיס אנושי לאינטרלויקין 1-בטא עם מחצית חיים של כמעט חודש וניתן בזריקה תת עורית פעם ב-8 שבועות[38].
Ilaris נמצא בסל הבריאות הישראלי לטיפול בתסמונות מחזוריות הקשורות לקריופירין. במקרים קשים, בעיקר עם מעורבות של מערכת העצבים המרכזית, יש לעתים צורך להגביר את תדירות ומינון התרופה[39],[40]
יש להדגיש את חשיבות האבחנה והטיפול המוקדמים מכיוון שבדרך כלל הנזק לשמיעה, לראייה ולעצמות אינו הפיך לאחר שנוצר[41],[42].
תסמונת יתר אימונוגלובולין D או תסמונת חסר מבלונט קינאז (Hyperimmunoglobulin D syndrome or Mevalonate kinase deficiency syndrome)
התסמונת, שתוארה לראשונה בהולנד ב־1984[43], היא למעשה מחלה מטבולית הנובעת מפגם בזרוע הארוכה של כרומוזום 12 הגורם לחסר באנזים מבלונט קינאז (Mevalonate kinase)[44],[45], החשוב במסלול יצירת הכולסטרול. המחלה, בעלה תורשה נסגנית, מתחילה בשנה הראשונה של החיים, לעתים תכופות לאחר חיסונים, המהווים גירוי חשוב של התקפים. ההתקפים נמשכים בין 3 ל-7 ימים וקורים בין 3 ל-6 שבועות. מלבד חום, חולים מפתחים בהתקף קלאסי כאבי בטן, הקאות ושלשולים, פריחה מפושטת, כאבי מפרקים, פצעים בפה והגדלת קשריות לימפה בצוואר. מלבד העלייה במדדים דלקתיים ניתן למדוד בעת התקף רמה גבוהה של חומצה מבלונית (אחת מהחומצות האורגניות) בשתן. אמנם התסמונת נקראת יתר אימונוגלובולין D, אך במחלות דלקתיות רבות אחרות יש בדם רמה גבוהה של אימונוגלובולין D, ומאידך בחולים רבים בתסמונת זו, בעיקר בילדים מתחת לגיל 3 שנים, רמות אימונוגלובולין D תקינות. ניתן לטפל בהתקפים קלים בתרופות נוגדות הדלקת שאינם סטרואידים. במקרים קשים ניתן לטפל בנוגדי גורם נמק הגידול או נוגדי אינטרלויקין 1, שניהם בעלי יעילות דומה בתסמונת זו[46]. יש שנותנים נוגדי אינטרלויקין 1 עם מחצית חיים קצרה (כמו Kineret) רק בתחילת התקף (טיפול לפי דרישה)[47]. הפרוגנוזה בדרך כלל טובה, בחולים מבוגרים תדירות ועוצמת ההתקפים פוחתת והסיכוי לפתח עמילואידוזיס או תמותה מוקדמת הוא קטן (כ-3%)[46].
דלקת מפרקים אידיופתית של הנעורים מהסוג המערכתי (JIA, Systemic Juvenile Idiopathic Arthritis)
JIA היא סוג ייחודי של דלקת מפרקים מתוך 6 סוגים לפחות של דלקת מפרקים בגיל הילדות (מתחת לגיל 16) המופיע בכ-1:5,000-10,000 ילדים [48]. בניגוד לסוגים אחרים של דלקת מפרקים הנחשבים למחלות אוטואימוניות, הסוג המערכתי של דלקת מפרקים נחשב לתסמונת אוטואינפלמטורית. במבוגרים המחלה נקראת מחלת סטיל (Still's disease) על שם הרופא הבריטי שתיאר מחלה זו ב-1897. דלקת מפרקים מערכתית מתבטאת בתחילה כחום לסירוגין (Intermittent) פעם או פעמיים ביום, שיורדים לנורמה או אף מתחת לנורמה, ובפריחה מקולארית (Macular) בצבע סלמון-ורוד המופיעה בעיקר על הגו והירכיים, בדרך-כלל בזמן הופעת החום. בנוסף לעתים קרובות מוצאים הגדלה של הכבד, הטחול וקשריות הלימפה ולפעמים מעורבות דלקתית של קרומי הלב והריאות. דלקת המפרקים יכולה להופיע בתחילת המחלה, אך הופעתה יכולה להתעכב אפילו מספר חודשים כאשר מעורבות המפרקים יכולה להיות קלה (מיעוט מפרקים) או קשה (רב מפרקית). יש סיכוי לתמותה של עד 0.6-2% מהחולים מסיבוכים של הדלקת [תסמונת הפעלת מקרופאג (Macrophage activation syndrome), יתר לחץ דם ריאתי ועוד] או הטיפול (זיהומים). בעבר, החולים טופלו בעיקר בסטרואידים, כאשר טיפולים אחרים המקובלים בדלקות מפרקים כמו תרופות נוגדות הדלקת שאינם סטרואידים, Methotrexate ונוגדי גורם נמק הגידול אלפה (TNF α) אינם יעילים במיוחד[49]. אולם, נמצא שמתן נוגדי אינטרלויקין 1 ואינטרלויקין 6 יעילים מאוד בטיפול בחולים אלה[50],[51],[52],[53], גם בתסמינים המערכתיים וגם בדלקת המפרקים, והטיפול הביולוגי מקובל כבר בשלב מוקדם כשלא ניתן לגמול את החולים מסטרואידים[49].
דגלים אדומים
ביבליוגרפיה
- ↑ HashkesPJ.Toker 0. Autoinflammatory syndromes. Pediatr Clin North Am 2012;59:447-70.
- ↑ The International FMF Consortium. Ancient missense mutations in a new member of the RoRet gene family are likely to cause familial Mediterranean fever. Cell 1997;90:797-807.
- ↑ The French FMF Consortium. A candidate gene for familial Mediterranean fever. Nat Genet 1997;17:25-31.
- ↑ 4.0 4.1 McDermott MF, Aksentijevich I, Galon J, etal. Germline mutation in the extracellular domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell 1999;97:133-44.
- ↑ 5.0 5.1 McGonagle D, Aziz A, Dickie LJ, et al. An integrated classification of pediatric inflammatory diseases, based on the concepts of autoinflammation and the immunological disease continuum. PediatrRes 2009;65:38R-45R.
- ↑ 6.0 6.1 Masters SL, Simon A, Aksentijevich I, etal. Horror Autoinflammaticus:The molecular pathophysiology of autoinflammatory disease. Annu Rev Immunol 2009;27:621-68.
- ↑ 7.0 7.1 Almeida de Jesus A, Goldbach-Mansky R. Monogenic autoinflammatory diseases: Concept and clinical manifestations. Clin Immunol 2013:147:155-74.
- ↑ 8.0 8.1 8.2 8.3 8.4 Gattorno M, Martini A. Beyond the NLRP3 inflammasome: autoinflammatory diseases reach adolescence. Arthritis Rheum 2013;65:1137-47.
- ↑ Ter Haar N, Lachmann H, Ozen S, et al for the Paediatric Rheumatology International Trials Organisation (PRINTO) and the Eurofever/Eurotraps Projects. Treatment of autoinflammatory diseases: results from the Eurofever Registry and a literature review. Ann Rheum Dis 2013,72:678-85.
- ↑ Federici L, Rittore-DomingoC, Kone-Paut I, etal. A decision tree for genetic diagnosis of hereditary periodic fevers in unselected patients. Ann Rheum Dis 2006;65:1427-32.
- ↑ Simon A, van der Meer JW, Vesely R, etal. Approach to genetic analysis in the diagnosis of hereditary autoinflammatory syndromes. Rheumatology (Oxford). 2006;45:269-73.
- ↑ Gattorno M, Sormani MP, D'Osualdo A, etal. A diagnostic score for molecular analysis of hereditary autoinflammatory syndromes with periodic fever in children. Arthritis Rheum 2008;58:1823-32.
- ↑ Aksentijevich I, Masters SL, Ferguson PJ, etal.. An autoinflammatory disease with deficiency of the interleukin-1-receptor antagonist. N Engl J Med 2009;360:2426-37.
- ↑ 14.0 14.1 Bulua AC, Simon A, Maddipati R, etal. Mitochondrial reactive oxygen species promote production of proinflammatory cytokines and are elevated inTNFRl-associated periodic syndrome (TRAPS). J Exp Med 2011;208:519-33.
- ↑ Liu Y, RamotY, Torrelo A, etal. Mutations in proteasomesubunit [3type 8 cause chronic atypical neutrophilic dermatosis with lipodystrophy and elevated temperature with evidence of genetic and phenotypic heterogeneity. Arthritis Rheum 2012;64:895-907.
- ↑ Marshall GS, Edwards KM, Butler J, etal. Syndrome of periodic fever, pharyngitis, and aphthous stomatitis. J Pediatr 1987;110:43-6.
- ↑ Akelma AZ.Cizmeci MN, Kanburoglu MK, etal Is PFAPA syndrome really a sporadic disorder or is it genetic? Med Hypotheses 2013:81:279-81.
- ↑ StojanovS, LapidusS, Chitkara Petal. Periodic fever, aphthous stomatitis, pharyngitis, and adenitis (PFAPA) is a disorder of innate immunity and Thl activation responsive to IL-1 blockade. Proc Natl Acad Sci U S A 2011;108:7148-53.
- ↑ Berkun Y, Levy R, Hurwitz A, etal. The familial Mediterranean fever gene as a modifier of periodic fever, aphthous stomatitis, pharyngitis, and adenopathy syndrome. Semin Arthritis Rheum 2011;40:467-72.
- ↑ 20.0 20.1 Padeh S, BrezniakN.Zemer D, etal. Periodic fever, aphthous stomatitis, pharyngitis, and adenopathy syndrome: Clinical characteristics and outcome. J Pediatr 1999:135:98-101.
- ↑ 21.0 21.1 Tasher D, Somekh E, Dalai I. PFAPA syndrome - new clinical aspects revealed. Arch Dis Child 2006;91:981-4.
- ↑ Garavello W, Pignataro L, Gaini L, et al. Tonsillectomy in children with periodic fever with aphthous stomatitis, pharyngitis, and adenitis syndrome. J Pediatr 2011:159:138-42.
- ↑ Licameli G, Lawton M, Kenna M, Dedeoglu F. Long-term surgical outcomes of adenotonsillectomy for PFAPA syndrome. Arch Otolaryngol Head Neck Surg 2012;138:902-6.
- ↑ .Feder HM Jr. Cimetidine treatment for periodic fever associated with aphthous stomatitis, pharyngitis and cervical adenitis. Pediatr Infect Dis J 1992;11:318-21.
- ↑ WursterVM, Carlucci JG, Feder HM Jr, Edwards KM. Long-term follow-up of children with periodic fever, aphthous stomatitis, pharyngitis, and cervical adenitis syndrome. J Pediatr 2011;159:958-64.
- ↑ Williamson LM, Hull D, Mehta R, et al. Familial Hibernian fever. Q J Med 1982;51:469-80.
- ↑ Arkwright PD, McDermott MF, Houton SM, et al. Hyper IgD syndrome (HIDS) associated within vitro evidence of defective monocyte TNFRSF1A shedding and partial response to TNF receptor blockade with etanercept. Clin Exp Immunol 2002;130:484-8.
- ↑ Aganna E, Hammond L, Hawkins P, etal. Heterogeneity among patients with tumor necrosis factor receptor-associated periodic syndrome phenotypes. Arthritis Rheum 2003;48:2632-44.
- ↑ Gattorno M, Pelagatti MA, Meini A, et al. Persistent efficacy of Anakinra in patients with tumor necrosis factor receptor-associated periodic syndrome. Arthritis Rheum 2008;58:1516-20.
- ↑ Bulua AC, Mogul DB, Aksentijevich I, etal. Efficacy of etanercept in the tumor necrosis factor receptor-associated periodic syndrome: a prospective, open-label, dose-escalation study. Arthritis Rheum 2012;64:908-13.
- ↑ Vaitla PM, Radford PM, Tighe PJ, et al. Role of interleukin-6 in a patient with tumor necrosis factor receptor-associated periodic syndrome: assessment of outcomes following treatment with the anti-interleukin-6 receptor monoclonal antibody tocilizumab. Arthritis Rheum 2011:63:1151-5.
- ↑ Aksentijevich I, Putnam CD, Remmers EF, et al. The clinical continuum of cryopyrinopathies: novel CIAS1 mutations in North American patients and a new cryopyrin model. Arthritis Rheum 2007;56:1273-85.
- ↑ Hoffman H, Mueller J, BrodieD, etal. Mutation of a new gene encoding a putative pyrin-like protein causes familial cold autoinflammatory syndrome and Muckle-Wells syndrome. Nat Genet 2001;29:301-5.
- ↑ Feldmann J, Prieur AM, Quartier Petal. Chronic infantile neurological cutaneous and articular syndrome is caused by mutations in CIAS1, a gene highly expressed in polymorphonuclear cells and chondrocytes. Am J Hum Genet 2002;71:198-203.
- ↑ Aksentijevich I, NowakM.Mallah M, etal. De novo CIAS1 mutations, cytokine activation, and evidence for genetic heterogeneity in patients with neonatal-onset multisystem inflammatory disease (NOMID):a new member of the expanding family of pyrin-associated autoinflammatory diseases. Arthritis Rheum 2002:46:3340-8.
- ↑ Goldbach-Mansky R, Dailey NJ, Canna SW, et al. Neonatal-onset multisystem inflammatory disease responsive to interleukin-1 (3 inhibition. N Engl J Med 2006;355:581-92.
- ↑ Hoffman HM, Throne ML, Amar NJ, etal. Efficacy and safety of rilonacept (interleukin-1 trap] in patients with cryopyrin-associated periodic syndromes. Arthritis Rheum 2008;58:2443-5.
- ↑ Lachmann HJ, Kone-Paut I, Kuemmerle-Deschner JB, etal, for the Canakinumab in CAPS Study Group. Use ofCanakinumab in the cryopyrin-associated periodic syndrome. N Engl J Med 2009;360:2416-25.
- ↑ Caorsi R, Lepore L, Zulian F, et al.The schedule of administration of Canakinumab in cryopyrin associated periodic syndrome is driven by the phenotype severity rather than the age. Arthritis ResTher 2013;15:R33.
- ↑ Kuemmerle-Deschner JB, Hachulla E, Cartwright R, etal. Two-year results from an open-label, multicentre, phase III study evaluating the safety and efficacy of Canakinumab in patients with cryopyrin-associated periodic syndrome across different severity phenotypes. Ann Rheum Dis 2011;70:2095-102,
- ↑ Sibley CH, PlassN, Snow J, et al. Sustained response and prevention of damage progression in patients with neonatal-onset multisystem inflammatory disease treated with anakinra: a cohort study to determine three- and five-year outcomes. Arthritis Rheum 20121:64:2375-86.
- ↑ Kuemmerle-Deschner JB, Koitschev A, et al. Hearing loss in Muckle-Wells syndrome. Arthritis Rheum 2013;65:824-31.
- ↑ van der Meer JW.Vossen JM.Radl J, et al.Hyperimmunoglobulinaemia Dand periodic fever: a new syndrome. Lancet 1984;1:1087-90.
- ↑ Houton SM, KuisW, Duran M, et al. Mutations in MVK, encoding mevalonate kinase, cause hyperimmunoglobulinaemia Dand periodic fever syndrome. Nat Genet 1999;22:175-7.
- ↑ Drenth JP, Cuisset L, Grateau G, et al. Mutations in the gene encoding mevalonate kinase cause hyper-lgDand periodic fever syndrome. Nat Genet 1999;22:178-81.
- ↑ 46.0 46.1 Simon A; International HIDS Study Group. Long-term follow-up, clinical features, and quality of life in a series of 103 patients with hyperimmunoglobulinemia D syndrome. Medicine (Baltimore) 2008:87:301-10.
- ↑ Bodar EJ, KuijkLM, Drenth JP, van der Meer JW, Simon A, Frenkel J. On-demand Anakinra treatment is effective in mevalonate kinase deficiency. Ann Rheum Dis 2011;70:2155-8.
- ↑ Ravelli A, Martini A. Juvenile idiopathic arthritis. Lancet 2007:369:767-78.
- ↑ 49.0 49.1 BeukelmanT, Patkar NM, Saag KG, etal. 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features. Arthritis Care Res (Hoboken) 2011;63:465-82.
- ↑ Quartier P, AllantazF, CimazR, etal. A multicentre, randomised, double-blind, placebo-controlled trial with the interleukin-1 receptor antagonist Anakinra in patients with systemic-onset juvenile idiopathic arthritis (ANAJIS trial). Ann Rheum Dis 2011;70:747-754.
- ↑ Lovell DJ, Giannini EH, Reiff AO, etal. Long-term safety and efficacy of rilonacept in patients with systemic juvenile idiopathic arthritis (sJIA). Arthritis Rheum 2013, EPUB.
- ↑ Ruperto N, Brunner HI, Quartier Petal. Two randomized trials of Canakinumab in systemic juvenile idiopathic arthritis. N Engl J Med 2012;367:2396-406.
- ↑ DeBenedettiF, Brunner HI, Ruperto N, etal. Randomized trial of tocilizumab in systemic juvenile idiopathic arthritis. N Engl J Med 2012:367:2385-395.
קישורים חיצוניים
- מבוא לתסמונות אוטואינפלמטוריות, TheMEDICAL
המידע שבדף זה נכתב על ידי פרופ׳ פנחס השקס, מנהל היחידה לריאומטולוגיה ילדים, המרכז הרפואי שערי צדק, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק