אנדותלין - Endothelin
הופניתם מהדף Endothelin לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| אנדותלין | |
|---|---|
| Endothelin | |
| שמות אחרים | ET-1 |
| מעבדה | כימיה בדם |
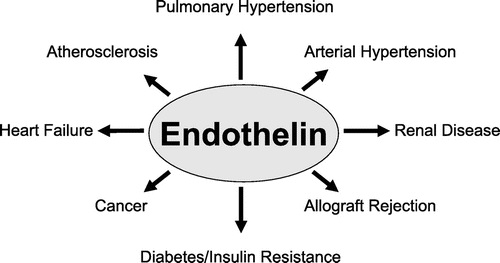
| תחום | הערכת מפגעים קרדיו-וסקולאריים כגון יתר לחץ-דם כלל מערכתי וריאתי, אי-ספיקת כליה ואי-ספיקת לב גדושה, וכן היצרות כלי-דם מוחיים |
| טווח ערכים תקין | 4.0-9.0 פיקוגרם/מ"ל |
| יוצר הערך | פרופ' בן עמי סלע |
ביוסינתזה של אנדותלין
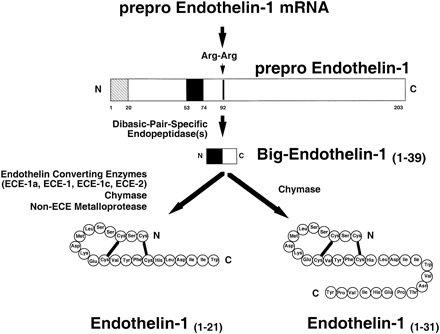
אנדותלין הוא פפטיד מכווץ כלי-דם, המכיל 21 חומצות אמינו שנוצר בתאי האנדותל לאחר ביקוע של הקודמן (precursor) שלו, big ET-1, המכיל 39 חומצות אמינו, על ידי האנזים ECE או endothelin converting enzyme, הנמצא על פני הממברנה של תאי האנדותל. היצירה וההפרשה של אנדותלין מושרים על ידי מספר גורמים כמו angiotensin II, תרומבין, ההורמון האנטי-דיורטי (ADH), ציטוקינים אחדים, ROS או reactive oxygen speciesוכוחות גזירה הפועלים על האנדותליום הוסקולארי. הפרשת אנדותלין מעוכבת על ידי NO, כמו גם על ידי פרוסטציקלין ו-ANP או atrial natriuretic peptide.
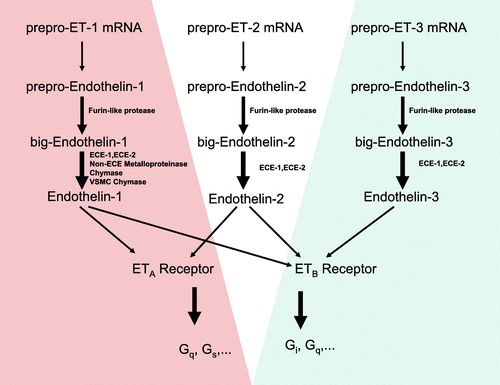
בנוסף לשלושת האנדותלינים ET-2, ET-1 ו-ET-3 זוהה על ידי Kishi וחב' ב-1998 אנדותלין רביעי שבניגוד לקודמיו המכילים 21 חומצות אמינו, הוא מכיל 31 חומצות אמינו. אנדותלין זה נוצר על ידי ביקוע של big endothelins על ידי האנזים chymase בין השיירים Tyr31-Gly32, ליצירת אנדולין גדול יותר בעל תכונות של כיווץ צינור הנשימה. אנדותלין (1-31) זה הוא בעל פעילות חלשה יותר בכיווץ כלי דם כליליים או בכיווץ הוותין, בהשוואה לאנדותלינים בעלי 21 חומצות אמינו, אך הוא בעל פעילות כיווץ ממושכת יותר. שניים מחוסמי הקולטנים של האנדותלינים, BQ485 ו-BQ788 חוסמים את פעילות אנדותלין (1-31) באופן יעיל יותר בהשוואה לחסימת הקולטנים של האנדותלינים הקצרים יותר.
שלושת האנדותלינים בעלי 21 חומצות אמינו, הם בעלי הומולוגיה גבוהה ביניהם למרות היותם מקודדים על ידי גנים שונים. בפעילותם הפיזיולוגית וברצף חומצות האמינו שלהם הם מראים דמיון לארס הנחשים-sarafotoxin, כפי שהראו יואל קלוג, מרדכי סוקולובסקי, אבנר בדולח ואלעזר כוכבא בשנת 1988 ב-Science. המבנה של האנדותלינים בני 21 חומצות האמינו כולל שתי לולאות: אחת מהן בעלת 15 חומצות אמינו בקצה ה-N טרמינאלי של הפפטיד יוצרות קשר די-סולפידי בין שיירי ציסטאין בעמדות 1 ו-15, ואילו לולאה קטנה יותר יוצרת קשר דיסולפידי בין שיירי ציסטאין בעמדות 3 ו-11.
שני האנדותלינים ET-2 ו-ET-3 שונים מ-ET-1 ב-2 חומצות אמינו וב-6 חומצות אמינו, בהתאמה, כאשר חומצות אמינו אלו בהן יש שוני בין שלושת האנדותלינים ממוקמות בלולאה ה-N טרמינאלית. האנדותלין הדומיננטי מבין השלושה הוא ET-1, שפרט לתכונתו כמכווץ כלי-דם, הוא ניחן בנוסף בפעילויות נוספות הן בהשפעה על התפתחות העובר, כיווץ סמפונות הריאה, שגשוג בלוטת הערמונית, התפתחות תהליכים ממאירים, ותפקוד מערכת העיכול והמערכת האנדוקרינית.
ביוסינתזה ורגולציה של ET-1
באנדותל מופרש ET-1 לעבר תאי שריר חלק במנגנון של השפעה פאראקרינית מקומית. בנוסף לתאי אנדותל, ET-1 מיוצר גם על ידי תאים נוספים הקשורים במחלה וסקולארית, כמו לויקוציטים, מקרופאגים, תאי שריר חלק, מיוציטים של שריר הלב, ותאי mesangium. השעתוק של הגן המקודד לחלבון האם prepro-endothelin, מווסת על ידי הקומפלקסים c-fos ו-c-jun, על ידי אלמנטים המווסתים סינתזה של מגיבי acute phase, ואתרי קישור כמו nuclear factor-I, AP-2 ו-GATA-2. התרגום של ה- mRNA ליצירת פפטיד האם של ET-1 המכיל 203 חומצות אמינו, מתרחש על ידי ביקוע מולקולת האם על ידי furin convertase, ליצירת פפטיד בעל 39 חומצות אמינו הידוע כ-big endothelin-1. כלומר, סינתזת אנדותלין מווסתת ברמת שעתוק הגנים, כתגובה לגירויים בזמן אמת תוך דקות אחדות, שכן תאי האנדותל אינם מאחסנים מאגרי אנדותלין. תקופת מחצית החיים של ה-mRNA היא בערך 15-20 דקות, ותקופת מחצית החיים של אנדותלין בפלזמה היא בערך 4-7 דקות.
האנזימים המשתתפים בסינתזה של אנדותלין
ברגע שנוצר big ET-1 הוא מוסב ל-ET-121 על ידי אנזים הידוע כ-ECE-1 או ET-converting enzyme-1, המבקע את הקשר Trp21-Val22 של big ET-1, וכן על ידי האנזימים ECE-2 ו-chymase. האנזים ECE-1 קיים כ-4 איזופורמים (a, b, c ו-d). בנוסף, chymase מבקע את big ET-1 בקשר Tyr31-Gly32, ליצירה של ET-131. ההבדל בין ECE-1 ו-ECE-2 הוא בכך ש-ECE-1 בא לביטוי על פניהם של תאים שונים ובתוכם תאי אנדותל, ופעילותו מרבית ב-pH ניטראלי. ECE-2 לעומת זאת, מעדיף pH חומצי ועיקר פעילותו בתאי עצב, ונראה שעיקר פעילותו תוך-תאית במערכת הגולג'י.
ECE-3 מסב באופן בררני את big ET-1 ל-ET-3. אנזימי ECE ממוקמים בתאי אנדותל, בתאי שריר חלק, במיוציטים של הלב, ובמקרופאגים. אנזימי ECE שייכים למשפחת המטלו-פרוטאזות, והם מעוכבים חלקית על ידי phosphoramidon, וכן על ידי EDTA ו-thiorphan. אנזימים אלה אינם בררניים ל-big ET-1: הם יכולים לבקע גם פפטידים כמו bradykinin, וכן substance P ואינסולין. ביטוי האנזים ECE-1 מווסת על ידי מנגנונים התלויים ב-protein kinase C, בקולטנים מסוג ETB, בגורם השעתוק est-1 ובציטוקינים שונים. בעכברי knock-out בהם פגעו Yanagisawa וחב' באופן יזום באנזים ECE-1 (מאמר מ-1998 ב-Development), פחתה רמת האנדותלין ET-1 ברקמות רק בשליש, מה שמרמז לקיום מנגנוני ביקוע אנזימטי נוספים (מטלופרוטואזות ו-chymases) שאינם תלויים ב-ECE.
מערכת האנדותלין
לאחר השיבוט של שלושת האנדותלינים ET-2, ET-1 ו-ET-3, זוהו הקולטנים התאיים שלהם, ושובטו אף הם. קיים למעשה אנדותלין נוסף, ET-4, הידוע כ-vasoactive intestinal constrictor. ביונקים, נמצא ש-2 קולטנים כאלה (ETA ו-ETB) הם המתווכים את פעילות אנדותלין. המולקולה הפעילה ביותר ביולוגית במשפחת פפטידים זו, אנדותלין-1, נקשר באופן מועדף לקולטן ETA, בעוד שלקולטן ETB נקשרים ET-1 ו-ET-2. ניתן לראות בציר ET-3/ETB מערכת אנדוגנית אנטגוניסטית להשפעות של הציר ET-1/ET, הכוללות כיווץ חזק של כלי דם, שגשוג תאים, התפתחות אמבריונלית, תפקוד כליות, ותפקידים נוירו-פיזילוגיים כמו איתות של תחושות כאב, הומאוסטאזיס קרדיו-וסקולארי, שגשוג תאי סרטן, ותפקוד אנדוקריני, מצבי דלקת, ותפקודי ריאות כמו כיווץ סמפונות, ותפקוד מערכת הרבייה.
גורמים המשפיעים ומווסתים את הסינתזה של ET-1
סינתזה של אנדותלין מווסתת על ידי גורמים פיזיקאליים וכימיים מגוונים, כמו מתיחה מכאנית ופעימתית של דופן כלי הדם. עליה בשפיעת הדם גורמת באמצעות כוחות הגזירה להפרשת NO המדכא את ייצור ET-1. ירידה ב-pH מעלה את הפרשת ET-1 על ידי תאי האנדותל (McArthur וחב', J Clin Invest משנת 1998), וגם פעילות גופנית מגבירה ביטוי ET-1 בשריר הלב של חולדות, מה שמרמז למעורבות אנדותלין בתפקוד הלב. מצבי היפוקסיה מעודדים יעילים את סינתזת ET-1, שעשויה להיות משמעותית במצבי איסכמיה. ביוסינתזה של ET-1 מושרית על ידי גורמי סיכון קרדיו-וסקולאריים כגון עלייה ברמת LDL כפי שהראו Boulanger וחב' ב-Circ Res בשנת 1992, עלייה ברמת גלוקוזה (Yamauchi וחב' FEBS lett משנת 1990), חסר באסטרוגנים (Akashita וחב' משנת 1996 ב-Atherosclrosis), השמנת-יתר (Barton וחב' משנת 2000 ב-Hypertension), גיל מתקדם (Barton חב' משנת 1999 ב-J Am Coll Cardiol), ותווכים של קרישת דם כמו תרומבין (Boulangeg ו-Luscher, משנת 1990 ב-J Clin Invest).
עוד חומרים המעודדים יצירת אנדותלין, בהם ציטוקינים (Colder וחב' משנת 1995 ב-J Cardiovasc Pharmacol), מכווצי כלי-דם דוגמת vasopressin, אנגיוטנסין II וניקוטין (Imai וחב' משנת 1992 ב-Hypertension), גורמי גדילה כמו VEGF (מחקרם של Matsuura וחב' משנת 1998 ב-Hypertension), ומולקולות ספיחה (Schwarting וחב' משנת 1996 ב-Scand J Rheumatol), וכן אדרנלין ואינסולין. חלק מהגורמים הללו מאיצים את ביטוי הגן המקודד לאנדותלין, על ידי שפעול של protein kinase C.
לעומת זאת, מעכבים של סינתזת ET-1 כוללים את NO, אסטרוגן ופרוגסטרון (Morey וחב' משנת 1998 ב-Biochem J), פרוסטציקלין (Stewart וחב', ב-Am J Physiol משנת 1994), הפפטיד הנתריאורטי ANP (על פי Wada וחב' ב-Am J Physiol משנת 1996), פרוסטגלנדין I2 והפארין.
| גירויים מעודדים | גירויים מעכבים |
|---|---|
| היפוקסיה, איסכמיה, כוחות גזירה, מתיחה משפיעת הדם, pH, אינסולין, מולקולות ספיחה, תרומבין, פקטורי גדילה, קטכולאמינים, אנגיוטנסין II, כולסטרול LDL מחומצן, כולסטרול HDL ואזופרסין. |
חד תחמוצת החנקן (NO), פרוסטציקלין, סטטינים, ANP (פפטיד נתריאורטי של האטריום) ואסטרוגנים. |
הקולטנים של אנדותלין
אנדותלין ET-1 משפעל קולטנים המצומדים לחלבוני G, כאשר ביונקים וביניהם האדם זוהו עד כה 2 סוגי קולטנים, ETA ו-ETB. בדופן כלי הדם, קולטני ETA נמצאים על פני תאי שריר חלק ובמיוציטים של הלב, ואילו קולטני ETB ממוקמים על תאי אנדותל ובמידה פחותה יותר על תאי שריר חלק ומקרופאגים כפי שהראו Bacon וחב' ב-Circ Res ב-1996. הזיקה של קולטני ETA ל-ET-1 ול-ET-2 גדולה פי-100 מאשר ל-ET-3, כאשר הזיקה של ETB דומה לשלושת צורות האנדותלין (Masaki משנת 1995 ב-Ann Rev Pharmacol Toxicol). ב-1997 הראו Mateo ו-Artinano ב-Pharmacol Res שלקולטני ETB יש 2 תת סוגים: ETB1 ו-ETB2, כאשר ETB1 נמצא על פני תאי אנדותל, ואילו ETB2 ממוקם על תאי שריר חלק של הווריד הג'וגולרי ובווריד צפון-saphena. הזרקת ET-1 לווריד, גורמת להתכווצות השריר החלק ולעליה תלולה בלחץ הדם.
יש לציין שהתכווצות כלי הדם מתרחשת לאחר תגובה קצרה שיכולה להימשך עד דקה אחת, בה נמצא דווקא הרחבת כלי-דם והפחתה בולטת בלחץ הדם, כנראה כתוצאה משפעול של קולטני ETB1 הנמצאים על תאי אנדותל שהפעלתם מביאה להפרשת NO החומר העובר דיפוזיה לתאי השריר החלק ומרפה אותם. בניגוד לתהליך זה, קישור והפעלה של קולטני ETB2 הממוקמים על פני חלק מתאי השריר החלק, גורמת להתכווצותם.
הקישור של ET-1 לקולטן ETA משפעל את האנזים phosphlipase C מה שמוביל להצטברות של inositol triphosphate, של diacylglycerol ושל סידן בציטוזול של תאי השריר החלק כפי שמצאו Goto וחב' ב-1989 ב-Proc Natl Acad Sci, מה שגורם לכיווץ ממושך של כלי הדם (Pollock וחב' ב-Faseb J משנת 1995). הגברת הריכוז של סידן ושל diacylglycerol מעודד את פעולת protein kinase C המתווך בפעילות המיטוגנית (Ohlstein וחב' משנת 1992 ב-Eur J Pharmacol).
לעומת זאת, השפעול של קולטני האנדותל מסוג ETB מעודד הפרשה של NO ו-prostacyclin על פי Hirata וחב' ב-J Clin Invest משנת 1993, מונע אפופטוזיס (Shichiri וחב' משנת 1997 ב-Hypertension), מעכב את הביטוי של האנזים ECE-1 בתאי האנדותל (Naomi חב' משנת 1998 ב-Circulation), ומשחק תפקיד קטן בוזודילציה (Clozel וחב' ב-J Cardiovasc Pharmacol משנת 1993. קולטנים מסוג ETB מתווכים גם בפינוי בריאות של מולקולות ET-1 בצירקולציה (Dupuis וחב' ב-J Appl Physiol משנת 1996.
מנגנון הפעולה של אנדותלין
כאשר תאי האנדותל מפרישים ET-1 הוא נקשר לקולטניו על פני תאי שריר חלק סמוכים. ישנם שני קולטנים עיקריים ETA ו-ETB (האחרון מכיל 2 תת קולטנים ETB1 ו-ETB2), וכן ישנו קולטן משני בחשיבותו-ETC. הקולטן ETB1 פועל להפרשת NO ולהרחבת כלי הדם, ופעילותו באבוביות הכליה ובמערכת העצבים המרכזית, בה בשעה שהקולטן ETB2 פועל לכיווץ כלי דם ולמיוגניות. שני הקולטנים העיקריים קשורים לחלבון Gq וליצירת IP3 או inositol triphosphate, שהוא messenger משני להעברת איתותים תוך-תאיים. הגברת רמת IP3 מביאה לשחרור סידן על ידי ה-sarcoplasmic reticulum, ובהמשך לכיווץ השריר החלק. בכלי הדם, הקולטן ETA הוא הדומיננטי בתנאים נורמאליים, במונחים של השפעת ET-1 על כיווץ כלי הדם. בנוסך לנוכחות קולטני ETA ו-ETB על פני תאי שריר חלק, קולטני ETB מופיעים גם על תאי האנדותל עצמם, וכאשר ET-1 נקשר לקולטני ETB על פני תאי האנדותל, מושרית יצירת nitric oxide או NO, שפעולתו הפוכה כידוע מזו של אנדותלין. הקולטנים של ET-1 בלב גם כן קשורים לחלבון Gq ולערור המסלול של IP3, וכך גדל כושר הכיווץ וקצב פעימות הלב.
ההשפעות הקרדיו-וסקולאריות של אנדותלין
הפיזור של הקולטנים לאנדותלין באנדותל ובתאי שריר חלקים, מסייע להסביר את התופעה לפיה הזרקה סיסטמית לווריד של ET-1 גורמת בהתחלה דווקא באופן זמני (0.5-1.0 דקה) להרחבת כלי-דם וללחץ-דם נמוך על ידי שפעול של הקולטנים האנדותליאליים מסוג ETB1 המביאה לשחרור של NO, ולאחריה מתקבל כיווץ ממושך של כלי-דם וללחץ-דם מוגבר, כאשר משופעלים בנוסף גם קולטני ETA על פני תאי שריר חלקים.
ההשפעה הישירה של ET-1 על הלב עוברת שיכוך להגנה עליו, וזאת על ידי מערכת ה-baroreceptor reflex, שהיא מנגנון הומאוסטטי המסייע לגוף לשמור על לחץ-דם יציב. ה-baroreflex מספק תגובת משוב שלילי בה עלייה בלחץ הדם גורמת רפלקסיבית להפחתת קצב הלב, ולעומת זאת ירידה בלחץ הדם מפחיתה את שפעול הרפלקס הבארו-רצפטורי וגורמת לעלייה בקצב הלב כדי להשיב לקדמותה את רמת לחץ הדם. הבארו-רפלקס יכול להתחיל בפעולתו תוך חלקיק שנייה. ל-ET-1 יש מספר פעילויות בנוסף לכיווץ כלי-דם וגירוי פעולת הלב, שיכולות להשפיע בצורה בלתי ישירה על התפקוד הקרדיו-וסקולארי. ET-1 מעודד הפרשת אלדוסטרון, מפחית את שפיעת הדם בכליות ואת קצב הסינון הגלומרולארי (GFR) וגורם לשחרור ANP או atrial natriuretic peptide.
בנוסף לפעילותו מכווצת כלי הדם ופעילותו המיטוגנית, אנדותלין מעודד יצירה של ציטוקינים כגון IL-6 ו-neutrophil chemotactic factor (הידוע כ-IL-8), כפי שהראו Hofman ןחב' ב-Blood ב-1998. אנדותלין מעודד גם הפרשת גורמי גדילה כמי VEGF, יצירת basic fibroblast growth factor-2 על ידי תאי שריר חלק וסקולאריים (Peifley ו-Winkles ב-Biochem Biophys Res Commun מ-1998), ו-epiregulin המיוצר אף הוא בתאי שריר חלק (Taylor וחב' ב-Proc Natl Acad Sci מ-1999. בהתאם, ET-1 תורם לשגשוג תאי שריר חלק ופיברובלטים ולשינויי מבנה בדופן כלי הדם, כולל הופעת לייפת (פיברוזיס), והפחתת הגמישות של כלי הדם (Rubanyi ו-Polokoff ב-Pharmacol Rev מ-1994, שינויים התורמים להגברת לחץ-דם.
ET-1 משרה גם יצירת של משתית חוץ-תאית (extracellular matrix proteins) יצירה של פיברונקטין (Marini וחב' Biochem Biophys Res Commun מ-1996, ומגביר את ההשפעות של TGF-β (כפי שהראו Weissberg וחב' בשנת 1990 ב-Atherosclerosis) ושל PDGF (על פי Yang וחב' ב-Circulation מ-1999. ET-1 מגיב עם תאי דם בעודדו ספיחת נויטרופילים (Lopez וחב' ב-Circulation מ-(1993, וצימות (aggregation) של טסיות-דם (Knofler וחב' ב-Thromn Res מ-1995), וכן מהווה ET-1 גורם כימוטקטי עבור מקרופאגים (Heller וחב' משנת 1991 ב-Am J Physiol).
אנדותלין וטרשת עורקים
כ-20 שנה לאחר גילויו של אנדותלין על ידי Yanagisawa בשנת 1988, התברר שלא מדובר רק במכווץ כלי-דם, אלא בפפטיד רב-פעילויות, כגון זו המדמה פעילות של ציטוקינים ומשפיעה על היבטים רבים של התפקוד התאי. נתונים מניסויים קליניים מצביעים על ET-1 כבעל תפקיד מרכזי בתהליך הטרשתי על ידי שהוא מעודד פעילות מיטוגנית בתאים וסקולאריים, ומשרה יצירה של משתית חוץ-תאית (extracellular matrix). נמצא ש-ET-1 מתבטא באופן ניכר בחלל החוץ-תאי, אך גם בסוגי תאים רבים כמו מקרופאגים, תאי שריר ב-intima של דופן כלי הדם, מיו-פיברובלסטים, ותאי אנדותל ברבדים טרשתיים של עורקים כליליים באדם, כפי שסיכמו Zeiher וחב' כבר ב-1995 ב-Circulation. עוד קודם לכן, בשנת 1991, פרסמו Lerman וחב' ב-N Eng J Med שיש מתאם בין רמות אנדותלין בפלזמה וברקמות, לבין חומרת המחלה הטרשתית. בשנת 2001 הציעו Wilson וחב' ב-Biochem Biophys Res Commun, שברמה המולקולארית ET-1 משפעל במונוציטים את גורם השעתוק הגרעיני NF-κB שהוא גורם חיוני ברצף השלבים הדלקתיים, כאשר תהליכי דלקת כידוע משתתפים ביצירת הטרשת בדופן כלי הדם.
מצב של היפר-כולסטרולמיה משבש את תפקוד האנדותל וכרוך ברמת מוגברות של ET-1 הן בפלזמה (Haak וחב' ב-Clin Invest מ-1994) כמו גם ברקמות (Leman וחב' משנת 1995 ב-Circulation). נמצא ש-LDL מחומצן, משרה את ביטוי הגן ל-ET-1 בתאי אנדותל (Boulanger וחב' ב-Circ Res מ-1992), וגם את השגשוג של תאי שריר חלק וסקולאריים ( Jing וחב' ב-Life Sci ב-1998). בנוסף, הפרשה מוגברת של ET-1 מעודדת את הסינתזה של TGF-β1, וכן של bFGF, של epiregulin, של PDGF ושל מספר מולקולות ספיחה המעורבות בתהליך הטרשתי. בכך מסייע ET-1 לצמיחת הרובד טרשתי, ולאירועי פקקת כללית.
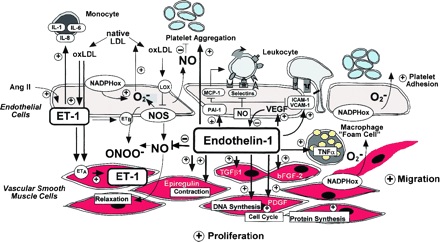
-ONOO מבטא peroxynitrite; NOS מבטא nitric oxide synthase; MCP-1 מבטא monocyte chemoattractant protein-1; ICAM-1 מבטא intracellular adhesion molecule-1; VCAM-1 מבטא vascular cell adhesion molecule-1; oxLDL מבטא oxidized LDL; O2- מבטא superoxide anion; LOX מבטא lectin-like oxidized LDL receptor; TGF β1 מבטא transforming growth factor β1; NADPHox מבטא nicotinamide adenine dinucleotide phosphate oxidase; PAI-1 מבטא plasminogen activator inhibitpr-1; VEGF מבטא vascular endothelial growth factor; bFGF-2 מבטא basic fibroblast growth factor-2; PDGF מבטא platelet-derived growth factor. (+) מבטא עידוד ואילו (-) מבטא עיכוב.
כן נמצא ש ET-1 מגביר את ספיחתם של נויטרופילים וטסיות-דם באזורי הרובד הטרשתי, ובמערכת ניסויית בה השרו יתר-כולסטרול באוגרים, חסימת הקולטן ETA הפחיתה את הסננת מקרופאגים לתוך הרובד השומני כפי שדווחו KIowala וחב' ב-Am J Pathol ב-1995. מחקרים אחדים הראו שטיפול בחוסמי הקולטן ETA, מאט את התהליך הטרשתי כאשר כמות המקרופאגים המופיעים ברובד הטרשתי בוותין של בעלי חיים המוזנים במזון עתיר כולסטרול, פוחתת בלמעלה מ-75%. כך נצפה גם בעכברים טרנסגניים ללא apolipoprotein A, שהוזנו במזון עתיר כולסטול, אשר טופלו בחוסם ETA כגון LU135252.
משמעותו הפיזיולוגית של אנדותלין, ובמצבי מחלה
תוך פרק זמן קצר באופן מפתיע של 4 שנים מגילוי אנדותלין, שובטו הקולטנים שלו, ותכשירים פרמקולוגיים אנטגוניסטים לקולטנים אלה הפכו זמינים. הניסוי הקליני הראשון במטופלים עם אי-ספיקת לב גדושה התקיים בציריך בראשית שנות ה-90, והתפרסם ב-1995 על ידי Kiowski וחב'. עוד מספר ניסויים קליניים מוצלחים עם מטופלים עם אי-ספיקת לב, ביססו את הרעיון של חסימת הקולטן לאנדותלין. בשנת 2001 אושר bosentan (שם מותג Tracleer) על ידי ה-FDA לטיפול באלה עם יתר לחץ-דם ריאתי, והיה זה המותג הפומי הראשון של אנטגוניסט לקולטן של אנדותלין. מאז התווספה קבוצה נוספת של אנטגוניסטים לקולטן זה, המשמשים לטיפול ביתר לחץ-דם ריאתי כולל ambrisentan (שם מותג Leitairis).
מחקרים משנות ה-90 על ידי שימוש באנטגוניסטים של קולטנים לאנדותלין, הפיק מידע נרחב על תפקיד ET-1 וקולטניו בוויסות של תפקודים ביולוגיים וסקולאריים בעיקרם במחלות שונות, בחיות מעבדה ובאדם. ET-1 המייצג את ה-isoform הדומיננטי והרלוונטי ביותר מבין האנדותלינים, פועל באופן אנדוקריני אך גם פאראקריני, והשפעותיו מועילות אך גם מזיקות לעתים, כולל השפעות על התפתחות תאי הרכס העצבי (neural crest) והעברת אותות עצביים (Kedzierski ו-Yanagisawa ב- Ann Rev Pharmacol Toxicol משנת 2001, בה הגדירו את אנדותלין כ"חרב פיפיות").
במערכת הוסקולארית, ET-1 דרך הקולטן ETA, הוא בעל תפקיד בסיסי של כיווץ כלי-דם, ותרומתו היא להתפתחות מחלה וסקולארית כמו יתר לחץ-דם, וטרשת עורקים. אנדותלין תורם להתכווצויות הלב, לקצב הלב (כרונוטרופיה), אך גם להפרעות קצב, כמו גם ל-remodeling של שריר הלב לאחר אי-ספיקת לב גדושה בעקבות אוטם שריר הלב. בריאות, מערכת האנדותלין מווסתת את ה-bronchal tone, וכן את השגשוג של כלי הדם המזינים את הריאות (Uchida וחב' משנת 1988 ב-Eur J Pharmacol). אנדותלין מפקח כמו כן על הפרשת מים ונתרן ועל מאזן חומצה-בסיס בכליות בתנאים פיזיולוגיים, אך יכול להיות גם אחראי להופעת glomerulo-sclerosis כפי שסקר Kahan ב-2008 ב-Curr Hypertens Rep. במוח, מערכת האנדותלין קשורה למודולציה של המרכזים הקרדיו-נשימתיים, ושחרור הורמונים מוחיים. כמו כן, תורמת מערכת האנדותלין לוויסות התפתחותם של תאי-עצב סימפטתיים. בנוסף, אנדותלין משפיע על הפיזיולוגיה של מערכת החיסון בכבד, בשרירים, בעצמות, בעור, בבלוטת הערמונית וברקמה השומנית, במערכת הרבייה, ואף קשורה להומאוסטאזיס של גלוקוזה.
מערכת האנדותלין ביתר לחץ-דם בעורק הריאתי (pulmonary arterial hypertension, להלן PAH)
על פי הגדרת ה-WHO, יתר לחץ דם בעורק הריאתי, הוא מפגע עם הגברה הדרגתית של התנגודת של כלי הדם הריאתיים, המוליכים לכשל של חדר הלב הימני ולמוות. תוחלת החיים החציונית מעת האבחון של PAH ללא טיפול ממוקד היא 2.8 שנים (D'Alonzo וחב' ב-Ann Internal Med מ-1991). הפתוגניות של PAH כורכת מנגנונים המכילים אי-תפקוד של האנדותל בצירקולציה, המוביל לכיווץ כלי-דם ריאתיים, ותהליכי עיצוב מחדש (remoeling) וסקולארי. תאי האנדותל בריאה משפיעים על פעילות תאי שריר חלק על ידי יצירה של מרחיבי כלי-דם כגון NO ופרוסטציקלין, או על ידי יצירה של מכווצי כלי-דם כגון ET-1 ו-thromboxane A2. ב-PAH משתבש שיווי המשקל בין התהליכים מרחיבי כלי הדם לבין התהליכים מכווצי כלי הדם, באופן שיש פחות יצירה של NO ופרוסטציקלין, ויצירה מוגברת של thromboxane A2.
אנדותלין ומערכת הנשימה
הריאות מייצגות יעד עיקרי להשפעות של אנדותלין, ובהן מתקיימים מסלולים מטבוליים של פפטיד זה. מעבר לנוכחות ET-1 באנדותל כלי הדם בריאות, ניתן למצוא שפע אנדותלין ואת הקולטנים שלו באפיתל של דרכי הנשימה (alveoli). קולטני ETA מופיעים בעיקר בעורקים הגדולים של מערכת הנשימה, ואילו קולטני ETB מופיעים בתאי שריר חלק של דרכי האוויר, בדופן של בועיות האוויר, והקפילרות. מחקר של Matsumoto וחב' שהופיע בשנת 1989 ב-Biochem Biophys Res Commun, מצא שהריכוז הגבוה ביותר של ET-1 נמצא דווקא בריאות של חולדות בריאות, כאשר ריכוז mRNA של ET-1 גבוה בריאות פי-5 מאשר בכל איבר אחר שנבדק.
נמצא שבריאות אדם דווקא קולטני ETB נמצאים בעודף על קולטני ETA ביחס של 10 ל-1, וסבורים ש-ETB חיוני בריאות לקליטה ופינוי של ET-1 מהצירקולציה הריאתית. החיוניות של פינוי ET-1 מן הריאות מובנת אם לוקחים בחשבון את השפעתו הניכרת של אנדותלין זה על הטונוס של דרכי האוויר. על פי Dupuis ו-Stewart במחקר משנת 1996 שהופיע ב-Circulation, ה-ET-1 המפונה מהריאות עובר בחלקו לצירקולציה. ידוע שהזרקת ET-1 לווריד, מגבירה מאוד את התנגודת של דרכי הנשימה, שכן פפטיד זה מכווץ יעיל של דרכי האוויר, מה שמרמז למעורבות של האנדותלין במפגעי ריאות המאופיינים על ידי היצרות דרכי האוויר כגון גנחת הסימפונות, יתר לחץ-דם ריאתי, או מחלות ריאה אינטרסטיציאליות. זאת בנוסף להשפעה המזיקה של ET-1 בהגברת תהליכי לייפת ריאתית בעיקר מחלות ריאה דלקתיות.
אנדותלין ומערכת הלב
ET-1 הוא האנדותלין השכיח ברקמת הלב, והוא מיוצר על ידי מיוציטים. תאי אנדותל ופיברובלסטים של רקמת הלב. קולטנים מסוג ETA מבוטאים על פני מיוציטים, וחלקם מופיעים של פני תאי שריר חלק בדופן העורקים הכליליים. בבני אדם עם אי-ספיקת לב רמות ET-1 מוגברות בפלזמה (Stewart וחב' ב-Circulation ב-1992), והן מוגברות מאוד בתרחישי הלם קרדיוגני (Cernacek ו-Stewart ב-Biochem Biophys Res Commun מ-1989), ויכולות לשמש כמדד פרוגנוסטי להערכה של תמותה במהלך השנה הראשונה לאחר AMI (על פי Omland וחב' ב-Circulation מ-1994.
ההשפעה של ET-1 על השגשוג של קרדיו-מיוציטים תורם על פי Ponicke וחב' במחקרם שהופיע ב-Br J Pharmacol ב-1997, להתפתחות של היפרטרופיה של החדר השמאלי. גם תרומת ET-1 להופעת היפוקסיה עלולה לתרום להרחבת הלב החשובה בתרחיש של איסכמיה כרונית. הקולטנים מסוג ETA, האנזים ECEוהגן ל-prepro-endothelin עוברים upregulation בכשל לב בבני-אדם ובחולדות (Sakai וחב' משנת 1996 ב-Circulation), ו-Ponicke וחב' באותו כתב עת ב-1998. כן דווח ש-ET-1 תורם להפרעה בתפקוד החדרים (Onishi וחב' משנת 1999 ב-J Pharmacol Exp Ther), וניתן היה לשפר את ההישרדות לטווח ארוך באלה עם אי-ספיקת לב על ידי עיכוב פעולת האנדותלין בשריר הלב (Sakai וחב' ב-Nature מ-1996).
במודלים בבעלי-חיים של אי-ספיקת לב כרונית, חסימה ממושכת של ET-1 שיפרה את ההמודינמיקה הלבבית, הפחיתה את הרחבת החדרים והאריכה הישרדותם (Borgeson וחב' מ-1998 ב-Hypertension ו-Zolk וחב' ב-Circulation ב-1999). חסימה ממושכת של הקולטן ETA על ידי תכשיר פומי, נתנה תוצאות של שיפור אי-ספיקת הלב בכלבים (Moe וחב' ב-Cardiovasc Res מ-1998). השפעות המודינמיות וקליניות משופרות הושגו בחסימת הקולטן ETA, תוך שימוש באנטגוניסטים בררניים ובלתי-בררניים, אם כי חסימה מקבילה של הקולטן ETB הגדילה משמעותית את רמת ET-1 בצירקולציה.
אנטגוניסטים של הקולטנים לאנדותלין מגבירים את שפיעת הדם בעורקי ההולכה (conduit arteries) לזרוע ואת המיקרוצירקולציה של העור (Wenzel וחב' ב-Hypetension ב-1994). המחקרים ההמודינמיים הראשונים על ידי חסימת הקולטן ETA באדם, נראו מבטיחים. במטופלים עם אי-ספיקת לב גדושה (CHF) חמורה, עירוי של האנטגוניסט הבלתי-בררני bosentan הגבירה את תפוקת הלב והפחיתה את התנגודת הסיסטמית והריאתית. ממצאים דומים הושגו גם עם BQ-123 ו-LU135252, האנטגוניסטים הבררניים של ETA. יחד עם זאת המחקר על השפעת bosentan על אי-ספיקת לב כרונית שנודע כמחקר REACH-1, הופסק טרם-עת כתוצאה מתופעות לוואי לכבד.
אנדותלין ומערכת הכליות
בסקירותיו של Kahan ב-Clin Exp Pharmacol Physiol משנת 1996 וב-Am J Kidney Dis משנת 1997, הוא הדגיש את הכליה כאיבר מטרה המגיב להשפעות ET-1, אך גם כאיבר המייצר פפטיד זה. ET-1 מיותר על ידי האנדותל הכלייתי, אך גם תאי אפיתל של הנפרון מייצרים ET-1 ו-ET-3. בכלי הדם ובאבוביות הכליה, מבוטאים גם הקולטנים ETA ו-ETB, כאשר ריכוזו של הראשון מביניהם גדול יותר בקורטקס כאשר ETB מרוכז יותר במדולה. בכליה התקינה, ה-ET-1 משתתף בוויסות זרימת הדם לכליה, משפיע על ספיגת אלקטרוליטים ומים באבוביות ומכאן השפעתו על מאזן חומצה-בסיס, וכן מעודד את צמיחתם של תאי המזנגיום העוטפים את נימי הגלומרולוס ומספקים לו תמיכה מבנית.
ET-1 מעודד כיווץ כלי-דם ושגשוג תאים בכלי הדם הכלייתיים. בהתאם, במודלים ניסויים בחולדות, חסימה כרונית של קולטני אנדותלין, מנעה פגיעה וסקולארית, הפחיתה את לחץ הדם (Barton וחב' ב-Hypertension משנת 1998, וכן ב-J Am Soc Nephrol משנת 2000, כמו גם Benigni וחב' מ-1996 ב-Am J Kidney Dis, ו-Kassab וחב' ב-Hypertension משנת 1998), וכן הפחיתה צורות אחרות של פגיעות בכליה (Benigni וחב' ב-Kidney Int מ-1993.
אנדותלין פונקציונלי בפגיעה כלייתית משנית ליתר לחץ דם
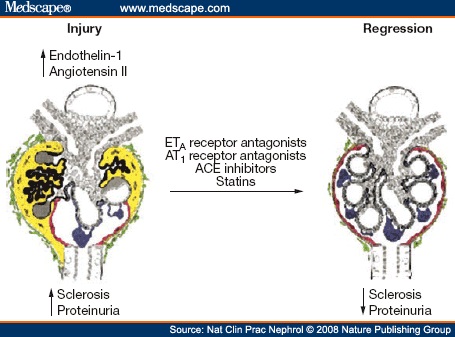
בהיותו חלבון מעודד-דלקת שמשרה התכווצות ניכרת של כלי הדם, עלתה ההשערה שאנדותלין הוא בעל תפקיד בהתפתחות הפגיעה הכלייתית המשנית ליתר לחץ-דם בלתי מאוזן. ההנחה היא שהתהליך מתחיל בחולים עם רמות מוגברות של ההורמון אנגיוטנסין-II, המכווץ אף הוא של כלי הדם. עלייה ברמת האנגיוטנסין-II כרוכה בעליה בהפרשת אנדותלין, שמעבר להשפעתו בכיווץ כלי הדם, הוא משרה נדידת תאי דלקת מסוג T והצטברותם שלהם בכליות. תהליך דלקתי כרוני זה מוליך במשך להצטלקות של רקמת הכליות והתפתחות אי ספיקת כליות.
יש חולים עם יתר לחץ-דם בהם מתפתחת פגיעה כלייתית משנית. בחולים אלו קיימת נטייה מוגברת לפתח תהליך דלקתי בכליות המוביל לנזק הכלייתי. במודל של עכברים, הוזרקו אלה עם אנגיוטנסין-II. הזרקה זו שהביאה להתפתחות של יתר לחץ דם, לעליה ברמות האנדותלין ולעליה בכמות תאי הדלקת בכליות של העכברים. טיפול בעכברים בתכשיר המעכב את האנדותלין, מנע את השפעת אנגיוטנסין-II שלא הובילה אצלם לעליה ברמת אנדותלין, וכמו כן נמנע תהליך דלקתי בכליות.
Hocher במחקר משנת 1997 ב-J Clin Invest מצא שעכברים טרנסגניים עם יצירה בעודף שלET-1 נוטים לפתח גלומרולו-סקלרוזיס, לייפת אינטרסיציאלית וציסטות כלייתיות, ולירידה בתפקוד בכלייתי, אך לחץ-דמם נשאר תקין. האטת התפקוד הכלייתי בעכברים אלה, הייתה תלויה בריכוז של ET-1 בכליותיהם. גם עכברי ניסוי בהם הוקטנה מסת הכליה כמודל למחלת כליה מתקדמת, ניתן היה על ידי טיפול באנטגוניסט של ETA הידוע כ-FR139317 לאחר 7 ימים מהשראת המפגע, להפחית את הפרוטאינוריה ואף להאריך את תוחלת החיים של העכברים המטופלים בהשוואה לקבוצת פלצבו.
שימוש ב-BQ-123 החוסם הבררני של הקולטן ETA, בחולדות בהם נחסם העורק הכלייתי להשראת איסכמיה, שיפר הן את ספיגת האלקטרוליטים באבוביות, וכן את ה-GFR, וממילא את תוחלת החיים של החולדות המטופלות. כיוון שמדכא מערכת החיסון דוגמת ציקלוספורין גורם להצרת עורק הכליה, במנגנון בו ציקלוספורין מגביר את הפרשת ET-1 על ידי תאי אנדותל הכליה, מצאו Benigni ו-Remuzzi שטיפול באנטגוניסט bosentan, הצליח לצמצם את נזקי ציקלוספורין, במחקר שפורסם ב-1999 ב-Lancet.
אנדותלין והמוח
בסקירתם המקיפה של Kedzierski ו-Yanagisawa ב-Annu Rev Pharmacol משנת 2001, מתואר הביטוי של אנדותלין בתאים של דופן כלי הדם, ב-choroid plexus כמו גם בנוירונים ותאי גליה במוח. ייצור מקומי של אנדותלין בתוך רקמת המוח, מתחייב מהעובדה שפפטיד זה אינו חודר למוח מהצירקולציה כתוצאה ממחסום דם מוח (BBB). באיבר זה מוצאים בעיקר ET-1 ו-ET-3 כאשר האחרון הנקשר לקולטני ETB משחק כנראה תפקיד בשלבי הדיפרנציאציה של תאי העצב. יש המייחסים לקולטני אנדותלין במוח תפקיד בהעברת גירויים של נוירוטרנסמיטורים.
על פי Schinelli בסקירה ב-Curr Med Chem משנת 2006, שינויים בהתבטאות של אנדותלין באסטרוציטים מופיעים במצבים פתולוגיים רבים במוח אדם, כמו תרחישי אוטם, לקונות מוחיות, מצבי טראומה, מחלת אלצהיימר ומחלות דלקתיות המוח. ידוע ש ET-1 בעל פוטנציאל חזק של עורקים במוח, ובמצבים של דמם תת-עכבישי (SAH) מתגברת ההשפעה המכווצת הזו (Roux וחב' ב-J Mol Med מ-1999). אותם חוקרים מצאו שבעקבות דמם מוחי, ובמיוחד באלה עם עווית כלי-דם מוחיים (vasospasms) נמדדת עליה בולטת ברמות ET-1 במוח. בתרחיש האחרון צפוי לכאורה שטיפול באנטגוניסטים של ET-1, ירחיב את כלי הדם המוחיים ויפחית את הנזק הפוטנציאלי. כאשר ET-1 הוחדר בכמות של פיקומולר ישירות למוחן של חולדות במודל ניסויי של שבץ, גרם אנדותלין זה לגירוי מטבולי חמור, להפחתת הזרימה של דם לאזורי המוח המוזרקים ולפרכוסים, כאשר השפעות אלה מתווכות על ידי תעלות סידן.
אנדותלין ויתר לחץ-דם
בשנת 1993 התייחסו Luscher וחב' בסקירה בכתב העת Hypertension לסוגיה האם ET-1 קשור לתהליך היווצרות יתר לחץ-דם עצמוני, שהרי אין מוצאים בדרך כלל רמות מוגברות של אנדותלין זה בפלזמה של חולים אלה. אולם, אם נלקח בחשבון ש-ET-1 מופרש מתאי אנדותל בדרכו לתאי שריר חלק בדופן כלי הדם, אין לכאורה לתמוה על כך שלא נמצא רמה מוגברת של ET-1 בפלזמת הדם. יחד עם זאת, במטופלים עם שאת מסוג hemangioendothelioma, הגורמת ליתר לחץ-דם, כאשר נכרת גידול זה המפריש ET-1, נמדדה נסיגה ברמת הפפטיד והפחתה ניכרת בלחץ הדם על ידי Yokokawa וחב' (Ann Intern Med, 1991). ואמנם, בשנת 1993 דיווחו Lariviere וחב' ב-Hypertension, שהשריית יתר לחץ-דם בעכברים על ידי מתן deoxycorticosteron acetate הביאה לעליה בולטת ברמת ET-1 בדופן כלי הדם.
עם פיתוח התכשירים חוסמי הקולטנים השונים לאנדותלין, התאפשר להוכיח שאמנם טיפול באחדים מתכשירים אלה, הפחית משמעותית את לחץ הדם בחיות מעבדה ובאדם. Krum וחב' במאמר מכונן משנת 1998 ב-N Eng J Med, הדגימו שמתן bosentan (החוסם ETA ו-ETB) לחולים עם יתר לחץ-דם ראשוני במינון של 100 עד 1,000 מיליגרם פעם או פעמיים ביום לתקופה של חודש הפחית את לחצי הדם הסיסטולי והדיאסטולי ב-6 מ"מ כספית, אם כי נרשמה עלייה ברמת אנזימי הכבד. בחולדות עם יתר לחץ-דם מושרה או תורשתי טיפול ב-bosentan הביא להפחתה בלחץ הדם וכמו כן גרם להפחתת שגשוג תאי שריר חלק, ירידה בהיפרטרופיה של חדר הלב הימני והצרת עובי הדופן (Roux וחב' מ-1999 ב-J Mol Med). ב-2002 פרסמו Rubin וחב' ב-N Eng J Med, שחולים עם יתר לחץ-דם ראשוני שטופלו ב-bosentan משך 4 שבועות במינון של 125 מיליגרם ליום, ולאחריו המשך טיפול של 12 שבועות עם הגדלת המינון ל-125-250 מיליגרם פעמיים ביום, חשו שיפור בחומרת המחלה, בהפחתת תופעות של נשמת (dyspnea), ובשיפור כושר הצעידה.
חוסמי הקולטנים של אנדותלין ומשמעותם בטיפולים קליניים
למרות שחברות פרמצבטיות נערכות לייצר תכשירים החוסמים את קולטני אנדותלין, עברו לפחות 10 שנים מתחילת המאמץ המחקרי הזה עד שהוא הגיע לשלב היישום הקליני. אך נראה היה שלפחות בניסויים הקליניים הראשונים לא הייתה בשורה משמעותית בחוסמי קולטנים אלה בתחום הטיפול באי-ספיקת לב מעבר למה שניתן להפיק מטיפולים סטנדרטיים.
כידוע ההשפעה המכווצת של ET-1 על העורקים הכליליים מביאה להפרעות קצב, לאי-ספיקת המיוקרד, להרחבת חדרי הלב ולאי-ספיקת לב. כפי שציינו Giannessi וחב' ב-Pharmacol Res משנת 2001, פעילותו המיטוגנית של ET-1 על תאי שריר הלב, תורמת להשפעתו הישירה של פפטיד זה ב-remodeling של שריר הלב במצבים של CHF. כיוון שרמות ET-1 מוגברות משמעותית בעקבות אוטם שריר לב, והם מוגברות אף יחסית לדרגת אי-ספיקת הלב, הייתה תחושה שחוסמי הקולטן לאנדותלין עשויים לסייע בהתנהלות עם תרחישי אי-ספיקה אלה.
באותו הקשר ראוי להזכיר את הפרסום של Herrmann וחב' משנת 2002 ב- J Am Coll Cardiol, שהשתמשו בגישה של מיקרו-CT להדגים שטיפול ממושך באנטגוניסטים של הקולטן לאנדותלין, מונע את הביטוי המוגבר של גורמי גדילה אנדותליאליים, בעורקים כליליים במערכת ניסיונית של היפר-כולסטרולמיה.
היה זה חלוץ הגילוי של אנדותלין, היפאני Yanagisawa, שדיווח בשנת 2001 ב-Ann Rev Pharmacol על כך שטיפול בחולדות לאחר אוטם שריר הלב כתוצאה מחסימה חלקית של העורק הכלילי הראשי, בעזרת התכשיר BQ-123 החוסם את הקולטן ETA (תוצרת חברת Banyu ביפאן), הפחית את לחץ הדם הריאתי, עיכב את ה-remodeling של שרירי הלב, והעלה את שיעור ההישרדות של חולדות אלו.
סוגי חוסמי קולטנים לאנדותלין
יש 3 קבוצות של תכשירים חוסמי הקולטנים לאנדותלין: כאלה שנקשרים לקולטן ETA, אלה הנקשרים דואלית לשני הקולטנים, ואלה הנקשרים באופן מועדף לקולטן ETB.
אנטגוניסטים בררניים לקולטן ETA כמו ambrisentan ,sitaxentan ,atrasentan ,zibotentan ,darusentan ו-BQ-123
התכשיר ambrisentan (שם מותג בארה"ב Letairis ובאירופה Volibris) הוא תכשיר המיועד לטיפול ביתר לחץ-דם ריאתי. בניסויים הקליניים הרב- מוסדיים ARIES-1 ו-ARIES-2, טיפול יומי אחד בנטילה פומית של 2.5 עד 10.0 מיליגרם, שיפר משמעותית את כושר הסבילות (צעידה למשך 6 דקות). ה-FDA אישר שימוש ב-ambrisentan ביוני 2007 במקרים של PAH, ובאפריל 2008 קיבל תכשיר זה את אישור הרשות האירופית (EMA).
Zibotentan הוא תכשיר פומי (שם קוד ZD4054 של חברת AstraZeneca) הנקשר בררנית לקולטן ETA ואמור לעכב תהליכים תלויי-אנדותלין המעודדים שגשוג תאי סרטן. בספטמבר 2010 הודיעה החברה המפתחת על כישלון תכשיר זה בניסוי phase III בחולי סרטן הערמונית.
Atrasentan היא תרופה נסיונית שנוסתה לטיפול במספר סוגי סרטן כולל NSCLC, אך גם נחקרת בהקשר של מחלת כלית סוכרתית. תכשיר זה נכשל בניסויי phase III של טיפל בסרטן הערמונית. נמצא ש-atrasentan חוסם את שגשוג התאים המושרה על ידי האנדותל. בשנת 2000 היה זה ההולנדי Rabelink שדיווח על פעילות תכשיר זה בהפחתת פרוטאינוריה ב-10 חולי סוכרת type 1, שטופלו משך 12 שבועות. בנוסף נמצא שלתכשיר יש פעילות של הפחתת לחץ-דם בקבוצת מטופלים זו. חברת Abbott החלה לבחון ממצאים אלה בשנת 2010.
באפריל 2014 de Zeeuw וחב' דיווחו ב-J Am Soc Nephrol על ניסוי רב-לאומי עם atrasentan בו השתתפו 211 חולים עם סוכרת type 2, עם ריכוזי אלבומין בשתן בתחום של 300-3,500 מיליגרם אלבומין לגרם קראטינין, ו-GFR של 30-75 מ"ל לדקה ל-1.73 מטר מרובע. משתתפי הניסוי חולקו באקראי ל-3 קבוצות: 78 איש טופלו בתכשיר במינון יומי של 0.75 מיליגרם; 83 איש טופלו במינון יומי של 1.25 מיליגרם; 50 טופלו בפלצבו. הטיפולים נמשכו 12 שבועות. בהשוואה עם מטופלי פלצבו, המינונים של 0.75 ו-1.25 מיליגרם הפחיתו את רמת האלבומין בשתן ב-35% וב-38%, בהתאמה.
בשני המינונים לא ניכר שיפור ב-GFR או בלחץ הדם בבדיקה נקודתית, אך לחצי דם סיסטולי ודיאסטולי למשך 24 שעות פחתו, כמו גם רמת כולסטרול-LDL וטריגליצרידים, בשני המינונים. תופעת לוואי משמעותית של atrasentan היא עליה במשקל וירידה בהמוגלובין. לכן יותר מטופלים במינון יומי של 1.25 מיליגרם פרשו מהניסוי במהלכו, מסיבת העלייה במשקל.
Sitaxentan שווק על ידי Pfizer תחת הקוד TBC-11251, ונועד לטיפול ביתר לחץ-דם ריאתי, אך בדצמבר 2010 הוסר תכשיר זה מעל המדפים על ידי Pfizer לאחר ממצאים מדאיגים של פגיעה בכבד. Sitaxentan היא מולקולה קטנה ממשפחת הסולפונאמידים, החוסמת את קולטן ETA, בזיקה הגדולה פי-6,000 בהשוואה לזיקה שלה ל-ETB. החיסרון לכאורה של sitaxentan על החוסם הבלתי-בררני bosentan, הוא בעיכוב הקל של ההשפעות המועילות של גירוי ETB כגון יצירת NO ופינוי ET-1 מהצירקולציה.
בשנת 1992 פרסמו Ishikawa וחב' ב-J Med Chem, על BQ-123 שהוא פפטיד מעגלי המכיל 5 חומצות אמינו ברצף של D-tryptaine-D-Asp-L-Pro-D-Val-L-Leu, בעל בררנות גבוהה לקולטן ETA. תכשיר זה מיוצר על ידי חברת Banyu והוא ניתן בעירוי לווריד.
תכשיר נוסף עם בררנות לקולטן ETA הוא darusentan שיוצר במקור על ידי חברת Knoll הגרמנית תחת הקוד LU 135252. בשלב מאוחר יותר עברו זכויות הייצור של darusentan לחברת Gilead וקוד התכשיר הומר ל-HMR-4005. התרופה יוצרה במקור לטיפול ביתר לחץ-דם עמיד (resistant hypertension) או בלתי נשלט.
למרות שחסימת אנדותלין נחקרה מאז סוף שנות ה-90 כאמצעי להתמודדות עם יתר לחץ-דם, לא בוצעו ניסויים קליניים בתרחישים של יתר לחץ-דם עמיד. Weber וחב' פרסמו בשנת 2009 ב-Lancet תוצאות מבטיחות של ניסוי ב-phase II של שימוש בתכשיר זה במטופלים עם יתר לחץ-דם עמיד, וחברת Gilead עצמה פרסמה חוזר בסוף שנת 2009 בו נמסר שתכשיר זה בניסוי Phase III הידוע כ-DAR-312/DORADO-AC, נמצא עדיף בהפחתת לחצי דם סיסטולי ודיאסטולי בישיבה בהשוואה לתרופה נוגדת לחץ-דם כגון guanfacine. על פי דיווח זה, במינון גבוה טיפול ב-darusentan הפחית ב-60% הפרשת אלבומין במטופלים עם מחלת כליות.
בניסוי DAR-312/DORADO-AC, השתתפו 849 מטופלים שקיבלו אחת ליום את התכשיר במינון של 50 עד 300 מיליגרם, לעומת guanfacine בטיפול אחד ליום מינון של 1 מיליגרם, או מטופלי פלצבו. למרות הודעות אופטימיות מוקדמות, הודיעה ב-16 בדצמבר 2009 חברת Gilead על הפסקת שיווק התרופה בעיקר בגלל תופעות לוואי כמו בצקת.
אנטגוניסטים בעלי בררנות דואלית, הנקשרים לקולטנים מסוג ETA ו-ETB
בקבוצה זו נכללים bosentan תוצרת Actelion/Roche עם הקוד Ro 46-2005, ומאותן חברות גם tezosentan (קוד Ro 61-0612). תכשירים נוספים עם בררנות דואלית ל-2 הקולטנים הם macitentan ו-enrasentan.
בשנת 2001 היה זה bosentan (שם מותג Tracleer), התכשיר הפומי הפעיל הראשון הפועל כאנטגוניסט של 2 הקולטנים לאנדותלין, ETA ו-ETB, שקיבל אישור מה-FDA לטיפול בסובלים מיתר לחץ-דם עורקי-ריאתי ראשוני (PAH), תוך התבססות על ממצאי המחקר של Davenport שהתפרסם ב-2002 ב-Pharmacol Rev, שהצביעו על שיפור במצב הקליני ובהישרדות. מאז אנגוניסטים נוספים של הקולטן לאנדותלין הפכו זמינים לטיפול יתר לחץ-דם ריאתי כולל ambrisentan (שם מותג Letairis).
בתנאים נורמאליים קישור ET-1 לשני הקולטנים (אם כי קישורו ל-ETA בולט יותר מקישורו ל-ETB) גורם לכווץ כלי הדם בריאה. על ידי חסימת קישור זה, bosentan מפחית את התנגודת הוסקולארית של הריאות. בגין ההשפעה הרעלנית על הכבד, דורש ה-FDA לבצע אחת לחודש בדיקות מעבדה לתפקודי כבד בעת טיפול ב-bosentan. כמון כן בגלל השפעה אפשרית לגרימת אנמיה נדרש ניטור על ידי המטוקריט. כן מומלץ לנשים הנוטלות אמצעי מניעה הורמונאליים להימנע מטיפול ב-bosentan בגל האינטראקציה בין התרופה לאסטרוגנים. נאסר על נשים הרות לצרוך bosentan בגלל תכונות טרטוגניות של התכשיר.
Tezoseantan פועל כמרחיב כלי-דם ונועד לטיפול בסובלים מאי ספיקת לב חריפה. נמצא שתכשיר זה או משפר מצבי נשמת (dyspnea) ואינו מפחית את הסיכון לאירועים קרדיו-וסקולאריים קטלניים או לא-קטלניים.
תכשיר נוסף macitentan (שם מותג Opsumit) הוא תכשיר פומי שקיבל באוקטובר 2013 את אישור ה-FDA לטיפול ביתר לחץ-דם ריאתי (PAH). התכשיר macitentan בעל בררנות דואלית ופועל על שני הקולטנים ETA ו-ETB, אם כי הזיקה שלו ל-ETA גדולה פי-50 מזו של הקישור ל-ETB. תכשיר זה חוסם את השפעת ET-1 בהעלאת רמת הסידן התוך-תאי. חסימת הקולטן ETA נראית חשובה יותר בטיפול ב-PAH מאשר חסימת הקולטן ETB, זאת כיוון שישנם הרבה יותר קולטנים מסוג ETA בהשוואה ל-ETB על פני תא שריר חלק בריאות. יתרון של macitentan הוא בכך שתקופת מחצית החיים של הקשר שלו עם הקולטן הוא בערך 17 דקות, כאשר לשם השוואה תקופת מחצית החיים של הקשר של bosentan עם קולטניו היא בערך 70 שניות, ובמקרה של ambrisentan מדובר בתקופת מחצית חיים של הקשר העומדת על 40 שניות.
התכשיר enrasentan הוא אנטגוניסט בעל השפעה דואלית על 2 הקולטנים ETA ו-ETB, עם זיקה חזקה יותר ל-ETA. על פי Cosenzi בסקירה משנת 2003 ב-Cardiovasc Drug Rev, במודלים בחיות מעבדה, בהן השרו יתר לחץ-דם והיפרטרופיה של חדרי הלב, תכשיר זה הפחית את לחץ הדם, מנע את ההיפטרופיה ושימר את תפקוד שריר הלב. בחולדות עם היפר-אינסולינמיה ויתר לחץ-דם, מתן enrasentan הביא לנרמול לחץ הדם ומנע נזק לבבי וכלייתי. בחולדות עם שבץ-מוחי, תכשיר זה הפחית את נפח המוח שסבל מאיסכמיה. בשלב מסוים הוספה תרופה זו לתפריט הטיפול הקונבנציונאלי בסובלים מכשל לבבי (NYHA Class 2-3).
אנטגוניסטים הנקשרים לקולטן ETB
בשנת 2002 פרסמו Okada ו-Nishikibe לראשונה על אנטגוניסט חדש מסוגו לקולטני אנדותלין, תחת השם BQ-788, הספציפי לקולטן ETB. בניסויי in vitro תכשיר זה עיכב באופן יעיל ותחרותי את הקישור של ET-1 מסומן ביוד רדיואקטיבי לקולטני ETB בתאי לב אדם, אך חסם רק באופן חלש פי-26.0את קישור של ET-1 לקולטני ETA על פני תאי נוירובלסטומה של אדם. בנוסף, BQ-788 עיכב גם מספר פעילויות ביולוגיות של ET-1 כגון כיווץ דרכי אוויר, שגשוג תאים, ואת הפינוי של ET-1 שהוזלף לגוף. בניסויים in vivo בחולדות בהכרה מלאה, עירוי לווריד של BQ-788 עיכב לחלוטין פעילות של ET-1 במינון פרמקולוגי או אף של ארס נחש (sarafotoxin) ברמה של הקולטן ETB.
יתרה מכך, BQ-788 הגדיל באופן בולט את רמות ET-1 בפלזמה, מה שמקובל כמדד של החסימה הפוטנציאלית של הקולטן ETB. בחולדות DHS או Dahl Salt-senstive Hypertensive rats, עירוי של BQ-788 הגדיל את לחץ הדם בערך ב-20 מ"מ כספית. בנוסף. דווח ש-BQ-788 עיכב גם את כיווץ דרכי האוויר המושרה על ידי ET-1, וכן את שגשוגם של תאי סרטן. אנטגוניסט אחר עם שם הקוד A-192621 יכול לשמש להדגמה של מעורבות הקולטן ETB בהיפרטרופיה של קרדיו-מיוציטים הנגרמת על ידי ET-1. תכשיר התפרסם לראשונה בשנת 2001 על ידי Cullen וחב' ב-Eur J Pharmacol.
מעכבי האנזים ECE או endothelin converting enzyme בגישה טיפולית
במקביל לגישה של שימוש באנטגוניסטים המונעים קישור אנדותלין לקולטניו, התפתחה הגישה המשתמשת במעכבים של אנזימים החיוניים לביקוע של prepro-endothelin או של big-ET-1 ליצירת הפפטיד הפונקציונלי. בסקירה של De Lombart משנת 2000 ב-J Med Chem מתוארים מעכבים של ECE-1 כגון neutral endopeptidase 24.11 הידוע גם כ- NEP inhibitor או CGS 26303, וכן שני מעכבים נוספים, CGS 34043 ו-CGS 35066. גם Fujisawa מחברה פרמצבטית ב-Osaka דיווח על FR901533 כעל מעכב בררני יעיל של ECE. תכשיר אחר של חברת התרופות Solvay, שנמצא ב-2012 ב-phase II של הערכה קלינית, ידוע כ-dalgutril או גם SLV306, המעכב את פעילות האנזים ECE-1.
ערכי רמות אנדותלין בפלזמה במצבים קליניים שונים
בשגרת המעבדה הקלינית, ניתן למדוד רק את רמות ET-1, שרמותיו גבוהות בילדים (Yoshibayashi וחב' משנת 1991 ב-J cardiovasc Pharmacol 1991, ונמוכות יחסית במבוגרים עם ערכים של 1-2 פיקוגרם/מ"ל, אך עם הבדלים אתניים ניכרים (Evans וחב' מ-1990 ב-Am J Cardiol). רמות ET-1 מוגברת ברקמה וגם בפלזמה בתהליכי טרשת עורקים (Lerman וחב' משנת 1991 ב-N Eng J Med ו-Zeiher וחב' משנת 1995 ב-Circulation), באוטם שריר הלב (Stewart וחב' משנת 1991 ב-J Am Coll Cardiol), ביתר לחץ-דם ריאתי (Giaid וחב' משנת 1993 ב-N Eng J Med), באי-ספיקת לב (McMurray וחב' ב-Circulation מ-1992), ובאי-ספיקת כליות (Begnini וחב' ב-Exp Opin Ther Patents מ-1997.
הביטוי של ET-1 מוגבר גם לאחר נזק מכאני הנגרם מהתערבות אנגיופלסטית על ידי בלון (Wang וחב' ב-Circ Res מ-1996). ניתן היה להגביר את תופעת ה-restenosis על ידי עירוי ET-1 בזמן אמת של כפי שהראו Douglas ו-Ohlstein ב-1993 ב-J Cardiovasc Pharmacol. בהקשר זה נציין שחסימת הקולטן ל-ET-1 יעילה בהפחתת התהליך של יצירת neointima בדופן כלי הדם, לאחר אנגיופלסטיקה עם בלון, כפי שהודגם בחולדות ובחזירים על ידי Douglas וחב' ב-1995 ב-Cardiovasc Res ועל ידי McKeena וחב' ב-Circulation בשנת 1998.
לכן, במפגעים קרדיו-וסקולאריים רבים תימצא רמה מוגברת של ET-1. בתלות בתרחיש הספציפי, עליות אלה ברמת ET-1 יכולות לשקף סינתזה מוגברת של ET-1, או פינוי איטי יותר של פפטיד זה, או דרגות שונות של המטבוליזם של הפפטיד. במטופלים עם אנטגוניסטים בלתי-בררניים של ET, רמות ET-1 בפלזמה עולות (Sutsch וחב' ב-Circulation מ-1998), בגלל פינוי מופחת של ET-1 על ידי קולטני ETB בריאות (Fukuroda וחב' מ-1994 ב-Biochem Biophys Res Commun).
הוראות לביצוע הבדיקה
יש ליטול דם במבחנה כימית (פקק אדום או צהוב) או במבחנת ספירת-דם (EDTA פקק סגלגל)ולהפריד את הנסיוב או את הפלזמה בסרכוז במהירות האפשרית. הדגימות יציבות לתקופה של 7 ימים בקירור רגיל, או ל-6 חודשים בהקפאה. יש להימנע במידת האפשר מנטילת תרופות לטיפול ביתר לחץ-דם, קורטיקוסטרואידים או בתכשירים לטיפול בבעיות של ACTH.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - תחלואת לב וכלי-דם
- בדיקות מעבדה - בעיות לחץ-דם
- בדיקות מעבדה - תפקודי כליות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק