פפטיד דמוי הורמון פאראתירואידי - Parathyroid hormone-related protein
הופניתם מהדף PTHrP לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| פפטיד דמוי הורמון פאראתירואידי | |
|---|---|
| Parathyroid hormone-related protein | |
| שמות אחרים | PTHrP; PTH Related Peptide |
| מעבדה | אנדוקרינולוגיה בדם |
| תחום | גורם הורמונאלי מרכזי במטבוליזם של סידן בגוף |
| טווח ערכים תקין | פחות מ-2 פיקומול' למ"ל, או 14-27 פיקוגרם למ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
אבחון מטופלים החשודים לתרחיש של היפר-קלצמיה של ממאירות (HHM או humoral hypercalcemia of malignancy), או אבחון של מטופלים עם היפר-קלצמיה מסיבה לא ידועה). רמת PTHrP יכולה לשמש גם לניטור יעילות הטיפול האנטי-סרטני.
היבטים היסטוריים של גילוי וההתפתחות בהבנת תפקידיו הפיזיולוגיים של PTHrP
נראה בדיעבד שגילויו של PTHrP היה מקרי במידה מסוימת. פפטיד זה מיוצר על ידי מספר סוגי סרטן, תוך שהוא "מחקה" חלקית את פעולת ההורמון PTH, וגורם לסיבוכי היפרקלצמיה של ממאירויות שונות. בשנת 1941 היה זה Fuller Albright שפרסם ב-N Engl J Med פרשת מקרה של מטופל שלו עם קרצינומה גרורתית של הכליה בו נמצאה רמת סידן גבוהה במיוחד. Albright יצא מהנחה שגידולים מסוימים יכולים לגרום להיפרקלצמיה, על ידי שהם מפרישים PTH או גורמים דמויי-PTH. כמו אחדים מניבוייו הוכח Albright בדיעבד כצודק, לא לפני שחלפו כמה עשרות שנים, בהם הלך והתבהר המושג של "יצירה אקטופית של PTH" על ידי גידולים סרטניים כסיבה להיפרקלצמיה-לא-גרורתית (Omenn וחב' ב-Cancer משנת 1969, ו-Martin ו-Atkins ב-Assays Med Biochem משנת 1979). בשנות ה-70 החלו מתעוררות ספקות כאשר שיטות משופרות כ-RIA למדידתPTH הראו שתגובה חיסונית בגידולים סרטניים או בפלזמה של חולי סרטן כמעט לא הגיבה עםPTH אוטנטי (Melick וחב' ב-Br Med J משנת 1972, ו-Roof וחב' ב-Am J Med משנת 1971 , כמו גם Benson וחב' ב- J Clin Invest משנת 1972). בשנת 1973 הראו Powell וחב' ב-N Engl J Med שבמקרים מסוימים לא היה ניתן כלל לגלות immunoreactivity כנגד PTH. בנקודת זמן זו התפרסמו מספר מחקרים קליניים מעולים שאיששו ללא כל ספק את הקשר הביוכימי בין היפר-פאראתירואידיזם ראשוני לבין תסמונת ההיפרקלצמיה של ממאירות (humoral hypercalcemia of malignancy להלן HHM) על פי Stewart וחב' ב-N Engl J Med משנת 1980, ו-Kukreja וחב' ב-J Clin Endocrinol Metab משנת 1980. בניגוד ל-PTH המיוצר רק על ידי בלוטת הפאראתירואיד, PTHrP מיוצר במגוון רחב של רקמות נורמאליות ופתולוגיות, כולל רקמות עובריות.
בראשית שנות ה-80, עם פיתוח שיטות רגישות ומהירות למדידת PTH, התגלו בתמציות של גידולים סרטניים ממקור תאים אוסטאובלסטים או כליות אדם תגובות של adenylate cyclase דומות לאלה הנגרמות על ידי PTH, הכרוכות עם תופעת HHM (על פי Rodan וחב' ב-J Clin Invest משנת 1983, ו- Stewart וחב' ב-Proc Natl Acad Sci USA משנת 1983, כמו גם Strewler וחב' שהתייחסו לראשונה לפפטיד "חדש" שגרם ל-HHM בעכברי-nude עם גידול של human renal carcinoma, פפטיד שזוהה על ידי קולטנים של PTH. תצפיות אלו סללו את הדרך לניקוי של PTHrP משורת תאי סרטן ריאות מאדם (Moseley וחב' ב-Proc Natl Acad Sci USA משנת 1987), וכן לניקויPTHrP משורת תאי סרטן שד (Burtis וחב' משנת 1987 ב- J Biol Chem שהגדירו פפטיד חדש זה כבעל משקל מולקולארי של 17,000 דלטון שהוא בעל יכולת לעודד פעילות של adenylate cyclase בדומה ל-PTH בתאי סרטן שד הכרוכים ב-HHM), וכן לאׅפיוּן המבנה של PTHrP מתאי קרצינומה של הכליה באדם, וקביעת ההומולוגיה בינו לבין PTH.
השיבוט של cDNA שלPTHrP הראה ש-8 מתוך 13 השיירים הראשונים שלו היו זהים לאלה ב-PTH (Suva וחב' ב-Science משנת 1987, ו-Mangin וחב' ב-Proc Natl Acad Sci USA משנת 1988), וכן שהפעילות הביולוגית שלPTHrP הייתה תלויה ב-34 חומצות האמינו הראשונות שלו, בדומה למה שהיה ידוע לגבי PTH (Kemp וחב' ב-Science משנת 1987). ממצאים אלה הסבירו את הדמיון הביוכימי בין PTH ו-PTHrP, שכנראה נובעים מאותו גן קדמון . הגן של PTH, הוא בעל מבנה מורכב יותר מזה של הגן ל-PTHrP, אך עם גבולות דומים של ה-intron-exon, וכן הרצף של חומצות האמינו של PTHrP באדם, חולדה, עכבר, תרנגולת וכלב עד לעמדה 111 שמורים מאוד אבולוציונית, ונראה שכל התפקידים הפיזיולוגיים החשובים ממוקמים באזור זה.
מיד לאחר גילויו של PTHrP, התברר שפפטיד זה אינו סתם שריד אבולוציוני המחקה את פעילות PTH בסוגי סרטן לא גרורתיים, אלא שיש לו תפקידים עיקריים בהיבטים אחרים של סרטן, בהתפתחות ובעיקר בתפקודים פיזיולוגיים נורמאליים בשלבים מוקדמים שלאחר הלידה. בשלב מאוחר יותר עם גילוי הקולטן ל-PTHrP, נמצא שהוא יכול לשמש גם את PTH בפעילותו הביולוגית תוך הפעלה זהה של G-protein (על פי Jüppner וחב' ב-Science משנת 1991), ועל ידי שימוש בעכברי knockout בהם נחסר קולטן זה התבררה ביתר-שאת החשיבות של PTHrP, כאשר Lanske וחב' הדגימו ב-Endocrinology משנת 1998 שהקולטן ל-PTHrP שימש את שני הליגנדים PTH/PTHrP בפעילותם בשלבים המוקדמים של התפתחות העצם.
מקובל זמן רב ש-PTH ו-PTHrP נובעים מתהליך של gene duplication: הגן ל- PTH ממוקם באדם על כרומוזום 11, ואילו הגן ל- PTHrP ממוקם על כרומוזום 12. חשיבות הגן ל-PTHrP באה לביטוי בעובדה שהחלבון אותו הוא מקודד מראה דמיון ניכר בין מיני חיות שונים השונים פילוגנטית מהאדם: ה-PTH של דגי fugu הוא בעל זהות של 44% עם PTH מאדם, ואילו ה-PTHrP של דגים אלה הוא בעל זהות של 53% עם PTHrP מאדם (Danks וחב' ב-J Bone Miner Res משנת 1993). ברמת חומצות האמינו, ל-PTH של תרנגולת יש זהות של 88% עם PTH אנושי, ואילו ל-PTHrP של תרנגולת יש 91% זהות עם פפטיד זה באדם (Pinheiro וחב' ב- BMC Evol Biolמשנת 1990). כפי שכבר נאמר, 111 חומצות האמינו הראשונות, שמורות באופן מרשים ביותר בין מינים רבים. מעניין ש-PTHrP נראה כמשחק תפקיד פאראקריני בבעלי חוליות נמוכים יותר, והוא השתנה אבולוציונית לבעל פעילות אנדוקרינית חיונית בבעלי חוליות גבוהים יותר.
בדגים,PTH המיוצר בזימי הנשימה אחראי לוויסות רמות הסידן המקומי, בעוד שבמעבר האבולוציוני ל-tetrapods, בלוטת הפארא-תירואיד מקבלת תפקיד אנדוקריני כיוון שהדרישה לסידן השתנתה מהסביבה המימית לסביבה היבשתית (Okabe ו-Graham ב-Proc Natl Acad Sci USA משנת 2004). ל-PTHrP יש מבנה פשוט בבעלי חוליות ירודים, והוא רוכש בהדרגה מבנה מורכב יותר עם תוספת של אקסונים ופרומוטרים חלופיים עם ההתקדמות האבולוציונית לאדם, תוך שהוא לוקח על עצמו פעילות עם דגש פאראקריני מובהק יותר (Liu וחב' ב-J Bone Miner Res משנת 1990).
בסיס פיזיולוגי
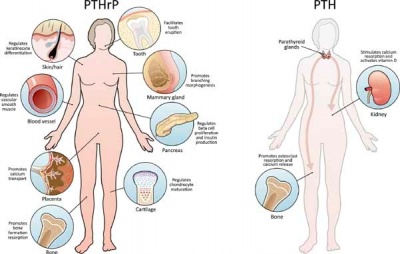
PTHrP הוא חלבון חבר במשפחת ההורמון PTH. הוא מופרש על ידי תאים סרטניים אך יש לו גם תפקידים בפיזיולוגיה התקינה של גוף האדם. PTHrP בא לביטוי באתרים רבים בגוף, ויש לו פעילות אנדוקרינית, פאראקרינית ואינטרה-קרינית, ובכך הוא משפיע על מגוון של תרחישים פיזיולוגיים ופתולוגיים, בנוסף לתפקידיו בבניית איברים (Wysolmerski ב-J Clin Endocrinol Metabol משנת 2012, ו-McCauley ו-Marin ב-J Bone Miner Res משנת 2012).
PTHrP הוא פפטיד מונומרי הקיים במספר איזופורמים, שגודלם נע בין 60 חומצות אמינו ועד 173 חומצות אמינו, הנוצרים על ידי תהליך splicing דיפרנציאלי, ומעורבות של האנזים prohormone convertase. החלבון PTHrP מיוצר בריכוזים נמוכים על ידי כל רקמות הגוף. תפקידיו הפיזיולוגיים אינם ברורים באופן מוחלט, וניתן לחלקם לארבע קטגוריות, שלא כולן באות לביטוי על ידי כל אחד מהאיזופורמים ולבטח לא כולם באים לביטוי בכל הרקמות: א. טרנספורט של סידן משני צידי האפיתל בעיקר בכליות וברקמת השד; ב. הרפיה של שריר חלק ברחם, בשלפוחית השתן, במערכת העיכול, ובדופן העורקים; ג. וויסות של שגשוג תאים; ד. התמיינות (דיפרנציאציה) של תאים ואפופטוזיס במגוון רקמות. כיוון ש-PTHrP הוא מרכיב חיוני של הריון תקין והתפתחות עוברית, חסר או פגם של חלבון זה קטלני בעוברי יונקים.
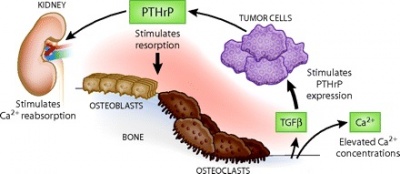
עניין רב ומחקר רחב ממדים מתחילת שנות ה-90, הם תולדה של הממצאים על היות PTHrP מיוצר באופן נורמאלי ברקמות רבות בהן הוא פועל באופן פאראקריני. ישנם רק שלושה מצבים, בהם PTHrP מופיע בצירקולציה ופועל באופן אנדוקריני: א) התסמונת ההיפרקצמית של ממאירות (HHM) בה מיוצר PTHrP על ידי השאתות ונודד דרך הדם לרקמת העצם וגורם לספיגת עצם (Burtis וחב' ב-J Clin Endocrinol Metabol משנת 1992, ו-Grill וחב' באותו כתב עת משנת 1991); ב) תהליך ההנקה (lactation) בו PTHrP נוצר בבלוטות החלב בשד ומגיע לצירקולציה (Grill וחב' ב-Clin Endocrinol משנת 1992); ג) החיים העובריים, בהם PTHrP מווסת את הטרנספורט של סידן מהאם לעובר דרך השליה (Kovacs וחב' ב-Proc Natl Acad Sci USA משנת 1996).
PTHrP זוהה כגורם להיפרקלצמיה של מצבי ממאירות בשנת 1987, על ידי Martin וחב' במלבורן על ידי שבודדו אותו משורת תאים של סרטן ריאה באדם (Proc Natl Acad Sci USA משנת 1987). באותה עת זיהו Rodan וחב' (J Clin Invest משנת 1983) חלבון זה המופרש מתאים אוסטאובלסטים, וכן זיהו Burtis וחב' (J Biol Chem משנת 1987) תאים שמקורם בסרטן שד חלבון שמשקלו המולקולארי 17,000 דלטון בעל פעילות מעודדת את האנזים adenylate cyclase), ואילו Strewler וחב' משנת 1987 ב-J Clin Invest, בודדו משורת תאים של סרטן כליה את החלבון שבדיעבד זוהה כ-PTHrP. לאחר מכן הראו Miao וחב' על ידי פגיעה בעכברים בגן המקודד ל-PTHrP שהדבר קטלני בעכברים אלה על ידי פגיעה במערכת העצמות, על ידי מניעת צמיחת העצם הטרבקולארית (Endocrinology משנת 2004).
ממצא אחרון זה הצביע על החשיבות הפיזיולוגית הניכרת של PTHrP. בשנים שחלפו מאז נמצא ש-PTHrP ו-PTH מקודדים על ידי גנים הקשורים זה לזה המהווים חלק ממשפחת גדולה יותר של ה-PTH gene. הקשר האבולוציוני הזה, מאפשר ל-חלבונים אלה להיקשר לאותו קולטן הידוע כ-type 1 PTH/PTHrP Receptor, מה שמסביר מדוע היפרקלצמיה של הממאירות דומה לזו הופיעה בהיפר-פארא-תירואידיזם. במקור, היו סבורים ש-PTHrP קשור בעיקר בתסמונת פארא-נאופלסטית, אך כיום כבר ברור ש-PTHrP קשור לתרחישים של אוסטאופורוזיס, אוסטאו-ארתריטיס, וסרטן השד, ואף נמצא ש-PTHrPעצמו עשוי לשמש כתרפיה של אוסטאופורוזיס וסוכרת.
כיום קיימת כבר ההכרה בדבר הפיזור הרחב של PTHrP ברקמות נרחבות בגוף, ולפעילויות האנדוקרינית, הפאראקרינית והאינטרה-קרינית, המניעות מספר תרחישים פיזיולוגיים ופתולוגיים, וכן בדבר תפקידו המרכזי ב-organogenesis. במחקר חלוצי קלאסי של מטופל עם קרצינומה של הכליות והיפרקלצמיה משנת 1941 ב-N Eng J Med, העלה Fuller Albright את ההשערה שמספר גידולים סרטניים יכולים לגרום להיפרקלצמיה, על ידי הפרשה של PTH או של "חלבון מאוד דומה ל-PTH". אכן בתרחיש של "היפרקלצמיה של ממאירות" יש ל-PTHrP פעילות דומה לזו של PTH, וכאשר שאת סרטנית מפרישה PTHrP הדבר גורם ישירות להיפרקלצמיה (Broadus וחב' ב-N Eng J Med משנת 1988). כיוון שהיפרקלצמיה הנגרמת על ישי PTHrP היא לעתים הסימן המוקדם של ממאירות, היא נחשבת כתופעה פארא-נאופלסטית.
הסינתזה והמבנה של PTHrP
PTHrP של אדם מקודד על ידי גן בודד (PTHLH) הנמצא על הזרוע הקצרה של כרומוזום 12 (עפ"י Strewler וחב' ב-J Clin Invest משנת 1987, ו-Suvaוחב' ב-Science משנת 1987). על ידי splicing חלופי, נוצר מגוון של סוגי mRNA, המקודדים ל-3 איזופורמים של PTHrP בעלי 139, 141 ו-173 חומצות אמינו. כבר מהתחלת המחקר הייתה הכרה שהגנים PTHLH ו-PTH קשורים זה לזה, כאשר ה-exon/intron של המקטע ב-2 גנים אלה המקודד לרצפי pre-pro שלהם, והחלק ההתחלתי של 2 הפפטידים הבשלים זהה לחלוטין. יתרה מכך, הקטעים של 2 הגנים המקודדים את הקצה ה-N טרמינאלי של PTH ו-PTHrP המופרשים לצירקולציה, הם בעלי הומולוגיה ניכרת, הבאה לביטוי בהיותם זהים ב-8 מתוך 13 חומצות האמינו (עפ"י Mangin וחב' ב-Proc Natl Acad Sci USA משנת 1988), וכן בהיותם בעלי מבנה שניוני דומה לאורך 21 חומצות האמינו הבאות.
ממצא אחר של Kemp וחב' שהופיע ב-Science בשנת 1987, היה שבדומה למה שידוע לגבי PTH גם במקרה של PTHrP כל פעילותו הביולוגית נכללת ב-34 חומצות האמינו בקצה ה-N טרמינאלי. רצפים הומולוגיים אלה, מאפשרים לשני הפפטידים להיקשר לאותו קולטן ולשפעל אותו, מה שעשוי להסביר מדוע PTHrP גורם להיפרקלצמיה של ממאירות. כל החברים במשפחת הגן PTH, הופיעו במקביל לאבולוציה של בעלי החוליות, כנראה כתוצאה מדופליקציה של גן קדמון בודד. בין כל חברי משפחת הגן PTH, הגן PTHLH הוא בעל המבנה הגנומי המורכב ביותר ואת השוֹנוּת הרבה ביותר בין מיני בעלי חיים שונים, מה שמשקף כנראה את המגוון הגדול של תפקודי PTHrP ברקמות השונות. אכן, המגוון הגדול של פעילויות פיזיולוגיות של PTHrP בא לביטוי בכך שהרכב חומצות האמינו של חלבון זה השתמר באופן בולט באדם, חולדה, עכבר, תרנגולת, ובכלב עד לחומצת אמינו 111. אפילו PTHrP של דג fugu הוא בעל הומולוגיה של 53% עם PTHrP של האדם.
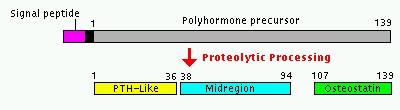
קודמן זה עובר ביקועים אנזימטיים נוספים, ליצירת פפטיד דמוי-PTH בעל 36 ח' אמינו, פפטיד נוסף החל בח' אמינו 38 עד 94, ופפטיד קרבוקסי-טרמינאלי בעל פעילות osteostatin, החל בח' אמינו 107 עד 139.
הפפטידים של PTHrP והקולטנים שלו
הפפטיד PTHrP 1-36 מופרש ממספר סוגי תאים כמו תאי לב, מוח, שריר השלד, שלפוחית השתן, צינורות המרה, מערכת החיסון, כבד, רחם ואשכים, כמו גם איברים אנדוקריניים הכוללים את בלוטת יותרת המוח ותאי C בבלוטת התריס (Orloff וחב' ב-Endocr Rev משנת 1994 ו-Ureña וחב' ב-Endocrinology משנת 1993), אך הצורות הארוכות יותר של הפפטידים בקצה האמיני של PTHrP, מופרשות גם מקרטינוציטים ומתאי אפיתל של בלוטות השד, במקרים של סרטן העור ובתקופת הנקה (Burtis וחב' ב-N Eng J Med משנת 1990, וכן Sowers וחב' ב-JAMA משנת 1996 ו-VanHouten וחב' ב-J Clin Invest משנת 2003).
ההפרשה של הפפטידים המוגדרים כ-midregion כולל חומצות אמינו 38-94, 39-95 ו-38-101 תוארה גם כן (Soifer וחב' ב-J Biol Chem משנת 1992), אם כי הביולוגיה של פפטידים האחרונים אינה ברורה, פרט לעובדה שה-mid-region של PTHrP מעודד טרנספורט של סידן בשִליָה וקשור למודולציה של ביקרבונאט בכליות. כמו כן, המקטעים ה-C טרמינאלים של PTHrP המורכבים מחומצות אמינו 107-138 ו-109-138 תוארו ותפקידם הוא בעיכוב יצירת אוסטאוקלסטים ובעידוד השגשוג של אוסטאובלסטים (Philbrick וחב' ב-Physiol Rev משנת 1996).
בשנת 1991 התפרסם ב-Science מחקרם של Juppner וחב', בו תואר בידודו של הקולטן של PTHrP, כאשר מחקרים בעכברי knock out עם פגיעה בקולטן זה, הדגימו את החשיבות של PTHrP (עפ"י Lanske וחב' ב-Science משנת 1996) אותה קבוצת חוקרים אף הדגימה במאמר משנת 1998 ב-Endocrinology, שאותו קולטן יכול לשמש את 2 הליגנדים, PTH ו-PTHrP. כמעט 20 שנה חלפו עד לפרסום של Miao וחב' משנת 2005 ב-J Clin Invest בו הודגמה חשיבותו של PTHrP המופרש מאוסטאובלסטים, כגורם אנאבולי פוטנטי בכל הקשור ליצירת עצם.
PTHrP, יותר מאשר גורם אנדוקריני
העניין הרב סביב PTHrP התעורר לא מעט כיוון שהתברר שהוא מיוצר על ידי רקמות רבות, ופועל בסביבת רקמות אלה וברקמות עצמן באופן פאראקריני. יש רק שלושה מצבים שזוהו בהם PTHrP שנמצא בצירקולציה פועל באופן אנדוקריני:
- תסמונת HHM בה PTHrP המיוצר על ידי התאים הסרטניים נודד לעצם ומעודד ספיגתה ושחרור סידן לצירקולציה (Burtis וחב' ב-J Clin Endocrinol Metabol משנת 1992, ו-Grill וחב' באותו כתב עת משנת 1991);
- תהליך יצירת חלב האם-(לקטציה), בו PTHrP המיוצר בשד מופרש לצירקולציה (Grill וחב' ב-Clin Endocrinol משנת 1992);
- חיי העובר, כאשר PTHrP מווסת את הטרנספורט של סידן מהאם לעובר (Rodda וחב' ב-J Endocrinol משנת 1998, ו-Kovacs וחב' ב-Proc Natl Acad Sci USA משנת 1996).
עד היום לא נמצאו רמות של PTHrP שניתנות למדידה בפלזמה בבני אדם בריאים, ונראה אם כן שרוב הפעילות של PTHrP היא פאראקרינית שלא בדומה ל-PTH. יש שלושה איזופורמים שהם splice-variant של PTHrP והם: PTHrP 1-139, וכן PTHrP 1-173 ו-PTHrP 1-141, שהשעתוק שלהם נעשה על ידי שלושה פרומוטרים נפרדים (Richard וחב' ב-Clin Chem משנת 2003).
הפעילות התוך גרעינית של PTHrP ופעילותו כ-intracrine factor
תצפית מוקדמת מאוד מסקרנת הייתה שניתן למצוא את PTHrP בתוך גרעין/גרעינון תאים על ידי תהליך טרנספורט ספציפי, וכן שהפפטיד האמור מפעיל חלק מפעילותיו הפיזיולוגיות מתוך הגרעין. המיקום של PTHrP בגרעינון על ידי רצף מוגדר של חומצות אמינו בחלק המרכזי של הרצף המלא (mid-region) כרוך בהישרדות מוגברת של תאים כונדרוציטים בתנאים המעודדים דווקא מות תאים באפופטוזיס (Henderson ב-Mol Cell Biol משנת 1995, ו-Aarts וחב' ב-J Biol Chem משנת 2001).
בתוך הרצף של PTHrP ישנם motifs האחראיים למיקומו של חלבון זה בגרעין ובגרעינון התא (CcN) כאשר מנגנון החדירה של PTHrP לגרעין מתבצע על ידי אינטראקציה שלו עם importinβ ועם החלבון GTP-Ran (על פי Lam וחב' ב-J Biol Chem בשנת 1999, ו-Jans וחב' ב-Vitam Horm משנת 2003 וכן Cingolani וחב' ב-Mol Cell משנת 2002). ל-PTHrP יש גם רצף חומצות אמינו (87-107) המכוונן אותו בגרעין ומונע אפופטוזיס (De Miguel וחב' ב-Endocrinology משנת 2001, ו-Dougherty וחב' ב-Cancer Res משנת 1999). ל-PTHrP יש גם רצף חומצות אמינו (109-139) הקשור בהוצאת חלבון זה מהגרעין (Pache וחב' ב-Endocrinology משנת 2007). יש ראיות לכך ש-PTHrP נקשר ישירות ל-RNA דרך motif מוגדר ב-nucleolar-targeting signal (על פי Aarts וחב' ב-J Biol Chem משנת 1999), מה שמדגיש את יכולתו של PTHrP להשפיע מתוך גרעין התא.
פעילויות ביולוגיות אחרות הנקבעות על ידי מקטעים בתוך הרצף של PYHrP הודגמו ב-2 מחקרים בעכברים: במחקר עם עכברי knockout של הרצף 1-84, החסרים הן את ה-nuclear locacization sequence (או NLS) והן את אזור ה-C טרמינאל, אך שומרים על אזור ה-N טרמינאל הפעיל ביולוגית, דרגת אי הסדירויות הביא למות העכברים הללו בגיל צעיר (Miao וחב' ב-Proc Natl Acad Sci USA משנת 2008).עכברים הומוזיגוטים לפגם האחרון הראו פיגור בצמיחת השלד, וחסר שלדי (osteopenia), כמו גם אפופטוזיס מוגבר של אוסטאבלסטים, וכן הזדקנות מוקדמת. מחקר שני עם עכברי knockout של המקטע 1-66, השומט חלק משמעותי של ה-midregion של PTHrP, הביא אף הוא ללידת עכברים עם פנוטיפ פגום בהתפתחות השלד ובהמאטופויאזה, ופגע בהישרדות של עכברים אלה (Toribio וחב' ב-FASEB J nab משנת 2010). מחקרים גנטיים אלה בעכברים מראים שרבות מפעילויותיו של PTHrP אינן מתווכות על ידי הקצה ה-N טרמינאלי שלו, והפגיעה השלדית או ההמאטופויאטית נקבעת על ידי חסר ב-midregion, בקצה ה-C טרמינאלי וב-NLS.
בנוסף לפעילויות האנדוקריניות והפאראקריניות של PTHrP המופרש מרקמות שונות, יש ראיות מוצקות לכך שצורה מסוימת של PTHrP אינה מופרשת, ועל ידי הכוונתו של הורמון זה לגרעין תאים יש לו שם פעילות גרעינית כגון זו הקשורה למודולציה של אפופטוזיס בתאים אלה. בין היתר, שעתוק של הגן PTHLH יכול להשפיע עת מניעת ההפרשה של PTHrP אל מחוץ לתאים, והכוונתו לגרעין התאים (Fiaschi-Taesch וחב' ב-Endocrinology משנת 2003). תנועת PTHrP לתוך גרעין התא מושפעת מרצף של חומצות אמינו בין עמדות 84 ו-93 המשפיע על התנועה הדו-כיוונית של PTHrP אל תוך הגרעין, והחוצה ממנו (Roth וחב' ב-J Biol Chem משנת 2011). נראה שהזרחון של PTHrP בעמדה Thr85 על ידי cyclin-dependent kinase p34cdc2, משחקת תפקיד בהחדרת PTHrP לגרעין התא.
לא הרבה ידוע על הפעילות התוך-גרעינית של PTHrP. ידוע שהוא נקשר ל-RNA ובמספר תאים הוא ממוקם בגרעינון (nucleolus), מה שמרמז לכך ש-PTHrP קשור לוויסות התנועה של RNA, לדינאמיקה של ריבוזומים ואף לתרגום של חלבונים. בתאים בתרבית נמצא ש-PTHrP גרעיני, משפיע על שגשוג תאים, אך גם על אפופטוזיס, ולעתים הוא פועל לנטרול פעילותו של THrP המופרש מתאים. בתאי סרטן השד, המעי הגס והערמונית, נראה ש-PTHrP מעודד שגשוגם של תאים אלה, מגן עליהם מפני אפופטוזיס, ומעודד את כושר נדידתם, בה בשעה ש-PTHrP המופרש מתאים אלה, מעכב את שגשוג התאים הללו ומעודד בהם אפופטוזיס (Park וחב' ב-Endocr Related Cancer משנת 2012, ו-Shen וחב' ב-Exp Cell Res משנת 2004).
PTHrP גרעיני נמצא גם כמעודד את השגשוג של תאי שריר חלק וסקולאריים in vitro ו-in vivo על ידי השריית הביטוי של c-myc ושל skp2, שבתגובה מפחיתים את רמות מעכב מחזור חלוקת התא, p27. לעומת זאת ל-PTHrP המופרש מהתא יש השפעות מנוגדות.
תפקיד PTHrP במערכת העצם והשלד
החשיבות הפיזיולוגית של PTHrP במערכת השלד הייתה מוכרת מאז שהתברר שפגיעה ביצירת הורמון זה בעכברים מייד לאחר הלידה גרמה למותם כתוצאה מכשל נשימתי, מה שיוחס לפגם ביצירת קופסת הצלעות שלהם (Karaplis וחב' ב-Genes Dev משנת 1994). תרחיש זה מבליט את ההבדל בין PTHrP לבין PTH שפגיעה בגן שלו הייתה פחות דרמטית בעכברים יילודים (Miao וחב' ב-J Clin Invest משנת 2002). החשיבות של PTHrP בהתפתחות השלד מבחינת הפגמים ביצירתו הנגרמים בחסרים של הורמון זה chondrodysplasia ו-premature epiphyseal closure, הודגמה בעוברי עכברים על ידי Amizuka וחב' ב-J Cell Biol משנת 1994, העיקר לגבי יצירת סחוס אפיפיזיאלי בלתי תקין ושינויים ביצירת עצם אנדוכונדראלית.
נמצא שעכברי PTHrP(+/-) עם חסר חלקי של PTHrP, נורמאליים פנוטיפית בלידה, אך לאחר 3 חודשים הם בעלי מסת עצם נמוכה, עם ירידה בולטת בעובי העצם הטרבקולארית, ועלייה ניכרת במספר האדיפוציטים במח העצם (Amizuka וחב' ב-Dev Biol משנת 1996). חוקרים אלה מצאו שעכברים עם גנוטיפ PTHrP(+/-), לוקים בגיוס של precursors של מח העצם, וכן יש באוסטאובלסטים שלהם רמת אפופטוזיס גבוהה בהשוואה לעכברים תקינים. עכברים פגומים לגבי יצירת PTHrP נמצאו גם בעלי יצירה מופחתת של אוסטאוקלסטים.
במודלים של בעלי-חיים נמצא שביטוי-יתר או ביטוי-חסר של PTHrP, נקבע על ידי האופן בו מגיב הקצה ה-N טרמינאלי של ההורמון עם הקולטן PTRH1 על מנת לסנכרן את קצב ההתמיינות של הכונדרוציט, ולשמור על גידול סדיר של עצמות ארוכות (Kronenberg ב-Ann NY Acad Sci משנת 2006). פלטת הגדילה מורכבת מעמודות של כונדרוציטים מתחלקים ומתמיינים הגדלים בהדרגה לשלב של כונדרוציטים קדם-היפרטרופיים ולאחר מכן לכונדרוציטים היפרטרופיים. PTHrP מופרש בעיקר על ידי בונדרוציטים לא-בשלים בקצות העמודות המתוארות, בתגובה למולקולה אחרת הידועה כ-IHH או Indian hedgehog, המיוצרת על ידי כונדרוציטים היפרטופיים מתמיינים. בתגובה, PTHrP משפעל את הקולטן PTHR1 הממוקם על פני תאים מתחלקים וקדם-היפרטרופיים כדי לשמר את קצב החלוקות שלהם ולהאט את קצב ההתמיינות שלהם לתאים היפרטרופיים. באופן זה, IHH ו-PTHrP פועלים במין לולאת משוב שלילית כדי לווסת את קצב ההתמיינות של כונדרוציטים.
לאחרונה התגלו פרטים רבים על מארג האיתותים דרכם מפעיל PTHrP את השפעתו על התמיינותם של כונדרוציטים. שתי קבוצות מחקר הראו ש-IHH מגביר את ביטויו של PTHrP בפלטת הגדילה על ידי החלשת הפעילות של גורם השיעתוק Gli3 (עפ"י Koziel וחב'ב-Development משנת 2005). הדרך בה פועל PTHrP על כונדרוציטים דרך הקולטן PTHR1, נעשית על ידי השפעול של Gα3, על ידי יצירת cAMP ועל ידי פעילות האנזים protein kinase A, כאשר בתגובה משתתפים בסדרת אירועים הכוללים זרחון של SOX9, עיכוב ביטויו של p57, והשריית הפעילות של Gli3, Bcl-2 ו-cyclin D1. בדיעבד פעילות PTHrP מזרחנת ופוגעת בשני גורמי השעתוק Runx2 ו-Runks3, החיוניים להתמיינות של כונדרוציטים (Marino ב-Curr Opin Endocrinol Diabetes Obes ).
לאחרונה הודגם ש-PTHrP יכול להשתתף במודולציה של התמיינות כונדרוציטים על ידי וויסות התנועה של histone deacetylase לתוך גרעין התא, מה שגורם לוויסות פעילותם של גורמי השעתוק Zfp521, MEF2, ו-Runks2 (עפ"י Correa וחב' ב-Dev Cell משנת 2010 ו-Seriwatanachai וחב' ב-FASEB Jמשנת 2011). מסלול זה נדרש לפעילות PTHrP. יתרה מכך, הוכר לאחרונה שמוטציות בגנים של PTHrP ושל HDAC4 גורמות לצורה של chondrodysplasia type E הידועה גם כ-brachydactyly type E, המזכירה אי-סדירויות במטופלים עם מוטציות בגן GNAS, מה שמרמז שכל שלושת הגנים נמצאים על אותו מסלול גנטי (Williams וחב' ב-Am J Hum Genet משנת 2010). מחקר עדכני של Hirai וחב' משנת 2011 ב-Proc Natl Acad Sci USA, בו השתמשו בגישה גנטית לפגיעה בגן של PTHrP בכונדרוציטים במהלך התקופה שלאחר הלידה של עכברים, מצא ש-PTHrP מווסת גם את ההתמיינות של כונדרוציטים ומשמר אותם בפלטת הגדילה הבשלה. הדבר מרמז על האפשרות שאובדן האיתות של PTHrP יכול לגרום ל"סגירה" של פלטת הגדילה, בשלב ההתבגרות (Wang וחב' ב-J Bone Miner Res משנת 2011).
PTHrP מיוצר גם באתרים סחוסיים אחרים כמו ב-perichondrium המקיף את רצועות ה-hyaline המשמשות להארכת הצלעות ותורמות לאלסטיות של קירות בית החזה, והידועות כ-costal cartilages, וכן מקיף את הכונדרוציטים הסוּב-ארטיקולאריים. PTHrP מבוטא גם באופן בולט בנקודות הנעיצה של רצועות וגידים לתוך העצם, ותורם לבניית מכלולים אלה בעת תהליך גדילת השלד.
ל-PTHrP יש תפקידים אנאבוליים חשובים בעצם, ומתוך לימוד מעורבותו של חלבון זה בביולוגיה התקינה של רקמות סחוס ועצם, אין הדבר מפתיע ששינויים בתפקוד PTHrP קשורים למפגעי שלד. הדוגמה הבולטת ביותר היא HHM בו PTHrP בצירקולציה המגיב עם הקולטן PTHR1 בשלד גורם לתהליך ספיגת עצם ושחרור סידן להופעת היפרקלצמיה. מוטציות loss-of-function בגן של PTHR1 גורמות ל-Blomstrand's chondrodysplasia הגורמת למות העובר ברחם (Nissenson ב-Endocrinology משנת 1998). בנוסף, מוטציות loss-of-function בגן של PTHLH גורמות לתסמונת הכוללת קומה נמוכה, עצמות מטקרפליות קצרות בידים, גרורות סרטניות, וקשיי לימודים. נראה שהפעילות האנאבּולית של PTHrP בעצם עשויה להיות שימושית בטיפול באוסטאופורוזיס (Horwitz וחב' ב-J Clin Endocrinol Metabol משנת 2010).
השפעול של PPR שהוא הקולטן המשותף של PTH/PTHrP, מגרה 2 חלבוני G הטרודימריים, Gs ו-Gq. אנליזה גנטית מראה שהשפעול של Gs מתווך בפעילות PTHrP לשמור על כונדרוציטים שיתחלקו וישגשגו, ואילו השפעול של Gq נוגד את הפעילות האחרונה. כאשר משופעל Gs, יש פעילות במסלול התוך-תאי בו חל דיכוי סינתזה של p57 שהוא מעכב של cyclin-CDK, וכתוצאה מכך יש שגשוג של כונדרוציטים.
לעומת זאת, ל-PTHrP יש גם פעילות להאטה של תהליכי התמיינות בכונדרוציטים, מה שמתבצע על ידי זרחון של גורם השעתוק SOX9, וכן על ידי דיכוי הסינתזה של mRNA המקודד לגורם השעתוק Runx2. מסלולים אלה וודאי אחרים שעדיין לא התגלו, חוברים על מנת לווסת את קצב ההתמיינות של כונדרוציטים בפלטת הגדילה בתגובה ל-PTHrP.
לקצה ה-N טרמינאלי של PTHrP יש הומולוגיה עם קצה זה ב-PTH, לכן שני חלבונים אלה יכולים להיקשר לאותו קולטן, הידוע כ-type 1 PTH receptorאו PTHR1. אך בניגוד ל-PTH המסוגל להיקשר רק לסוג קולטנים יחיד, PTHrP מסוגל להיקשר למגוון גדול יותר של קולטים. אכן, PTHrP יכול לגרות את רוב הפעילויות שמשרה PTH, כולל הגברת ספיגת עצם, והגברת הספיגה מחדש בקצה הרחיקני (דיסטאלי) של אבוביות הכליה, ועיכוב הטרנספורט של פוספאט באבוביות הקריבניות (פרוקסימאליות). יחד עם זאת, הסבירות של PTHrP לגרות יצירת קלציטריול (1,25dihydroxy vitamin D) נמוכה יותר מזו של PTH. לכן, PTHrP אינו מגביר ספיגת סידן במעי.
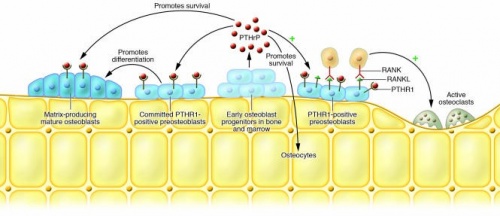
תפקיד PTHrP בהתפתחות בלוטות החלב בשד
מחקרים על PTHrP ועל הקולטן PTHR1 בעכברי knock-out, העלו שאיתות על ידי הורמון זה נחוץ ליצירת ה-mammary glands העובריים (Hens וחב' ב-Breast Cancer Res משנת 2007). עוברי אדם הלוקים ב-Blomstrad's chondrodysplasia חסרים אף הם רקמת שד, מה שמוכיח שאיתות של PTHrP חיוני להתפתחות השד גם באדם (Wysolmerski וחב' ב-J Clin Endocrinol Metabol משנת 2001). בלוטות השד נוצרות בעובר בתהליך של שקיעה פנימה (invagination) של תאים אפידרמליים אל תוך סטרומה שומנית מתפתחת, באופן היוצר מעין צינורית שמתפתחת בהמשך למערכת ה-mammary ducts (עפ"י Robinson ב-Nat Rev Genet משנת 2007).
בעוברים של עכבר ואדם, תאי אפיתל בנבט של רקמת השד מייצרים PTHrP, אשר מגיב עם קולטני PTHR1 המופיעים על פני התאים המזנכימאלים המקיפים. אינטראקציה זו חיונית להתמיינות תקינה של התאים המזנכימאלים, אשר בתגובה מעודדים את הצמיחה של הצינורות (ducts) האפיתליאלים. איבוד האיתות של PTHrP מונע את ה"דו-שיח" החיוני בין תאי האפיתל והתאים המזנכימאלים, מה שעוצר את התפתחות רקמת השד כבר בשלב הנבט. PTHrPגורם למודולציה של איתותי Wnt ו-BMP, כמו גם לביטוי במזנכימה של מספר גורמי שעתוק, כולל הקולטן לאנדרוגנים, Max2 ו-Lef1, כאשר כל אלה תורמים לצמיחה של צינורות עובריים ברקמת השד (Hens וחב' ב-Dev Dyn משנת 2009).
לאחר הלידה, ממשיך PTHrP להיות מבוטא ברמה נמוכה בתאים מיו-אפיתליאלים, כאשר הקולטן PTHR1 מבוטא בתוך הסטרומה מסביב לצינוריות השד. בתקופה הבוגרת, PTHrP מבוטא באופן ניכר על ידי תאי אפיתל בשד בתקופת ההנקה, וכמויות ניכרות שלו מופרשות לחלב (Budayr וחב' ב-Proc Natl Acad Sci USA משנת 1989), אך תפקידו בחלב אינו ברור. יחד עם זאת, PTHrP מופרש גם מרקמת השד לצירקולציה, והוא משתתף בוויסות הסיסטמי של סידן והמטבוליזם של העצם בעת ההנקה. רקמת העצם של האם משמשת כמקור סידן ליצירת חלב, וידוע שבנשים מניקות יש איבוד מהיר של רקמת עצם.
רמות מוגברות של PTHrP בצירקולציה, תואמות איבוד רקמת עצם באדם, כאשר CaSR או calcium-sensing receptor, שהוא קולטן הקשור ל-G-protein type C, ה"חש" בריכוזים חוץ-תאיים של יון הסידן, ומדכא את הפרשת PTHrP מתאי השד (VanHouten וחב' ב-J Clin Invest משנת 2004). תהליך זה מבטא באופן קלאסי לולאת משוב שלילי אנדוקרינית, בה PTHrP מגייס סידן מעצם השלד, כאשר בתגובה מעוכבת הפרשת PTHrP מרקמת השד. מהבנת תפקידו של PTHrP בהגברת ספיגת העצם בעת הנקה, אין זה מפתיע ש-PTHrP תורם גם להמסת רקמת עצם (osteolysis) בתהליך יצירת גרורות לעצם. אי לכך, תאי סרטן שד גרורתיים לעצם מייצרים יותר PTHrP מאשר תאי הגידול הראשוני (Akhtari וחב' ב-Cancer Biol The משנת 2008).
נמצא ש-TGF-β המופרש באזורי ספיגת עצם, מגביר את יצירת PTHrP על ידי מסלול איתותים אליו קשור גורם השעתוק Gli2 (עפ"י Johnson וחב' ב-Cancer Res משנת 2011). בתגובה, מגביר PTHrP את קישורו של גורם השעתוק NF-κB לקולטנו, ומפחית את היצור של אוסטאופרוטגרין ובכך מגדיל את כמות התאים האוסטאוקלסטים ואת פעילותם האוסטאוליטית. בנוסף, בניגוד למתרחש בתאי שד תקינים, איתות של CaSR בתאי סרטן שד מגרה בהם את יצירת PTHrP. במחקרם של Henderson וחב' ב-Cancer Res משנת 2006, נחקרו 526 מקרים של סרטן שד בהם נמצא שביטוי של PTHrP היה מנבא בלתי-תלוי למהלך קליני יותר שפיר. גם Li וחב' במחקרם בעכברים שהופיע ב- J Clin Invest משנת 2011, הראו שפגיעה בגן ל-PTHLH האריכה באופן דרמטי את הלטנטיות של סרטן השד והאטה את התפתחות השאת.
הריכוז של PTHrP מוגבר ברקמת השד בעת ההיריון או בתקופת ההנקה ונמצא גם שריכוזו היה מוגבר בנסיוב של האם כתקופות אלה. נמצאה עלייה ברמת PTHrP ברקמת השד בתקופת ההנקה (Burton וחב' ב-J Pathol משנת 1992, ו-Halapas וחב' ב-In vivo משנת 2003). ריכוז PTHrP בחלב האם גבוה פי-1,000-10,000 מאשר בפלזמה של האם, והוא גבוה פי-100 מאשר ריכוזו בפלזמה של מטופלים עם היפרקלצמיה של ממאירות (Namgung ו-Tsang ב-Clin Chim Acta משנת 2003, ו-Khosla וחב' ב-Mayo Clin Proc משנת 1990). הועלתה ההשערה שאחד מתפקידי PTHrP הוא לשמור על הומאוסטאזיס של סידן בנסיוב של יילודים. ידוע שבתינוקות עם לידתם, בפרט אם הם נולדים כפגים, חלה נפילה משמעותית בריכוזי סידן מיד לאחר הלידה (Hsu ו-Levine ב-Semin Neonatol משנת 2004, ו-Tsang וחב' ב-J Pediatr משנת 1973). יש לציין שרמת הסידן הייתה נמוכה בהרבה בתינוקות שהוזנו מיד עם לידתם בפורמולה, בהשוואה לאלה שניזונו מחלב אימם.
התמותה של עכברי −/−PTHrP שנולדו זה עתה הייתה קשה לפיענוח בהקשר של הסיבה העיקרית למותם, ולכן מנעו תמותה זו על ידי שכיוונו להשפעת PTHrP על יצירת רקמת סחוס על ידי שימוש בפרומוטר של קולאגן-II, מה שאׅפשֵר את לימוד השפעת הפנוטיפ PTHrP-null על מספר איברים אחרים (Wysolmerski וחב' ב-Development משנת 1995). בהקשר של רקמת השד, נמצא שבעכברים הטרנסגניים מסוג PTHrP-null היה כשל בהתפתחות מוקדמת של הצינוריות ברקמה זו, מה שהוכיח את ההשפעה הפאראקרינית של PTHrP במורפוגנזה של רקמת השד. יחד עם זאת, מחקר עדכני של Boras-Granic וחב' ב-PLoS One משנת 2011, מראה שאין צורך ב-PTHrP להתפתחות נורמאלית של צינורות השד או של ה-alveoli של בלוטות החלב בתקופת החיים שלאחר הלידה. הגילוי של יצירת RANKL או receptor activator of NF-κB ligand על ידי תאים פרימיטיביים של צינוריות השד, ליגנד הנקשר לקולטן RANK בתאי הגזע של בלוטות החלב לעודד את שגשוגם, מחייב מחקר נוסף להבנת תפקיד PTHrP בשלבים מוקדמים של התפתחות רקמת השד (Gonzalez-Suarez וחב' ב-Nature משנת 2010).
תפקיד PTHrP בטרנספורט של סידן בשלייה
סידן מועבר דרך השלייה מהאם לעובר (Kovacs ב-J Clin Endocrinol Metabol משנת 2001), כאשר השלייה מייצרת PTHrP שמסייע לשמור על רמת סידן תקינה בעובר. הראשונים שהדגימו את פעילות PTHrP במעבר סידן דרך דופן השלייה היו Rodda וחב' ב-J Endocrinol משנת 1998. בשנת 1990 פרסמו Care וחב' ב-Exp Physiol, ולאחר מכן Wu וחב' ב-J Biol Chem משנת 1996, שדווקא הפפטידים "הפנימיים" ב-PTHrP, דהיינו 67-86 ו-38-94 הם הפפטידים הפעילים ביותר בתחום זה, כאשר לחומצות האמינו בקצה ה-N טרמינאלי של PTHrP אין פעילות דומה. נתון זה רומזים לכך שיש בשלייה קולטנים ספציפיים ל-mid-region של PTHrP. ניסויים בעכברים של Simmonds וחב', בהם נעשתה מניפולציה גנטית אישרו שאמנם ל-PTHrP יש תפקיד בוויסות של הטרנספורט של סידן בשלייה, שחיוני לתהליך המינרליזציה של השלד בעובר (Crit Rev Eukaryot Gene Expr משנת 2012).
תפקיד PTHrP בהרפיה של שריר חלק
דוגמה לפעילות הפאראקרינית של PTHrP ניתן למצוא בהשפעתו על תאי שריר חלק בדופן כלי-דם. PTHrP מופרש משריר חלק באיברים רבים, בדרך כלל בתגובה ל-stretching המופעל על שריר זה. כבר משנות ה-20 היה ידוע שהזרקה של תמצית של יותרת בלוטת התריס גרמה בחיות להגברה בזרימת הדם ולהפחתת לחץ הדם (Charbon וחב' ב-Eur J Pharmacol משנת 1968, וכן Wang וחב' באותו כתב עת משנת 1984 ו-Mok וחב' ב-Endocr Rev משנת 1989). אך כאשר התגלה PTHrP, התברר שפעילות זו של הרפיית כלי-דם אינה תפקידו של PTH, אלא היא נובעת מהשפעה פיזיולוגית מקומית של PTHrP המשפיעה גם על שריר חלק בקיבה, במעי, ברחם, בשלפוחית השתן וכן בדופן העורקית (עפ"י Philbrick וחב' ב-Physiol Rev משנת 1996, וכן Qian וחב' ב-Endocrinology משנת 1999, ו-Martin וחב' ב-J Endocrinol משנת 1997).
בשנת 1991 הראו Roca-Cusache וחב' ב-J Pharmacol Exp Ther, ש-PTHrP הבא לביטוי בשריר חלק פועל באופן מהיר להרחבת כלי הדם במנגנון שאינו תלוי באנדותל, כאשר מכווץ כלי דם כמו angiotensin II, משרה עלייה מהירה ביצירת PTHrP (עפ"י Pirola וחב' ב-J Biol Chem משנת 1993). נראה שדווקא ה-PTHrP של גרעין התא, חיוני במיוחד בוויסות השגשוג של תאי שריר חלק בדופן כלי הדם. ל-PTHrP עלולה להיות גם השפעה שלילית, ונמצא שלאחר פרוצדורה אנגיופלסטית של פתיחת כלי דם עם בלון, יש הגברה ביצירת PTHrP, מה שעלול להגביר שגשוג תאי שריר חלק, מה שיכול לעבות את שכבת ה-neointima (עפ"י Fiaschi-Taesch וחב' ב-Circulation משנת 2004, ו-Sicari וחב' ב-J Endocrinology משנת 2012).
תפקיד PTHrP בבלוטת הלבלב
בפנקריאס, תאי האיים נמצאו מייצרים PTHrP וכן נושאים את הקולטנים ל-PTH ול-PTHrP, כאשר השפעת PTHrP היא בהגברה משמעותית ברמת סידן בתוך תאי β (עפ"י Vascavada וחב' ב-J Biol Chem משנת 1996) ובשפעול של האנזים phospholipase C (עפ"י Vasvada וחב' ב-Diabetes משנת 2007). מחקרם של Drucker וחב' ב-Mol Endocrinol משנת 2011, הראה שכל ארבעת הסוגים של תאי בלוטת הלבלב, α, β, δ ו-pancreatic polypeptide cells, מייצרים PTHrP. יצירת-יתר של PTHrP כמו גם החדרה של הפפטיד ה-N טרמינאלי 1-36 של חלבון זה לעכברים, מגבירה את יצירת תאי β (עפ"י Gutalu וחב' ב-Diabetes משנת 2010) ומפחית תהליכי אפופטוזיס של תאים אלה, מה שגורם להיפוגליקמיה המושרית על ידי יצירת עודף של אינסולין (Cebrian וחב' ב-Diabetes משנת 2002). ניסויים עדכניים בעכברים, הראו שהזרקות תת-עוריות יומיות של PTHrP 1-36, מגבירות את שגשוגם של תאי β, משפרות את ה-glucose tolerance, ויכולות להילקח בחשבון כטיפול פוטנציאלי בסוכרת (Williams וחב' ב-Diabetologia משנת 2011).
החלבון PTHrP והשן
שיניים מתפתחות מוקפות על ידי עצם והן חייבות לפרוץ דרך הכיסוי של הקריפטה הדנטאלית כדי להופיע בחלל הפה. בקיעת שיניים (tooth eruption) דורשת קואורדינציה מרחבית של עצמות הלסת, כאשר אוסטאוקלסטים חייבים לספוג את רקמת העצם המכסה את כתר השן על מנת לאפשר לה לבקוע ולהופיע, ואילו אוסטאובלסטים אמורים ליצור עצם בבסיס השן, כדי לאפשר לה להידחף אל מחוץ לקריפטה. PTHrP מיוצר באופן נורמאלי על ידי תאי ה-stellate reticulum שהם מארג של תאים אפיתליאלים במרכז ה-enamel האפיתליאלי (Beck וחב' ב-Cell Tissue Res משנת 1995, וכן Ouyang וחב' ב-J Bone Miner Res משנת 2000 ו-Tenorio ו-Hughes ב-Arch Oral Biol משנת 1996).
בשנת 1998 פרסמו Philbrick וחב' ב-Proc Natl Acad Sci USA שעל ידי שימוש ב-cytokeratin שהוא טרנסגן של K14-PTHrP, ניתן היה להראות שהחלפת PTHrP באפיתליום של ה-enamel, החזירה לתקינות את פעולת בקיעת השיניים. כיוון שאוסטאוקלסטים אינם מכילים קולטנים מסוג PPR, הממצא הזה תומך בתפקיד ההתפתחותי של PTHrP בהשפעה על אוסטאוקלסטים לפלס דרך לבקיעת השן. תפקידו של PTHrP הוא לאותת לתאי הזקיק הדנטאלי לעודד את יצירת האוסטאוקלסטים מעל הקריפטה. בהיעדר PTHrP לא נוצרים אוסטאוקלסטים אלה, ולא מתרחשת בקיעת השיניים הצעירות.
PTHrP וסרטן
המשמעות של PTHrP בתחלואת הסרטן אינה מוגבלת לנושא של HHM. סרטן השד הוא אחד המקורות המוקדמים של PTHrP, ואכן נמצא שמטופלות עם סרטן שד עם גרורות לעצם בהן אובחנה היפר-קלצמיה, נמצאו גם עם רמות מוגברות של PTHrP בפלזמה. נמצא ש-60% של גידולי שד ראשוניים, ו-90% של גידולי שד גרורתיים, נמצאו חיוביים ל-PTHrP באימונו-היסטוכימיה (Southby וחב' ב-Cancer Res משנת 1990, ו- Powell וחב' ב-Cancer Res משנת 1991). מכאן צמח הרעיון שייצור של PTHrP במח העצם על ידי תאי סרטן שד מעודד ספיגת עצם, ומסייע התפשטות הסרטן בעצם (Liao וחב' ב-Cancer Metastasis Res משנת 2006). נמצאו סימוכין מחקריים התומכים בתפקידו של PTHrP בפתוגנזה של תמס של רקמת עצם בשלבים גרורתיים של סרטן השד (Guise וחב' ב-J Clin Invest משנת 1996, ו-Mundy ב-Nat Rev Cancer משנת 2002). ואמנם יש דיווחים על מניעה או עיכוב של ספיגת עצם על ידי שימוש בנוגדנים חד-שבטיים המכוונים נגד PTHrP.
גם בסוגי סרטן אחרים יש ל-PTHrP תפקיד בהתפתחות התהליך הסרטני ומדובר ב-renal cell carcinoma (על פי Sourbier ו- Massfelderב-Cancer Lett משנת 2006), סרטן הערמונית (Deftos וחב' ב-Biochem Biophys Res Commun משנת 2005, וכן סרטן ריאות, סרטן המעי הגס, לימפומות (Shu וחב' ב-Leuk Lymphoma משנת 2012) וסוגי סרטן נוספים.
- הקשר בין PTHrP וסרטן השד
החשיבות הביולוגית והקלינית של PTHrP בסרטן השד התבררה בראשית שנות ה-90 (על פי Southby וחב' ב-Cancer Res משנת 1990 ו-Kissin וחב' ב-Eur J Surg Oncol משנת 1993). ייצור PTHrP על ידי גידולים סרטניים של השד שכיח ביותר ומופיע ב-50-60% מהמקרים (Bundred וחב' ב-Eur J Cancer משנת 1992), ואף באחוזים גבוהים יותר כאשר המטופלת היא היפר-קלצמית (Bundred וחב' ב-Br Med J משנת 1991, ו-Grill וחב' ב- J Clin Endocrinol Metab משנת 1991, וכן Francini וחב' ב-Clin Exp Metastasis משנת 1993). רק ב-17% מהמקרים של גידולי שד שאינם שולחים גרורות לעצם ניתן לגלות PTHrP בגידולים. גידולי שד המייצרים PTHrP הם בעלי סבירות גבוהה יותר להיות גרורתיים, תאי סרטן שד השולחים גרורות לעצם הם בעלי יכולת ייצור PTHrP גבוהה יותר (Powell וחב' ב-Cancer Res משנת 1991). סרטן השד מבטא באופן שכיח את הקולטן של PTHrP כמו גם תאי ממקור סרטן שד הגדלים בתרבית כשורות תאים (Birch וחב' ב- Br J Cancer משנת 1995, ו-Ferrari וחב' ב-J Cell Physiol משנת 1992).
PTHrP והפפטידים שלו מופרשים לדם מהגידול בשד, אך הוא נמצא גם ברקמת שד לא ממאירה, בשיטות של אימונו-היסטוכימיה (Liapis וחב' ב-Am J Pathol משנת 1991), והוא מיוצר על ידי בלוטות חלב פעילות, ונמצא כאמור בחלב האם בריכוזים גבוהים (Thiede ו-Rodan ב-Science משנת 1988, ו-Bucht וחב' ב-Metabolism משנת 1992). משלושת האיזופורמים המתקבלים על ידי splicing של mRNA, הדומיננטי הוא PTHrP 1-141, אך בנוסף יש פירוק של PTHrP לסדרת פפטידים תהליך שאף הוא בעל חשיבות רגולטורית (Southby וחב 'ב-Br J Cancer משנת 1995). לפפטידים אלה מיוחסות תכונות ביולוגיות מוגדרות ואף זוהו עבורם קולטנים ספציפיים (Orloff וחב' ב-Endocrinology משנת 1995, ו-Fenton וחב' באותו כתב עת משנת 1991 בו הדגימו שהפנטה-פפטיד (107-111) של PTHrP מעכב יעיל של ספיגת עצם על ידי אוסטאוקלסטים).
- ביטוי של PTHrP במיאלומה נפוצה
כיוון שב-multiple myeloma יש לעתים קרובות מאוד מעוּרבוּת של מפגעי שלד רבים והיפרקלצמיה, בחנו Kitazawa וחב' את ההיבט של מעורבות אפשרית של PTHrP בממאירות זו. מספר ציטוקינים, כולל IL-6, IL-1 ו-TNF-β, המיוצרים על ידי תאי מיאלומה, נחשדים כגורמים המחישים את תהליכי ספיגת העצם, ויצירת היפרקלצמיה דרך מנגנון פאראקריני. במאמרם שהתפרסם ב-Pathol Int משנת 2002, הראו חוקרים אלה שלאחר טיפול בחולה ב-MM עם ביפוספונאט בשילוב עם melphalan ו-prednisolone, רמת הסידן בנסיוב חזרה לרמתה הנורמאלית לזמן קצר. אנליזה ביוכימית מצאה בנסיוב עלייה מרשימה ברמת PTHrP, שהגיעה ל-3.7 פיקומול'/ליטר. על ידי שיטות של אימונוהיסטוכימיה והיברידיזציה in situ, בחומר ביופסיה שנשאב ממח העצם, נמצאו הן PTHrP כמו גם ה-mRNA שלו בציטופלזמה של לפחות שליש מתאי המיאלומה. ממצאים דומים פורסמו על ידי Kano וחב' ב-Naika משנת 1995, על ידי Tsujimura ב-Am J Hematol משנת 1998, על ידי Schneider וחב' ב-J Bone Miner Res משנת 1998, על ידי Zeimer וחב' ב-J Pathol משנת 2000 ו-Otsuki וחב' ב-Leuk Lymphoma משנת 2002.
- שימושיות של מדידת רמת PTHrP בהערכת ההיפרקלצמיה במצבי ממאירות
היפרקלצמיה, הוגדרת כרמת סידן בפלזמה שמעל 10.2 מיליגר/ד"ל, היא ממצא קליני שכיח כאשר ממאירות או תרחיש של היפר-פארא-תירואידיזם ראשוני הם הגורמים לו ב-80-90% מהמקרים. בנוסף, היפרקלצמיה של ממאירות מתרחשת בדרך כלל בתחילת תהליך פתולוגי זה, והיא משקפת במקרים רבים את רמת הממאירות באופן שניתן להשתמש בה למטרות אבחוניות. אך בה בשעה שהיפר-פארא-תירואידיזם ראשוני כרוך בדרך כלל ברמה גבולית או בעלייה מתונה ברמת הסידן (בדרך כלל פחות מ-11.0 מיליגרם/ד"ל), הרי שבמצבי ממאירות היפרקלצמיה משמעותית יותר (בדרך כלל מעל 13.0 מיליגרם/ד"ל).
היפרקלצמיה של ממאירות נגרמת לרוב מספיגת עצם מוגברת ושחרור סידן מרקמת העצם, הנגרמת על ידי גרורות אוסטאוליטיות, שחרור מקומי של ציטוקינים, הפרשה מהשאת של (OH)D-1,25 והפרשה מהשאת של PTHrP (על פי Rosol ו-Capen ב-Lab Invest משנת 1992, ו- Seymour ו-Gagel ב-Blood משנת 1993). לעתים קרובות ישנה דרישה למדידת רמת PTHrP בחולים עם היפרקלצמיה עוד לפני עצם הקביעה שהיפרקלצמיה קיימת, ו/או לפני שנמדדו רמות PTH. במחקר של Fritchie וחב' ב-Clin Chim Acta משנת 2009, נכללו 123 נבדקים, מתוכם 47 היו עם היפרקלצמיה כתוצאה מממאירות כאשר ב-15 מבין אלה עם היפרקלצמיה כתוצאה מממאירות נמצאו רמות מוגברות של PTHrP. הרגישות האבחונית של מדידת PTHrP הייתה 32%, ואילו ספציפיות הבדיקה זו הייתה 95%. רמות PTH היו נמוכות ביותר בנבדקים עם רמות מוגברות של PTHrP, בהשוואה לאלה בהם רמות PTHrP לא היו מוגברות (p<0.01). מסקנת מחקר זה היא שיש הצדקה לבצע מדידת רמת PTHrP רק לאחר ביצוע מדידת רמת PTH, שכן אם רמת PTH אינה נמוכה או שהיא נמוכה באופן מתון, ביצוע מדידת PTHrP לא יוסיף מידע חיוני.
מגבלות הבדיקה
אין לבצע בדיקה זו כדי לשלול ממאירות או על מנת לבחון חולי סרטן לתרחיש של היפר-קלצמיה של ממאירות. PTHrP יכול להיות מוגבר בנשים הרות או מניקות כמו גם ביילודים. תרחישים לא ממאירים שתוארו בהקשר של רמות מוגברות של PTHrP בפלזמה, כוללים systemic lupus erythematosus, לימפאדנופתיה הקשורה ל-HIV, מצב של lymphedema של החזה, וכן במקרה שלך גידולים שפירים של השחלות, הכליות, ושל המערכת הנוירואנדוקרינית (Burtis ב-Clin Chem משנת 1992).
בגלל המוּרכּבוּת של האיזופורמים של PTHrP, ההבדלים בשיטות המדידה השונות של PTHrP והמחסור בסטנדרט כיול אחיד, קיים קושי בהשוואה של רמות הורמון זה או של האיזופורמים שלו בתרחישים שונים. תערובת של האיזופורמים יכולה לפגוע בלינאריות של תוצאות הבדיקה בדגימות פלזמה של מטופלים, ולמנוע קביעה מדויקת של ריכוזי PTHrP (עפ"י Wu וחב' ב-Mayo Clin Proc משנת 1997).
המשמעות של תוצאות תקינות ובלתי-תקינות של PTHrP
ריכוזים נמוכים ביותר של-PTHrP עד כדי כאלה שלא ניתן לגלותם הן תוצאות נורמאליות. בנשים מיניקות ניתן לגלות את PTHrP. רמות מוגברות של PTHrP עם רמות מוגברות של סידן בדם, נגרמות בדרך כלל על ידי תהליכים סרטניים. PTHrP יכול להיווצר על ידי סוגי סרטן שונים, כולל סרטן ריאות, שד, ראש וצוואר, מערכת העיכול, שלפוחית השתן והשחלות כמו גם בלויקמיה ובלימפומה. בתלות באוכלוסייה הנבדקת, עד 80% מהנבדקים עם שאתות ממאירות והיפרקלצמיה, יסבלו מ-HHM או humoral hypercalcemia of malignancy. רמה גבוהה של PTHrP היא הסיבה להיפרקלצמיה בערך ב-2/3של חולי הסרטן. בנבדקים אלה בנוסף להיפרקלצמיה ניתן יהיה לגלות גם היפו-פוספטמיה, hypercalciuria, רמות מוגברות של פוספטאזה בסיסית בנסיוב ו-hyperphosphaturia. רמות מוגברות של PTHrP מוצאים גם בנבדקים עם מחלת כליות.
במטופלים עם ממצאים ביוכימיים המרמזים, אם כי לא מוכיחים מצב של היפר-פאראתירואידיזם ראשוני (דהיינו היפרקלצמיה, אך רמות נורמאליות או קרובות לנורמה של פוספאט ושל PTH, כאשר רמת האחרון היא בתחום הנורמה (אם כי מעל 30 פיקוגרם/מ"ל), ניתן לקחת בחשבון אפשרות של HHM, בעיקר אם המטופל קשיש, ובעל היסטוריה של ממאירות, או של גורמי סיכון לממאירות. רמות מוגברות של PTHrP במטופל האחרון, מצביעים על HHM כסיבה להיפרקלצמיה.
מדידה ברגישות גבוהה של רמת PTHrP בפלזמה בשיטת LC-MS/MS
בבריאות מלאה רמות PTHrP בפלזמה מאוד נמוכות, וערכות מסחריות מתקשות לעתים לגלות פפטיד זה כביקורת של דגימות מאנשים בריאים. Kushnir וחבר' פרסמו ב-Clin Chem משנת 2016 שיטת מדידה תוך שימוש ב-liquid chromatography tandem mass spectrometry, בדרך הבאה: העשרה של הריכוזים הנמוכים של PTHrP בפלזמת הדם נעשתה תוך שימוש בנוגדנים המכוונים כנגד PTHrP שהיו מצומדים לחרוזים מגנטיים. לאחר הדגרה, החרוזים נשטפו, וה-PTHrP הקשור לנוגדן על פניהם עבר עיכול עם טריפסין, ותוצרי עיכול זה עברו אנליזה על ידי LC-MS/MS.
הרף התחתון של כימות הריכוז והרף העליון של לינאריות השיטה היו 0.6 ו-580 פיקומול'/ליטר, בהתאמה. הרגישות האנליטית הייתה מספקת על מנת למדוד רמת PTHrP בדמם של אנשים בריאים. במחקר זה נעשה שימוש בלמעלה מ-2,000 דגימות, כאשר נמצאה התאמה גרועה בין תוצאות המדידה בשיטה זו השווה לערכת Immunotech המסחרית המבוססת על RIA, זאת בגין הרגישות הנמוכה של RIA וחוסר הלינאריות המתקבלת בשיטה זו. כחלופה לאנליזת רגרסיה לינארית, ערכו בעלי המחקר בדיקת התאמה בין מדידות כמותיות בשיטת LC-MS/MS לבין התוצאות האיכותיות בשיטת RIA, תוך שימוש באנליזה של רגרסיה לוגיסטית (כאשר תוצאות בשיטת RIA נחשבו חיוביות בריכוזים מעל 4.0 פיקומול'/ליטר).
השטח מתחת לעקומת ROC או AUC לאנליזה של רגרסיה לוגיסטית היה 0.82. ריכוזי רפרנס של PTHrP שנקבעו עבור 282 אנשים בריאים היו 0.6-3.3 פיקומול'/ליטר בנשים, ו-0.6-2.2 פיקומול'/ליטר בגברים. כדי לאשש את דרגת הדיוק של השיטה נמדדו רמות PTHrP בסדרה של דגימות פלזמה מ-88 נבדקים עם רמות סידן מוגברות ללא הסבר, (רמת סידן מעל 10.5 מיליגרם/ד"ל ורמות PTH נמוכות מ-15 פיקוגרם/מ"ל), כאשר ב-42% מתוכם רמות PTHrP היו מעל תחום הנורמה, מה שהצביע על הפפטיד הזה כסיבה להיפרקלצמיה.
עדיין מעבדות שונות משתמשות בשיטות המדידה המקובלות של רמת PTHrP הן RIA, Immunochemiluminometric Assay או ICMA, ו-LC-MS/MS.
הוראות לביצוע הבדיקה
ברוב ערכות הבדיקה יש העדפה לנטילת דם במבחנות EDTA (פקק סגלגל) לאחר צום של 8 שעות. הסרכוז נעשה בצנטריפוגה מקוררת, ויש לפסול דגימות המוליטיות באופן בולט. הפלזמה המופרדת יציבה לצורך הבדיקה עד 7 ימים בטמפרטורת החדר, עד 30 יום בקירור, ועד שנה בהקפאה. יש מעבדות המבצעות את הבדיקה בפלזמה שנלקחה במבחנת הפארין (פקק ירוק), אלא שאז יציבות הדגימה שונה: 7 ימים בטמפרטורת החדר או בקירור, וחודש בהקפאה. רצוי לכלול במבחנת נטילת הדם מעכב פרוטאזות דוגמת aprotinin או leupeptin, ויש המשתמשים במעכב הפרוטאזות PPACK או Phe-Pro-Arg-chlomethylketone.
שיטות המדידה: ניתן למדוד רמת PTHrP או על ידי שילוב של שיטת HPLC ו- Tandem Mass Spectrometry, או בשיטת ICMA או immunochemiluminometric assay, תוך שימוש ב-2 נוגדנים שנוקו על ידי כרומטוגרפיית-זיקה מנסיוב של עז מחוסנת כנגד המקטע 1-86 של PTHrP. אחד מ-2 הנוגדנים מסומן עם acridinium ester כנוגדן גלאי (tracer), כאשר הנוגדן השני מקובע על פני כדורונים זעירים (beads). כאשר הפלזמה מכילה PTHrP נוגדן ה-tracer נקשר אל ה-beads וניתן לגילוי וכימות (עפ"י Wu וחב' ב-Ann Clin Lab Sci משנת 1997).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק