בסיס מולקולרי של מלנומה עורית - Molecular basis of cutaneous melanoma
הופניתם מהדף The molecular basis of cutaneous melanoma לדף הנוכחי.
| הבסיס המולקולרי של מלנומה עורית | ||
|---|---|---|
| The molecular basis of cutaneous melanoma | ||

| ||
| יוצר הערך | פרופסור כרמית לוי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מלנומה
מודלים להתפתחות מלנומה עורית
הבנת תהליך התפתחותו של הגידול הסרטני נמצאת במרכז חקר הסרטן ותורמת רבות למציאת תרופה ממוקדת ויעילה למיגור וריפוי המחלה. בזכות התקדמות טכנולוגית מרשימה, התעצם מאגר הנתונים שמקורו בחולים, והצטבר מידע רב על שונות בביטוי גנים, רצפי החומר הגנטי, מראה פתולוגי, מופע קליני ועוד. מאגר מידע זה משמש בסיס מחקרי איתן, אשר באמצעותו גובשו מודלים שונים להתפתחות סרטן, כפי שמתוארים להלן:
- אבולוציה שבטית (clonal evolution) - מודל ההתפתחות הקלאסי של סרטן. בהתאם למודל זה, מקורו של הגידול הסרטני בתא יחיד אשר נושא מוטציות גנטיות או אפיגנטיות, המעניקות לו יכולות צמיחה ויתרון על פני תאים תקינים. תא בודד זה יהווה את המקור ליצירת שבט תאים הדומה לו מבחינה גנטית. במהלך התפתחות המחלה תאי הגידול מתחרים זה בזה על משאבים שונים הנחוצים להישרדותם, כגון חמצן, התחמקות מתגובות חיסוניות, זמינות חומרים מטבוליים וכדומה. לחצים הישרדותיים משרים 'סלקציה הישרדותית' בהקנייתם יתרון לתא בודד אשר יעבור שינויים גנטיים נוספים המחזקים אותו בהיבטים אלה בהשוואה ליתר תאי הגידול. תא זה הוא שישרוד ויבטיח את המשך קיום הגידול על ידי יצירת שבט תאים דומה לו[1](איור מספר 1)
- תאי גזע סרטניים (cancer stem cells) - מודל נוסף. בעוד שמודל האבולוציה לעיל מתאר את התקדמות הסרטן כבר מהשלב המוקדם ביותר, שלב ההתמרה הסרטנית, הרי שמודל תאי גזע סרטניים מתאר את התפתחות הגידול בשלביו המאוחרים יותר. תאי גזע סרטניים הם תאים ממאירים בעלי מאפיינים של תאי גזע, ומכאן שמם. אין הכוונה לתאי גזע הקיימים ברקמה נורמלית ומבטיחים את המשך קיומה התקין של הרקמה. המאפיינים הבסיסיים של התפתחות תאי גזע סרטניים ידועים ממחקרים על ממאירות המטולוגית: בדומה למתרחש ברקמה נורמלית, מנגנוני התקדמות הגידול מבוססים על היררכיה יציבה ומוגדרת של התחדשות תאים עצמית ולאחריה התמיינות. בהתאם למודל זה, הגידול הסרטני מורכב בעיקרו מלפחות שתי אוכלוסיות תאים נפרדות: רוב הגידול מורכב מתאי בת שאינם אגרסיביים, בעלי תוחלת חיים מוגבלת ורגישות גבוהה לטיפול, ואילו מעט מתאי הגידול נושאים מאפיינים של תאי גזע. תאי הגזע הסרטניים הם אלו המקיימים את המשך תוחלת הסרטן, וביכולתם לשלוח גרורות לרקמות מרוחקות. מאמצים רבים מוקדשים במחקר ובקליניקה בניסיון לאתר תאים מעטים אלו כיעד טיפולי. במלנומה, מודל תאי הגזע הסרטניים זכה לביקורת רבה בקרב חוקרים, וחלקם העלו מודל חלופי, אשר לטענתם עולה בקנה אחד עם הנתונים הקליניים הקיימים [1]
- הגמישות הפנוטיפית (phenotypic plasticity) - מודל חלופי זה פותח על בסיס תצפיות במחקרי מלנומה, בהן נראתה הטרוגניות פנוטיפית גבוהה בתאי הגידול הסרטני, המאופיינת באי יציבות. בהתאם למודל זה, מקור התנודות הפנוטיפיות באוכלוסיית תאי הגידול אינו בשינויים גנטיים בלתי הפיכים, אלא בהסתגלות הפיכה של תאי הגידול לתנאי סביבה משתנים. כל אחד מתאי הגידול עשוי לשנות באופן הפיך את תכונותיו בהתאם לאותות שהוא מקבל מהסביבה, כגון חמצן, זמינות מטבולית, איתות מסביבה תאית משתנה. כך למשל, תא שמתחלק באופן לא מבוקר אך חסר יכולת לנדוד וליצור גרורות, עשוי לרכוש תכונה זו ולהפוך לאגרסיבי בעקבות מצוקת חמצן. להבדיל ממודל תאי הגזע הסרטניים, במודל זה כל תאי הגידול מהווים יעד טיפולי [1][2][3]
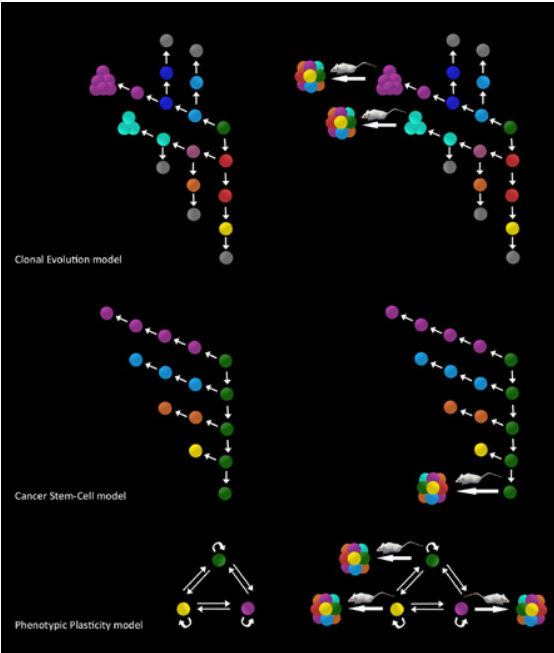
שלושה מודלים של התפשטות הסרטן מוצגים:
אבולוציה שבטית (clonal evolution), רק תא בעל מודיפיקציה גנטית מסוימת המועילה לגידול (המקביל לכדורי טורקיז וסגול), מסוגל להשתיל גידולים (פאנל עליון, מימין);
מודל תאי גזע סרטניים (cancer stem cells, פאנל אמצעי, משמאל) מתאר את הארגון ההיררכי הבלתי הפיך של התפשטות הגידול, שבו רק הכדורים הירוקים, תאי הגזע של הסרטן, מסוגלים, עם ההשתלה בעכבר, לעורר גידולים (פאנל אמצעי, מימין);
מודל הגמישות הפנוטיפית (phenotypic plasticity, פאנל תחתון, משמאל) מתאר אינטראקציות דו-כיווניות בין תאי הגידול שבהם כל תא גידול הוא סרטני (פאנל תחתון, מימין).
נתון זה מייצג מצב היפותטי שבו כל תא (כדור ירוק, סגול או צהוב) הוא בעל סבירות שווה להפוך לסרטני בעכבר. החצים תואמים לדורות עוקבים, עכברים תואמים למבחני היווצרות סרטן.
שיבושים גנטיים שכיחים במלנומה
שינויים גנטיים השכיחים במלנומה מעורבים בעיקר במסלולים המבקרים התפשטות תאים ומוות תאי מתוכנן (אפופטוזיס). גילויים והבנתם של השינויים הגנטיים, המתרחשים במהלך התפתחות המלנומה, מספקים כלים אבחנתיים חדשים ומטרות טיפוליות חדשניות.
מוטציות בחלבון BRAF (בפרט V600E) הן השכיחות ביותר במלנומה, ומופיעות בכ-50 אחוזים עד 70 אחוזים מן המקרים. BRAF מתווך בין מסלול האיתות של חלבונים פרוטו-אונקוגניים (proto-oncogenic proteins) ממשפחת RAS ובין מסלול הקינאזות של MAPK. בעוד שמוטציות בכל החלבונים ממשפחת RAS מעורבות בהתפתחות גידולי סרטן אנושיים, הרי שבמלנומה מוטציות ב-KRAS-1 HRAS הן נדירות, ואילו מוטציה בחלבון NRAS נפוצה יחסית.
מוטציות ב-NRAS תורמות ישירות למופע גרורות ומצביעות על פרוגנוזה גרועה. מוטציות בחלבונים אלו גורמות לפעילות יתר שלהם, מובילות לגדילה מואצת, ומקדמות התפשטות מוגברת של תאים וכן יכולת התחמקות ממערכת החיסון[4].
PI3K או מסלול Akt מופעל לעיתים קרובות במלנומה בגלל מוטציות בגן PTEN המבטלות את פעילותו, או על ידי הפעלה בלתי מבוקרת של Akt. שיבושים אלו מביאים לפגיעה בוויסות רמת השומנים בתא, המובילה לירידה במוות תאי מתוכנן ולשליחה מוגברת של אותות סרטניים. במורד הזרם של Akt נמצא mTOR, הממלא תפקיד מרכזי בשליטה על תרגום החלבון ומטבוליזם. רמת ביטוי נמוכה של PTEN ניתן לראות ב-50 אחוזים של דגימות מלנומה [4].
KIT הוא אנזים בעל פעילות החיונית להתפתחות תאי גזע ומלנוציטים. מוטציות בגן זה או שיבושים ברמת הביטוי שלו נפוצים במלנומות המופיעות באזורים שאינם חשופים לשמש. עדיין לא ברור כיצד הפעלה מכווננת של KIT תורמת להתפתחות מלנומה, אך ידוע כי הוא מזרחן את פקטור השיעתוק המרכזי של מלנומה, MITF, ואולי זירחון זה תורם להתפתחות המחלה[4].
גורם השיעתוק המרכזי של מלנוציטים, תאי המקור של מלנומה, הוא MITF. ללא MITF, עכברים מאבדים מלנוציטים בכל הגוף. נמצא כי ביטוי MITF מוגבר קיים ב-10 אחוזים מהמלנומות המקומיות וב-21 אחוזים מהגרורות. MITF מגביר את יכולת הצמיחה של הגידול, אך מחליש את יכולת ההתפשטות של התאים. היכולת של גורם השיעתוק לבצע שתי פעולות שונות בתאי סרטן בו זמנית, מחזקת את המודל על פיו הסרטן מתקדם בתהליך הגמישות הפנוטיפית. מחקר פעיל נכון לזמן כתיבת מאמר זה, מנסה להבין את המנגנון המאפשר בקרת ביטוי גנים דינמית[4][5].
חלבון ה-TP53 הוא גורם שיעתוק מרכזי בתאי הגוף ומגיב באופן בולט למגוון לחצים, כולל נזק לדנ"א. בעקבות לחצים אלה, TP53 מביא למותו של תא המכיל נזקים רבים מכדי שניתן יהיה לתקנם. מוטציות בגן TP53 או מחיקה שלו זוהו בכ-50 אחוזים ממקרי הסרטן, אך בניגוד לסוגים אחרים של סרטן, מוטציות ב-TP53 אינן שכיחות במלנומה, ודיווחים על כך נדירים בהשוואה לרוב הגידולים המוצקים האחרים. הביטוי של רמות רגילות או גבוהות של חלבון TP53 בתאי מלנומה הוא מסקרן, בייחוד מכיוון שתאי מלנומה הם עמידים מאוד בפני מוות תאי מתוכנן. המנגנון העומד מאחורי עובדה זו אינו ידוע ברובו [4].
התגליות אשר נדונו כאן בהקשר של הגנטיקה של מלנומה הניבו מטרות טיפוליות מולקולריות חדשות, לדוגמה תרכובות מולקולות קטנות וחדישות התוקפות מוטציות ב-BRAFV600E ומביאות לתוצאות קליניות.
מיקרו-סביבה של הסרטן ותרומתה להתפתחות המחלה
במשך תקופה ארוכה, כפי שפורט מעלה, התמקד מחקר המלנומה בגידול עצמו וניתנה תשומת לב רבה להבנת הגנטיקה ומסלולי האיתות התוך-תאיים. בעשור הראשון של המאה ה-21, חלה תפנית מחקרית, כאשר חוקרים בעלי שם גילו את תפקידה המכריע של סביבת התאים שאינם סרטניים להתפתחות המחלה[6].
כבר בשלב המחלה המוקדם, בו תא מלנוציט הופך לממאיר, ובמהלך התקדמות המחלה, התאים השכנים, איתם הסרטן בא במגע ישיר, משתנים. מיקרו-סביבה זו תורמת באופן ישיר להתפתחות המחלה. שכבת העור העליונה, האפידרמיס, מורכבת מקרטינוציטים ומלנוציטים. מלנוציטים הם המקור התאי למלנומה, ובהתמרה הסרטנית שלהם נוצרת מלנומה. השכבה התחתונה יותר, הדרמיס, מורכבת מכלי דם, ובניגוד לאפידרמיס מכילה כלי דם. השלב הראשוני בהתפתחות מלנומה כרוך בהתפשטות של תאים מן האפידרמיס הבסיסי לכיוון האפידרמיס העליון, והוא נקרא מלנומה ראשונית (in-situ melanoma). מלנומה זו אינה יוצרת גרורות. יצירת גרורות דורשת מעבר למלנומה פולשנית (metastatic melanoma), שלב המאופיין בפלישה של תאי מלנומה אל הדרמיס וזליגה לתוך כלי הדם, וזו מאפשרת לתאים להתפשט. כאשר תאי המלנומה מגיעים לזרם הדם ולאחר מכן לאזורי הגרורות השונים, כגון בלוטות לימפה, ריאה, כבד או מוח, הם נתקלים בתאי סביבה שונים[7][8].
תאי המלנומה מתקשרים עם סוגי תאים אחרים בסביבתם באמצעות מגע ישיר או בעקיפין דרך הפרשת מולקולות מסיסות, כגון מיקרו-רנ"א או באמצעות שלפוחיות זעירות. תאי המלנומה השכנים משמשים וסתים מרכזיים במספר היבטים של התקדמות סרטן ועמידות לתרופות, כולל יכולת התפשטות, אפופטוזיס, פלישה, גרורות ואנגיוגנזה.
בשלב הראשוני, in-situ melanoma, תאי המלנומה מגיבים לאותות (סיגנלים) הנשלחים מקרטינוציטים באפידרמיס, המעודדים פלישה לדרמיס. פיברובלסטים בדרמיס יכולים לעבור תפנית ולהפוך לתאים תומכי סרטן בעקבות אותות הנשלחים אליהם מתאי המלנומה. פיברובלסט כזה שולח בחזרה גורמי גידול למלנומה ומעודד צמיחה והיווצרות גרורות. פיברובלסטים תומכי סרטן יכולים להימצא גם באזורי גרורות מרוחקים. עם התקדמות המלנומה, התאים חודרים לתוך רקמות תת-עוריות, שם הם באים במגע ישיר עם תאי שומן תת-עורי. לתאים אלו יש יכולת לאחסן אנרגיה, ובעקבות אותות מהתא הסרטני הם מספקים אנרגיה לצמיחה מהירה של הגידול ותמיכה בשיעורי התפשטות גבוהים של תאים סרטניים. תאי מלנומה באים גם במגע ישיר עם תאי אנדוטל של צינורות הלימפה וכך מתפשטים בכל הגוף. נמצא כי תאי האנדוטל מפרישים חומרים המושכים את תאי הגידול אליהם ובכך מכוונים את מסלול צמיחת הגידול. בנוסף, מלנומה יודעת להפריש ציטוקינים שונים, כגון IL-6, IL-10 ו-TGF-β המגייסים את תאי ה-T הרגולטורים התורמים להתקדמות הגידול.
למרות הידע הרב בתחום זה, ההתקשרות של תאי המלנומה עם המערכת החיסונית עדיין מצריכה חקירה נוספת, בייחוד לאור ההצלחה הגדולה של תרופות מכווננות (ביולוגיות) המסתמכות על מערכת החיסון על מנת למגר את הגידול. באופן כללי, תובנות מקיפות לגבי המנגנון המולקולרי העומד מאחורי התקשורת הבין-תאית בין מלנומה לתאים בסביבתה, עשויות לקדם את התפתחותן של גישות טיפוליות חדשות לטיפול במלנומה [7][8].
מיקרו-רנ"א (miRNAs) בהתפתחות מלנומה
miRNAs (micro-RNA) הם יחידות רנ"א קטנות ביותר בגודל של 25-21 נוקליאוטידים, שאינם מקודדים לחלבון, המשמשים כווסת שלילי של ביטוי גנים. miRNAs המתבטאים באופן לא תקין בסוגים שונים של גידולים כולל מלנומה, נמצאו כמעורבים ישירות בהתקדמות המחלה. miRNAs יכולים לתרום להתפתחות סרטן על ידי ביטוים בתאי הסרטן עצמם, או לחלופין על ידי שחרורם לחלל הבין-תאי והחוץ-תאי, ובכך הם תורמים לתקשורת עם תאים בסביבת המלנומה. תאי מלנומה משחררים miRNAs לסביבתם באמצעות שלפוחיות קטנות הנקראות 'אקסוסומים' או 'מלנוזומים'.
להלן דוגמאות ל-miRNAs המעורבים בהתפתחות מלנומה:
בביופסיות של מלנומה נמצא ביטוי לא תקין של miR 142, miR-150, miR-155, miR-223, miR-486, miR-335 ו-494-miR, בהשוואה לנקודות חן שפירות. רמות גבוהות יותר באופן משמעותי של miR-17, miR-19a, miR-21, miR-126 ו-miR-149 נמצאו בפלזמה של חולי מלנומה, לעומת פלזמה של נבדקים בריאים. בנוסף, רמות נמוכות משמעותית של miR-125b נמצאו בסרום של חולי מלנומה בהשוואה לנבדקים בריאים [1][9]. דוגמאות אלו מעידות כי miRNAs יכולים לשמש כלי אבחון וכלי פרוגנוסטי. מחקרים מראים כי זיהוי miRNAs רגיש יותר מזיהוי גן רגיל בדגימות פתולוגיות. יתר על כן, יציבותם בנוזלי הגוף תורמת ליכולתם לשמש סמנים ביולוגיים להימצאות מחלה ולאפיון שלב המחלה.
miRNAs אחד יכול לבטא מספר גנים בו זמנית וכתוצאה מכך להשפיע על מספר מסלולי איתות סרטניים במקביל. יתרון ייחודי זה מקנה ל-miRNAs פוטנציאל קליני וטיפולי. כך למשל, טיפול תרופתי ב-miRNAs עשוי לעכב את יכולת הגדילה של תאים ממאירים, את יכולת הצמחת כלי דם אל הגידול וכדומה. יתר על כן, טיפול משולב של miRNAs עם טיפול כימי או קרינתי, עשוי לעקוף את מנגנוני העמידות לתרופות ולשפר את התגובה לטיפול[1][9]. במטרה לממש את הפוטנציאל הטיפולי העצום הטמון ב-miRNAs, חזית המחקר העולמית מתמקדת בשיפור יעילות הגעתו אל רקמות היעד, עיכוב ממוקד של גני מטרה ומניעת רעילות ותגובות אימונוגניות.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 Bell, RE, Levy C. The three M's: melanoma, microphthalmia-associated transcription factor and microRNA. Pigment Cell Melanoma Res. 2011 Dec;24(6):1088-106.
- ↑ Hoek, KS, Goding, CR. Cancer stem cells versus phenotype-switching in melanoma. Pigment Cell Melanoma Res. 2010 Dec;23(6):746-59. Epub 2010 Aug 20.
- ↑ Quintana, E, Shackleton, M, Sabel, MS, et al. Efficient tumour formation by single human melanoma cells. Nature. 2008 Dec 4;456(7222):593-8.
- ↑ 4.0 4.1 4.2 4.3 4.4 Kong, Y, Kumar, SM, Xu, X. Molecular pathogenesis of sporadic melanoma and melanoma-initiating cells. Arch Pathol Lab Med. 2010 Dec;134(12):1740-9.
- ↑ Levy, C, Khaled, M, Fisher, DE. MITF: master regulator of melanocyte development and melanoma oncogene. Trends Mol Med. 2006 Sep;12(9):406-14. Epub 2006 Aug 8.
- ↑ Hanahan, D, and Weinberg, RA. Hallmarks of cancer: the next generation. Cell. 2011 Mar 4;144(5):646-74.
- ↑ 7.0 7.1 Dror, S, Sander, L, Schwartz, H, et al. Melanoma miRNA trafficking controls tumour primary niche formation. Nat Cell Biol. 2016 Sep;18(9):1006-17. Epub 2016 Aug 22.
- ↑ 8.0 8.1 Golan, T, Messer, AR, Amitai-Lange, A, et al. Interactions of melanoma cells with distal keratinocytes trigger metastasis via notch signaling inhibition of MITF. Mol Cell. 2015 Aug 20;59(4):664-76. Epub 2015 Jul 30.
- ↑ 9.0 9.1 Levy, C, Khaled, M, Iliopoulos, D, et al. Intronic miR-211 assumes the tumor suppressive function of its host gene in melanoma. Mol Cell. 2010 Dec 10;40(5):841-9. Epub 2010 Nov 25.
המידע שבדף זה נכתב על ידי פרופ' כרמית לוי - חוקרת ומרצה בכירה, הפקולטה לרפואה ע"ש סאקלר, אוניברסיטת תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק