הבדלים בין גרסאות בדף "קרטן סולפט - Keratan sulfate"
(יצירת דף עם התוכן "{{בדיקת מעבדה |שם עברי= |שם לועזי= |קיצור= |תמונה= |כיתוב תמונה= |מעבדה= |תחום= |יחידות מדידה= |ט...") |
(←ראו גם) |
||
| (27 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
{{בדיקת מעבדה | {{בדיקת מעבדה | ||
| − | |שם עברי= | + | |שם עברי=קרטן סולפט |
| − | |שם לועזי= | + | |שם לועזי=Keratan sulfate |
| − | |קיצור= | + | |קיצור= MPS IVA, N-acetylgalactosamine-6-sulfate sulfatase |
|תמונה= | |תמונה= | ||
|כיתוב תמונה= | |כיתוב תמונה= | ||
| − | |מעבדה= | + | |מעבדה= [[כימיה בשתן]] |
| − | |תחום= | + | |תחום= אחד ה-glycosaminoglycans (GAG) ב[[מחלת אגירה]] ממשפחת ה[[מוקופוליסכרידוזות]] (MPS) |
|יחידות מדידה= | |יחידות מדידה= | ||
| − | |טווח ערכים תקין= | + | |טווח ערכים תקין= 0-12 months: < or =2.50 mg/mmol creatinine; 13-24 months: < or =2.00 mg/mmol creatinine; 25 months-4 years: < or =1.50 mg/mmol creatinine; 5-10 years: < or =1.00 mg/mmol creatinine; -18 years: < or =0.80 mg/mmol creatinine11; >18 years: < or = 0.50 mg/mmol creatinine |
|יוצר הערך=[[משתמש:בן עמי סלע|פרופ' בן-עמי סלע]] | |יוצר הערך=[[משתמש:בן עמי סלע|פרופ' בן-עמי סלע]] | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| + | ==מטרת הבדיקה== | ||
| + | ניטור של ההשפעות הפרמאקו-דינמיות של תוספי האנזים החסר במחלת Morquio A (MPS IVA) . | ||
| + | |||
| + | ==מידע קליני== | ||
| + | ה[[מוקופוליסכריזודות]] (MPS) היא קבוצה של מפגעים הנגרמים כתוצאה מפגם באחד מהאנזימים המשתתפים בפירוק של ה-GAGs הבאים: dermatan sulfate, heparan sulfate, keratan sulfate או chondroitin sulfate.{{כ}} GAGs שאינם מתפרקים או שהם מפורקים באופן חלקי בלבד, נאגרים בליזוזומים ומופרשים בשתן. אגירה של GASGs בליזוזומים מפריעה לתפקוד התקין של תאים, רקמות ואיברים, מה שגורם לתסמינים קליניים המאפיינים את מפגעי MPS. ידוע על 11 חסרים אנזימטיים העלולים לגרום ל-MPS. | ||
| + | |||
| + | [[תסמונת Morquio]] או mucopolysaccharidosis IV נגרמת על ידי פגיעה בפירוק של keratan sulfate בגין החסר של האנזים N-acetylgalactosamine 6-sulfatase ב-MPS IVA, או בגין חסר שלβ-galactosidase ב-MPS{{כ}}.IVB Keratan sulfate , וכן chondroitin-6-sulfate במקרה של MPS IVA, מצטברים בתאים והעודף מופרש בשתן. מאפיינים קליניים של Morquio A ו-B, כוללים גמדוּת, דיספלזיה של השלד (spondyloepiphyseal) השונה מזו שמוצאים ב-MPS אחרים, [[קרנית עכורה]], פגיעה בשיניים, נגעים לבביים, hepatomegaly, ועם זאת אינטליגנציה תקינה. דרגת החומרה מגוונת מאוד ב-2 סוגי המחלה, וכללית חומרת התסמינים מתונה יותר ב-Morquio B. השכיחות של תסמונות MPS IVA ו- MPS IVB נעה בין מקרה אחד לכל 200,000-300,000 לידות-חי. תרפיה על ידי מתן האנזים החסר (enzyme replacement therapy) זמינה במקרים של Morquio A, אם כי במקרים של Morquio B יעילותה מוגבלת. טיפול אנזימטי זה נמצא מפחית את רמת keratan sulfate בשתן של המטופלים עם Morquio A, אך היעילות הקלינית שנויה במחלוקת. | ||
| + | |||
| + | ==שבעה עשורים של keratin sulfate== | ||
| + | Keratan sulfate (להלן KS) זוהה לראשונה בשנת 1939 על ידי Suzuki בתמצית של קרנית העין מה שדווח ב-J Biochem באותה שנה. בשנות ה-50 היו אלה Karl Meyer ואחרים שאפיינו את התרכובת כפולימר ליניארי של lactosamine (3Galβ1–4GlcNAcβ1) שעבר סולפציה בעמדה C6 של שתי מולקולות ה-hexose (Meyer וחב' ב-J Biol Chem משנת 1953). במרוצת העשורים שחלפו העניין ב-KS הלך והתגבר, ומספר הפרסומים עליו גדל פי-5 משנות ה-70 ועד סוף שנות ה-90. בין המאמרים המכוננים על המבנה והביוסינתזה של KS נזכיר את אלה של Hascall ב- Prog. Clin. Biol. Res משנת 1982, Nieduszynski וחב' ב- Biochem. Soc. Trans משנת 1990, ו-Funderburgh וחב' ב- Biochem. Soc. Trans. משנת 1991. | ||
| + | |||
| + | ==סוגי KS== | ||
| + | במקור ההגדרות של KSI ו-KSII היו מבוססות על ההבדלים בין KS ממקור קרנית העין ו-KS ממקור סחוס. KS בקרנית קשור בקשר N לשייר aspargine בחלבון הליבה, בעוד ש-KS בסחוס קשור בקשר O לשיירי serine או threonine. שני קשרים אלה אינם ספציפיים לרקמה זו או אחרת מבחינת מיקומם. ההגדרות הנמצאות בשימוש הן KSI הכולל את כל מולקולות KS הקשורות לאספרגין, ו-KSII מתייחס לכל מולקולות KS הקשורות לחלבון בקשר GalNAc-O-Ser/Thr. סוג שלישי של קשר KS זוהה אף הוא כאשר הסוכר mannose קשור ל-serine בקשר O - גליקוזידי, והוא מוגדר כ-KSIII (Krusius וחב' ב-J Biol Chem משנת 1986). | ||
| + | |||
| + | ==KSI של קרנית העין== | ||
| + | סוג זה של KS בקרנית העין הוא הפרוטוטיפ של KSI והוא גם הסוג הנחקר ביותר. כמות ה-KS בקרנית גדולה פי-10 ויותר מכמות KS בסחוס, והיא גדולה ב-2-4 סדרי גודל מאשר כמותו ברקמות אחרות (Funderburgh וחב' ב-J Biol Chem משנת 1987). הקשר בין KSI לחלבון בקרנית העין הוא מורכב, בו האוליגוסכריד במבנה biantennary קשור בקשר N לאספרגין בחלבון הליבה (Oeben וחב' ב-Biochem J משנת 1987 כפי שמודגם בתמונה למטה). | ||
| + | |||
| + | |||
| + | [[קובץ:Corneal KSI.png|מרכז|650 פיקסלים]] | ||
| + | |||
| + | |||
| + | דיווחים אחדים מראים שהסתעפות C3 בקשר האוליגוסכרידי יכולה להיות ארוכה יותר בדומה להסתעפות C6. אכן אנליזה מבנית של KS מקרנית של קופים לא מצאה כל הוכחה לכך שהסתעפות היא קצרה ומסתיימת כמקובל על ידי חומצה סיאלית טרמינאלית (Nilsson וחב' ב-J Biol Chem משנת 1983). | ||
| + | |||
| + | ראיות להארכה של מזלג דו-שרשרתי (biantennary) של הקשר האוליגוסכרידי, מגיעות גם בהשוואת המשקל המולקולארי של KS ממקור בקר המשתחרר על ידי האנזים N-glycanase לזה של השרשרת המלאה של KS (על פי Tai וחב' ב-J Biol Chem משנת 1996). בנוסף, הסינתזה KS ממקור קרנית או זו של KS על fibromodulin (שהוא פרוטאוגליקן ממקור סחוס בו KS קשור בקשר N-type 1), לא נחסמה באופן מלא על ידי swainsonine, שהוא מעכב של העיבוד של זרוע C6 של הקודמן (precursor) של האוליגוסכריד, מה שמצביע על כך ש-KS חייב להתארך על זרוע C3 של הליבה המכילה mannose (על פי Ziegler ו-Mersmann ב-Biochim Biophys Acta משנת 1984, ו-Plaas ו-Wong-Palms ב-J Biol Chem משנת 1993). | ||
| + | |||
| + | ההוכחה להתארכות biantennary של הקשר של KSI מגיעה מניסויים בהם פרוטאוגליקן קשור ל-KS ממקור קרנית בקר, שטופל על ידי endo-beta-galactosidase, סומן בשייר GlcNAc שנבקע, וכן סומן בשיירי חומצה סיאלית בטיפול מתון של periodate (על פי Funderburgh וחב' ב-J Biol Chem משנת 1991). פפטידים תוצרי ביקוע טריפטי מחלבונים מסומנים אלה זוהו בהם הסימון הופיע כצפוי ב-KS ובשיירי חומצה סיאלית. מחקרים אלה מראים שההתארכות המונו- והבי-אנטנרי עשויה להופיע ב-KSI, ומיקום הקשר על פני החלבון עשוי להשפיע על סוג ההתארכות. הטרוגניות מוצאים גם באזור הקשר של המבנה הסוכרי לחלבון ZP3, המופיע ב-zona pellucida בו הקשר הוא מסוג N. ב-ZP3, ה-KS יכול לשנות את C3, או את C6 או את 2 הזרועות של המבנה האוליגו-סכרידי הבי-אנטנרי (Noguchi ו-Naakno ב-Eur J Biochem משנת 1992). | ||
| + | |||
| + | Oeben וחב' ב-Biochem J משנת 1987, גילו שהסולפציה של KS ממקור קרנית של חזיר, מופיעה באתרים מוגדרים ולא אקראיים. דיסכרידים הקרובים ביותר לקצה המחזר של החלבון לא הכילו שיירי סולפאט, ומרוחקים מהם מוצאים דיסכרידים עם שיירי סולפאט רק על הסוכר GlcNAc. הקצה הלא מזר של שרשרות KS מקרנית חזיר, הכילו מקטעים באורכים שונים (8-34 יחידות) של דיסכרידים שעברו סולפציה. יש גם השערה שה-N-sulfation של GlcN, יכולה להתרחש במקטעים עשירים בסולפאט של KS מהקרנית (Tang וחב' ב-Eur J Biochem משנת 1986). ב-KS מקרנית בקר בערך 70% מהשרשרות מסתיימות עם חומצה סיאלית, אשר השרשרות החרות מסתיימות עם alfagal או עם betaGalNAc (על פי Tai וחב' ב-J Biol Chem מהשנים 1996 ו-1997). | ||
| + | |||
| + | ==KSI שלא ממקור קרנית העין== | ||
| + | Fibromodulin, וכן PRELP ו-osteoadherin הם חלבונים בסחוס ובעצם, בהם גם כן מוצאים שרשרות KS בקשר N עם שינויים קלים (Antonsson וחב' ב-J Biol Chem Urine משנת 1991, Bengtsson וחב' ב-J Biol Chem משנת 1995 ו-Sommarin וחב' ב-J Biol Chem משנת 1998). מספר חלבונים בשכבת ה-Zona pellucida בשחלה (כגון הגליקופרוטאין PZP3) נושאים סכרידים הנחשבים כ-KS (Noguchi ו-Nakano ב-European J Biochem משנת 1992). גם הפרוטאו-גליקן הסחוסי הידוע כ-aggrecan מכיל שרשרות KS הקשורות בקשר N{{כ}} 2-3 , בנוסף ל-20 או יותר חלבונים של הקשר הוא מסוג O (Barry וחב' ב-J Biol Chem משנת 1995). KS עם קשרי N בודד מהדרמיס של דגי mackerel (Ito וחב' ב-Histochem J משנת 1996). בנוסף לדוגמאות אלה של KSI שלא ממקור קרנית, sulfated lactosamine הוא מרכיב שכיח של פני תאים ושל גליקופרוטאינים חוץ-תאיים. אחדים מתוצרי סולפציה זו, כוללים מבנים מסוג O-linked Lewis x, השונים מ-KS בכך שהסולפציה בהם מתרחשת רק בנקודות הקצה הלא מחזרות של השרשרת הסכרידית, ולעומת זאת מחובר בהם שייר fucose ל- GlcNAc הטרמינלי (Hemmerich וחב' ב-J Biol Chem משנת 1995 ו-Capon וחב' ב-J Biol Chem משנת 1997). | ||
| + | |||
| + | למרות שהקשרים של החלקים הסכרידיים לחלבון הליבה ב-KSI אינם ספציפיים לרקמות מסוימות, מאפיינים אחרים של KS ברקמות השונות מקרנית העין, נובעים מהמודל של הקרנית. שרשרות ה-KS ב-fibromodulin וב-osteoadherin קצרות יחסית (מכילות 8-9 דיסכרידים) והן מכילות שיירי סולפאט רבים יותר מאשר KS בקרנית (Lauder וחב' ב-Proc Natl Acad Sci USA משנת 1997). KS ב-fibromodulin בדומה ל-KS מהקרנית, מכיל שיירי galactose מעטים יותר שעברו סולפציה ליד קצות השרשרת הסוכרית. כללית, KS של fibromodulin דומה יותר לזה של הסחוס בהשוואה לה של הקרנית. | ||
| + | |||
| + | ==KSII== | ||
| + | המבנה של KS מהסחוס הארטיקולארי בבקר, מתואר בחלק 1B של התרשים. השרשרות קצרות מאלו של KS בקרנית (5-11 דיסכרידים). KSII עבר סולפציה ניכרת, ומורכב באופן כמעט מלא ממונומרים עם 2 שיירי סולפאט, ומדי פעם מופיע ב-KS זה מונומר עם שייר סולפאט יחיד של יחידת לקטוזאמין. הקישור לחלבון הוא דרך serine או threonine ומערב גם פוליסכריד מסוג mucin הידוע כ-Core 2 oligosacchride. הסיאלילציה של ה-galactose הקשור ל-C-3 של חיבור ה-GlcNAc היא רק חלקית. | ||
| + | |||
| + | השרשרות של KS מכילות חומצה סיאלית כסוכר קצה בעמדות C3 ו-C6 של ה-GlcNAc הטרמינאלי. סוכר fucose קשור בקשר α מופיע גם הוא בעמדה C3 של GlcNAc שעבר סולפציה לאורך כל השרשרת הסוכרית אך לא ב-4 שיירי hexose בקצה הלא מחזר (Brown וחב' ב-Biochem J משנת 1996). תכונה זו מבדילה את מולקולות KS מהאנטיגן Lewis X שמכיל שיירי fucose על סוכר GlcNAc בעמדת penultimate בקצה הלא-מחזר. גליקופורמים דמויי KS אלה מופיעים על פני תאי אנדותל ומשמשים כליגנדים של selectin (על פי Tangemann וחב' ב-J Exp Med משנת 1999). בצינור הנשימה, ה-KS אינו עובר fucosylaion של GlcNAc פנימי, ונושא רק חומצה סיאלית בקשר 2 →3 בעמדת הקצה של השרשרת הסוכרית (Nieduszynski וחב' ב-Biochem J משנת 1990, ו-Dickenson וחב' ב-Biochem J משנת 1991). | ||
| + | |||
| + | ==KSIII-בו השרשרת הסוכרית קשורה חלבון הליבה דרך הסוכר mannose בקשר O== | ||
| + | סוג שלישי של קשר בין KS לחלבון תואר בפרוטאוגליקאנים מהמוח (Krusius ו-Ruoslahti ב-Proc Natl Acad Sci USA משנת 1986). שרשרות KS אלו קשורות ל-serine או ל-threonine בחלבון הליבה דרך mannose בקשר KS-Man-O-Ser. קשר זה כנראה נמצא ב-phosphocan-KS, אם כי האפיון המלא של החלבונים בהם קיים קשר KS-Man-O-Ser, עדיין תלוי ועומד. | ||
| + | |||
| + | ==הביוסינתזה של KS== | ||
| + | '''אנזימים ביוסינתטיים''': KS מתארך על ידי הפעילות של גליקוזיל-טרנספראזות המוסיפים לסירוגין galactose ו-GlcNAc לפולימר ההולך וגדל. פעילות gal-transferase בתאי הקרנית דומה לזו של האנזים β-1,4-galactosyltransferase (הידוע גם כ-β4Gal-T1) הפעיל בנסיוב ובחלב (Christner וחב' ב-Arch Biochem Biophys משנת 1979). זוהתה משפחה של לפחות 7 גנים של β4Gal-T (Amado וחב' ב-Biochim Biophys Acta משנת 1999). במהלך התפתחות עוברי אפרוחים נרשמה בקרנית הגברה של ריכוז עותקי β4Gal-T במקביל לסינתזה של KS בקרנית. הפעילות של אנזים זה נותרה גבוהה במיוחד בתאי הקרנית הבוגרים (Cai וחב' ב- Exp. Eye Res משנת 1996). השוואה עם רצפים ידועים של cDNA מראה ש- β4Gal-T זהה ל-β4Gal-T1. פעילות β4Gal-T1 ממשיכה להיות מוגברת בתאי קרנית בתרבית שאבדו את היכולת לסנתז KS. למרות ש-β4Gal-T1 מצטייר כאנזים הקשור לסינתזה של KS בקרנית , אנזים ספציפי זה לא נכרך עם ביוסינתזה של KS ברקמות אחרות. | ||
| + | |||
| + | האנזים הספציפי N-acetylglucosaminyltransferase (או GnT) האחראי לסינתזה של KS לא זוהה עדיין. ידועים מספר אנזימי GnT, ששניים מהם נראים מועמדים סבירים. האנזים המאוד נפוץ iGnT נמצא משתתף בסינתזה של ה-polylactosamine הלינארי הידוע כ-i"-antigen" {{כ}}(Sasaki וחב' ב-Proc Natl Acad Sci USA משנת 1997). עותקי RNA של אנזים זה נמצאו מועשרים במוח, רקמה בה KS מסונתז באופן פעיל. זוהה אנזים GnT שני (β3GnT) הפעיל בסינתזה של polylactosamine לינארי, והוא אף שובט (Zhou וחב' ב-Proc Natl Acad Sci USA משנת 1999). אך אין כל הוכחה הכורכת GnT ספציפי עם סינתזה של KS. | ||
| + | |||
| + | הסולפציה של KS בקרנית מסתייעת על ידי לפחות 2 אנזימים מסוג sulfotransferase (Ruter ו-Kresse ב- Keratan Sulphate. Chemistry, Biology, Chemical Pathology. The Biochemical Society, London משנת 1984). שני אנזימים זוהו ושובטו, כאלה המוסיפים סולפאט ל-KS (Habuchi וחב' ב-Glycobiology משנת 1996, ו-Fukuta וחב' ב-J Biol Chem משנת 1997). אחד מ-2 אנזימים אלה מוסיף סולפאט לשיירי GalNAc של chondroitin sulfate וכן לשייר galactose של KS. האנזים השני גם כן מוסיף סולפאט ל-galactose של KS אך אינו פועל על chondroitin sulfate. כן נמצא ש-mRNA של sulfotransferase ספציפי ל-KS מבוטא באופן בולט במוח ובקרנית. נראה אם כן סביר ש- sulfotransferaseזה מייצג אנזים הקשור לביוסינתזה של KS. | ||
| + | |||
| + | KS מכיל סולפאט גם על שיירי GlcNAc וסביר שאנזים ספציפי אחראי לפעילות זו. נמצא שפעילות האנזים GlcNAc-6-sulfotransferase (או Gn6ST) בתמצית תאים קרטוציטים גורמת לסולפציה ספציפית של הקצה הלא-מחזר GlcNAc(β1–3)Gal-R (Nakazawa וחב' ב- Arch Biochem Biophysמשנת 1998). ה-cDNAs של 2 אנזימי Gn6ST עם ספציפיות לקצה הלא-מחזר GlcNAc זוהו ושובטו (Uchimura וחב' ב-J Biol Chem משנת 1998, ו-Lee וחב' ב- Biochem Biophys Res Commun משנת 1999). עם זאת השאלה נותרת פתוחה האם אחד מאנזימים אלה משתתף בסינתזה של KS. מטופלים עם macular corneal dystrophy, מחלה בה KS חסר סולפציה של GlcNAc בגוף כולו, הם בעלי רמות פעילות של אנזים זה בנסיוב (Hasegawa וחב' ב-J Biochem משנת 1999). משמעות ממצאים אלה היא שאנזים עם ספציפות דומה ויקום רקמתי מוגדר עשוי להיות קשור לסינתזה של KS. הספציפיות של האנזים Gn6ST מרמזת לכל שהסולפציה של KS GlcNAc, יכולה להתרחש באופן סימולטני רק בשיירי קצה של השרשרת המתארכת (Degroote ב-J Biol Chem משנת 1997, ו-Uchimura וחב' ב-Glycobiology משנת 1998). | ||
| + | |||
| + | ==חלבונים אליהם קשור KS== | ||
| + | ניתן לזהות KS במגוון רחב של רקמות, מה שמצביע על כך שהמנגנון האנזימטי ליצירת פולימר זה אינו מוגבל לרקמה מסוימת. אך היפוכו של דבר, רק מספר קטן של חלבונים ידועים כנשאי KS כאקט של מודיפיקציה posttranslational. המסקנה ההגיונית הנובעת משתי העובדות האחרונות היא שחלבוני ליבה אלה השפעתם ניכרת בביוסינתזה של KS. הבנת הגנים וביטויים של גנים אלה בהקשר של KS proteoglycan core proteins, חיונית להבנת הביוסינתזה של KS. בשנים האחרונות, זוהו ואופיינו מספר חלבונים נשאי-KS, וכן זוהו הגנים המקודדים לחלבונים אלה. הטבלה למטה מפרטת את החלבונים נשאי-KS שזוהו עד כה: | ||
| + | |||
| + | {| class="wikitable" dir="ltr" | ||
| + | |- | ||
| + | !חלבון!!הקשר בין החלבון וקרטאן סולפאט!!מיקום רקמתי!!מובאה | ||
| + | |- | ||
| + | !Protein/gene!!KS-protein linkage!!Tissue/cell type localization!!Reference | ||
| + | |- | ||
| + | | Lumican ||KSI||Cornea|| Blochberger et al., 1992 | ||
| + | |- | ||
| + | |Keratocan||KSI||Cornea ||Corpuz et al., 1996 | ||
| + | |- | ||
| + | |Mimecan ||KSI ||Cornea ||Funderburgh et al., 1997a | ||
| + | |- | ||
| + | |Fibromodulin||KSI||Cartilage||Oldberg et al., 1989 | ||
| + | |- | ||
| + | |Aggrecan||KSI and KSII ||Cartilage||Barry et al., 1995 | ||
| + | |- | ||
| + | |PRELP||KSI||Cartilage ||Bengtsson et al., 1995 | ||
| + | |- | ||
| + | |Osteoadherin||KSI||Bone ||Sommarin et al., 1998 | ||
| + | |- | ||
| + | |PZP3||KSI||Zona pellucida||Noguchi and Nakano, 1992 | ||
| + | |- | ||
| + | |MUC1||NAa ||Endometrial epithelium||Aplin et al., 1998 | ||
| + | |- | ||
| + | |CD44 ||NA||Carcinoma line KM12L4 ||Takahashi et al., 1996 | ||
| + | |- | ||
| + | ||| ||Epidermis||Tuhkanen et al., 1997 | ||
| + | |- | ||
| + | |Cytokeratins ||NA||Epidermal keratinocytes||Schafer and Sorrell, 1993 | ||
| + | |- | ||
| + | |ABAKAN ||NA ||Brain||Seo and Geisert, 1995 | ||
| + | |- | ||
| + | |SV2 ||NA||Synaptic vesicles||Carlson, 1996 | ||
| + | |- | ||
| + | |Phosphocan KS||KSIII ||Brain||Margolis et al., 1996 | ||
| + | |- | ||
| + | |Claustrin ||NA||Brain ||Burg and Cole, 1994 | ||
| + | |- | ||
| + | |PG-1000||NA ||Electric organ||Carlson et al., 1996 | ||
| + | |- | ||
| + | |Lumican||KSI||Cornea||Blochberger et al., 1992 | ||
| + | |- | ||
| + | |Keratocan ||KSI||Cornea||Corpuz et al., 1996 | ||
| + | |- | ||
| + | |Mimecan||KSI ||Cornea||Funderburgh et al., 1997a | ||
| + | |- | ||
| + | |Fibromodulin||KSI ||Cartilage ||Oldberg et al., 1989 | ||
| + | |- | ||
| + | |Aggrecan||KSI and KSII||Cartilage||Barry et al., 1995 | ||
| + | |- | ||
| + | |PRELP||KSI||Cartilage|| Bengtsson et al., 1995 | ||
| + | |- | ||
| + | |Osteoadherin|| KSI||Bone||Sommarin et al., 1998 | ||
| + | |- | ||
| + | |PZP3||KSI||Zona pellucida ||Noguchi and Nakano, 1992 | ||
| + | |- | ||
| + | |MUC1||NAa||Endometrial epithelium||Aplin et al., 1998 | ||
| + | |- | ||
| + | |CD44||NA||Carcinoma line KM12L4||Takahashi et al., 1996 | ||
| + | |- | ||
| + | |CD44|| NA||Epidermis||Tuhkanen et al., 1997 | ||
| + | |- | ||
| + | |Cytokeratins||NA||Epidermal keratinocytes ||Schafer and Sorrell, 1993 | ||
| + | |- | ||
| + | |ABAKAN||NA ||Brain ||Seo and Geisert, 1995 | ||
| + | |- | ||
| + | |SV2 ||NA||Synaptic vesicles ||Carlson, 1996 | ||
| + | |- | ||
| + | |Phosphocan KS||KSIII ||Brain||Margolis et al., 1996 | ||
| + | |- | ||
| + | |Claustrin||NA||Brain||Burg and Cole, 1994 | ||
| + | |- | ||
| + | |PG-1000||NA||Electric organ||Carlson et al., 1996 | ||
| + | |} | ||
| + | |||
| + | ==הביולוגיה של התא של KS== | ||
| + | התפקיד של KS בהידרציה של הקרנית אין בו כדי להסביר את הנוכחות של כמויות קטנות של KS במספר כה גדול של רקמות אחרות. מספר תפקידים ביולוגיים פעילים תועדו עבור hyaluronan ,heparan sulfate ו-chondroitin sulfate (על פי Iida וחב' ב-Semin Cancer Biol משנת 1996, ו-Toole וחב' ב-J Intern Med משנת 1997 וכן Lindahl ב-Haemostasis משנת 1999). מחקרים על KS הגיעו למסקנה ש-KS הוא גם משתתף פעיל בביולוגיה התאית של הרקמות בהן הוא ממוקם. מקרופאגים של עכברים מבטאים על פניהם קולטן בעל זיקה גבוהה ל-lumican כמו גם ל-lumican שעבר מודיפיקציה על ידי oligolactosamine המכיל סולפאט בודד. תאים אלה אינם קושרים lumican הנושא KS ששרשרותיו עברו סולפציה. הרחקת KS על ידי האנזים endo-β-galactosidase, החזירה לתאים את יכולתם להיספח in vitro למשטחים המצופים עם lumican-KS (על פי Funderburgh וחב' ב-Invest Ophthalmol Vis Sci משנת 1997). תכונה נוגדת-ספיחה זו של KS, נמצאה גם במחקרים אחרים. | ||
| + | |||
| + | מולקולות המכילות KS, מהוות מחסום לשגשוג תאי neurites בתנאי in vitro, וסבורים שהם משפיעים על כוונון צורת גידולם של אקסונים בעת ההתפתחות העוברית, או בעת הרגנרציה שלהם in vivo (על פי Burg ו-Cole ב-J Neurobiol משנת 1994, ו-Olsson וחב' ב-Pigment Cell Res משנת 1996). תכונת מחסום זו של KS משתמעת גם מהממצאים ששרשרות KS על aggrecan חוסמות את ההתפתחות של תגובה חיסונית in vivo וכן in vitro למקטע ה-G1 של חלבון זה, ובכך מדכאות את ההתפתחות של osteoarthritis המושרה על ידי אנטיגנים (Guerassimov וחב' ב-Arthritis Rheum משנת 1999). | ||
| + | |||
| + | ריכוז גבוה יחסית של KS תאי בשכבת האנדומטריום של הרחם משתנה במהלך המחזור החודשי, ומגיע לשיאו בשלב של השרשת העובר (Graham וחב' ב-Hum Reprod משנת 1994). בנקודת זמן זו מולקולות רגישות לאנזים keratanase חוסמות את הגישה של נוגדנים כנגד אפיטופים של muc1 שבדרך כלל כן זמינים לנוגדנים בפרקי זמן אחרים של המחזור החודשי (DeLoria וחב' ב-Hum Reprod משנת 1998). ממצאים אלה מרמזים לתפקידו הפוטנציאלי של KS בשלב השרשת העובר. ל-KS מייחסים גם תפקיד בתנועה של תאי האנדותל בקרנית, שהוא אפיתליום חד שכבתי המכסה את פני הקרנית האחוריים. תאים אלה באופן נורמאלי מכילים KS בפיזור דמוי-מוזאיקה בחלק האפיקלי שלהם, אך לאחר פציעה כמות ה-KS פוחתת או אף מתאפסת על פני התאים הנודדים. עם הפסקת הנדידה של תאים אלה רמת KS חוזרת לקדמותה על פני התאים (Davies וחב' ב-Exp Eye Res משנת 1999). התכונות נוגדות הספיחה של KS, עשויות להיות משמעותיות בתהליך השרשת העובר כמו גם בתהליך תנועתיות של תאים (Greenwood ו-Murphy-Ullrich ב-Microsc Res Tech משנת 1998). | ||
| + | |||
| + | ==פרוטאו-גליקאנים קצרים עתירי leucine== | ||
| + | זו קבוצה של חלבונים שהם מרכיבים אופייניים של המשתית (matrix) האינטרסטיציאלית. כל חלבונים במשפחה זו, מכילים סדרה של 24 רצפים העשירים בחומצת האמינו- leucine, הבונים את החלק המרכזי של כל אחד מחלבונים אלה. כנראה שרצפים-עתירי-leucine אלה, גורמים לחלבונים המכילים אותם לקפל אותם לסדרה של beta-sheets, ליצור מבנה תלת-ממדי דמוי-קשת, עם אתרי קישור ל-KS המכווננים באופן ששרשרות KS משתרעות מהצד הקמור של הקשת (Iozzo ב-Crit Rev Biochem Nol Biol משנת 1997, ו-Scott ב-Biochemistry משנת 1996). בקרנית, KS מופיע על 3 חלבונים עם רצפים-עתירי-leucine, והם lumican, keratocan ו-mimecan (על פי Funderburgh וחב' ב-J Biol chem משנת 1993, ו-Corpuz וחב' ב-J Biol Chem משנת 1996).החלבונים fibromodulin ו-prolargin (המקודד על ידי הגן PRELP), הנמצאים בסחוס, והחלבון osteoadherin הנמצא בעצם, הם גם כן חלבונים עתירי leucine המכילים KS (על פי Antonsson וחב' ב-J Biol Chem משנת 1991). | ||
| + | |||
| + | פפטידים הקשורים ל-KS שנוצרו בביקוע של fibromodulin על ידי טריפסין, מכילים את כל ארבעת האתרים הפוטנציאליים ל-N-גליקוזילציה בחלבון זה, אך מדידת הגודל של פיברומודולין שלם, מביאה למסקנה שקיים רק אתר בודד במולקולת החלבון אליה נקשר KS (על פי Plaas ב-J Biol Chem משנת 1990). בגישה דומה זוהו אתרי קישור של KS בחלבונים lumican ו-keratocan מקרנית של תרנגולת (Dunlevy ב-J Biol Chem משנת 1998). אתר הקישור של KS בכל אחד מחלבונים אלה, היה בצידו ה-N טרמינאלי של ה-leucine הראשון של ה-leucine-rich-repeat. | ||
| + | |||
| + | ==הפרוטאוגליקן aggrecan== | ||
| + | הפרוטאוגליקן העיקרי בסחוס הוא החלבון המאוד גדול aggrecan בו ה-KS קשור ל-2 מקטעים (domains) נפרדים. רוב ה-KS קשור בקשר O ל-aggrecan בין האזורים G2 ו-G3 במקטע המאופיין על ידי motif שבו יש repeats של 6 חומצות אמינו (Flannery וחב' ב-Matrix Biol משנת 1998). הרצף של ה-motif שמור מאוד במינים שונים של בעלי חוליות, אך מספרם של הרצפים החוזרים משתנה (Barry וחב' ב-Matrix Biol 1994 משנת 1994). שינוי זה במספר הרצפים החוזרים אחראי כנראה להבדלים בתכולת KS של aggrecan במיני בעלי החוליות השונים. במכרסמים, הרצף של ה-motif אינו שמור, ולכן במכרסמים ה-KS השלדי מופחת מאוד בכמותו או אפילו חסר. KS קשור כמוכן ל-aggrecan ליד הקצה ה-N טרמינאלי של החלבון, במטע הקושר-HA, בשתי צורות הקישור N ו-O. שרשרות KS באזור הקישור של HA, עשויים להיות בעלי אורכים שונים ומספר שיירי סולפאט שונים, בהשוואה לשרשרת מהאזור הקושר GAG של החלבון. עובדה זו מרמזת לכך שהקונפורמציה של החלבון במולקולת ענק זו, יכולה לפקח על הזמינות לאנזימים glycosyl transferase ו-sulfotransferase בעת המעבר של החלבון דרך ה-Golgi. | ||
| + | |||
| + | ==פרוטאו-גליקנים קשורים לתאים== | ||
| + | הודגם ש-KS קשור למספר רקמות אפיתליאליות. קרטינוציטים, תאי אנדומטריום של הרחם, תאי אנדותל של הקרנית, בלוטת הרוק, אפיתל של בלוטות הזיעה, ובלוטת ה-sebaceous (החלב), כל אלה מכילים KS ברקמות של מבוגרים (Sorell ו-Caterson ב-Histochemistry משנת 1990, ו-Shiozawa וחב' ב-Gynecol Obstet Invest משנת 1991 ו-Fullwood וחב' ב-Invest Ophthalmol Vis Sci משנת 1996). ניתן למצוא KS גם במגוון של תאי קרצינומה ממקור אפיתליאלי (Leygue וחב' ב-Cancer Res משנת 1998). החלבון MUC1 של האנדומטריום נמצא מכיל KS (על פי Alpin וחב' ב-Glycobiology משנת 1998). החלבון MUC1 הוא מרכיב שכיח של שכבת ה-mucin הקשורה עם המשטחים האפיקליים של האפיתליום המפריש. ייתכן ש-MUC1 אחראי לנוכחות של KS ברבות מבין בלוטות בהן דווח על הימצאו. | ||
| + | |||
| + | חלבון נוסף של פני התא, CD44, מכיל אף הוא KS (על פי Tuhkanen וחב' ב-Invest Dermatol משנת 1997). החלבון CD44 מופיע במספר צורות spliced, שחלקן מכילות heparan sulfate. מסתבר ש-CD44 ו-SV2 הם 2 החלבונים האינטגרליים של ממברנות תאים הראשונים הידועים כמכילים KS. סוג שלישי של KS הקשור לתאים תואר בדמותם של קרטינים תוך-תאיים בקרטינוציטים (Schafer ו-Sorell ב-Exp Cell Res משנת 1993). דוגמאות אלו של חלבונים תאיים מכילי-KS, מצביעים על כך שבדומה ל-chondroitin sulfate ו-heparan sulfate, מולקולות של KS אינן מוגבלות רק לרקמות חיבור אינטרסטיציאליות, אלא מופיעות גם כחלק של חלבונים במגוון רחב של מיקומים תאיים. | ||
| + | |||
| + | ==פרוטאוגליקנים במוח== | ||
| + | אחד מתחומי המחקר הפעילים ביותר בהקשר של KS, מתייחס לפרוטאוגליקנים של מערכת העצבים המרכזית. לאחר הקרנית ורקמות השלד, נראה שהמוח הוא עשיר ב-KS, ואחד העשירים ביותר מבחינת האנזימים הביוסיתטיים של KS. הפרוטאוגליקן העיקרי בסחוס, aggrecan, מופיע ברקמות עצביות, אך aggrecan במוח כנראה שאינו מכיל KS (על פי Domowicz וחב' ב-Develop Biol משנת 1995(. מספר פרוטאוגליקנים שנראים אופייניים לרקמות עצביות תוארו, כולל ABAKAN (על פי Seo ו-Geisert ב-Neurosci Lett משנת 1995), החלבון SV2 (על פי Carlson ב-Perspect Dev Neurobiol משנת 1996), החלבון PG-1000 (על פי Carlson וחב' ב-Matrix Biol משנת 1996), החלבון claustrin (על פי Burg ו-Cole משנת 1994), ו-phosphocan-KS (על פי Margolis וחב' ב-Perspect Dev Neurobiol משנת 1996). מספר נוסף של חלבונים להם קשור KS קיימים ברקמה עצבית אך האפיון שלהם אינו מלא (Miller ב-J Comp Neurol משנת 1997). | ||
| + | |||
| + | ==הבקרה על סינתזה של KS== | ||
| + | הביוסינתזה של KS לעתים קרובות משתנה באופן בולט בתגובה לשינויים מטבוליים, פתולוגיים או התפתחותיים ברקמות. צורה אופיינית אחת של ביטוי KS היא ביטוי וסולפציה מוגברים של KS הכרוכה בשינויים התפתחותיים. תופעה זו תוארה לראשונה בקרנית. בעוברי תרנגולת לא ניתן לגלות sulfated KS אלא לאחר 12 שעות לאחר החדירה של הנדידה של תאי הרכס העצבי (neural crest) לתוך הסטרומה הראשונית של הקרנית (Funderburgh וחב' ב-Dev Biol משנת 1986). לאחר 12 שעות, KS מצטבר במהירות בסטרומה, והצטברות זו נמשכת גם לאחר בקיעת הגוזל מהביצה, וגם בתרנגולת הבוגרת. בדומה, גם בקרנית של עוברי עכבר lumican נמצא בעיקר בגליקופרוטאין נטול סולפאט, אך לאחר 10-14 יום מתחילים לגלות בו KS, בערך במועד בו הוא פותח את עיניו (Ying וחב' ב-J Biol Chem משנת 1997). הגידול בממדי KS בקרנית העכבר נמשך עד גיל שנה. מחקרים על ריכוז KS בקרנית האדם, מצביעים על המשך בגידול KS לאורך כל החיים (Praus ו-Brettschneider ב-Ophthal Res משנת 1975). | ||
| + | |||
| + | בסחוס מראה KS שינויים התפתחותיים דומים לאלה שמוצאים בקרנית. תכולת KS ב-aggrecan של הסחוס גדלה עם הגיל בכל הקשור להתארכות שרשרות KS ודרגת הסולפציה שלהן (Brown וחב' ב-J Biol Chem משנת 1998). ממצא דומה דווח על ידי Lauder וחב' ב-Biochem J משנת 1998 באשר להתפתחות KS ב-fibromodulin בסחוס ארטיקולארי. גם במוח חולדה, מוצאים כמות קטנה של KS בשלב העוברי, כאשר ההגדלה המשמעותית של KS מתגלה לאחר הלידה (Meyer-Puttlitz וחב' ב-J Neurochem משנת 1995). | ||
| + | |||
| + | תכונה נוספת של הביוסינתזה של KS היא בשינויים התכופים שהוא עובר בריפוי פציעות וכן in vitro. סוגי תאים המפרישים KS (תאי עצב, כונדרוציטים וקרטינוציטים), שקטים in vivo, אך בתנאי in vitro, כונדרוציטים וקרטינוציטים, בתלות בתנאי התרבית מציגים לעתים מורפולוגיה פיברובלסטית, ומאבדים את יכולת הסינתזה של KS. בפציעות של הקרנית, קרטינוציטים משופעלים להתחלק, לרכוש פנוטיפ פיברובלסטי ולסנטז רק כמות מועטה של KS. מצבים פתולוגיים תת-חריפים או כרוניים המשפיעים על הקרנית גם כן גורמים לעתים תכופות לאיבוד KS בסטרומה (Funderburgh וחב' ב-Invest Ophthalmol vis Sci משנת 1990, ו-Rodriguez וחב' ב-Am J Ophthalmol משנת 1992). במוח, KS של תאי מיקרוגליה פוחת במצבי דלקת (Jander וחב' ב-Glia משנת 2000), ו-KS צרבראלי מופחת במחלת אלצהיימר (Lindahl וחב' ב-J Biol Chem משנת 1996). הפחתת הכמות של KS במוח וכן בקרנית קשור כנראה לתהליך הדלקת, מה שמרמז לתפקיד של ציטוקינים תומכי-דלקת ב-downregulation של הביוסינתזה של KS. | ||
| + | |||
| + | מספר מחקרים חקרו את ההיעלמות של KS בפיברובלסטים ממקור קרנית שגודלו בתרבית. אנליזה מפורטת של תוצרי סינתזה של תרביות תאים אלה, הדגימה ביטוי של כל שלושת החלבונים קושרי-KS, אך חלבונים אלה עברו מודיפיקציה עם oligogalactosamine קטום (truncated) עם מעט מאוד או אף ללא כל סולפציה (Funderburgh וחב' ב-J Biol Chem משנת 1996). תוצאות אלה מרמזות לכך שההפחתה בביו-סינתזה של KS בתנאי in vitro וכן במצבי ריפוי פציעות, נובעת מ-downregulation של פעילות של גליקוזיל טרנספרזות וסולפו טרנספרזות ספציפיות ל-KS. מחקר שהשתמש בקרטינוציטים טריים שבודדו זה עתה מתרנגולות, וזמן קצר לאחר זריעת התאים בתרבית נמצאה ירידה תלולה בסולפציה של שיירי GlcNAc (על פי Nakazawa וחב' ב-J Biol Chem משנת 1998). פיתוח שיטה לגידול בתרבית של קרטינוציטים המסוגלים לסנתז KS מקרו-מולקולארי עם סולפציה מלאה למשך פרקי זמן ארוכים in vitro, סיפק כלי חיוני לזיהוי של אנזימים ספציפיים לסינתזה של KS (על פי Beales וחב' ב-Invest Ophthalmol vis Sci משנת 1999). נמצא שביוסינתזה של KS על ידי קרטינוציטים בתרבית בשיטה זו, דוכאה על ידי נסיוב של עוברי בקר, וכן על ידי TGFβ, אך לעומת זאת FGF או fibroblast growth factor 2 סייע לשמור על סינתזת KS בתרבית (Long וחב' ב-J Biol Chem משנת 2000). | ||
| + | |||
| + | ==פונקציות ביולוגיות של KS== | ||
| + | הידרציה של רקמות: בקרנית, הנוכחות הניכרת של KS נראית קשורה להידרציה של רקמה זו שהיא מאוד חיונית לשקיפות הקרנית. פרוטאו-גליקנים הקושרים KS ו-dermata sulfate בקרנית, הם בעלי תכונה של ספיחת מים (Bettelheim ו-Plessy ב-Biochim Biophys Acta משנת 1975, ו-Hedbys ב-Exp Eye Res משנת 1961). ברמות הידרציה האופייניות לסטרומה נורמאלית של הקרנית, dematan sulfate מייצג דרגת הידרציה מלאה, בה בשעה ש-KS מייצג רק הידרציה חלקית, ונראה ש-KS מספק בופר דינאמי להידרציה של הקרנית. החשיבות של KS בסטרומה, נתמכת על ידי נתונים ממחלות כמו macular corneal dystrophy בה חל שינוי באיזון של glycosaminoglycans (על פי Hassell וחב' ב-Proc Natl Acad Sci USA משנת 1980). מוטציה בעכברים שגרמה לחסר lumican, גרמה בקרנית לירידה של 25% ברמת KS, וגרמה להפחתה בהידרציה של הסטרומה (Chakravarti וחב' ב-J Cell Biol משנת 1998). עכברים אלה פיתחו תוך 3-6 חודשים קרנית מעורפלת, שהוא פרק הזמן המתאים להצטברות של KS עם סולפציה מלאה בקרנית עכבר. | ||
| + | |||
| + | ==הוראות לביצוע הבדיקה== | ||
| + | יש לאסוף דגימת שתן אקראית (עדיפה דגימת בוקר), ולהקפיאה באופן מידי. כדגימת שתן קפואה, יציבות הדגימה היא עד שנה. שיטת הבדיקה Liquid Chromatography-Tandem Mass Spectrometry (LC-MS/MS). | ||
| + | |||
| + | ==ראו גם== | ||
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[אבחון מחלות ומפגעים מטבוליים-גנטיים|בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים]] | ||
| + | * [[אבחון תסמנות גנטיות|בדיקות מעבדה - אבחון תסמנות גנטיות]] | ||
| + | |||
| + | |||
| + | {{ייחוס בן עמי}} | ||
| + | |||
| + | |||
| + | [[קטגוריה:בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים]] | ||
| + | [[קטגוריה:בדיקות מעבדה - אבחון תסמנות גנטיות]] | ||
| + | [[קטגוריה:בדיקות מעבדה: גנטיקה]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בשתן]] | ||
גרסה אחרונה מ־18:19, 26 בספטמבר 2017
| מדריך בדיקות מעבדה | |
| קרטן סולפט | |
|---|---|
| Keratan sulfate | |
| שמות אחרים | MPS IVA, N-acetylgalactosamine-6-sulfate sulfatase |
| מעבדה | כימיה בשתן |
| תחום | אחד ה-glycosaminoglycans (GAG) במחלת אגירה ממשפחת המוקופוליסכרידוזות (MPS) |
| טווח ערכים תקין | 0-12 months: < or =2.50 mg/mmol creatinine; 13-24 months: < or =2.00 mg/mmol creatinine; 25 months-4 years: < or =1.50 mg/mmol creatinine; 5-10 years: < or =1.00 mg/mmol creatinine; -18 years: < or =0.80 mg/mmol creatinine11; >18 years: < or = 0.50 mg/mmol creatinine |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
ניטור של ההשפעות הפרמאקו-דינמיות של תוספי האנזים החסר במחלת Morquio A (MPS IVA) .
מידע קליני
המוקופוליסכריזודות (MPS) היא קבוצה של מפגעים הנגרמים כתוצאה מפגם באחד מהאנזימים המשתתפים בפירוק של ה-GAGs הבאים: dermatan sulfate, heparan sulfate, keratan sulfate או chondroitin sulfate. GAGs שאינם מתפרקים או שהם מפורקים באופן חלקי בלבד, נאגרים בליזוזומים ומופרשים בשתן. אגירה של GASGs בליזוזומים מפריעה לתפקוד התקין של תאים, רקמות ואיברים, מה שגורם לתסמינים קליניים המאפיינים את מפגעי MPS. ידוע על 11 חסרים אנזימטיים העלולים לגרום ל-MPS.
תסמונת Morquio או mucopolysaccharidosis IV נגרמת על ידי פגיעה בפירוק של keratan sulfate בגין החסר של האנזים N-acetylgalactosamine 6-sulfatase ב-MPS IVA, או בגין חסר שלβ-galactosidase ב-MPS.IVB Keratan sulfate , וכן chondroitin-6-sulfate במקרה של MPS IVA, מצטברים בתאים והעודף מופרש בשתן. מאפיינים קליניים של Morquio A ו-B, כוללים גמדוּת, דיספלזיה של השלד (spondyloepiphyseal) השונה מזו שמוצאים ב-MPS אחרים, קרנית עכורה, פגיעה בשיניים, נגעים לבביים, hepatomegaly, ועם זאת אינטליגנציה תקינה. דרגת החומרה מגוונת מאוד ב-2 סוגי המחלה, וכללית חומרת התסמינים מתונה יותר ב-Morquio B. השכיחות של תסמונות MPS IVA ו- MPS IVB נעה בין מקרה אחד לכל 200,000-300,000 לידות-חי. תרפיה על ידי מתן האנזים החסר (enzyme replacement therapy) זמינה במקרים של Morquio A, אם כי במקרים של Morquio B יעילותה מוגבלת. טיפול אנזימטי זה נמצא מפחית את רמת keratan sulfate בשתן של המטופלים עם Morquio A, אך היעילות הקלינית שנויה במחלוקת.
שבעה עשורים של keratin sulfate
Keratan sulfate (להלן KS) זוהה לראשונה בשנת 1939 על ידי Suzuki בתמצית של קרנית העין מה שדווח ב-J Biochem באותה שנה. בשנות ה-50 היו אלה Karl Meyer ואחרים שאפיינו את התרכובת כפולימר ליניארי של lactosamine (3Galβ1–4GlcNAcβ1) שעבר סולפציה בעמדה C6 של שתי מולקולות ה-hexose (Meyer וחב' ב-J Biol Chem משנת 1953). במרוצת העשורים שחלפו העניין ב-KS הלך והתגבר, ומספר הפרסומים עליו גדל פי-5 משנות ה-70 ועד סוף שנות ה-90. בין המאמרים המכוננים על המבנה והביוסינתזה של KS נזכיר את אלה של Hascall ב- Prog. Clin. Biol. Res משנת 1982, Nieduszynski וחב' ב- Biochem. Soc. Trans משנת 1990, ו-Funderburgh וחב' ב- Biochem. Soc. Trans. משנת 1991.
סוגי KS
במקור ההגדרות של KSI ו-KSII היו מבוססות על ההבדלים בין KS ממקור קרנית העין ו-KS ממקור סחוס. KS בקרנית קשור בקשר N לשייר aspargine בחלבון הליבה, בעוד ש-KS בסחוס קשור בקשר O לשיירי serine או threonine. שני קשרים אלה אינם ספציפיים לרקמה זו או אחרת מבחינת מיקומם. ההגדרות הנמצאות בשימוש הן KSI הכולל את כל מולקולות KS הקשורות לאספרגין, ו-KSII מתייחס לכל מולקולות KS הקשורות לחלבון בקשר GalNAc-O-Ser/Thr. סוג שלישי של קשר KS זוהה אף הוא כאשר הסוכר mannose קשור ל-serine בקשר O - גליקוזידי, והוא מוגדר כ-KSIII (Krusius וחב' ב-J Biol Chem משנת 1986).
KSI של קרנית העין
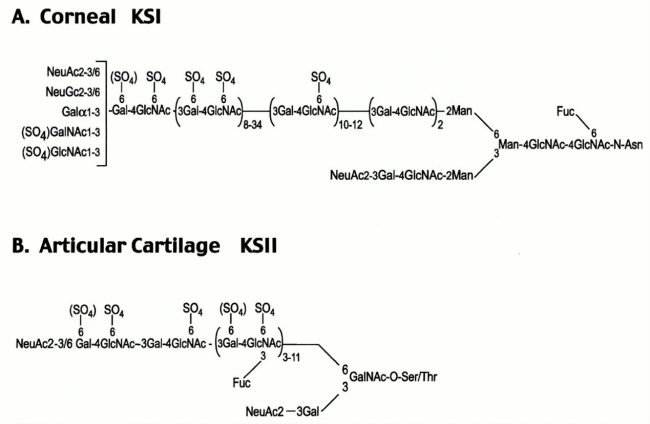
סוג זה של KS בקרנית העין הוא הפרוטוטיפ של KSI והוא גם הסוג הנחקר ביותר. כמות ה-KS בקרנית גדולה פי-10 ויותר מכמות KS בסחוס, והיא גדולה ב-2-4 סדרי גודל מאשר כמותו ברקמות אחרות (Funderburgh וחב' ב-J Biol Chem משנת 1987). הקשר בין KSI לחלבון בקרנית העין הוא מורכב, בו האוליגוסכריד במבנה biantennary קשור בקשר N לאספרגין בחלבון הליבה (Oeben וחב' ב-Biochem J משנת 1987 כפי שמודגם בתמונה למטה).
דיווחים אחדים מראים שהסתעפות C3 בקשר האוליגוסכרידי יכולה להיות ארוכה יותר בדומה להסתעפות C6. אכן אנליזה מבנית של KS מקרנית של קופים לא מצאה כל הוכחה לכך שהסתעפות היא קצרה ומסתיימת כמקובל על ידי חומצה סיאלית טרמינאלית (Nilsson וחב' ב-J Biol Chem משנת 1983).
ראיות להארכה של מזלג דו-שרשרתי (biantennary) של הקשר האוליגוסכרידי, מגיעות גם בהשוואת המשקל המולקולארי של KS ממקור בקר המשתחרר על ידי האנזים N-glycanase לזה של השרשרת המלאה של KS (על פי Tai וחב' ב-J Biol Chem משנת 1996). בנוסף, הסינתזה KS ממקור קרנית או זו של KS על fibromodulin (שהוא פרוטאוגליקן ממקור סחוס בו KS קשור בקשר N-type 1), לא נחסמה באופן מלא על ידי swainsonine, שהוא מעכב של העיבוד של זרוע C6 של הקודמן (precursor) של האוליגוסכריד, מה שמצביע על כך ש-KS חייב להתארך על זרוע C3 של הליבה המכילה mannose (על פי Ziegler ו-Mersmann ב-Biochim Biophys Acta משנת 1984, ו-Plaas ו-Wong-Palms ב-J Biol Chem משנת 1993).
ההוכחה להתארכות biantennary של הקשר של KSI מגיעה מניסויים בהם פרוטאוגליקן קשור ל-KS ממקור קרנית בקר, שטופל על ידי endo-beta-galactosidase, סומן בשייר GlcNAc שנבקע, וכן סומן בשיירי חומצה סיאלית בטיפול מתון של periodate (על פי Funderburgh וחב' ב-J Biol Chem משנת 1991). פפטידים תוצרי ביקוע טריפטי מחלבונים מסומנים אלה זוהו בהם הסימון הופיע כצפוי ב-KS ובשיירי חומצה סיאלית. מחקרים אלה מראים שההתארכות המונו- והבי-אנטנרי עשויה להופיע ב-KSI, ומיקום הקשר על פני החלבון עשוי להשפיע על סוג ההתארכות. הטרוגניות מוצאים גם באזור הקשר של המבנה הסוכרי לחלבון ZP3, המופיע ב-zona pellucida בו הקשר הוא מסוג N. ב-ZP3, ה-KS יכול לשנות את C3, או את C6 או את 2 הזרועות של המבנה האוליגו-סכרידי הבי-אנטנרי (Noguchi ו-Naakno ב-Eur J Biochem משנת 1992).
Oeben וחב' ב-Biochem J משנת 1987, גילו שהסולפציה של KS ממקור קרנית של חזיר, מופיעה באתרים מוגדרים ולא אקראיים. דיסכרידים הקרובים ביותר לקצה המחזר של החלבון לא הכילו שיירי סולפאט, ומרוחקים מהם מוצאים דיסכרידים עם שיירי סולפאט רק על הסוכר GlcNAc. הקצה הלא מזר של שרשרות KS מקרנית חזיר, הכילו מקטעים באורכים שונים (8-34 יחידות) של דיסכרידים שעברו סולפציה. יש גם השערה שה-N-sulfation של GlcN, יכולה להתרחש במקטעים עשירים בסולפאט של KS מהקרנית (Tang וחב' ב-Eur J Biochem משנת 1986). ב-KS מקרנית בקר בערך 70% מהשרשרות מסתיימות עם חומצה סיאלית, אשר השרשרות החרות מסתיימות עם alfagal או עם betaGalNAc (על פי Tai וחב' ב-J Biol Chem מהשנים 1996 ו-1997).
KSI שלא ממקור קרנית העין
Fibromodulin, וכן PRELP ו-osteoadherin הם חלבונים בסחוס ובעצם, בהם גם כן מוצאים שרשרות KS בקשר N עם שינויים קלים (Antonsson וחב' ב-J Biol Chem Urine משנת 1991, Bengtsson וחב' ב-J Biol Chem משנת 1995 ו-Sommarin וחב' ב-J Biol Chem משנת 1998). מספר חלבונים בשכבת ה-Zona pellucida בשחלה (כגון הגליקופרוטאין PZP3) נושאים סכרידים הנחשבים כ-KS (Noguchi ו-Nakano ב-European J Biochem משנת 1992). גם הפרוטאו-גליקן הסחוסי הידוע כ-aggrecan מכיל שרשרות KS הקשורות בקשר N 2-3 , בנוסף ל-20 או יותר חלבונים של הקשר הוא מסוג O (Barry וחב' ב-J Biol Chem משנת 1995). KS עם קשרי N בודד מהדרמיס של דגי mackerel (Ito וחב' ב-Histochem J משנת 1996). בנוסף לדוגמאות אלה של KSI שלא ממקור קרנית, sulfated lactosamine הוא מרכיב שכיח של פני תאים ושל גליקופרוטאינים חוץ-תאיים. אחדים מתוצרי סולפציה זו, כוללים מבנים מסוג O-linked Lewis x, השונים מ-KS בכך שהסולפציה בהם מתרחשת רק בנקודות הקצה הלא מחזרות של השרשרת הסכרידית, ולעומת זאת מחובר בהם שייר fucose ל- GlcNAc הטרמינלי (Hemmerich וחב' ב-J Biol Chem משנת 1995 ו-Capon וחב' ב-J Biol Chem משנת 1997).
למרות שהקשרים של החלקים הסכרידיים לחלבון הליבה ב-KSI אינם ספציפיים לרקמות מסוימות, מאפיינים אחרים של KS ברקמות השונות מקרנית העין, נובעים מהמודל של הקרנית. שרשרות ה-KS ב-fibromodulin וב-osteoadherin קצרות יחסית (מכילות 8-9 דיסכרידים) והן מכילות שיירי סולפאט רבים יותר מאשר KS בקרנית (Lauder וחב' ב-Proc Natl Acad Sci USA משנת 1997). KS ב-fibromodulin בדומה ל-KS מהקרנית, מכיל שיירי galactose מעטים יותר שעברו סולפציה ליד קצות השרשרת הסוכרית. כללית, KS של fibromodulin דומה יותר לזה של הסחוס בהשוואה לה של הקרנית.
KSII
המבנה של KS מהסחוס הארטיקולארי בבקר, מתואר בחלק 1B של התרשים. השרשרות קצרות מאלו של KS בקרנית (5-11 דיסכרידים). KSII עבר סולפציה ניכרת, ומורכב באופן כמעט מלא ממונומרים עם 2 שיירי סולפאט, ומדי פעם מופיע ב-KS זה מונומר עם שייר סולפאט יחיד של יחידת לקטוזאמין. הקישור לחלבון הוא דרך serine או threonine ומערב גם פוליסכריד מסוג mucin הידוע כ-Core 2 oligosacchride. הסיאלילציה של ה-galactose הקשור ל-C-3 של חיבור ה-GlcNAc היא רק חלקית.
השרשרות של KS מכילות חומצה סיאלית כסוכר קצה בעמדות C3 ו-C6 של ה-GlcNAc הטרמינאלי. סוכר fucose קשור בקשר α מופיע גם הוא בעמדה C3 של GlcNAc שעבר סולפציה לאורך כל השרשרת הסוכרית אך לא ב-4 שיירי hexose בקצה הלא מחזר (Brown וחב' ב-Biochem J משנת 1996). תכונה זו מבדילה את מולקולות KS מהאנטיגן Lewis X שמכיל שיירי fucose על סוכר GlcNAc בעמדת penultimate בקצה הלא-מחזר. גליקופורמים דמויי KS אלה מופיעים על פני תאי אנדותל ומשמשים כליגנדים של selectin (על פי Tangemann וחב' ב-J Exp Med משנת 1999). בצינור הנשימה, ה-KS אינו עובר fucosylaion של GlcNAc פנימי, ונושא רק חומצה סיאלית בקשר 2 →3 בעמדת הקצה של השרשרת הסוכרית (Nieduszynski וחב' ב-Biochem J משנת 1990, ו-Dickenson וחב' ב-Biochem J משנת 1991).
KSIII-בו השרשרת הסוכרית קשורה חלבון הליבה דרך הסוכר mannose בקשר O
סוג שלישי של קשר בין KS לחלבון תואר בפרוטאוגליקאנים מהמוח (Krusius ו-Ruoslahti ב-Proc Natl Acad Sci USA משנת 1986). שרשרות KS אלו קשורות ל-serine או ל-threonine בחלבון הליבה דרך mannose בקשר KS-Man-O-Ser. קשר זה כנראה נמצא ב-phosphocan-KS, אם כי האפיון המלא של החלבונים בהם קיים קשר KS-Man-O-Ser, עדיין תלוי ועומד.
הביוסינתזה של KS
אנזימים ביוסינתטיים: KS מתארך על ידי הפעילות של גליקוזיל-טרנספראזות המוסיפים לסירוגין galactose ו-GlcNAc לפולימר ההולך וגדל. פעילות gal-transferase בתאי הקרנית דומה לזו של האנזים β-1,4-galactosyltransferase (הידוע גם כ-β4Gal-T1) הפעיל בנסיוב ובחלב (Christner וחב' ב-Arch Biochem Biophys משנת 1979). זוהתה משפחה של לפחות 7 גנים של β4Gal-T (Amado וחב' ב-Biochim Biophys Acta משנת 1999). במהלך התפתחות עוברי אפרוחים נרשמה בקרנית הגברה של ריכוז עותקי β4Gal-T במקביל לסינתזה של KS בקרנית. הפעילות של אנזים זה נותרה גבוהה במיוחד בתאי הקרנית הבוגרים (Cai וחב' ב- Exp. Eye Res משנת 1996). השוואה עם רצפים ידועים של cDNA מראה ש- β4Gal-T זהה ל-β4Gal-T1. פעילות β4Gal-T1 ממשיכה להיות מוגברת בתאי קרנית בתרבית שאבדו את היכולת לסנתז KS. למרות ש-β4Gal-T1 מצטייר כאנזים הקשור לסינתזה של KS בקרנית , אנזים ספציפי זה לא נכרך עם ביוסינתזה של KS ברקמות אחרות.
האנזים הספציפי N-acetylglucosaminyltransferase (או GnT) האחראי לסינתזה של KS לא זוהה עדיין. ידועים מספר אנזימי GnT, ששניים מהם נראים מועמדים סבירים. האנזים המאוד נפוץ iGnT נמצא משתתף בסינתזה של ה-polylactosamine הלינארי הידוע כ-i"-antigen" (Sasaki וחב' ב-Proc Natl Acad Sci USA משנת 1997). עותקי RNA של אנזים זה נמצאו מועשרים במוח, רקמה בה KS מסונתז באופן פעיל. זוהה אנזים GnT שני (β3GnT) הפעיל בסינתזה של polylactosamine לינארי, והוא אף שובט (Zhou וחב' ב-Proc Natl Acad Sci USA משנת 1999). אך אין כל הוכחה הכורכת GnT ספציפי עם סינתזה של KS.
הסולפציה של KS בקרנית מסתייעת על ידי לפחות 2 אנזימים מסוג sulfotransferase (Ruter ו-Kresse ב- Keratan Sulphate. Chemistry, Biology, Chemical Pathology. The Biochemical Society, London משנת 1984). שני אנזימים זוהו ושובטו, כאלה המוסיפים סולפאט ל-KS (Habuchi וחב' ב-Glycobiology משנת 1996, ו-Fukuta וחב' ב-J Biol Chem משנת 1997). אחד מ-2 אנזימים אלה מוסיף סולפאט לשיירי GalNAc של chondroitin sulfate וכן לשייר galactose של KS. האנזים השני גם כן מוסיף סולפאט ל-galactose של KS אך אינו פועל על chondroitin sulfate. כן נמצא ש-mRNA של sulfotransferase ספציפי ל-KS מבוטא באופן בולט במוח ובקרנית. נראה אם כן סביר ש- sulfotransferaseזה מייצג אנזים הקשור לביוסינתזה של KS.
KS מכיל סולפאט גם על שיירי GlcNAc וסביר שאנזים ספציפי אחראי לפעילות זו. נמצא שפעילות האנזים GlcNAc-6-sulfotransferase (או Gn6ST) בתמצית תאים קרטוציטים גורמת לסולפציה ספציפית של הקצה הלא-מחזר GlcNAc(β1–3)Gal-R (Nakazawa וחב' ב- Arch Biochem Biophysמשנת 1998). ה-cDNAs של 2 אנזימי Gn6ST עם ספציפיות לקצה הלא-מחזר GlcNAc זוהו ושובטו (Uchimura וחב' ב-J Biol Chem משנת 1998, ו-Lee וחב' ב- Biochem Biophys Res Commun משנת 1999). עם זאת השאלה נותרת פתוחה האם אחד מאנזימים אלה משתתף בסינתזה של KS. מטופלים עם macular corneal dystrophy, מחלה בה KS חסר סולפציה של GlcNAc בגוף כולו, הם בעלי רמות פעילות של אנזים זה בנסיוב (Hasegawa וחב' ב-J Biochem משנת 1999). משמעות ממצאים אלה היא שאנזים עם ספציפות דומה ויקום רקמתי מוגדר עשוי להיות קשור לסינתזה של KS. הספציפיות של האנזים Gn6ST מרמזת לכל שהסולפציה של KS GlcNAc, יכולה להתרחש באופן סימולטני רק בשיירי קצה של השרשרת המתארכת (Degroote ב-J Biol Chem משנת 1997, ו-Uchimura וחב' ב-Glycobiology משנת 1998).
חלבונים אליהם קשור KS
ניתן לזהות KS במגוון רחב של רקמות, מה שמצביע על כך שהמנגנון האנזימטי ליצירת פולימר זה אינו מוגבל לרקמה מסוימת. אך היפוכו של דבר, רק מספר קטן של חלבונים ידועים כנשאי KS כאקט של מודיפיקציה posttranslational. המסקנה ההגיונית הנובעת משתי העובדות האחרונות היא שחלבוני ליבה אלה השפעתם ניכרת בביוסינתזה של KS. הבנת הגנים וביטויים של גנים אלה בהקשר של KS proteoglycan core proteins, חיונית להבנת הביוסינתזה של KS. בשנים האחרונות, זוהו ואופיינו מספר חלבונים נשאי-KS, וכן זוהו הגנים המקודדים לחלבונים אלה. הטבלה למטה מפרטת את החלבונים נשאי-KS שזוהו עד כה:
| חלבון | הקשר בין החלבון וקרטאן סולפאט | מיקום רקמתי | מובאה |
|---|---|---|---|
| Protein/gene | KS-protein linkage | Tissue/cell type localization | Reference |
| Lumican | KSI | Cornea | Blochberger et al., 1992 |
| Keratocan | KSI | Cornea | Corpuz et al., 1996 |
| Mimecan | KSI | Cornea | Funderburgh et al., 1997a |
| Fibromodulin | KSI | Cartilage | Oldberg et al., 1989 |
| Aggrecan | KSI and KSII | Cartilage | Barry et al., 1995 |
| PRELP | KSI | Cartilage | Bengtsson et al., 1995 |
| Osteoadherin | KSI | Bone | Sommarin et al., 1998 |
| PZP3 | KSI | Zona pellucida | Noguchi and Nakano, 1992 |
| MUC1 | NAa | Endometrial epithelium | Aplin et al., 1998 |
| CD44 | NA | Carcinoma line KM12L4 | Takahashi et al., 1996 |
| Epidermis | Tuhkanen et al., 1997 | ||
| Cytokeratins | NA | Epidermal keratinocytes | Schafer and Sorrell, 1993 |
| ABAKAN | NA | Brain | Seo and Geisert, 1995 |
| SV2 | NA | Synaptic vesicles | Carlson, 1996 |
| Phosphocan KS | KSIII | Brain | Margolis et al., 1996 |
| Claustrin | NA | Brain | Burg and Cole, 1994 |
| PG-1000 | NA | Electric organ | Carlson et al., 1996 |
| Lumican | KSI | Cornea | Blochberger et al., 1992 |
| Keratocan | KSI | Cornea | Corpuz et al., 1996 |
| Mimecan | KSI | Cornea | Funderburgh et al., 1997a |
| Fibromodulin | KSI | Cartilage | Oldberg et al., 1989 |
| Aggrecan | KSI and KSII | Cartilage | Barry et al., 1995 |
| PRELP | KSI | Cartilage | Bengtsson et al., 1995 |
| Osteoadherin | KSI | Bone | Sommarin et al., 1998 |
| PZP3 | KSI | Zona pellucida | Noguchi and Nakano, 1992 |
| MUC1 | NAa | Endometrial epithelium | Aplin et al., 1998 |
| CD44 | NA | Carcinoma line KM12L4 | Takahashi et al., 1996 |
| CD44 | NA | Epidermis | Tuhkanen et al., 1997 |
| Cytokeratins | NA | Epidermal keratinocytes | Schafer and Sorrell, 1993 |
| ABAKAN | NA | Brain | Seo and Geisert, 1995 |
| SV2 | NA | Synaptic vesicles | Carlson, 1996 |
| Phosphocan KS | KSIII | Brain | Margolis et al., 1996 |
| Claustrin | NA | Brain | Burg and Cole, 1994 |
| PG-1000 | NA | Electric organ | Carlson et al., 1996 |
הביולוגיה של התא של KS
התפקיד של KS בהידרציה של הקרנית אין בו כדי להסביר את הנוכחות של כמויות קטנות של KS במספר כה גדול של רקמות אחרות. מספר תפקידים ביולוגיים פעילים תועדו עבור hyaluronan ,heparan sulfate ו-chondroitin sulfate (על פי Iida וחב' ב-Semin Cancer Biol משנת 1996, ו-Toole וחב' ב-J Intern Med משנת 1997 וכן Lindahl ב-Haemostasis משנת 1999). מחקרים על KS הגיעו למסקנה ש-KS הוא גם משתתף פעיל בביולוגיה התאית של הרקמות בהן הוא ממוקם. מקרופאגים של עכברים מבטאים על פניהם קולטן בעל זיקה גבוהה ל-lumican כמו גם ל-lumican שעבר מודיפיקציה על ידי oligolactosamine המכיל סולפאט בודד. תאים אלה אינם קושרים lumican הנושא KS ששרשרותיו עברו סולפציה. הרחקת KS על ידי האנזים endo-β-galactosidase, החזירה לתאים את יכולתם להיספח in vitro למשטחים המצופים עם lumican-KS (על פי Funderburgh וחב' ב-Invest Ophthalmol Vis Sci משנת 1997). תכונה נוגדת-ספיחה זו של KS, נמצאה גם במחקרים אחרים.
מולקולות המכילות KS, מהוות מחסום לשגשוג תאי neurites בתנאי in vitro, וסבורים שהם משפיעים על כוונון צורת גידולם של אקסונים בעת ההתפתחות העוברית, או בעת הרגנרציה שלהם in vivo (על פי Burg ו-Cole ב-J Neurobiol משנת 1994, ו-Olsson וחב' ב-Pigment Cell Res משנת 1996). תכונת מחסום זו של KS משתמעת גם מהממצאים ששרשרות KS על aggrecan חוסמות את ההתפתחות של תגובה חיסונית in vivo וכן in vitro למקטע ה-G1 של חלבון זה, ובכך מדכאות את ההתפתחות של osteoarthritis המושרה על ידי אנטיגנים (Guerassimov וחב' ב-Arthritis Rheum משנת 1999).
ריכוז גבוה יחסית של KS תאי בשכבת האנדומטריום של הרחם משתנה במהלך המחזור החודשי, ומגיע לשיאו בשלב של השרשת העובר (Graham וחב' ב-Hum Reprod משנת 1994). בנקודת זמן זו מולקולות רגישות לאנזים keratanase חוסמות את הגישה של נוגדנים כנגד אפיטופים של muc1 שבדרך כלל כן זמינים לנוגדנים בפרקי זמן אחרים של המחזור החודשי (DeLoria וחב' ב-Hum Reprod משנת 1998). ממצאים אלה מרמזים לתפקידו הפוטנציאלי של KS בשלב השרשת העובר. ל-KS מייחסים גם תפקיד בתנועה של תאי האנדותל בקרנית, שהוא אפיתליום חד שכבתי המכסה את פני הקרנית האחוריים. תאים אלה באופן נורמאלי מכילים KS בפיזור דמוי-מוזאיקה בחלק האפיקלי שלהם, אך לאחר פציעה כמות ה-KS פוחתת או אף מתאפסת על פני התאים הנודדים. עם הפסקת הנדידה של תאים אלה רמת KS חוזרת לקדמותה על פני התאים (Davies וחב' ב-Exp Eye Res משנת 1999). התכונות נוגדות הספיחה של KS, עשויות להיות משמעותיות בתהליך השרשת העובר כמו גם בתהליך תנועתיות של תאים (Greenwood ו-Murphy-Ullrich ב-Microsc Res Tech משנת 1998).
פרוטאו-גליקאנים קצרים עתירי leucine
זו קבוצה של חלבונים שהם מרכיבים אופייניים של המשתית (matrix) האינטרסטיציאלית. כל חלבונים במשפחה זו, מכילים סדרה של 24 רצפים העשירים בחומצת האמינו- leucine, הבונים את החלק המרכזי של כל אחד מחלבונים אלה. כנראה שרצפים-עתירי-leucine אלה, גורמים לחלבונים המכילים אותם לקפל אותם לסדרה של beta-sheets, ליצור מבנה תלת-ממדי דמוי-קשת, עם אתרי קישור ל-KS המכווננים באופן ששרשרות KS משתרעות מהצד הקמור של הקשת (Iozzo ב-Crit Rev Biochem Nol Biol משנת 1997, ו-Scott ב-Biochemistry משנת 1996). בקרנית, KS מופיע על 3 חלבונים עם רצפים-עתירי-leucine, והם lumican, keratocan ו-mimecan (על פי Funderburgh וחב' ב-J Biol chem משנת 1993, ו-Corpuz וחב' ב-J Biol Chem משנת 1996).החלבונים fibromodulin ו-prolargin (המקודד על ידי הגן PRELP), הנמצאים בסחוס, והחלבון osteoadherin הנמצא בעצם, הם גם כן חלבונים עתירי leucine המכילים KS (על פי Antonsson וחב' ב-J Biol Chem משנת 1991).
פפטידים הקשורים ל-KS שנוצרו בביקוע של fibromodulin על ידי טריפסין, מכילים את כל ארבעת האתרים הפוטנציאליים ל-N-גליקוזילציה בחלבון זה, אך מדידת הגודל של פיברומודולין שלם, מביאה למסקנה שקיים רק אתר בודד במולקולת החלבון אליה נקשר KS (על פי Plaas ב-J Biol Chem משנת 1990). בגישה דומה זוהו אתרי קישור של KS בחלבונים lumican ו-keratocan מקרנית של תרנגולת (Dunlevy ב-J Biol Chem משנת 1998). אתר הקישור של KS בכל אחד מחלבונים אלה, היה בצידו ה-N טרמינאלי של ה-leucine הראשון של ה-leucine-rich-repeat.
הפרוטאוגליקן aggrecan
הפרוטאוגליקן העיקרי בסחוס הוא החלבון המאוד גדול aggrecan בו ה-KS קשור ל-2 מקטעים (domains) נפרדים. רוב ה-KS קשור בקשר O ל-aggrecan בין האזורים G2 ו-G3 במקטע המאופיין על ידי motif שבו יש repeats של 6 חומצות אמינו (Flannery וחב' ב-Matrix Biol משנת 1998). הרצף של ה-motif שמור מאוד במינים שונים של בעלי חוליות, אך מספרם של הרצפים החוזרים משתנה (Barry וחב' ב-Matrix Biol 1994 משנת 1994). שינוי זה במספר הרצפים החוזרים אחראי כנראה להבדלים בתכולת KS של aggrecan במיני בעלי החוליות השונים. במכרסמים, הרצף של ה-motif אינו שמור, ולכן במכרסמים ה-KS השלדי מופחת מאוד בכמותו או אפילו חסר. KS קשור כמוכן ל-aggrecan ליד הקצה ה-N טרמינאלי של החלבון, במטע הקושר-HA, בשתי צורות הקישור N ו-O. שרשרות KS באזור הקישור של HA, עשויים להיות בעלי אורכים שונים ומספר שיירי סולפאט שונים, בהשוואה לשרשרת מהאזור הקושר GAG של החלבון. עובדה זו מרמזת לכך שהקונפורמציה של החלבון במולקולת ענק זו, יכולה לפקח על הזמינות לאנזימים glycosyl transferase ו-sulfotransferase בעת המעבר של החלבון דרך ה-Golgi.
פרוטאו-גליקנים קשורים לתאים
הודגם ש-KS קשור למספר רקמות אפיתליאליות. קרטינוציטים, תאי אנדומטריום של הרחם, תאי אנדותל של הקרנית, בלוטת הרוק, אפיתל של בלוטות הזיעה, ובלוטת ה-sebaceous (החלב), כל אלה מכילים KS ברקמות של מבוגרים (Sorell ו-Caterson ב-Histochemistry משנת 1990, ו-Shiozawa וחב' ב-Gynecol Obstet Invest משנת 1991 ו-Fullwood וחב' ב-Invest Ophthalmol Vis Sci משנת 1996). ניתן למצוא KS גם במגוון של תאי קרצינומה ממקור אפיתליאלי (Leygue וחב' ב-Cancer Res משנת 1998). החלבון MUC1 של האנדומטריום נמצא מכיל KS (על פי Alpin וחב' ב-Glycobiology משנת 1998). החלבון MUC1 הוא מרכיב שכיח של שכבת ה-mucin הקשורה עם המשטחים האפיקליים של האפיתליום המפריש. ייתכן ש-MUC1 אחראי לנוכחות של KS ברבות מבין בלוטות בהן דווח על הימצאו.
חלבון נוסף של פני התא, CD44, מכיל אף הוא KS (על פי Tuhkanen וחב' ב-Invest Dermatol משנת 1997). החלבון CD44 מופיע במספר צורות spliced, שחלקן מכילות heparan sulfate. מסתבר ש-CD44 ו-SV2 הם 2 החלבונים האינטגרליים של ממברנות תאים הראשונים הידועים כמכילים KS. סוג שלישי של KS הקשור לתאים תואר בדמותם של קרטינים תוך-תאיים בקרטינוציטים (Schafer ו-Sorell ב-Exp Cell Res משנת 1993). דוגמאות אלו של חלבונים תאיים מכילי-KS, מצביעים על כך שבדומה ל-chondroitin sulfate ו-heparan sulfate, מולקולות של KS אינן מוגבלות רק לרקמות חיבור אינטרסטיציאליות, אלא מופיעות גם כחלק של חלבונים במגוון רחב של מיקומים תאיים.
פרוטאוגליקנים במוח
אחד מתחומי המחקר הפעילים ביותר בהקשר של KS, מתייחס לפרוטאוגליקנים של מערכת העצבים המרכזית. לאחר הקרנית ורקמות השלד, נראה שהמוח הוא עשיר ב-KS, ואחד העשירים ביותר מבחינת האנזימים הביוסיתטיים של KS. הפרוטאוגליקן העיקרי בסחוס, aggrecan, מופיע ברקמות עצביות, אך aggrecan במוח כנראה שאינו מכיל KS (על פי Domowicz וחב' ב-Develop Biol משנת 1995(. מספר פרוטאוגליקנים שנראים אופייניים לרקמות עצביות תוארו, כולל ABAKAN (על פי Seo ו-Geisert ב-Neurosci Lett משנת 1995), החלבון SV2 (על פי Carlson ב-Perspect Dev Neurobiol משנת 1996), החלבון PG-1000 (על פי Carlson וחב' ב-Matrix Biol משנת 1996), החלבון claustrin (על פי Burg ו-Cole משנת 1994), ו-phosphocan-KS (על פי Margolis וחב' ב-Perspect Dev Neurobiol משנת 1996). מספר נוסף של חלבונים להם קשור KS קיימים ברקמה עצבית אך האפיון שלהם אינו מלא (Miller ב-J Comp Neurol משנת 1997).
הבקרה על סינתזה של KS
הביוסינתזה של KS לעתים קרובות משתנה באופן בולט בתגובה לשינויים מטבוליים, פתולוגיים או התפתחותיים ברקמות. צורה אופיינית אחת של ביטוי KS היא ביטוי וסולפציה מוגברים של KS הכרוכה בשינויים התפתחותיים. תופעה זו תוארה לראשונה בקרנית. בעוברי תרנגולת לא ניתן לגלות sulfated KS אלא לאחר 12 שעות לאחר החדירה של הנדידה של תאי הרכס העצבי (neural crest) לתוך הסטרומה הראשונית של הקרנית (Funderburgh וחב' ב-Dev Biol משנת 1986). לאחר 12 שעות, KS מצטבר במהירות בסטרומה, והצטברות זו נמשכת גם לאחר בקיעת הגוזל מהביצה, וגם בתרנגולת הבוגרת. בדומה, גם בקרנית של עוברי עכבר lumican נמצא בעיקר בגליקופרוטאין נטול סולפאט, אך לאחר 10-14 יום מתחילים לגלות בו KS, בערך במועד בו הוא פותח את עיניו (Ying וחב' ב-J Biol Chem משנת 1997). הגידול בממדי KS בקרנית העכבר נמשך עד גיל שנה. מחקרים על ריכוז KS בקרנית האדם, מצביעים על המשך בגידול KS לאורך כל החיים (Praus ו-Brettschneider ב-Ophthal Res משנת 1975).
בסחוס מראה KS שינויים התפתחותיים דומים לאלה שמוצאים בקרנית. תכולת KS ב-aggrecan של הסחוס גדלה עם הגיל בכל הקשור להתארכות שרשרות KS ודרגת הסולפציה שלהן (Brown וחב' ב-J Biol Chem משנת 1998). ממצא דומה דווח על ידי Lauder וחב' ב-Biochem J משנת 1998 באשר להתפתחות KS ב-fibromodulin בסחוס ארטיקולארי. גם במוח חולדה, מוצאים כמות קטנה של KS בשלב העוברי, כאשר ההגדלה המשמעותית של KS מתגלה לאחר הלידה (Meyer-Puttlitz וחב' ב-J Neurochem משנת 1995).
תכונה נוספת של הביוסינתזה של KS היא בשינויים התכופים שהוא עובר בריפוי פציעות וכן in vitro. סוגי תאים המפרישים KS (תאי עצב, כונדרוציטים וקרטינוציטים), שקטים in vivo, אך בתנאי in vitro, כונדרוציטים וקרטינוציטים, בתלות בתנאי התרבית מציגים לעתים מורפולוגיה פיברובלסטית, ומאבדים את יכולת הסינתזה של KS. בפציעות של הקרנית, קרטינוציטים משופעלים להתחלק, לרכוש פנוטיפ פיברובלסטי ולסנטז רק כמות מועטה של KS. מצבים פתולוגיים תת-חריפים או כרוניים המשפיעים על הקרנית גם כן גורמים לעתים תכופות לאיבוד KS בסטרומה (Funderburgh וחב' ב-Invest Ophthalmol vis Sci משנת 1990, ו-Rodriguez וחב' ב-Am J Ophthalmol משנת 1992). במוח, KS של תאי מיקרוגליה פוחת במצבי דלקת (Jander וחב' ב-Glia משנת 2000), ו-KS צרבראלי מופחת במחלת אלצהיימר (Lindahl וחב' ב-J Biol Chem משנת 1996). הפחתת הכמות של KS במוח וכן בקרנית קשור כנראה לתהליך הדלקת, מה שמרמז לתפקיד של ציטוקינים תומכי-דלקת ב-downregulation של הביוסינתזה של KS.
מספר מחקרים חקרו את ההיעלמות של KS בפיברובלסטים ממקור קרנית שגודלו בתרבית. אנליזה מפורטת של תוצרי סינתזה של תרביות תאים אלה, הדגימה ביטוי של כל שלושת החלבונים קושרי-KS, אך חלבונים אלה עברו מודיפיקציה עם oligogalactosamine קטום (truncated) עם מעט מאוד או אף ללא כל סולפציה (Funderburgh וחב' ב-J Biol Chem משנת 1996). תוצאות אלה מרמזות לכך שההפחתה בביו-סינתזה של KS בתנאי in vitro וכן במצבי ריפוי פציעות, נובעת מ-downregulation של פעילות של גליקוזיל טרנספרזות וסולפו טרנספרזות ספציפיות ל-KS. מחקר שהשתמש בקרטינוציטים טריים שבודדו זה עתה מתרנגולות, וזמן קצר לאחר זריעת התאים בתרבית נמצאה ירידה תלולה בסולפציה של שיירי GlcNAc (על פי Nakazawa וחב' ב-J Biol Chem משנת 1998). פיתוח שיטה לגידול בתרבית של קרטינוציטים המסוגלים לסנתז KS מקרו-מולקולארי עם סולפציה מלאה למשך פרקי זמן ארוכים in vitro, סיפק כלי חיוני לזיהוי של אנזימים ספציפיים לסינתזה של KS (על פי Beales וחב' ב-Invest Ophthalmol vis Sci משנת 1999). נמצא שביוסינתזה של KS על ידי קרטינוציטים בתרבית בשיטה זו, דוכאה על ידי נסיוב של עוברי בקר, וכן על ידי TGFβ, אך לעומת זאת FGF או fibroblast growth factor 2 סייע לשמור על סינתזת KS בתרבית (Long וחב' ב-J Biol Chem משנת 2000).
פונקציות ביולוגיות של KS
הידרציה של רקמות: בקרנית, הנוכחות הניכרת של KS נראית קשורה להידרציה של רקמה זו שהיא מאוד חיונית לשקיפות הקרנית. פרוטאו-גליקנים הקושרים KS ו-dermata sulfate בקרנית, הם בעלי תכונה של ספיחת מים (Bettelheim ו-Plessy ב-Biochim Biophys Acta משנת 1975, ו-Hedbys ב-Exp Eye Res משנת 1961). ברמות הידרציה האופייניות לסטרומה נורמאלית של הקרנית, dematan sulfate מייצג דרגת הידרציה מלאה, בה בשעה ש-KS מייצג רק הידרציה חלקית, ונראה ש-KS מספק בופר דינאמי להידרציה של הקרנית. החשיבות של KS בסטרומה, נתמכת על ידי נתונים ממחלות כמו macular corneal dystrophy בה חל שינוי באיזון של glycosaminoglycans (על פי Hassell וחב' ב-Proc Natl Acad Sci USA משנת 1980). מוטציה בעכברים שגרמה לחסר lumican, גרמה בקרנית לירידה של 25% ברמת KS, וגרמה להפחתה בהידרציה של הסטרומה (Chakravarti וחב' ב-J Cell Biol משנת 1998). עכברים אלה פיתחו תוך 3-6 חודשים קרנית מעורפלת, שהוא פרק הזמן המתאים להצטברות של KS עם סולפציה מלאה בקרנית עכבר.
הוראות לביצוע הבדיקה
יש לאסוף דגימת שתן אקראית (עדיפה דגימת בוקר), ולהקפיאה באופן מידי. כדגימת שתן קפואה, יציבות הדגימה היא עד שנה. שיטת הבדיקה Liquid Chromatography-Tandem Mass Spectrometry (LC-MS/MS).
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - אבחון תסמנות גנטיות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק