הבדלים בין גרסאות בדף "אינטרלויקין 18 Interleukin"
| (2 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 80: | שורה 80: | ||
העיבוד והפרשת הקודמן של IL-18 בתיווך של ADAM 33 במנגנון התלוי ב-VEGF: כיוון ש-IL-18 מעודד תאי אנדותל ומעודד התפשטות של תאי סרטן ממאירים, מחקרים בחנו את מנגנון הפרשת IL-18 משורת תאים שמקורם בסרטן הקיבה. מתברר ש-vascular endothelial cell growth factor-D (להלן VEGF-D), הגביר את הייצור וההפרשה של IL-18 מתאי סרטן קיבה אלה (Kim וחב' ב-J Immunol משנת 2009). כיוון ש-VEGF-D מכיל מקטע (domain) בעל פעילות metalloprotease, השיכוך של ADAM33 מנע את ההפרשה של IL-18. | העיבוד והפרשת הקודמן של IL-18 בתיווך של ADAM 33 במנגנון התלוי ב-VEGF: כיוון ש-IL-18 מעודד תאי אנדותל ומעודד התפשטות של תאי סרטן ממאירים, מחקרים בחנו את מנגנון הפרשת IL-18 משורת תאים שמקורם בסרטן הקיבה. מתברר ש-vascular endothelial cell growth factor-D (להלן VEGF-D), הגביר את הייצור וההפרשה של IL-18 מתאי סרטן קיבה אלה (Kim וחב' ב-J Immunol משנת 2009). כיוון ש-VEGF-D מכיל מקטע (domain) בעל פעילות metalloprotease, השיכוך של ADAM33 מנע את ההפרשה של IL-18. | ||
| − | == IL-18 ומחלת לב | + | == IL-18 ומחלת לב == |
| + | מחלת לב כוללת מחלת עורקים כליליים הכרוכה ב[[אוטם שריר הלב]], וכן ב[[אי-ספיקת לב כרונית]] כאשר האחרונה נובעת מ-remodeling של חדרי הלב לאחר אירוע האוטם. מחקרים קדם-קליניים הדגימו שחסימה של IL-1β היא גישה יעילה (Abbate וחב' ב-Eur J Heart Failure משנת 2010), ואכן ניסויים תוך שימוש ב-Anakinra נמצא מפחית אפופטוזיס ב-AMI ניסויי (Abbate וחב' ב-Circulation משנת 2008) , וכן הראו שחסימת IL-1β יעילה בהפחתת ה-remodeling שלאחר האוטם (Abbate וחב' ב-Am J Cardiol משנת 2013), וכן הגבירה את הסבילות במאמץ גופני באלה עם אי-ספיקת לב סיסטולית (Van Tassell וחב' ב-PLos One משנת 2012). הניסוי הקליני הגדול ביותר, המכונה ניסוי CANTOS, שכלל 17,200 מטופלים בסיכון גבוה שטופלו בנוגדן כנגד IL-1beta, החל דרכו על ידי Ridker וחב' בשנת 2011 על פי הדיווח ב-Am Heart J. | ||
| − | + | מספר הולך וגדל של ניסויים קליניים וכן ניסויים בחיות, מצביע על תפקיד ל-IL-18 במחלת לב. המיוקרד של מטופלים עם מחלת לב איסכמית מבטא את שרשרת α של הקולטן של IL-18, ונמצא שיש ריכוזים מוגברים של IL-18 בצירקולציה מה שכרוך בתמותה (Mallat וחב' ב-FASEB J משנת 2004). הזרקה יומיומית לעכברים של IL-18 גרמה להיפרטרופיה חדרית, להגברת ריכוז קולאגן (Platis וחב' ב-Perfusion משנת 2008), וללחץ דיאסטולי מוגבר בחדר הלב השמאלי (Woldbaek וחב' ב-Am J Physiol Heart Circ Physiol משנת 2005). במודל של דיכוי שריר הלב הכרוך בהלם ספטי, עכברים הוזרקו עם LPS, ולאחר מכן הוחדר להם נוגדן מנטרל כנגד IL-18 (על פי Raeburn וחב' ב-Am J Physiol משנת 2002). הרציונל של ניסוי זה היה ש-IL-18 מגביר את היצירה של TNFα וכן של IL-1β, ומשרה את הביטוי של מולקולות הספיחה הבינתאית ICAM-1 ו-VCAM-1. עכברים הוזרקו עם LPS ונמדד בהם הלחץ שהתפתח בחדר הלב השמאלי. נמצא שלחץ זה דוכא ב-38% לאחר 6 שעות מהזרקת LPS, אך טיפול מוקדם עם נוגדן כנגד IL-18 החליש את התפקוד הלקוי של המיוקרד המושרה על ידי LPS, בשיעור ניכר של 92%. | |
| + | |||
| + | במחקר אחר, נלקחו רצועות משריר פרוזדור הלב ממנותחים שעברו ניתוח מעקפים, ורקמות אלה נחשפו לאיסכמיה תוך מדידת כושר ההתכווצות שלהם. הוספה של IL-18BP לנוזל הפרפוזיה במהלך ולאחר האירוע האיסכמי, הביאה לשיפור יכולת ההתכווצות מ-35% בביקורת, ל-76% בהוספת IL-18BP (על פי Pomerantz וחב' ב-Proc Natl Acad Sci משנת 2001). הטיפול ב-IL-18BP גם שימר את הרמה התוך תאית של creatine kinase. לאחר אירוע איסכמי רמת IL-18 mRNA הוגברה, ובהתאם גם רמת IL-18 גדלה בתמצית של המיוקרד בהשוואה לביקורת (26 לעומת 5.8 פיקוגרם/מיליגרם). | ||
| + | |||
| + | ==הוראות לביצוע הבדיקה == | ||
| + | אין צורך בהכנות מוקדמות כצום. לאחר נטילת הדם במבחנה כימית (פקק אדום או צהוב), יש לסרכז בקירור, ולהקפיא את הנסיוב המתקבל. הדגימה יציבה בטמפרטורת החדר למשך 48 שעות, בקירור למשך 7 ימים ובהקפאה למשך 28 יום. מדידת רמת IL-18 מתבצעת בשיטת ELISA. | ||
| − | + | ==ראו גם== | |
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[אבחון מחלות ומפגעים מטבוליים-גנטיים|בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים]] | ||
| + | * [[בדיקות ביוכימיות|בדיקות מעבדה - בדיקות ביוכימיות]] | ||
| − | |||
| − | + | {{ייחוס בן עמי}} | |
| − | + | [[קטגוריה:בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים]] | |
| + | [[קטגוריה:בדיקות מעבדה - בדיקות ביוכימיות]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
גרסה אחרונה מ־09:11, 19 באוקטובר 2019
| מדריך בדיקות מעבדה | |
| אינטרלויקין 18 | |
|---|---|
| Interleukin-18 | |
| שמות אחרים | IL-18 |
| 250 פיקסלים | |
| מעבדה | כימיה בדם |
| תחום | ציטוקין בעל השפעות פלאוטרופיות מגוונות. |
| טווח ערכים תקין | 29.3-140.1 פיקוגרם/מ"ל (ממוצע של 84.7 פיקוגרם/מ"ל); גבוה בגברים ב-10-15% בהשוואה לנשים. |
| יוצר הערך | פרופ' בן-עמי סלע |
הביולוגיה של IL-18
אינטרלוקין-18 (להלן IL-18) הוא חבר במשפחת IL-1 של ציטוקינים. בדומה ל-IL-1β, מסונתז IL-18 כקודמן לא פעיל, המבוקע על ידי האנזים caspase-1 ליצירת הציטוקין הפעיל, אך בניגוד ל-IL-1β, הקודמן של IL-18 מצוי באופן קונסטיטוטיבי כמעט בכל התאים באדם ובחיות בבריאות מלאה. הפעילות של IL-18 מאוזנת על ידי הנוכחות הטבעית של חלבון הקושר IL-18 בזיקה גבוהה, חלבון הידוע כ-IL-18BP . בבני אדם, החמרה במצבי מחלה יכולה להיות כרוכה באיזון פגום בין IL-18 לחלבון הקושר אותו, באופן שרמות IL-18 חופשי מוגברות בצירקולציה. מספר הולך וגדל של מחקרים בחן את התפקיד של IL-18 בתיווך מצבי דלקת במודלים של מחלות בחיות, תוך שימוש בעכברים החסרים IL-18 ו-IL-18BP, או על ידי נטרול של IL-18, או במצבי חסר של שרשרת α בקולטן של IL-18. מחקרים מייחסים תפקיד ל-IL-18 במספר מחלות אוטו-אימוניות, בתפקוד שריר הלב, באמפיזמה, בתסמינים מטבוליים, בפסוריאזיס, ב-IBS, בתסמינים הומו-פגוציטיים, בתסמונת שפעול מקרופאגים, בספסיס, ובפגיעה כלייתית חדה, למרות שבמספר מודלים של מחלה IL-18 דווקא מספק הגנה. ל-IL-18 תפקיד חשוב ביצירת אינטרפרון-γ מתאי T ומתאי NK. באדם, נוסה IL-18BP בניסויים קליניים בבטיחות, כמו גם ניסויים בהזרקת נוגדנים כנגד IL-18.
החלבון IL-18 תואר לראשונה בשנת 1989 כ"גורם המשרה יצירת אינטרפרון-γ" , שהופק מנסיוב של עכברים שהוזרקו עם אנדוטוקסין לתוך הפריטונאום. ימים אחדים קודם לכן העכברים טופלו עם Propionibacterium acnes המגרה את המערכת הרטיקולו-אנדותליאלית, ובעיקר את תאי Kupffer שבכבד. IL-18 נוקה מכבד עכבר ושובט בשנת 1995 על ידי Okamura וחב' כפי שדווחו ב-Infect Immun. בדומה ל-IL-1βz גם IL-18 מסונטז קודם כקודמן לא פעיל וללא signal peptide, שנותר כציטוקין תוך-תאי. המבנה השלישוני של הקודמן של IL-18 דומה לזה של הקודמן של IL-37, וגבולות ה-intron-exon בגנים המקודדים ל- IL-18 ול- IL-37 מרמזים לקשר בין שני ציטוקינים אלה. מאז שנת 1995 נוסו נטרול של IL-18 אנדוגני או שימוש בעכברים משוללי IL-18 על מנת להדגים את תפקידו של ציטוקין זה בתהליכי דלקת ובתגובות של מערכת החיסון (Boraschi ו-Dinarello ב-Eur Cytokine Net משנת 2006, Dinarello ב-Semin Nephrol משנת 2007, ו-Tsutsui ו-Nakanishi ב-Immunother משנת 2012).
עם זאת, הביולוגיה של IL-18 אינה מייצגת כמעט את זו של IL-1β, וקיימים מספר הבדלים ייחודיים וספציפיים בין השניים. לדוגמה, בבני אדם ובעכברים בריאים, חסר ביטוי גני של IL-1β בתאים מונונוקלטאריים או בתאים המאטו-פויאטיים ואין כל ראייה לכך שהקודמן של IL-1β מבוטא באופן קונסטיטוטיבי בתאי אפיתל (Puren וחב' ב-Proc Natl Acad Sci USA משנת 1999). בניגוד לכך, הקודמן של IL-18 נמצא בתאים מונוציטים בדם של בני אדם בריאים ובתאי אפיתל של כל צינור העיכול. הקודמן של IL-18 נמצא גם בקרטינוציטים ובמרבית תאי האפיתל. בהקשר זה IL-18 דומה ל-IL-1α ול-IL-33.
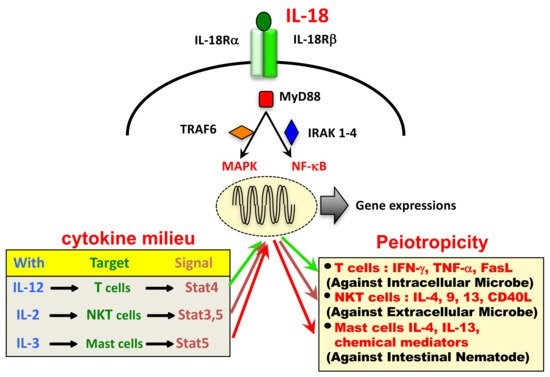
IL-18 התגלה במקור כגורם המעודד יצירת IFN-γ בתאי Th1 המגורים על ידי anti-CD3, בעיקר בנוכחות של IL-12. על ידי גירוי אנטיגני בנוסף ל-IL-12, תאי T נאיביים מתפתחים לתאי Th1 המבטאים את הקולטן ל-IL-18, מה שמגביר יצירת IFN-γ בתגובה לגירוי של IL-18. לעומת זאת, IL-18 הוא ציטוקין קדם-דלקתי המעודד תגובות type 1. עם זאת, IL-18 ללא IL-12, אך עם IL-2, מעודד תאי NK, תאי T שהם CD4+NK, ותאי Th1 , לייצר IL-3, IL-9 ו-IL-13. יתרה מכך, IL-18 ביחד עם IL-3 מעודדים תאי פיטום ובזופילים לייצר IL-4, IL-13 והיסטמין.
IL-18 באדם מכיל 193 חומצות אמינו (Oshio וחב' ב-J Immunol משנת 1996). IL-18 ו- IL-1β הם בעלי הומולוגיה של 15% בלבד, ובדומה ל-IL-1β, IL-18 נוצר כקודמן בלתי פעיל ביולוגית, pro-IL-18, החסר signal peptide, ודורש פעילות פרוטאוליטית להפוך לציטוקין פעיל. פעילות זו מתקבלת על ידי האנזים התוך-תאי caspase-1 בתוך ה- NLRP3 inflammasome (Gu וחב' בScience משנת 1997, ו-Martinon וחב' ב-Ann Rev Immunol משנת 2009). המקור של IL-18 הודגם בתחילה בתאי Kuppfer המבטאים באופן קונסטיטוטיבי pro-IL-18, אם כי הקודמן הזה מיוצר על ידי מגוון רחב של תאים אחרים כולל קרטינציטים, תאי אפיתל של מעי וכן אוסטאובלסטים. בדומה לציטוקינים אחרים, גם ל-IL-18 יש פעילות פלאוטרופית כמודגם בתמונה:
יצירה ופעילות של IL-18
הגן של IL-18 ממוקם על כרומוזום 11 באדם, ועל כרומוזום 9 בעכברים. הפעילות של ה-cysteine פרוטאז caspase-1 על הקודמן של IL-18 שמשקלו המולקולרי הוא 24,000 דלטון היא תוך תאית, וכתוצאה מביקוע זה מתקבל הציטוקין הפעיל שמשקלו המולקולרי הוא 17,2000 דלטון. כמו בעיבוד של IL-1β, ה-pro-caspase-1 הבלתי פעיל הופך ל-caspase-1 פעיל על ידי leucine-rich repeat pyrin containing protein-3 (להלן NLRP3). לאחר הביקוע על ידי caspase-1 הפעיל, IL-18 הבשל מופרש ממונוציטים/מקרופאגים, למרות שמעל 80% מהקודמן של IL-18 נותר בלתי מעובד בתוך התא. בהשוואה לעכברים wild-type, עכברים החסרים caspase-1, אינם מפרישים לצירקולציה אינטרפרון-γ לאחר החדרת אנדוטוקסין. כיוון שנוגדנים המנטרלים IL-18 מייצרים הגנה במודל של colitis המושרה לאחר הזרקת dextran sodium sulfate (להלן DSS), וחסר של caspase-1 מונע את העיבוד של IL-18 (על פי Siegmund וחב' ב-Proc Natl Acad Sci USA משנת 2001). מצד שני, יש מספר דוגמאות שהעיבוד של IL-18 על ידי caspaase-1 אינו נחוץ. לדוגמה, סטימולציה של Fas ligand מביאה לשחרור של IL-18 פעיל ביולוגית ממקרופאגים של עכברים משוללי caspase-1 (על פי Tsutsui וחב' ב-Immun Rev משנת 2000).
בדומה ל-IL-1α ול-IL-33, הקודמן של IL-18 מבוטא באופן קונסטיטוטיבי בתאי אנדותל, בקרטינוציטים, ובתאי אפיתל של המעי. מקרופאגים ותאים דנדריטים הם המקורות העיקריים להפרשת IL-18 פעיל, בעוד שהקודמן הבלתי פעיל נותר בתוך האזורים התוך-תאיים של תאים מזנכימליים. כמו כן, בדומה ל-IL-1α ול-IL-33, הקודמן של IL-18 מופרש מתאים מתים, והוא מעובד מחוץ לתאים בעיקר על ידי פרוטאזות ממקור נויטרופילים כגון proteinase-3 (על פי Sugawara וחב' ב-J Immunol משנת 2001). למרות שאיתות על ידי Fas מעודד אפופטוזיס, איתות זה גם משרה יצירה של ציטוקינים דלקתיים, כולל IL-18. בנוסף להשראה של יצירת IL-18, איתות של Fas משפעל יצירת caspase-8 במקרופאגים ובתאים דנדריטים, הגורמת לעיבוד ושחרור של IL-1β ו-IL-18 בשלים. דווח שהעיבוד של IL-1β ושל IL-18 מתבצע באופן בלתי תלוי ב-NLRP3 או ב-RIP3 (על פי Bossaller וחב' ב-J Immunol משנת 2012).
החלבון הקושר IL-18 או IL-18BP
IL-18BP הוא גורם אנדוגני מסיס המעכב באופן ספציפי את פעילות IL-18, הוא מורכב ממקטע יחיד של של Ig. הזיקה שלIL-18BP ל-IL-18 היא בערך 400pM, שהיא גבוהה בהרבה מהזיקה של IL-18 ל- IL-18Rα בלבד (שהיא 0-50nM1). התקשרות IL-18 ל-IL-18BP מונעת יצירת IFN-γ, ומגבילה את התגובות של תאי Th1 (Novick וחב' ב-Immunity משנת 1999, ו-Kim וחב' ב-Proc Natl Acad Sci USA משנת 2000).
העיבוד והפרשת הקודמן של IL-18 בתיווך של ADAM 33 במנגנון התלוי ב-VEGF
כיוון ש-IL-18 מעודד תאי אנדותל ומעודד התפשטות של תאי סרטן ממאירים, מחקרים בחנו את מנגנון הפרשת IL-18 משורת תאים שמקורם בסרטן הקיבה. מתברר ש-vascular endothelial cell growth factor-D (להלן VEGF-D), הגביר את הייצור וההפרשה של IL-18 מתאי סרטן קיבה אלה (Kim וחב' ב-J Immunol משנת 2009). כיוון ש-VEGF-D מכיל מקטע (domain) בעל פעילות metalloprotease, השיכוך של ADAM33 מונע את ההפרשה של IL-18.
העברת איתותים על ידי IL-18
כפי שמודגם בתמונה למטה, IL-18 יוצר קומפלקס של איתותים על ידי התקשרותו לשרשרת α של הקולטן IL-18Rα, שהוא המקטע קושר הליגנד IL-18. עם זאת, קישור זה הוא בזיקה נמוכה. בתאים המבטאים את ה-co-receptor, הידוע כ- IL-18 receptor β chain (IL-18Rβ), נוצר קופלקס איתות בזיקה גבוהה. הקומפלקס של IL-18 עם שרשרות IL-18Rα ו- IL-18Rβ, דומה לזה הנוצר על ידי חברים אחרים במשפחת IL-1 עם הקו-קולטן הידוע כ- IL-1R accessory chain (IL-1RAcP). לאחר יצירת ההטרודימר, חל קירוב של מקטעי Toll-IL-1 receptor (או TIR), ונראה שה-cascade של גיוס MyD88, של ארבעת ה-IRAKs ושל TRAF-6 החל לאחר ההרס של IκB והשחרור של NFκB, כמעט זהה לזה של IL-1 (על פי Weber וחב' ב-Scin Signal משנת 2010). עם זאת, ישנם הבדלים בין האיתותים של IL-1 ו-IL-18. עם יוצאי-דופן מעטים, IL-1α או-IL-1β, פעילים על תאים בתחום הריכוזים הנמוך של ננוגרמים/מ"ל, ולעתים בריכוזים של פיקוגרמים/מ"ל. בניגוד לכך, השפעול של IL-18 של תאים המבטאים את שני שרשרות הקולטן של IL-18, דורש ריכוזי IL-18 של 10-20 ננוגרמים/מ"ל, ולעתים אף ריכוזים גבוהים יותר (Morel וחב' ב-J Biol Chem משנת 2001, ו-Lee וחב' ב-Proc Natl Acad Sci USA משנת 2004).
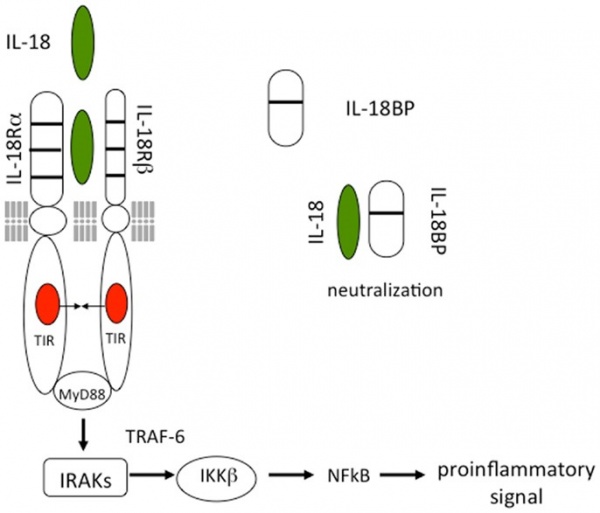
הקולטן של IL-18
הקולטן של IL-18 שייך למשפחת קולטני IL-1R, המורכבים משרשרת IL-18Rα ושרשרת IL-18Rβ. לאחר קישור IL-18 ל- IL-18Rα, מצטרף לקומפלקס IL-18Rβ ליצירת טרימר. למרות ש-IL-18 יכול להיקשר רק ל- IL-18Rα , קישור זה הוא בעל זיקה נמוכה (Hoshino וחב' ב-J Immunol משנת 1999), ושרשרת IL-18Rβ נדרשת להברת הזיקה לצורך יצירת האיתות התאי (Kim וחב' ב-J Immunol משנת 2001, Wu וחב' באותו כתב-עת משנת 2003, ו-Tsutsumi וחב' ב-Nat Commun משנת 2014). הקולטן ל-IL-18 מבוטא לא רק על תאי T ותאי NK, אלא גם בבזופילים, תאי פיטום, ותאי CD4+ NKT, כאשר כל התאים האלה מיצרים ציטוקינים של Th2, דוגמת IL-4 ו-IL-13 בתגובה לגירוי של IL-18 (Nakanishi ב-Front Immunol משנת 2018). IL-18R מבוטא גם על תאי אפיתל ותאי עצב, והוא מעורב בהישרדות ובהתמיינות של תאים אלה.
המקטעים הציטופלזמטיים של IL-18Rα ושל IL-18Rβ, מכילים מקטע משותף הידוע כ-Toll-like receptor. מקטע זה מגיב עם myeloid differentiation primary response 88 (להלן MyD88) (Adachi וחב' ב-Immunity משנת 1998), ואז MyD88 משרה אירועים המביאים לשפעול של NF)-κB) ושל mitogen-activated protein kinase (להלן MAPK), זאת דרך פעולת הקינאזה IRAK כמו גם TRAF 6 שהוא ,TNF receptor-activated factor ופעילויות אלה מביאות לביטוי של Tnfa, Cd40l ו-FasL.
למרות שכמעט כל התאים מבטאים את הקולטן IL-1RI, לא כולם מבטאים את IL-1RAcP. בדומה, רוב התאים מבטאים את IL-18Rα, אך לא כולם מבטאים את IL-18Rβ, המבוטא בעיקר על ידי תאי T ותאים דנדריטים, אך לא מבוטא באופן כללי על ידי תאים מזנכימלים. בהיעדר של IL-18Rβ, IL-18 נקשר ל- IL-18Rα ללא איתות קדם-דלקתי. בתאי A549 שעברו טרנספקציה עםIL-18Rβ , IL-18 משרה את יצירת IL-8 ומספר גדול של גנים. אחד מהגנים האלה, הוא NK4 שהיום הוסב שמו ל-IL-32 המבוטא בתאי T בתאי NK (Dahl וחב' ב-J Immunol משנת 2012). . IL-32 אינו חבר במשפחת IL-1, אך משחק תפקיד חשוב בוויסות פעולתם של ציטוקינים דוגמת IL-1β ו- TNFα. חשוב מכך ש-IL-32 הוא גן המושרה על ידי IL-18.
התפקיד האימונו-רגולטורי של IL-18
תפקידו של IL-18 ביצירת אינטרפרון-γ: IL-18 ביחד עם IL-12 משתתף במערכת של Th1. זאת כיוון ש-IL-18 יכול להשרות INFγ ביחד עם IL-12 או עם-IL-15, ואינו מסוגל להשרות יצירת אינטרפרון-γ ללא שני הציטוקינים האחרים. IL-12 או IL-15 מגבירים את ביטוי הקולטן IL-18Rβ החיוני להעברת איתותים של IL-18. עם זאת, גם ללא נוכחות של 2 הציטוקינים האמורים, IL-18 משחק תפקיד בתחלואה הקשורה ל-TH2 (על פי Nakanishi וחב' ב-Cytokine Growth Factor Rev משנת 2001). יכולת IL-18 להשרות יצירת INFγ מתאי NK, חיונית לפעילותו האימונו-רגולטורית. מונוציטים בדם אדם המבטאים על הממברנה שלהם IL-18, יכולים לעבור התמיינות ולהפוך לתת-קבוצה של מקרופאגים (Bellora וחב' ב-Eur J Immunol משנת 2012). בערך 30-40% מהמקרופאגים שעוברים priming על ידי M-CSF מבטאים על הממברנה שלהם את IL-18, ובניגוד להם, מונוציטים ודנדריטים, אינם מבטאים ציטוקין זה על פני הממברנה. למרות שהביטוי של IL-18 על הממברנה תלוי בפעילות caspase-1, הטיפול ב-LPS נחוץ להפרשה של IL-18 מהממברנה.
תפקיד אימונו-רגולטורי מרכזי של IL-18 קשור לתאי NK, שכן כאשר IL-18 משתחרר מהממברנה לצורתו המסיסה, תאי NK מייצרים רמות גבוהות של INFgama. כצפוי, יצירת INFγ נמנעה עם ניטרולו של IL-18. השראת היצירה של INFγ על ידי IL-18, נלמדה ביחד עם המשרן האחר IL-12. כאשר עכברים הוזרקו על ידי IL-18 בשילוב עם IL-12, פיתחו החיות רמה גבוהה של INFγ, ומתו בתמונה של היפו-גליקמיה, דלקות מעיים, ותשישות כתוצאה מרעב (Nakamura וחב' ב-J Immunol משנת 2000). מספר מחלות אוטו-אימוניות באדם, כרוכות ברמות גבוהות של IL-18 ושל INFgama. מחלות כגון SLE, סוכרת type 1, פסוריאזיס, מחלת קרוהן ודלקת פרקים שגרונית (RA), נחשבות כמתווכות לפחות בחלקן על ידי IL-18.
IL-18 ודלקת
IL-18 מדגים תכונות של ציטוקינים קדם-דלקתיים אחרים, כגון הגברת ספיחה לתאים של מולקולות ספיחה, הגברת הייצור של NO, וכן של כימוקינים. חסימת IL-18 מפחיתה את הופעת גרורות במודל בעכברים של מלנומה, כתוצאה מהפחתת הייצור של 1-VCAM המושרית על ידי IL-18 (על פי Vidal-Vanaclocha וחב' ב-Proc Natl Acad Sci USA משנת 2000). תכונה ייחודית של IL-18 היא בהשראת יצירת FasL, היכולה להסביר את הנזק לכבד המתרחש בתסמונת השפעול של מקרופאגים (MAS) (על פי Mazodier וחב' ב-Blood משנת 2005). הזרקת IL-18 לעכברים או לארנבות, אינה גורמת להופעת חום (Gatti וחב' ב-Am J Physiol Regul Integr Comp Physioln משנת 2002, ו-Li וחב' ב-Brain Res משנת 2003). הזרקה תוך-ורידית של IL-18s לאדם אינה פירוגנית, ובניגוד ל-IL-1 ול-TNFα הגורמים לעליית חום במינונים של 10 ננוגרם/ק"ג, IL-18 העלה את החום רק במינונים של 100-200 מיקרוגרם/ק"ג (Robertson וחב' ב-Clin Cancer Res משנת 2006).
בניגוד ל-IL-1 ול-TNFα, הרי ש-IL-18 אינו משרה יצירת COX-2, ולכן אין יצירה של פרוסטגלנדין E2 (על פי Reznikov וחב' ב-Proc Natl Acad Sci משנת 2000). אמנם IL-18 הוזרק לחולי סרטן כדי להגביר את הפעילות של תאי T ציטוטוקסיים. אך הדגש התרפויטי הוסב בהגברת הפעילות האימונו-סטימולנטית של IL-18, לעיכוב פעילותו (Tak וחב' ב-Eur J Drug Metab Pharmacokinetics משנת 2006). כיוון ש-IL-18 יכול להגדיל את INFgama, חסימת IL-18 במחלות אוטו-אימוניות היא גישה טיפולית אטרקטיבית, שכן IL-12/23 מפחיתים את החומרה של מחלת קרוהן וכן של פסוריאזיס. עם זאת, מספר פעילויות של IL-18 אינן תלויות ב-INFγ. לדוגמה IL-18 מעכב את הסינתזה של proteglycan בכונדרוציטים (Joosten וחב' ב-J Immunol משנת 2000, וידוע שפרטאוגליקן חיוני לבריאות הסחוס. כמו כן, IL-18 מגביר את הביטוי של VCAM-1 בתאי אנדותל, באופן בלתי-תלוי ב-INFγ. ל-VCAM-1 יש תפקיד מרכזי בטרשת נפוצה וכן במחלות אוטו-אימוניות אחרות וכן בתהליכים גרורתיים (Carrascal וחב' ב-Cancer Res משנת 2003).
תפקיד IL-18 במודלים של מחלת מעיים דלקתית
מחלות מעי דלקתיות כמו מחלת קרוהן, הן מחלות אוטו-אימוניות מורכבות. הטיפול מבוסס בתחילה על תכשירים המדכאים את המערכת החיסונית, תכשירים אנטי-ציטוקיניים בדומה לנוגדנים חד-שבטיים כנגד TNFγ (על פי ten Hove וחב' ב-Gut משנת 2002), או כנגד IL-12/23 מועילים למטופלים רבים (Sandborn וחב' ב-Gastroenterology משנת 2008, ו-Mannon וחב' ב-N Eng J Med משנת 2004). המולקולה הבשלה של IL-18 נמצאת בביופסיות של נגעי מעי בחולי קרוהן (Pizzaro וחב' ב-J Immunol משנת 1999).
מודל מקובל בעכברים לקוליטיס, הוא בהוספת DSS למי השתייה מה שפוגע בדופן המעי, ובהתאם מפחית את יכולת החסימה של אפיתל המעי למעבר של תוצרי חיידקים בנהור המעי. במודל זה, הפחתת פעילות IL-18 על ידי נוגדן המנטרל אותו, היא פעולה הגנתית הכרוכה ביצירה מופחתת של INFγ. חסימת IL-18 עם החלבון הקושר אותו (IL-18BP) גם כן מפחיתה את חומרת קוליטיס (ten Hove וחב' ב-Gastroenterology משנת 2001). כיוון שיצירת IL-18 פעיל דורשת פעילות של caspase-1, מחקרים נעשו בעכברים טרנסגניים נטולי caspase-1 בהם הושרתה קוליטיס על ידי DSS, אך התקבלו תוצאות סותרות. מחקר אחד מצא שעכברים נטולי caspase-1 היו מוגנים מפני קוליטיס (Siegmund ב-Biochem Pharmacol משנת 2002). בנוסף, טיפול של עכברים עם מעכב ספציפי של caspase-1 היה גם יעיל בהגנה מפני קוליטיס (Bauer וחב' ב-Gut משנת 2010, ו-Loher וחב' ב-J Pharmacol Exp Ther משנת 2004). בשני המחקרים, ההשפעה של חסר caspase-1 נכרכה בפעילות מופחתת של IL-18, ולחיזוק ההשערה על חשיבות IL-18 בקוליטיס מושרית על ידי DSS, נמצא שעיכוב של merprin beta האנדוגני, מפחית את יצירת IL-18 פעיל והגן בפני DSS colitis (על פי Banerjee ו-Bond ב-J Biol Chem משנת 2008).
כדי לפשר בין התוצאות הסותרות במודל עכבר של קוליטיס, העלה Siegmund ב-Immunity משנת 2010, את ההשערה הבאה: סביר שמולקולת IL-18 שהיא קונסטיטוטיבית באפיתל המעי, היא בעלת תפקיד בהגנה על שלמותו. כאשר יש פגיעה בשלמות דופן המעי, תוצרי חיידקים מעודדים מקרופאגים ב-lamina propria והשפעת caspas-1 על IL-18 מעודדת דלקת. במודל זה, עיכוב יצירת IL-18 בעכברים נטולי caspase-1, או טיפול בעכברים wildtype עם נוגדנים כנגד IL-18 מספק לעכברים הגנה. החמרת המחלה בעכברים נטולי caspase-1 מפחיתה את רמת IL-18 האנדוגני הנדרשת להגנה על שלמות דופן המעי. למרות שעדיין לא ברור מדוע חסר של caspase-1 מחמיר את DSS colitis, באנשים עם מחלת קרוהן, הנוגדן natalizumab החוסם את very late antigen-4 או VLA-4, יעיל מאוד בטיפול במחלה. הנוגדן כנגד VLA-4 נקשר אל פני מקרופאגים ותאים מייאלואידים אחרים, ומונע קישור תאים אלה לקולטן של VLA-4 על תאי אנדותל, הידוע כ-VCAM-1. כיוון ש-IL-18 משרה יצירת VCAM-1, חסימת IL-18 גם כן תפחית את מעברם של מקרופאגים ותאי מיילואיד אחרים דרך האנדותל לתוך המעיים.
נראה ש-IL-18 פועל כרגולטור של הומאוסטזיס. עכברים נטולי IL-18 מתחילים להגזים באכילה, משמינים ומראים אי סדירות בהרכב הליפידים בדם, עם עלייה בטרשת עורקים, עמידות לאינסולין והופעת סוכרת באופן המזכיר תסמונת מטבולית (Netea וחב' ב-Nature Med משנת 2006). גם בעכברים נטולי IL-18Rα מופיעות תופעות דומות (Zorrilla וחב' ב-Proc Natl Acad Sci USA משנת 2007). ממצא בולט הוא שבעכברים נטולי IL-18 מוצאים עלייה של 100% ברקמת השומן, המלווה במשקעי שומן על דופן העורקים. כן יצוין, שהעמידות לאינסולין תוקנה על ידי הזרקת IL-18 רקומביננטי.
תפקיד הגנתי של IL-18
בנוסף לתפקיד ההגנתי של IL-18 שתואר לעיל בהקשר של מודל קוליטיס המושרה על ידי DSS, והופעת תסמונת מטבולית בעכברים בהיעדר IL-18, התפקיד ההגנתי של ציטוקין זה אינו מוגבל רק למערכת העיכול. בעיניים, מצב הדומה ל-"ניוון רטוב של המאקולה" מחמיר בהוספת נוגדנים ל-IL-18 (על פי Doyle וחב' ב-Nature Med משנת 2012).
העיבוד והפרשת הקודמן של IL-18 בתיווך של ADAM 33 במנגנון התלוי ב-VEGF: כיוון ש-IL-18 מעודד תאי אנדותל ומעודד התפשטות של תאי סרטן ממאירים, מחקרים בחנו את מנגנון הפרשת IL-18 משורת תאים שמקורם בסרטן הקיבה. מתברר ש-vascular endothelial cell growth factor-D (להלן VEGF-D), הגביר את הייצור וההפרשה של IL-18 מתאי סרטן קיבה אלה (Kim וחב' ב-J Immunol משנת 2009). כיוון ש-VEGF-γδADAM33 מנע את ההפרשה של IL-18.
IL-18 וסרטן
IL-18 משפעל תאי NK לייצר INFγ ולהגביר ציטו-טוקסיות כנגד תאים סרטניים בסינרגיה עם IL-12 (על פי Okamura וחב' ב-Nature משנת 1995, Takeda וחב' ב-Immunity משנת 1998, ו-Hyodo וחב' ב-J Immunol משנת 1999). כיוון שתאי NK הוכחו כתאים הורגי סרטן (Chiossone וחב' ב-Nature Rev Immunol משנת 2018), מחקרים רבים בחנו האם IL-18 מונע את התפשטות הגידול הסרטני (Granzin וחב' ב-Front Immunol משנת 2017, Park וחב' ב-Cell Mol Immunol משנת 2007, ו-Fabbi וחב' ב-J Leukoc Biol משנת 2015. ישנן 2 תאוריות על התפקידים המועילים של IL-18 בהגנה מפני סרטן: התאוריה הראשונה, קשורה ליצירת תרפיה למצבים סרטניים על ידי תאים של γδT של אדם; התאוריה האחרת מתייחסת לחשיבות של פטריות במיקרוביוטה להגנה בפני סרטן המעי הגס והחלחולת הכרוך בקוליטיס על ידי השראת IL-18.
מסתבר ש-IL-18 מגביר פעילותם של תאי γδT שהם תאים עם מספר סגולות בדומה לתאי מערכת החיסון הטבעית (innate), (על פי Bonneville וחב' ב-Nat Rev Immunol משנת 2010, ו-Fisher ו-Anderson ב-Front Immunol משנת 2018). לדוגמה, בדומה לתאי αβT, תאי γδT משופעלים מתוך מעורבות של הקולטן של תאי T.
העיבוד והפרשת הקודמן של IL-18 בתיווך של ADAM 33 במנגנון התלוי ב-VEGF: כיוון ש-IL-18 מעודד תאי אנדותל ומעודד התפשטות של תאי סרטן ממאירים, מחקרים בחנו את מנגנון הפרשת IL-18 משורת תאים שמקורם בסרטן הקיבה. מתברר ש-vascular endothelial cell growth factor-D (להלן VEGF-D), הגביר את הייצור וההפרשה של IL-18 מתאי סרטן קיבה אלה (Kim וחב' ב-J Immunol משנת 2009). כיוון ש-VEGF-D מכיל מקטע (domain) בעל פעילות metalloprotease, השיכוך של ADAM33 מנע את ההפרשה של IL-18.
IL-18 ומחלת לב
מחלת לב כוללת מחלת עורקים כליליים הכרוכה באוטם שריר הלב, וכן באי-ספיקת לב כרונית כאשר האחרונה נובעת מ-remodeling של חדרי הלב לאחר אירוע האוטם. מחקרים קדם-קליניים הדגימו שחסימה של IL-1β היא גישה יעילה (Abbate וחב' ב-Eur J Heart Failure משנת 2010), ואכן ניסויים תוך שימוש ב-Anakinra נמצא מפחית אפופטוזיס ב-AMI ניסויי (Abbate וחב' ב-Circulation משנת 2008) , וכן הראו שחסימת IL-1β יעילה בהפחתת ה-remodeling שלאחר האוטם (Abbate וחב' ב-Am J Cardiol משנת 2013), וכן הגבירה את הסבילות במאמץ גופני באלה עם אי-ספיקת לב סיסטולית (Van Tassell וחב' ב-PLos One משנת 2012). הניסוי הקליני הגדול ביותר, המכונה ניסוי CANTOS, שכלל 17,200 מטופלים בסיכון גבוה שטופלו בנוגדן כנגד IL-1beta, החל דרכו על ידי Ridker וחב' בשנת 2011 על פי הדיווח ב-Am Heart J.
מספר הולך וגדל של ניסויים קליניים וכן ניסויים בחיות, מצביע על תפקיד ל-IL-18 במחלת לב. המיוקרד של מטופלים עם מחלת לב איסכמית מבטא את שרשרת α של הקולטן של IL-18, ונמצא שיש ריכוזים מוגברים של IL-18 בצירקולציה מה שכרוך בתמותה (Mallat וחב' ב-FASEB J משנת 2004). הזרקה יומיומית לעכברים של IL-18 גרמה להיפרטרופיה חדרית, להגברת ריכוז קולאגן (Platis וחב' ב-Perfusion משנת 2008), וללחץ דיאסטולי מוגבר בחדר הלב השמאלי (Woldbaek וחב' ב-Am J Physiol Heart Circ Physiol משנת 2005). במודל של דיכוי שריר הלב הכרוך בהלם ספטי, עכברים הוזרקו עם LPS, ולאחר מכן הוחדר להם נוגדן מנטרל כנגד IL-18 (על פי Raeburn וחב' ב-Am J Physiol משנת 2002). הרציונל של ניסוי זה היה ש-IL-18 מגביר את היצירה של TNFα וכן של IL-1β, ומשרה את הביטוי של מולקולות הספיחה הבינתאית ICAM-1 ו-VCAM-1. עכברים הוזרקו עם LPS ונמדד בהם הלחץ שהתפתח בחדר הלב השמאלי. נמצא שלחץ זה דוכא ב-38% לאחר 6 שעות מהזרקת LPS, אך טיפול מוקדם עם נוגדן כנגד IL-18 החליש את התפקוד הלקוי של המיוקרד המושרה על ידי LPS, בשיעור ניכר של 92%.
במחקר אחר, נלקחו רצועות משריר פרוזדור הלב ממנותחים שעברו ניתוח מעקפים, ורקמות אלה נחשפו לאיסכמיה תוך מדידת כושר ההתכווצות שלהם. הוספה של IL-18BP לנוזל הפרפוזיה במהלך ולאחר האירוע האיסכמי, הביאה לשיפור יכולת ההתכווצות מ-35% בביקורת, ל-76% בהוספת IL-18BP (על פי Pomerantz וחב' ב-Proc Natl Acad Sci משנת 2001). הטיפול ב-IL-18BP גם שימר את הרמה התוך תאית של creatine kinase. לאחר אירוע איסכמי רמת IL-18 mRNA הוגברה, ובהתאם גם רמת IL-18 גדלה בתמצית של המיוקרד בהשוואה לביקורת (26 לעומת 5.8 פיקוגרם/מיליגרם).
הוראות לביצוע הבדיקה
אין צורך בהכנות מוקדמות כצום. לאחר נטילת הדם במבחנה כימית (פקק אדום או צהוב), יש לסרכז בקירור, ולהקפיא את הנסיוב המתקבל. הדגימה יציבה בטמפרטורת החדר למשך 48 שעות, בקירור למשך 7 ימים ובהקפאה למשך 28 יום. מדידת רמת IL-18 מתבצעת בשיטת ELISA.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - בדיקות ביוכימיות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק