הבדלים בין גרסאות בדף "מוטציות בתסמונת Hunter"
| (12 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 2: | שורה 2: | ||
|שם עברי=מוטציות בתסמונת Hunter | |שם עברי=מוטציות בתסמונת Hunter | ||
|שם לועזי={{רווח קשיח}} | |שם לועזי={{רווח קשיח}} | ||
| − | |קיצור= | + | |קיצור= IDS, MPS2, MPSII |
|תמונה= | |תמונה= | ||
|כיתוב תמונה= | |כיתוב תמונה= | ||
| שורה 16: | שורה 16: | ||
==מידע קליני:== | ==מידע קליני:== | ||
| − | ה[[מוקופוליסכרידוזות]] הן משפחה של מפגעים הנגרמים בשל חסר של כל אחד מהאנזימים הכרוכים בפירוק השלבי של dermatan sulfate ,heparan sulfate, keratan sulfate ושל chondroitin sulfate הידועים כגליקוז-אמינו-גליקנים או GAGs. הצטברות של GAGs בליזוזומים פוגעת בתפקוד התקין של התאים, הרקמות, והאיברים. מחלת Hunter היא מפגע של אגירה ליזוזומלית הכרוך בכרומוזום X, הנובע מחסר האנזים | + | ה[[מוקופוליסכרידוזות]] הן משפחה של מפגעים הנגרמים בשל חסר של כל אחד מהאנזימים הכרוכים בפירוק השלבי של dermatan sulfate ,heparan sulfate, keratan sulfate ושל chondroitin sulfate הידועים כגליקוז-אמינו-גליקנים או GAGs. הצטברות של GAGs בליזוזומים פוגעת בתפקוד התקין של התאים, הרקמות, והאיברים. מחלת Hunter היא מפגע של אגירה ליזוזומלית הכרוך בכרומוזום X, הנובע מחסר האנזים iduronate sulfatase (להלן IDS), שגורם לביטוי קליני פנימי וחיצוני כאחד בתסמונת Hunter. האנזים [[iduronate 2-sulfatase]] כרוך בפירוק הליזוזומאלי של heparan sulfate ושל dermatan sulfate (Bielicki וחב' ב-Biochemistry משנת 1990). |
| − | המאפיינים הקליניים וחומרתם מגוונים ביותר החל במחלה חמורה ועד צורה מתונה שלה המתחילה להתבטא רק בגיל מתקדם יותר עם תסמינים קליניים בדרגת חומרה נמוכה עד מתונה. כללית, תסמיני מפגע זה כוללים תווי פנים גסים, קומה נמוכה, כבד וטחול מוגדלים, קול צרוד, מפרקים נוקשים, מחלת לב, ומעורבות נירולוגית בולטת הכוללת פיגור התפתחותי ונסיגה מנטאלית. כיוון שתסמונת Hunter כרוכה בכרומוזום X, היא מופיעה כמעט בלעדית בזכרים בתדירות של 1:120,000 לידות זכרים, אם כי דווח גם על נשים נשאיות עם חלק מתסמיני המחלה. חלופות טיפוליות כוללות השתלת תאי גזע המאטו-פויאטיים, ותרפיה על ידי עירוי האנזים החסר. | + | המאפיינים הקליניים וחומרתם מגוונים ביותר החל במחלה חמורה ועד צורה מתונה שלה המתחילה להתבטא רק בגיל מתקדם יותר עם תסמינים קליניים בדרגת חומרה נמוכה עד מתונה. כללית, תסמיני מפגע זה כוללים תווי פנים גסים, קומה נמוכה, כבד וטחול מוגדלים, קול צרוד, מפרקים נוקשים, [[מחלת לב]], ומעורבות נירולוגית בולטת הכוללת פיגור התפתחותי ונסיגה מנטאלית. כיוון שתסמונת Hunter כרוכה בכרומוזום X, היא מופיעה כמעט בלעדית בזכרים בתדירות של 1:120,000 לידות זכרים, אם כי דווח גם על נשים נשאיות עם חלק מתסמיני המחלה. חלופות טיפוליות כוללות השתלת תאי גזע המאטו-פויאטיים, ותרפיה על ידי עירוי האנזים החסר. |
| − | בירור אבחוני באלה המאובחנים עם MPS II מדגים באופן אופייני רמות מוגברות בשתן של גליקוזאמינוגליקנים (GAGs) ורמות מוגברות בעיקר של dermatan sulfate ושל heparin sulfate. רמה מופחתת או חסר מוחלט של IDS יכולים לאשר אבחון של MPS II. | + | בירור אבחוני באלה המאובחנים עם MPS II מדגים באופן אופייני רמות מוגברות בשתן של גליקוזאמינוגליקנים (GAGs) ורמות מוגברות בעיקר של dermatan sulfate ושל heparin sulfate. רמה מופחתת או חסר מוחלט של IDS יכולים לאשר אבחון של MPS II. עם זאת, בדיקה אנזימטית אינה אמינה בכל הקשור לגילוי נשאי הטרוזיגוטיים של המחלה. לעומת זאת בחינה גנטית מולקולארית של בחינת הגן IDS המקודד לאנזים הרלוונטי, מאפשר גילוי המוטציה שגרמה למחלה וכן לזיהוי נשים נשאיות בעלות קרבת-דם לזכר הנגוע. עדיין לא ביססו קשר ברור בין הגנוטיפ והפנוטיפ של המחלה. |
טווח הערכים הנורמאלי של האנזים IDS הוא מעל 1.5nmol/h/ml. רמות אנזים הנמוכות מערך זה בדגימות שנדגמו כראוי תואמות מצב של חסר iduronate-2-sulfatase או MPS II. אם גם יש אישוש המפגע על פי המדדים הקליניים, יש לשקול אימות נוסף באנליזה המולקולארית-גנטית של הגן IDS. יש לקח בחשבון שפעילות אנזים זה יכולה להיות מופחתת ב-MDS או multiple sulfatase deficiency. אם יש גם ראיות קליניות, יש לשקול בחינה גנטית מולקולארית של סולפטאזות אחרות או בחינה מולקולארית של הגן SUMF 1 לשלול אפשרות של MSD. | טווח הערכים הנורמאלי של האנזים IDS הוא מעל 1.5nmol/h/ml. רמות אנזים הנמוכות מערך זה בדגימות שנדגמו כראוי תואמות מצב של חסר iduronate-2-sulfatase או MPS II. אם גם יש אישוש המפגע על פי המדדים הקליניים, יש לשקול אימות נוסף באנליזה המולקולארית-גנטית של הגן IDS. יש לקח בחשבון שפעילות אנזים זה יכולה להיות מופחתת ב-MDS או multiple sulfatase deficiency. אם יש גם ראיות קליניות, יש לשקול בחינה גנטית מולקולארית של סולפטאזות אחרות או בחינה מולקולארית של הגן SUMF 1 לשלול אפשרות של MSD. | ||
| שורה 36: | שורה 36: | ||
==מבנה הגן IDS== | ==מבנה הגן IDS== | ||
| + | בשנת 1993 קבעו Flomen וחב' ב-Genomics שהגן IDS מכיל 9 אֶקסונים (שסומנו כ-A עד I). הם אפיינו את ה-introns המקיפים את 9 האֶקסונים, ומצאו שלגן IDS אין כל קשר לארגון האֶקסון של steroid sulfatase, זאת למרות ההומולוגיה בין שני האנזימים. ממצא זה רמז לכך שחלוקת הסולפטאזות ל-2 תת-קבוצות על בסיס הספציפיות שלהם למצע האנזים, משתקף גם ברמת מבנה האנזים. Wilson וחב' פרסמו בשנת 1993 ב-Genomics את הרצף השלם של הגן IDS שגודלו בערך 24kb. הפרומוטר הפוטנציאלי עבור IDS חסר TATA box אך הוא מכיל רצפים של GC box, התואמים את תפקידו של IDS כ-housekeeping gene. בשנת 1990 פרסמו Wilson וחב' ב-Proc Natl Acad Sci USA את המיקום של הגן IDS בזרוע הארוכה של כרומוזום X בעמדה Xq28 במיקום דיסטאלי לזה של "כרומוזום X השביר", על ידי שימוש בשבט cDNA של IDS. | ||
| + | |||
| + | בשנת 1992 הדגימו Faust וחב' ב-Genomics ובשנת 1993 עשו זאת Daniele וחב' באותו כתב עת, שהגן IDS תופס בעכברים את אותה עמדה בכרומוזום X ביחס לגן F9 המקודד לפקטור הקרישה IX, לגן FMR1 המקודד לחלבון הקרוי fragile X mental retardation protein או FMRP, וכן לגן GABRA3 המקודד לחלבון Gamma-aminobutyric acid receptor subunit alpha-3. | ||
| + | |||
| + | ==פסבדו-גן== | ||
| + | בשנת 1995 דווחו Bondeson וחב' ב-Europ J Hum Genet על זיהוי של גן IDS שני (שכונה על ידם IDS2) הממוקם בתוך מתחם 90kb טלומרי של הגן ל-IDS. הם הראו שאזור זה כרוך באירוע רקומבינציה עם הגן הראשוני IDS בערך ב-13% הלוקים במחלת Hunter. | ||
| + | |||
| + | ==ריבוי מוטציות בגן IDS== | ||
| + | Ricci וחב' ציינו ב- Am J Med Genet משנת 2003 את העובדה שעד לנקודת זמן זו, דווח על למעלה מ-200 מוטציות ב-IDS בחולים עם מחלת Hunter. אכן מדובר במספר ניכר של מוטציות שונות בחולים ממוצא אתני מגוון. Kosuga וחב' דווחו ב-Molec Genet Metab משנת 2016 על אנליזה גנטית שבוצעה ב-65 משפחות יפניות עם MPS II. זוהו בהן 16 מוטציות חדשות: ב-24 גברים עם הפנוטיפ המוחלש של מחלת Hunter, נמצאו מוטציות missense ב-21 מתוכם, בשניים מהם נמצאו 2 מוטציות nonsense ( P8Xו- R443X), ובאחד נתגלה שמט (deletion) של 20 חומצות אמינו באֶקסון 8. | ||
| + | |||
| + | בשנת 1991 דווחו Wilson וחב' ב-Hum Genet על שנמצא שמט (deletion) או gene rearrangement ב-7 מתוך 23 חולים עם mucopolysaccharidosis type II ממוצא אוסטרלי או בריטי. כמו כן, ב-2 מתוך 14 גרמנים ללא קרבה ביניהם עם MPS II, נמצאו שינויים מבניים בגן IDS על ידי Southern analysis תוך שימוש שבט cDNA של IDS בתור probe. באחד מבין חולים אלה, גבר חולה באופן חמור, לא אותרו פרגמנטים בשיטת Southern. בשנת 1992 דווחו Sukegawa וחב' על ילד בן-12 שנה עם MPS II ומוטציית missense בגן IDS. | ||
| + | |||
| + | ב-6 חולים במחלת Hunter, זיהו Flomen וחב' (Genomics משנת 1992) מוטציות בגן IDS הכוללות שמט (deletion) שלם, מוטציית nonsense, מוטציה נקודתית שיצרה נקודת splice חדשה, ו-3 מוטציות missense. בשנת 1995 תוארו 8 דוגמאות חדשות של מוטציה נקודתית בגן IDS של חולים יפניים עם מחלת Hunter עם דרגות שונות של חומרה (Sukegawa וחב' ב-Hum Mutat משנת 1995). חוקרים אלה ביצעו אנליזה של הגן IDS בחולי Hunter יפניים עם פנוטיפים קליניים שונים. חמש מוטציות missense זוהו על ידי שיטת RT-PCR: מוטציית S333L (חמורה), R468Q (חמורה), R468L (חמורה), W337R (מתונה) ו-R48P (קלה). באותה שיטה זוהו גם 3 מוטציות nonsense והן: W345X (חמורה), R443X (מתונה) ו-Q531X (קלה). בחינת פיברובלסטים מחוסרי האנזים, גילתה שכל 5 מוטציות missense סונתזו כמו הקודמן (precursor) בגודל התקין של 73kD, ואילו שלושת המוטציות nonsense סונתזו מקוטעים- truncated כ-: W345X:54 kD, וכן R443X:59 kD ו-Q531X:69 kD. עם זאת האנזים הבשל והיציב (kD45-56) לא זוהה באף לא אחת מהמוטציות באנליזה שיטת Western blot. יתרה מכך, ביטוי של cDNA של כל 8 המוטציות הביא להפחתה חמורה של פעילות iduronate-2-sulfatase בהשוואה ל-cDNA תקין. | ||
| + | |||
| + | בשנת 1998 דווחו Isogai וחב' ב-J Inherit Metab Dis על הזיהוי של 25 מוטציות קטנות ושונות בגן IDS ב-43 יפנים עם מחלת Hunter. ביניהן התגלו בקודון 468 של אקסון 9 שלוש מוטציות שונות: arg468-to-trp, arg468-to-gln ו-arg468-to-Leu, ששלושתן היו כרוכות בפנוטיפ חמור. | ||
| + | |||
| + | במטופל עם פנוטיפ חמור של Hunter זיהו Isogai וחב' בשנת 1998 שחלוף של G ל-T בנוקלאוטיד 1403 של הגן IDS, מה שגרם לשחלוף Arg468leu. בסדרה של חולים יפניים 5 מתוך 17 (29%) עם מוטציות missense הראו שינוי זה בקודון 468. הם גם הדגימו שהדו-נוקלאוטיד CpG בנקודה זו עבר מתילציה, מה שרמז לכך שקודון R468 היה אמנם hotspot של מוטציות. | ||
| + | |||
| + | '''מוטציות Cys422Gly ו-Lys135Arg :''' בשנת 1992 וחב' דווחו Bunge וחב' ב-Hum Molec Genet על ילד בן-8 עם תסמינים מאוד מתונים של Hunter ואינטליגנציה נורמאלית, בו זוהה שחלוף של TGC ל-GGC בקודון 422 שח הגן IDS, מה שהביא להכנסת שייר גליצין במקום ציסטאין. באותו מחקר דווח גם על ילד בן-5 עם מאפינים טיפוסיים של מחלת Hunter ויכולת דיבור דועכת. בילד זה זוהה שחלוף של AAA ל-AGA בקודון 135 מה שהביא להכנסת שייר ארגינין במקום ליזין. בנוסף, שינוי "שקט" של ACC ל-ACT נמצא בקודון 146. | ||
| + | |||
| + | '''מוטציית Arg468Leu:''' מוטציה זו בקודון R468 אותרה בחולי Hunter מתונים ממוצא אתני שונה: Crotty וחב' ב-Hum Molec Genet משנת 1992; Hopwood וחב' ב-Hum Mutat משנת 1993. מוטציית Trp475Ter: בבחור בן 20 שנה עם תסמינים אופייניים של MPS II, "אך עדיין מסוגל לדבר", Bunge וחב' דווחו בשנת 1992 ב-Hum Molec Genet על זיהוי שינוי שלTGG ל-TGA בקודון 475 של הגן IDS, שגרם להמרה של Trp codon ל-stop codon. | ||
| + | |||
| + | '''מוטציית Arg468Leu:''' מוטציות בקודון 468 נמצאו בחולי MPS II ממוצאים אתניים שונים (Crotty וחב' משנת 1992, Hopwood וחב' משנת 1993 ו-Whitley וחב' משנת 1993). בשנת 1998 דווחו Isogai וחב' על מקרה חמור של MPS II בו זיהו המרה של G ל-T בנוקלאוטיד 1403 של הגן IDS, שהביא לשחלוף של ארגינין על ידי לאוצין בעמדה 468. במחקרם על חולים יפאניים עם מוטציות , נמצא שב-5 מתוך 17 חולים (29%) עם מוטציות missense, השינוי היה בקודון R468. חוקרים אלה מצאו שהדינוקלאוטיד CpG במקום זה נשא קבוצת מתיל, מה שמרמז על כך שהקודון R468 הוא hotspot של מוטציות. | ||
| + | |||
| + | ==מוטציה Arg468Trp גורמת לתסמונת מתונה== | ||
| + | ריצוף של תוצרי RT-PCR על ידי Crotty וחב' (Hum Molec Genet משנת 1992), הביא לזיהוי שחלוף C ל-T בנוקלאוטיד 1402 של הגן IDS, מה שגרם שחלוף של ארגינין על ידי טריפטופן בעמדה 468, במטופל עם תסמונת Hunter מתונה. | ||
| + | |||
| + | בשנת 2003 תיארו Ricci וחב' ב-Am J Med Genet חולה איטלקי עם מחלת Hunter בו נמצאו 2 מוטציות missense בשתי חומצות אמינו שכנות, met488-to-Ile ו-Gly489-to-Ala. ביטוי in vitro על ידי תאי 7-COS אישר שהמוטציה G489A הייתה המוטציה הגורמת ל-2 שינויים אלה. המוטציה M488I הייתה כרוכה בפעילות שארית. למרות שההשפעה המצטברת של 2 המוטציות יכולה הייתה להיות מבוטלת in vitro, לא ניתן הדבר in vivo, ואכן החולה המדובר בהגיעו לגיל 23 שנה, הראה פנוטיפ קליני בעל חומרת בינים. | ||
| + | |||
| + | למרות שהמוטציה Arg468-to-Trp הייתה כרוכה בצורה מתונה של Hunter, הראו Whitley וחב' ב-Hum Mutat משנת 1993 ביטוי מאוד חמור של המחלה בתינוק בו נמצאה מוטציה באותו קודון: שינוי G ל-A בנוקלאוטיד 1403 של הגן IDS, גרם לשחלוף של גלוטמין במקום ארגינין (R468Q). מטופל זה נפטר בגיל 23 חודש. | ||
| + | |||
| + | בחולה Hunter יפני בצורה החמורה של המחלה, תיארו Sukegawa וחב' בשנת 1995 ב-Hum Mutat שמט (in frame של שלושה נוקלאוטידים 473delTCC באקסון 3 של הגן IDS, מה שגרם לאובדן של שייר serine בעמדה 117. בשנת 2001 דוווחו Bonuccelli וחב' ב-Biochim Biophys Acta על מחקר בו נבחנה השפעת מוטציה זו בתאי 7-COS, ואכן לא נמצאה בתאים אלה כל פעילות של IDS. | ||
| + | |||
| + | בשנת 1992 פרסמו Flomen וחב' ב-Genomics נתונים על 6 חולי Hunter והמוטציות שלהם בגן IDS. מוטציות אלו כללו שמט שלם, מוטציית nonsense, מוטציה נקודתית שיצרה נקודת splice חדשה, ו-3 מוטציות missense. באחד החולים זוהה שינוי של G ל-C בנוקלאוטיד 1629 של הגן IDS, שהביא להתמרה של serine ל-trytophan בעמדה 502 והכנסת שרשרת צדדית מעט קוטבית במקטע שהוא הידרופובי. בחולה אחר זוהה שינוי של C ל-G בנוקלאוטיד 603 בגן IDS, שהביא להתמרה של ארגינין לפרולין בעמדה 160 של האנזים. בחולה נוסף זוהה שינוי C ל-T בנוקלאוטיד 638 של IDS, שממיר את ארגינין 172 ל-stop codon. בחולה נוסף נמצא שינוי של C ל-T בנוקלאוטיד 1246 של הגן IDS, שלא גרם לשום שינוי בקודון, דהינו היה שינוי "שקט", אך יצר נקודת splice קריפטית שגרמה לאובדן חלקי של האֶקסון. ששים base pairs אבדו ב-cDNA מ-G1244 עד G1305. בחולה נוסף זוהה שינוי C ל-T בנוקלאוטיד 1122 של הגן IDS, שגרם לחלוף של leucine על ידי serine בעמדה 333. שינוי זה הביא ליצירה של אזור splice חדש שגורם לאיבוד חלקי של אֶקסון 1 ב-RNA. | ||
| + | |||
| + | בילד יפני בן 12 עם מחלת Hunter בדרגת חומרה מתונה, מצאו Sukegawa וחב' בשנת 1992 שינוי C ל-T בנוקלאוטיד 1327 בגן IDS, שגרמה להתמרה של "קודון הפסק" במקומו של ארגינין נורמלי בשייר 443 של רצף הפפטיד (Arg443TER). למרות שהאנזים המקוטע (truncated) סונתז, הוא לא היה יציב. Bunge וחב' דווחו בשנת 1992 ב-Hum Molec Genet על מוטציה זהה בילד בן 3, שסבל מעיוותי שלד, אך ההתפתחות הפסיכו-מוטורית שלו הייתה תקינה. | ||
| + | |||
| + | בשנת 1997 פרסמו Sukegawa וחב' ב-Hum Mutat על ממצאים בילדה יפנית עם צורה חמורה של Hunter. הקריוטיפ שלה היה תקין, אך היה חסר בולט של האנזים IDS בלימפוציטים ובפיברובלטים שלה שגודלו בתרבית. זוהתה אצלה מוטציה R468Q בגן IDS. אנליזה בשיטת RT-PCR הראתה שה-cDNA שלה מייצג רק את האלל R468Q, למרות שברמה הגנומית היא הייתה הטרוזיגוטית, עם אלל אחד נורמאלי. לאחיה הייתה מוטציית R468Q. ואילו האמא שלה הייתה נשאית של מוטציה זו. נראה שבילדה זו היה ביטוי בררני של האלל האימהי שנשא את מוטציית ה-missense R468Q. | ||
| + | |||
| + | ==הוראות לביצוע הבדיקה== | ||
| + | יש לדגום דם למבחנת ספירת-דם (EDTA, פקק סגלגל), אם כי ניתן גם להשתמש במבחנה כימית (פקק אדום או צהוב). אין לפסול דגימות דם המוליטיות, ליפמיות או איקטריות. דגימות פלזמה או נסיוב יכולות להישלח למעבדה מקוררות או בטמפרטורת החדר ויציבות הדגימה היא 7 ימים. | ||
| + | |||
| + | ==ראו גם== | ||
| + | *[[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[אבחון מחלות ומפגעים מטבוליים-גנטיים|בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים]] | ||
| + | * [[אבחון תסמנות גנטיות|בדיקות מעבדה - אבחון תסמנות גנטיות]] | ||
| + | *[[מפגעי מערכת העצבים והמוח|בדיקות מעבדה - מפגעי מערכת העצבים והמוח]] | ||
| + | |||
| + | |||
| + | {{ייחוס בן עמי}} | ||
| + | |||
| + | [[קטגוריה:בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים]] | ||
| + | [[קטגוריה:בדיקות מעבדה - אבחון תסמנות גנטיות]] | ||
| + | [[קטגוריה:בדיקות מעבדה: גנטיקה]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
| + | [[קטגוריה:בדיקות מעבדה - מפגעי מערכת העצבים והמוח]] | ||
גרסה אחרונה מ־12:34, 15 באפריל 2017
| מדריך בדיקות מעבדה | |
| מוטציות בתסמונת Hunter | |
|---|---|
| שמות אחרים | IDS, MPS2, MPSII |
| מעבדה | כימיה בדם |
| תחום | פגם אנזימטי הגורם לתסמונת Hunter |
| טווח ערכים תקין | > or =1.5 nmol/h/mL |
| יוצר הערך | פרופ' בן-עמי סלע |
- מטרת הבדיקה
אבחון של תסמונת Hunter הידועה גם כ-mucopolysaccharidosis II או MPS II.
מידע קליני:
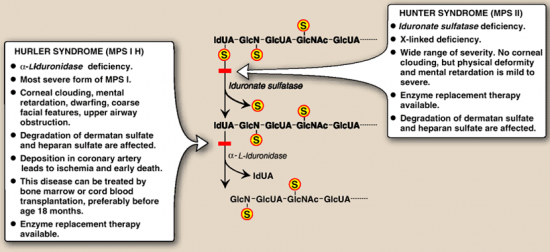
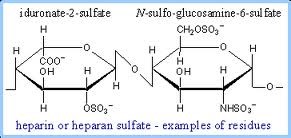
המוקופוליסכרידוזות הן משפחה של מפגעים הנגרמים בשל חסר של כל אחד מהאנזימים הכרוכים בפירוק השלבי של dermatan sulfate ,heparan sulfate, keratan sulfate ושל chondroitin sulfate הידועים כגליקוז-אמינו-גליקנים או GAGs. הצטברות של GAGs בליזוזומים פוגעת בתפקוד התקין של התאים, הרקמות, והאיברים. מחלת Hunter היא מפגע של אגירה ליזוזומלית הכרוך בכרומוזום X, הנובע מחסר האנזים iduronate sulfatase (להלן IDS), שגורם לביטוי קליני פנימי וחיצוני כאחד בתסמונת Hunter. האנזים iduronate 2-sulfatase כרוך בפירוק הליזוזומאלי של heparan sulfate ושל dermatan sulfate (Bielicki וחב' ב-Biochemistry משנת 1990).
המאפיינים הקליניים וחומרתם מגוונים ביותר החל במחלה חמורה ועד צורה מתונה שלה המתחילה להתבטא רק בגיל מתקדם יותר עם תסמינים קליניים בדרגת חומרה נמוכה עד מתונה. כללית, תסמיני מפגע זה כוללים תווי פנים גסים, קומה נמוכה, כבד וטחול מוגדלים, קול צרוד, מפרקים נוקשים, מחלת לב, ומעורבות נירולוגית בולטת הכוללת פיגור התפתחותי ונסיגה מנטאלית. כיוון שתסמונת Hunter כרוכה בכרומוזום X, היא מופיעה כמעט בלעדית בזכרים בתדירות של 1:120,000 לידות זכרים, אם כי דווח גם על נשים נשאיות עם חלק מתסמיני המחלה. חלופות טיפוליות כוללות השתלת תאי גזע המאטו-פויאטיים, ותרפיה על ידי עירוי האנזים החסר.
בירור אבחוני באלה המאובחנים עם MPS II מדגים באופן אופייני רמות מוגברות בשתן של גליקוזאמינוגליקנים (GAGs) ורמות מוגברות בעיקר של dermatan sulfate ושל heparin sulfate. רמה מופחתת או חסר מוחלט של IDS יכולים לאשר אבחון של MPS II. עם זאת, בדיקה אנזימטית אינה אמינה בכל הקשור לגילוי נשאי הטרוזיגוטיים של המחלה. לעומת זאת בחינה גנטית מולקולארית של בחינת הגן IDS המקודד לאנזים הרלוונטי, מאפשר גילוי המוטציה שגרמה למחלה וכן לזיהוי נשים נשאיות בעלות קרבת-דם לזכר הנגוע. עדיין לא ביססו קשר ברור בין הגנוטיפ והפנוטיפ של המחלה.
טווח הערכים הנורמאלי של האנזים IDS הוא מעל 1.5nmol/h/ml. רמות אנזים הנמוכות מערך זה בדגימות שנדגמו כראוי תואמות מצב של חסר iduronate-2-sulfatase או MPS II. אם גם יש אישוש המפגע על פי המדדים הקליניים, יש לשקול אימות נוסף באנליזה המולקולארית-גנטית של הגן IDS. יש לקח בחשבון שפעילות אנזים זה יכולה להיות מופחתת ב-MDS או multiple sulfatase deficiency. אם יש גם ראיות קליניות, יש לשקול בחינה גנטית מולקולארית של סולפטאזות אחרות או בחינה מולקולארית של הגן SUMF 1 לשלול אפשרות של MSD.
שיבוט וביטוי של הגן האנזים המקודד ל-IDS
בשנת 1981 פרסמו DiNatale ו-Ronsisvalle ב-Biochim Biopys Acta על זיהוי שתי צורות של iduronate sulfatase משליית אדם, ואילו Bielicki וחב' דווחו ב-Biochem J בשנת 1990, על ניקוי של 2 צורות עיקריות של אנזים זה עם משקלים מולקולאריים של 42,000 ו-14,000 דלטון. Wilson וחב' ב-Hum Genet משנת 1990 דווחו על בידוד וריצוף של cDNA בגודל של 2.3kb, המקודד לרצף המלא של IDS מאדם מתוך ספריה של cDNA ממקור תאי אנדותל. אנליזה של קודמן (precrsor) האנזים בעל 550 חומצות האמינו, הצביע על כך ש-IDS הוא בעל מקטע של 25 חומצות אמינו המשמש כ-signal sequence, המלווה על ידי מקטע של 8 חומצות אמינו המורחקות מהקודמן pro-protein.
ביקוע פרוטאוליטי תוך-מולקולארי מתרחש ליצירה של 2 פוליפפטידים בשלים עם משקלים מולקולאריים של 42,000 ו-14,000 דלטון שמוצאים בכבד, בריאות ובשלייה. נמצאה כמו כן הומולוגיה חזקה של IDS עם שלושת הצורות של arylsulfatase B, arylsulfatase A ו-arylsulfatase C האנושיים, וכן עם האנזים האנושי glucosamine-6-sulfatase. אנליזה של Northern blot זיהתה שלושה סוגים עיקריים של RNA בגדלים של 5.4kb, 5.7kb ו-2.1kb וכן RNA מינורי בגודל 1.4kb. על פי Malmgren וחב' ב-Genomics משנת 1995, זוהה העותק המינורי של 1.4kb והוצע שהוא יכול לקודד לאנזים דמוי-IDS.
החלבון המשוער זהה לאנזים שתואר, פרט לעובדה שהוא חסר מקטע של 207 חומצות אמינו בקצה ה-N-טרמינאלי, ובמקום המקטע החסר מופיעות 7 חומצות אמינו חלופיות.
מבנה הגן IDS
בשנת 1993 קבעו Flomen וחב' ב-Genomics שהגן IDS מכיל 9 אֶקסונים (שסומנו כ-A עד I). הם אפיינו את ה-introns המקיפים את 9 האֶקסונים, ומצאו שלגן IDS אין כל קשר לארגון האֶקסון של steroid sulfatase, זאת למרות ההומולוגיה בין שני האנזימים. ממצא זה רמז לכך שחלוקת הסולפטאזות ל-2 תת-קבוצות על בסיס הספציפיות שלהם למצע האנזים, משתקף גם ברמת מבנה האנזים. Wilson וחב' פרסמו בשנת 1993 ב-Genomics את הרצף השלם של הגן IDS שגודלו בערך 24kb. הפרומוטר הפוטנציאלי עבור IDS חסר TATA box אך הוא מכיל רצפים של GC box, התואמים את תפקידו של IDS כ-housekeeping gene. בשנת 1990 פרסמו Wilson וחב' ב-Proc Natl Acad Sci USA את המיקום של הגן IDS בזרוע הארוכה של כרומוזום X בעמדה Xq28 במיקום דיסטאלי לזה של "כרומוזום X השביר", על ידי שימוש בשבט cDNA של IDS.
בשנת 1992 הדגימו Faust וחב' ב-Genomics ובשנת 1993 עשו זאת Daniele וחב' באותו כתב עת, שהגן IDS תופס בעכברים את אותה עמדה בכרומוזום X ביחס לגן F9 המקודד לפקטור הקרישה IX, לגן FMR1 המקודד לחלבון הקרוי fragile X mental retardation protein או FMRP, וכן לגן GABRA3 המקודד לחלבון Gamma-aminobutyric acid receptor subunit alpha-3.
פסבדו-גן
בשנת 1995 דווחו Bondeson וחב' ב-Europ J Hum Genet על זיהוי של גן IDS שני (שכונה על ידם IDS2) הממוקם בתוך מתחם 90kb טלומרי של הגן ל-IDS. הם הראו שאזור זה כרוך באירוע רקומבינציה עם הגן הראשוני IDS בערך ב-13% הלוקים במחלת Hunter.
ריבוי מוטציות בגן IDS
Ricci וחב' ציינו ב- Am J Med Genet משנת 2003 את העובדה שעד לנקודת זמן זו, דווח על למעלה מ-200 מוטציות ב-IDS בחולים עם מחלת Hunter. אכן מדובר במספר ניכר של מוטציות שונות בחולים ממוצא אתני מגוון. Kosuga וחב' דווחו ב-Molec Genet Metab משנת 2016 על אנליזה גנטית שבוצעה ב-65 משפחות יפניות עם MPS II. זוהו בהן 16 מוטציות חדשות: ב-24 גברים עם הפנוטיפ המוחלש של מחלת Hunter, נמצאו מוטציות missense ב-21 מתוכם, בשניים מהם נמצאו 2 מוטציות nonsense ( P8Xו- R443X), ובאחד נתגלה שמט (deletion) של 20 חומצות אמינו באֶקסון 8.
בשנת 1991 דווחו Wilson וחב' ב-Hum Genet על שנמצא שמט (deletion) או gene rearrangement ב-7 מתוך 23 חולים עם mucopolysaccharidosis type II ממוצא אוסטרלי או בריטי. כמו כן, ב-2 מתוך 14 גרמנים ללא קרבה ביניהם עם MPS II, נמצאו שינויים מבניים בגן IDS על ידי Southern analysis תוך שימוש שבט cDNA של IDS בתור probe. באחד מבין חולים אלה, גבר חולה באופן חמור, לא אותרו פרגמנטים בשיטת Southern. בשנת 1992 דווחו Sukegawa וחב' על ילד בן-12 שנה עם MPS II ומוטציית missense בגן IDS.
ב-6 חולים במחלת Hunter, זיהו Flomen וחב' (Genomics משנת 1992) מוטציות בגן IDS הכוללות שמט (deletion) שלם, מוטציית nonsense, מוטציה נקודתית שיצרה נקודת splice חדשה, ו-3 מוטציות missense. בשנת 1995 תוארו 8 דוגמאות חדשות של מוטציה נקודתית בגן IDS של חולים יפניים עם מחלת Hunter עם דרגות שונות של חומרה (Sukegawa וחב' ב-Hum Mutat משנת 1995). חוקרים אלה ביצעו אנליזה של הגן IDS בחולי Hunter יפניים עם פנוטיפים קליניים שונים. חמש מוטציות missense זוהו על ידי שיטת RT-PCR: מוטציית S333L (חמורה), R468Q (חמורה), R468L (חמורה), W337R (מתונה) ו-R48P (קלה). באותה שיטה זוהו גם 3 מוטציות nonsense והן: W345X (חמורה), R443X (מתונה) ו-Q531X (קלה). בחינת פיברובלסטים מחוסרי האנזים, גילתה שכל 5 מוטציות missense סונתזו כמו הקודמן (precursor) בגודל התקין של 73kD, ואילו שלושת המוטציות nonsense סונתזו מקוטעים- truncated כ-: W345X:54 kD, וכן R443X:59 kD ו-Q531X:69 kD. עם זאת האנזים הבשל והיציב (kD45-56) לא זוהה באף לא אחת מהמוטציות באנליזה שיטת Western blot. יתרה מכך, ביטוי של cDNA של כל 8 המוטציות הביא להפחתה חמורה של פעילות iduronate-2-sulfatase בהשוואה ל-cDNA תקין.
בשנת 1998 דווחו Isogai וחב' ב-J Inherit Metab Dis על הזיהוי של 25 מוטציות קטנות ושונות בגן IDS ב-43 יפנים עם מחלת Hunter. ביניהן התגלו בקודון 468 של אקסון 9 שלוש מוטציות שונות: arg468-to-trp, arg468-to-gln ו-arg468-to-Leu, ששלושתן היו כרוכות בפנוטיפ חמור.
במטופל עם פנוטיפ חמור של Hunter זיהו Isogai וחב' בשנת 1998 שחלוף של G ל-T בנוקלאוטיד 1403 של הגן IDS, מה שגרם לשחלוף Arg468leu. בסדרה של חולים יפניים 5 מתוך 17 (29%) עם מוטציות missense הראו שינוי זה בקודון 468. הם גם הדגימו שהדו-נוקלאוטיד CpG בנקודה זו עבר מתילציה, מה שרמז לכך שקודון R468 היה אמנם hotspot של מוטציות.
מוטציות Cys422Gly ו-Lys135Arg : בשנת 1992 וחב' דווחו Bunge וחב' ב-Hum Molec Genet על ילד בן-8 עם תסמינים מאוד מתונים של Hunter ואינטליגנציה נורמאלית, בו זוהה שחלוף של TGC ל-GGC בקודון 422 שח הגן IDS, מה שהביא להכנסת שייר גליצין במקום ציסטאין. באותו מחקר דווח גם על ילד בן-5 עם מאפינים טיפוסיים של מחלת Hunter ויכולת דיבור דועכת. בילד זה זוהה שחלוף של AAA ל-AGA בקודון 135 מה שהביא להכנסת שייר ארגינין במקום ליזין. בנוסף, שינוי "שקט" של ACC ל-ACT נמצא בקודון 146.
מוטציית Arg468Leu: מוטציה זו בקודון R468 אותרה בחולי Hunter מתונים ממוצא אתני שונה: Crotty וחב' ב-Hum Molec Genet משנת 1992; Hopwood וחב' ב-Hum Mutat משנת 1993. מוטציית Trp475Ter: בבחור בן 20 שנה עם תסמינים אופייניים של MPS II, "אך עדיין מסוגל לדבר", Bunge וחב' דווחו בשנת 1992 ב-Hum Molec Genet על זיהוי שינוי שלTGG ל-TGA בקודון 475 של הגן IDS, שגרם להמרה של Trp codon ל-stop codon.
מוטציית Arg468Leu: מוטציות בקודון 468 נמצאו בחולי MPS II ממוצאים אתניים שונים (Crotty וחב' משנת 1992, Hopwood וחב' משנת 1993 ו-Whitley וחב' משנת 1993). בשנת 1998 דווחו Isogai וחב' על מקרה חמור של MPS II בו זיהו המרה של G ל-T בנוקלאוטיד 1403 של הגן IDS, שהביא לשחלוף של ארגינין על ידי לאוצין בעמדה 468. במחקרם על חולים יפאניים עם מוטציות , נמצא שב-5 מתוך 17 חולים (29%) עם מוטציות missense, השינוי היה בקודון R468. חוקרים אלה מצאו שהדינוקלאוטיד CpG במקום זה נשא קבוצת מתיל, מה שמרמז על כך שהקודון R468 הוא hotspot של מוטציות.
מוטציה Arg468Trp גורמת לתסמונת מתונה
ריצוף של תוצרי RT-PCR על ידי Crotty וחב' (Hum Molec Genet משנת 1992), הביא לזיהוי שחלוף C ל-T בנוקלאוטיד 1402 של הגן IDS, מה שגרם שחלוף של ארגינין על ידי טריפטופן בעמדה 468, במטופל עם תסמונת Hunter מתונה.
בשנת 2003 תיארו Ricci וחב' ב-Am J Med Genet חולה איטלקי עם מחלת Hunter בו נמצאו 2 מוטציות missense בשתי חומצות אמינו שכנות, met488-to-Ile ו-Gly489-to-Ala. ביטוי in vitro על ידי תאי 7-COS אישר שהמוטציה G489A הייתה המוטציה הגורמת ל-2 שינויים אלה. המוטציה M488I הייתה כרוכה בפעילות שארית. למרות שההשפעה המצטברת של 2 המוטציות יכולה הייתה להיות מבוטלת in vitro, לא ניתן הדבר in vivo, ואכן החולה המדובר בהגיעו לגיל 23 שנה, הראה פנוטיפ קליני בעל חומרת בינים.
למרות שהמוטציה Arg468-to-Trp הייתה כרוכה בצורה מתונה של Hunter, הראו Whitley וחב' ב-Hum Mutat משנת 1993 ביטוי מאוד חמור של המחלה בתינוק בו נמצאה מוטציה באותו קודון: שינוי G ל-A בנוקלאוטיד 1403 של הגן IDS, גרם לשחלוף של גלוטמין במקום ארגינין (R468Q). מטופל זה נפטר בגיל 23 חודש.
בחולה Hunter יפני בצורה החמורה של המחלה, תיארו Sukegawa וחב' בשנת 1995 ב-Hum Mutat שמט (in frame של שלושה נוקלאוטידים 473delTCC באקסון 3 של הגן IDS, מה שגרם לאובדן של שייר serine בעמדה 117. בשנת 2001 דוווחו Bonuccelli וחב' ב-Biochim Biophys Acta על מחקר בו נבחנה השפעת מוטציה זו בתאי 7-COS, ואכן לא נמצאה בתאים אלה כל פעילות של IDS.
בשנת 1992 פרסמו Flomen וחב' ב-Genomics נתונים על 6 חולי Hunter והמוטציות שלהם בגן IDS. מוטציות אלו כללו שמט שלם, מוטציית nonsense, מוטציה נקודתית שיצרה נקודת splice חדשה, ו-3 מוטציות missense. באחד החולים זוהה שינוי של G ל-C בנוקלאוטיד 1629 של הגן IDS, שהביא להתמרה של serine ל-trytophan בעמדה 502 והכנסת שרשרת צדדית מעט קוטבית במקטע שהוא הידרופובי. בחולה אחר זוהה שינוי של C ל-G בנוקלאוטיד 603 בגן IDS, שהביא להתמרה של ארגינין לפרולין בעמדה 160 של האנזים. בחולה נוסף זוהה שינוי C ל-T בנוקלאוטיד 638 של IDS, שממיר את ארגינין 172 ל-stop codon. בחולה נוסף נמצא שינוי של C ל-T בנוקלאוטיד 1246 של הגן IDS, שלא גרם לשום שינוי בקודון, דהינו היה שינוי "שקט", אך יצר נקודת splice קריפטית שגרמה לאובדן חלקי של האֶקסון. ששים base pairs אבדו ב-cDNA מ-G1244 עד G1305. בחולה נוסף זוהה שינוי C ל-T בנוקלאוטיד 1122 של הגן IDS, שגרם לחלוף של leucine על ידי serine בעמדה 333. שינוי זה הביא ליצירה של אזור splice חדש שגורם לאיבוד חלקי של אֶקסון 1 ב-RNA.
בילד יפני בן 12 עם מחלת Hunter בדרגת חומרה מתונה, מצאו Sukegawa וחב' בשנת 1992 שינוי C ל-T בנוקלאוטיד 1327 בגן IDS, שגרמה להתמרה של "קודון הפסק" במקומו של ארגינין נורמלי בשייר 443 של רצף הפפטיד (Arg443TER). למרות שהאנזים המקוטע (truncated) סונתז, הוא לא היה יציב. Bunge וחב' דווחו בשנת 1992 ב-Hum Molec Genet על מוטציה זהה בילד בן 3, שסבל מעיוותי שלד, אך ההתפתחות הפסיכו-מוטורית שלו הייתה תקינה.
בשנת 1997 פרסמו Sukegawa וחב' ב-Hum Mutat על ממצאים בילדה יפנית עם צורה חמורה של Hunter. הקריוטיפ שלה היה תקין, אך היה חסר בולט של האנזים IDS בלימפוציטים ובפיברובלטים שלה שגודלו בתרבית. זוהתה אצלה מוטציה R468Q בגן IDS. אנליזה בשיטת RT-PCR הראתה שה-cDNA שלה מייצג רק את האלל R468Q, למרות שברמה הגנומית היא הייתה הטרוזיגוטית, עם אלל אחד נורמאלי. לאחיה הייתה מוטציית R468Q. ואילו האמא שלה הייתה נשאית של מוטציה זו. נראה שבילדה זו היה ביטוי בררני של האלל האימהי שנשא את מוטציית ה-missense R468Q.
הוראות לביצוע הבדיקה
יש לדגום דם למבחנת ספירת-דם (EDTA, פקק סגלגל), אם כי ניתן גם להשתמש במבחנה כימית (פקק אדום או צהוב). אין לפסול דגימות דם המוליטיות, ליפמיות או איקטריות. דגימות פלזמה או נסיוב יכולות להישלח למעבדה מקוררות או בטמפרטורת החדר ויציבות הדגימה היא 7 ימים.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - אבחון תסמנות גנטיות
- בדיקות מעבדה - מפגעי מערכת העצבים והמוח
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק