הבדלים בין גרסאות בדף "מחלות מיאלופרוליפרטיביות ומיאלודיספלסטיות - Myelodysplastic syndrome and myeloproliferative neoplasms"
מ (added Category:משפחה using HotCat) |
|||
| (34 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
| − | |||
{{מחלה | {{מחלה | ||
|תמונה=Myelogram of person with a myeloproliferative disorder.png | |תמונה=Myelogram of person with a myeloproliferative disorder.png | ||
|כיתוב תמונה=Myelogram of someone with a myeloproliferative disorder. | |כיתוב תמונה=Myelogram of someone with a myeloproliferative disorder. | ||
|שם עברי= מחלות מיאלופרוליפרטיביות ומחלות מיאלודיספלסטיות: סקירה כללית | |שם עברי= מחלות מיאלופרוליפרטיביות ומחלות מיאלודיספלסטיות: סקירה כללית | ||
| − | |שם לועזי= | + | |שם לועזי=Myelodysplastic syndrome and myeloproliferative neoplasms |
| − | |שמות נוספים=שאת מיילופרוליפרטיבית, | + | |שמות נוספים=שאת מיילופרוליפרטיבית, |
|ICD-10= | |ICD-10= | ||
|ICD-9= | |ICD-9= | ||
| שורה 13: | שורה 11: | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | {{הרחבה| | + | {{הרחבה|מחלות מיאלופרוליפרטיביות}} |
| − | |||
==מבוא== | ==מבוא== | ||
| − | תסמונות מיאלודיספלסטיות | + | תסמונות מיאלודיספלסטיות ([[Myelodysplastic Syndrome]] - MDS) וגידולים מיאלופרוליפרטיביים ([[Myeloproliferative Neoplasms]] - MPN) הם מחלות של ייצור לא תקין של תאי דם במח העצם. הן חולקות מאפיינים דומים בשל היותן מחלות כרוניות שמקורן בתא האב הרב תכליתי במח העצם. מאפיין נוסף הוא הפוטנציאל להתקדם ל[[לוקמיה|לוקמיה חריפה]]. עם זאת, המאפיינים הקליניים והמעבדתיים שלהן שונים: MDS בדרך כלל מתאפיינת בירידה ב[[ספירת דם - Complete blood count|ספירת הדם]] של שורת תאים אחת או יותר, ואילו ב-MPN ישנה עלייה בספירות הדם. MDS ו-MPN כוללות מחלות שונות המסווגות על פי ארגון הבריאות העולמי, WHO{{כ}} - World Health Organization (תרשים 1). במאמר זה נביא סקירה על MDS והתסמונות הקלאסיות של Philadelphia negative MPNs, כולל: [[פוליציטמיה ורה - Polycythemia Vera|פוליציטמיה ורה]] (Polycythemia Vera - PV) [[טרומבוציטוזיס ראשונית]] (Essential Thrombocytosis - ET) ו[[מילופיברוזיס ראשונית]] (Primary Myelo-Fibrosis - PMF). |
| − | (Myelodysplastic Syndrome - MDS | ||
| − | וגידולים מיאלופרוליפרטיביים | ||
| − | |||
| − | הם מחלות של ייצור לא תקין של תאי דם במח העצם. הן חולקות מאפיינים דומים בשל היותן מחלות כרוניות שמקורן בתא האב הרב תכליתי במח העצם. מאפיין נוסף הוא הפוטנציאל להתקדם | ||
| − | פוליציטמיה ורה | ||
| − | (Essential Thrombocytosis - ET( | ||
| − | |||
| − | |||
==פתוגנזה== | ==פתוגנזה== | ||
| − | אף שלמחלות MDS ו-MPN מאפיינים קליניים ומעבדתיים שונים, הן חולקות שינויים מולקולריים חשובים בהתפתחות והתקדמות המחלה. אמנם לא נמצאו גורמים אטיולוגיים ספציפיים למחלות אלו, אך | + | אף שלמחלות MDS ו-MPN מאפיינים קליניים ומעבדתיים שונים, הן חולקות שינויים מולקולריים חשובים בהתפתחות והתקדמות המחלה. אמנם לא נמצאו גורמים אטיולוגיים ספציפיים למחלות אלו, אך זוהו שינויים גנטיים ב-MDS ו-MPN ששופכים אור על הבנת תהליכים מולקולריים ותאיים המעורבים בהתפתחות מחלות אלו. כמו כן, שינויים מולקולריים אלו חשובים בניבוי הפרוגנוזה של החולה וסיכויי תגובה לטיפול. |
===פתוגנזה MDS=== | ===פתוגנזה MDS=== | ||
| − | בכ-90 | + | בכ-90 אחוזים ממקרי MDS מוצאים לפחות מוטציה אחת בגן או בגנים הידועים כמשפיעים על התפתחות ממאירות במח עצם. הגנים המעורבים שייכים למשפחות שונות של גנים האחראים על תהליכים שונים בתא. המוטציות מכונות "Driver mutations" אם הן קורות מוקדם או מתחילות אירוע אונקוגני. אם הן "Passenger mutations" הן קרויות מופיעות מאוחר יותר בתהליך. גנים מוטנטים "driver" כוללים גנים של שחבור של RNA{{כ}} ([[RNA|Ribo-Nucleic Acid]]) כגון SF3B1 ,U2AF1 ,SRFS2 גנים שאחראיים למתילציה של DNA (Deoxyribonucleic Acid) כגון TET2 ,DNMT3A ,DH1/2 גנים המשתתפים במודיפיקציה של הכרומטין כמו ASXL1 ו-EZH2, ויסות שיעתוק - RUNX1, תיקון DNA בעיקר TP53 והעברת סיגנלים CBL ,NRAS ,KRAS. |
| − | המוטציות מכונות "Driver mutations" אם הן קורות מוקדם או מתחילות אירוע אונקוגני. | + | |
| − | אם הן "Passenger mutations" הן קרויות | + | לרוב החולים יש בדרך כלל שתיים או שלוש driver mutations בעת ההתייצגות הקלינית. חלק מהשינויים הגנטיים מופיעים בתתי-קבוצות ספציפיות של MDS, כגון המוטציה SF3B1 ב-Refractory anemia with ringed sideroblasts, שילוב של המוטציות TET2/SRSF2 ב[[לוקמיה מיאלואידית כרונית - Chronic myelogenous leukemia|לוקמיה מיאלואידית מונוציטית כרונית]], והמוטציה CSF3R ב[[לוקמיה נויטרופילית כרונית]]. מוטציות אלו ואחרות שימושיות לצורך אבחנה מדויקת וסיווג תתי-סוגים של MDS, ובעתיד הן עשויות להיות בעלות ערך פרוגנוסטי וטיפולי{{הערה|שם=הערה1|Cazzola M, Della Porta MG, Malcovati L. The genetic basis of myelodysplasia and its clinical relevance. Blood. 2013;122:4021-4034}}. |
| − | מופיעות מאוחר יותר בתהליך. גנים מוטנטים "driver" כוללים גנים של שחבור של RNA | ||
| − | |||
| − | DH1/2 | ||
| − | |||
| − | |||
===פתוגנזה MPNs=== | ===פתוגנזה MPNs=== | ||
| − | כמו MDS, ה-MPNs נובעות מתא אב/תא פרוגניטורי קדום במח העצם. מספר גנים עוברים מוטציה בשכיחות גבוהה ב-MPNs. JAK2 | + | כמו MDS, ה-MPNs נובעות מתא אב/תא פרוגניטורי קדום במח העצם. מספר גנים עוברים מוטציה בשכיחות גבוהה ב-MPNs. |
| − | גן נוסף מוטנטי בחולי ET ו-PMF בשכיחות של פחות מ-5 | + | |
| + | JAK2 הוא גן המעורב בהעברת אותות כימיים מדופן פני התא לגרעין. מוטציה ספציפית בגן JAK2 מופיעה כמעט בכל החולים עם PV, ובקירוב ב-50 אחוזים מהחולים עם ET ו-PMF. הגן המוטנטי גורם לשגשוג בלתי מבוקר של תאים. התגלתה מוטציה בגן CALR (קלרטיקולין), והיא קיימת ב-25 אחוזים מהחולים עם ET ו-PMF ואינה מופיעה יחד עם מוטציה ב-JAK2. המנגנון שבו גן זה מעודד שגשוג תאים מיאלואידים אינו ידוע. | ||
| + | |||
| + | גן נוסף מוטנטי בחולי ET ו-PMF בשכיחות של פחות מ-5 אחוזים הוא MPL. מניחים שחלק מהמוטציות המוזכרות עשויות להספיק כדי לגרום ל-MPN, אך לא בהכרח חיוניות להתחלת תהליך המחלה. אחת התעלומות הלא פתורות היא כיצד אותה מוטציה בגן, למשל ב-JAK2, יכולה להופיע בחולים עם מחלות MPN שונות, שיש ביניהן שונות רבה ברמה הקלינית. הסברים אפשריים כוללים "מינון" של הגן המוטנטי או Zygosity; שונות במעורבות מולקולות אחרות הנקראות "STATs" בתאים של חולי MPN; וקיום מוטציות בגנים אחרים. | ||
==אבחנה== | ==אבחנה== | ||
===אבחנת MDS=== | ===אבחנת MDS=== | ||
| − | החשד ל-MDS עשוי לעלות כאשר בספירת הדם ישנה ירידה לא מוסברת של שורת תאים אחת או יותר. כאשר יש אנמיה, היא לרוב מקרוציטית, אך עשויה להיות נורמוציטית ונורמוכרומית. משטח דם עשוי להדגים נויטרופילים דיספלסטים או תאי Pelger-Huet - תאים עם גרעין | + | החשד ל-MDS עשוי לעלות כאשר בספירת הדם ישנה ירידה לא מוסברת של שורת תאים אחת או יותר. כאשר יש [[אנמיה]], היא לרוב מקרוציטית, אך עשויה להיות נורמוציטית ונורמוכרומית. [[משטח דם]] עשוי להדגים [[נויטרופילים]] דיספלסטים או תאי Pelger-Huet - תאים עם גרעין דו-אונתי אופייני. אולם ממצאי משטח דם פריפרי אינם ספציפיים ומביאים לאבחנה מבדלת רחבה, ולכן יש צורך לבצע בדיקה אבחנתית של אספירציית וביופסיית מח עצם, כשיש חשד לאבחנה. שינויים מורפולוגיים של התאים המוגדרים על ידי ארגון הבריאות העולמי הם אבחנתיים ל-MDS ומאשרים את האבחנה. חשוב לדגום תאי מח עצם לאנליזת כרומוזומים, כולל [[קריוטיפ]] ו-[[בדיקת Fluorescence In situ hybridization - FISH|FISH]] (Fluorescence In-Situ Hybridization), שיש להם השפעה חשובה על הפרוגנוזה וההחלטות הטיפוליות. |
| − | Fluorescence In- | ||
| − | Hybridization, שיש להם השפעה חשובה על הפרוגנוזה וההחלטות הטיפוליות. | ||
===אבחנת MPNs=== | ===אבחנת MPNs=== | ||
| − | סימן ההיכר של MPNs הוא עלייה של אחת או יותר משורות תאי הדם בדם הפריפרי. ארגון הבריאות העולמי הגדיר קריטריונים לאבחנה של MPNs שכוללים פרמטרים המטולוגיים (למשל המטוקריט), ביולוגיים | + | סימן ההיכר של MPNs הוא עלייה של אחת או יותר משורות תאי הדם בדם הפריפרי. ארגון הבריאות העולמי הגדיר קריטריונים לאבחנה של MPNs שכוללים פרמטרים המטולוגיים (למשל [[המאטוקריט - Hematocrit|המטוקריט]]), ביולוגיים (למשל מוטציה ב-JAK2, רמת [[אריתרופויאטין - Erythropoietin|אריתרופויאטין]] בדם) ופתולוגיים (רטיקולין פיברוזיס במח עצם, מורפולוגיית מגה קריוציטים). ישנה חפיפה משמעותית בין שורת התאים המוגברת ובין האבחנה הספציפית. כאשר ההמוגלובין מוגבר, האבחנה היא PV, גם אם יש [[לויקוציטוזיס]] ו[[טרומבוציטוזיס]]. לעומת זאת, חולים עם ET יכולים להיות עם לויקוציטוזיס וחולים עם PMF בשלבים מוקדמים יכולים להיות עם לויקוציטוזיס ו/או טרומובוציטוזיס. שורות התאים בדרך כלל יורדות עם הזמן ב-PMF, ובשלבים המתקדמים של המחלה שכיח לראות [[פנציטופניה]]. אנליזת כרומוזומים עם קריוטיפ ו-FISH חשובה ב-PMF מאחר וזה עוזר לקבוע פרוגנוזה. אנליזה מולקולרית של [[לויקוציטים]] במח העצם או בדם היא בעלת חשיבות לא רק על מנת לבסס אבחנה של מחלה המטופויטית קלונלית, אלא גם כדי לקבוע פרוגנוזה. קרוב לוודאי שהפרעות מולקולריות יכוונו החלטות טיפוליות בעתיד. |
| + | |||
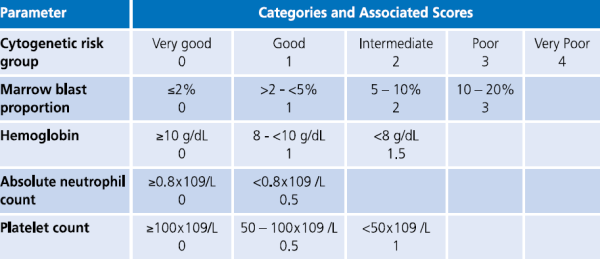
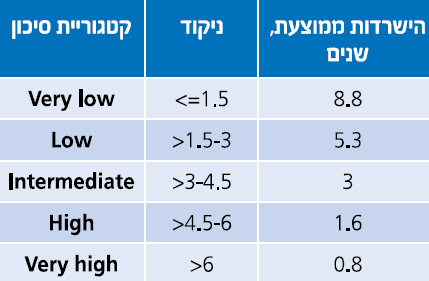
| + | [[קובץ:ניקוד פרוגנוסטי1.png|ממוזער|מרכז|600 פיקסלים|'''טבלה מספר 1: מערכת ניקוד פרוגנוסטי, ה-R-lPSS. ניקוד נע בין 10-0.''']][[קובץ:סיכון פרוגנוסטי 1.png|ממוזער|מרכז|600 פיקסלים|'''טבלה מספר 2: קטגוריות סיכון פרוגנוסטי של R-IPSS ותוצאות קליניות.''']] | ||
| − | + | ==מהלך קליני== | |
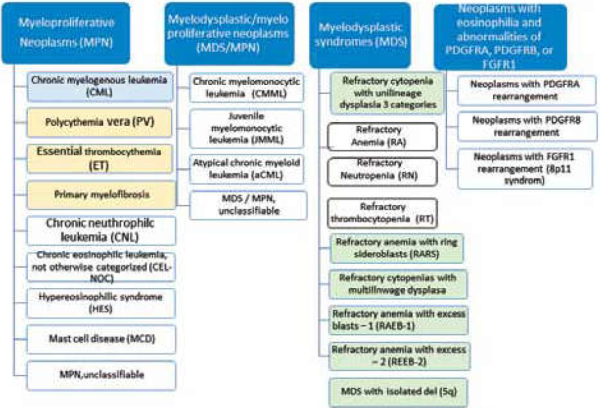
| − | [[קובץ: | + | [[קובץ:קלסיפיקציה מיאלואידיות 1.png|ממוזער|מרכז|600 פיקסלים|'''תרשים מספר 1: קלסיפיקציה של ארגון הבריאות העולמי {{כ}}(WHO){{כ}} 2008, של מחלות מיאלואידיות כרוניות. פוליציטמיה ורה, טרומבוציטמיה ראשונית ומיאלופיברוזיס ראשונית מכונות ביחד "Philadelphia-negative classic myeloproliferative neoplasms".''']] |
| − | |||
===מהלך קליני MDS=== | ===מהלך קליני MDS=== | ||
| − | המהלך הקליני של MDS משתנה ונע בין אורך חיים כמעט נורמלי בחולים עם Refractory | + | המהלך הקליני של MDS משתנה ונע בין אורך חיים כמעט נורמלי בחולים עם Refractory anemia או Refractory anemia with ring sideroblasts, ועד מחלה המתקדמת מהר עם מעבר ל[[לוקמיה מיאלואידית חריפה]] תוך 6–12 חודשים בחולים עם Multilineage dysplasia with excess of blasts. מערכות ניקוד פותחו ועודכנו על מנת לנבא את המהלך הקליני של החולים באופן פרטני. הראשון היה International Prognostic Scoring System) IPSS) המורכב מהפרעות בקריוטיפ, אחוז בלסטים במח עצם ומספר הציטופניות בדם{{הערה|שם=הערה3| Greenberg P, Cox C, LeBeau MM, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood. 1997;89:2079-2088}}. פורסמה גרסה מעודכנת של ה-IPSS, הנקראת IPSS-R, והיא מאפשרת סיווג ברור יותר של החולים בהתבסס על פרמטרים המטולוגיים במח העצם ושינויים ציטוגנטיים (טבלה 1 וטבלה 2){{הערה|שם=הערה4|Greenberg PL1, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012;120:2454-2465}}: בחולים עם MDS בסיכון נמוך, תלות במנות דם הגורמת לעומס [[ברזל]] בגוף או [[המוכרומטוזיס]] משני לעירויי דם, עשויה להיות בעיה קלינית רצינית. לחולים אלה צפוי משך חיים ארוך למרות התלות במוצרי דם, ולכן נזק לאיברים מעומס ברזל, במיוחד לב וכבד, עשוי להפוך לגורם המרכזי לתחלואה ותמותה. בחולים עם MDS בסיכון גבוה, סיבוכים כמו דימום או [[זיהומים]] הנגרמים מציטופניה קשה, לעתים קרובות מביאים למוות. חולים בסיכון גבוה יכולים גם להתקדם ללוקמיה מיאלואידית חריפה הניתנת לריפוי רק אם ניתן לבצע השתלת מח עצם מתורם. |
| − | Refractory anemia with ring | ||
| − | sideroblasts, ועד מחלה המתקדמת מהר עם מעבר | ||
| − | |||
| − | with excess of blasts. מערכות ניקוד פותחו ועודכנו על מנת לנבא את המהלך הקליני של החולים באופן פרטני. הראשון היה | ||
| − | International Prognostic Scoring System | ||
| − | )IPSS | ||
| − | עם MDS בסיכון נמוך, תלות במנות דם הגורמת לעומס ברזל בגוף או המוכרומטוזיס משני לעירויי דם, עשויה להיות בעיה קלינית רצינית. לחולים אלה צפוי משך חיים ארוך למרות התלות במוצרי דם, ולכן נזק לאיברים מעומס ברזל, במיוחד לב וכבד, עשוי להפוך לגורם המרכזי לתחלואה ותמותה. בחולים עם MDS בסיכון גבוה, סיבוכים כמו דימום או זיהומים הנגרמים מציטופניה קשה, לעתים קרובות מביאים למוות. חולים בסיכון גבוה יכולים גם להתקדם ללוקמיה מיאלואידית חריפה הניתנת לריפוי רק אם ניתן לבצע השתלת מח עצם מתורם. | ||
===מהלך קליני MPNs=== | ===מהלך קליני MPNs=== | ||
| − | משך החיים הצפוי ב-MPNs הוא קצר יותר מאשר באוכלוסייה הכללית. משך ההישרדות | + | משך החיים הצפוי ב-MPNs הוא קצר יותר מאשר באוכלוסייה הכללית. משך ההישרדות הממוצע הוא 20 שנה ל-ET{{כ}}, 14 שנה ל-PV ו-6 שנים ל-PMF. הישרדות ב-PV ו-ET מושפעת מגיל מבוגר, לויקוציטוזיס ו[[תרומבואמבוליזם|אירוע טרומבוטי]], ובנוסף ב-PV, קריוטיפ לא תקין{{הערה|שם=הערה5|Tefferi A, Pardanani A. Myeloproliferative Neoplasms: A Contemporary Review. JAMA Oncol. 2015;1:97-105}}. ב-ET, גיל מעל 60, לויקוציטוזיס מעל 15.000 למיקרוליטר והמוגלובין פחות מערך נורמלי קשורים עם פרוגנוזה טובה פחות. בנוכחות שניים או יותר מגורמים אלו, ההישרדות הצפויה היא 9 שנים בלבד{{הערה|שם=הערה5}}. נוכחות מוטציה ב-CALR/JAK2 לא משפיעה על הישרדות, לא ב-ET ולא ב-PV. מעבר ללוקמיה מיאלואידית חריפה קורה בפחות מ-10 אחוזים מחולי PV במהלך של 20 שנה וב-5 אחוזים מחולי ET. שיעור המעבר למילופיברוזיס גבוה מעט יותר. |
| − | + | ||
| − | + | הפרוגנוזה של PMF נקבעת על ידי שימוש במודל "DIPSS plus" שכולל שמונה מאפיינים פרוגנוסטיים: גיל מעל 65, המוגלובין פחות מ-10 גרם לדציליטר, לויקוציטים מעל 25,000 למיקרוליטר, בלסטים בדם פריפרי לפחות 1 אחוז, "B symptoms", קריוטיפ בעל משמעות פרוגנוסטית לא טובה, צורך במנות דם, טסיות פחות מ-103,000 למיקרוליטר. במודל זה מוגדרות ארבע קבוצות סיכון, וההישרדות הצפויה נעה בין 1.3 ל-15.4 שנים{{הערה|שם=הערה6|Gangat N, Caramazza D, Vaidya R, et al. DIPSS Plus: a Refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol. 2011;29:392-397}}. | |
| − | + | ||
| − | + | נצפה שמוטציות ב-CALR קשורות בפרוגנוזה טובה ומוטציות ב-ASXL1 קשורות בפרוגנוזה לא טובה ב-PMF. ממצאים אלו מביאים לפיתוח מערכות ניקוד פרוגנוסטיות הכוללות מדדים מולקולריים, שיצטרכו לעבור ולידציה במחקרים קליניים{{הערה|שם=הערה7|Vannucchi A, Guglielmelli P, Rotunno G, et al. Mutation- enhanced international prognostic scoring system (MIPSS) for primary myelofibrosis: an AGIMM & IWG- MRT project. Blood. 2014;124:405urr Opin Hematol. 2011 Mar;18 (2):83-8}}. | |
| − | + | ||
| − | + | ==טיפול== | |
| − | + | ===טיפול MDS=== | |
| − | שנים ל-PMF. הישרדות ב-PV ו-ET מושפעת מגיל מבוגר, לויקוציטוזיס | + | טיפול בחולים בסיכון נמוך מתבסס על הצורך בעירויי דם. לגבי חולים שאינם תלויים במוצרי דם - בדרך כלל עוקבים אחריהם עד שהם נזקקים למוצרי דם. גישה חדשה בחולי MDS בסיכון נמוך יותר היא התערבות מוקדמת בחולים עם Poor prognosis lower risk MDS, על ידי מתן Hypomethylating agents במינון נמוך{{הערה|שם=הערה8|Garcia-Manero G. Myelodysplastic syndromes: 2015 update on diagnosis, risk-stratification and management. Am. J. Hematol. 2015; 90:832-841}}. השימוש ב-Erythroid stimulating agents (ESA) מקובל. אף שלא קיים מידע ממחקרים קליניים פרוספקטיביים, מידע רטרוספקטיבי מדגים שיפור בהישרדות לחולים המטופלים ב-ESA{{הערה|שם=הערה9|Moyo V, Lefebvre P, Duh MS, et al. Erythropoiesis¬stimulating agents in the treatment of anemiain myelodysplastic syndromes: a meta-analysis. Ann Hematol. 2008;87:527-536}}. שיעורי התגובה נעים בין 30 אחוזים ל-60 אחוזים, והוספת Granulocyte colony stimulating factor ([[G-CSF]]) לאריתרופויטין מעלה שיעורי תגובה. נערכים מחקרים המעריכים את השפעתם של תכשירים טרומבופויאטים על טרומבוציטופניה ב-MDS, במיוחד [[Eltrombopag]]{{כ}} ([[Revolade]]){{כ}}. [[Lenalidomide]] {{כ}}([[Revlimid]]) היא תרופה אימונומדולטורית שהראתה יעילות בחולים עם MDS בסיכון נמוך עם הפרעה כרומוזומלית מסוג 5q מינוס, והיא מאושרת לשימוש באוכלוסייה זו. |
| − | הפרוגנוזה של PMF נקבעת על ידי שימוש במודל "DIPSS plus" שכולל שמונה מאפיינים פרוגנוסטיים: גיל מעל 65, המוגלובין פחות מ- | + | |
| − | + | ה-hypomethylating agents כולל [[Azacytidine]]{{כ}} ([[Vidaza]]) ו-[[Decitabine]]{{כ}} ([[Dacogen]]) מהווים את הטיפול הסטנדרטי לחולים עם MDS בסיכון גבוה יותר. אף ששיעורי התגובה נראים דומים עם שני התכשירים, רק וידאזה הראתה שיפור בהישרדות במחקר קליני רנדומלי. | |
| − | טיפול | + | |
| − | MDS | + | [[כימותרפיה]] אינטנסיבית, כמו זאת שמשתמשים בה להשריית הפוגה בלוקמיה מיאלואידית חריפה, אפשרית לשימוש בחולי MDS בסיכון גבוה, אך שיעורי התגובה ומשך התגובה נמוכים יותר מאלו המושגים בחולים עם לוקמיה מיאלואידית חריפה ושיעור הסיבוכים גבוה יותר, ולכן כימותרפיה אגרסיבית היא אפשרות לא אטרקטיבית בחולים אלו. השתלת מח עצם מתורם היא הטיפול היחידי עם פוטנציאל לריפוי לחולים עם MDS בסיכון גבוה, והישרדות ממושכת ללא מחלה היא בין 30 אחוזים ל-50 אחוזים. בכל אופן, השתלת מח עצם מוגבלת לחולים צעירים יותר עם תורם מתאים{{הערה|שם=הערה8}}. |
| − | טיפול בחולים בסיכון נמוך מתבסס על הצורך בעירויי דם. לגבי חולים שאינם תלויים במוצרי דם - בדרך כלל עוקבים אחריהם עד שהם נזקקים למוצרי דם. גישה חדשה בחולי MDS בסיכון נמוך יותר היא התערבות מוקדמת בחולים עם | + | |
| − | + | ===טיפול MPN=== | |
| − | נמוך | + | הטיפול ב-PV מתמקד במניעת סיבוכים טרומבוטיים. הטיפול היעיל ביותר למניעת אירועים טרומבוטיים הוא שילוב של ויסות המטוקריט אל מתחת ל-45 אחוזים עם נטילת [[אספירין]] 100 מיליגרם ליום. ויסות המטוקריט מושג על ידי הקזות דם חוזרות בחולים בני פחות מ-60 ללא היסטוריה של [[טרומבוזיס ורידים|טרומבוזיס]]. האחרים מטופלים על ידי תרופות ציטורדוקטיביות. [[Hydroxyurea]] היא תרופת הבחירה. |
| − | השתלת מח עצם מתורם | + | |
| − | MPN | + | הטיפול ב-ET מבוסס על סיכון החולה לפתח טרומבוזה. כמו ב-PV, חולים מעל גיל 60, או בעלי היסטוריה של אירוע טרומבוטי, מקבלים טיפול ציטורדוקטיבי, בדרך כלל Hydroxyurea, ובנוסף מטופלים באספירין. חולים צעירים יותר וללא אירוע טרומבוטי קודם מקבלים אספירין כתלות בפרופיל גורמי הסיכון הווסקולריים שלהם, וייתכן כתלות בסטטוס של JAK2. חולים בני פחות מ-60, ללא גורמי סיכון וסקולריים, יכולים להישאר בהשגחה ללא טיפול כלשהו. |
| − | הטיפול ב-PV מתמקד במניעת סיבוכים טרומבוטיים. הטיפול היעיל ביותר למניעת אירועים טרומבוטיים הוא שילוב של ויסות המטוקריט אל מתחת ל-45 | + | |
| − | + | חולי PMF עשויים להזדקק לטיפול על מנת לווסת תסמינים סיסטמיים הקשורים למחלה, כגון עייפות וירידה במשקל או הגדלת טחול תסמינית או בשל ציטופניות. [[Ruxolitinib]] {{כ}}([[Jakavi]]), מעכב לא ספציפי של JAK, היא התרופה הראשונה שאושרה לטיפול ב-PMF ומשתמשים בה לטיפול בתסמינים כגון [[עייפות]], [[ירידה במשקל]] והגדלת טחול סימפטומטית. טיפולים לאנמיה כוללים ESAs, [[סטרואידים]], [[אנדרוגנים]] ותרופות אימונומדולטוריות - [[Thalidomide]] ו-[[Lenalidomide]] - כל אלה הם בעלי יעילות משתנה. השתלת תאי אב מתורם היא הטיפול היחיד שעשוי להביא לריפוי ב-PMF, אך הוא אפשרי רק במיעוט החולים. | |
| − | + | ||
| − | + | ==סיכום== | |
| − | + | התקדמות בהבנת מנגנונים מולקולריים בפתוגנזה של MDS ו-MPN הביאה לתובנות חדשות, מחקר קליני ניכר הדגים מאפיינים קליניים הקשורים לפרוגנוזה ואיפשר גישה רציונלית לטיפול. התפתחויות מדעיות וקליניות אלו הביאו לפיתוח ובדיקת טיפולים חדשים ב-MDS ו-MPN ששינו את המהלך הקליני ושיפרו את תוצאות הטיפול. ריצוף גנטי עמוק ([[NGS]] - Next Generation Sequencing), עשוי לאפשר הגדרות של סמנים מולקולריים חדשים שיגדירו מחדש הערכה פרוגנוסטית, וגילוי תרופות חדשות ומחקר קליני רב צפויים לשפר עוד את תוצאות החולים{{הערה|שם=הערה10| Patel KP, Newberry KJ, Luthra R, et al. Correlation of mutation profile and response in patients with myelofibrosis treated with ruxolitinib. Blood. 2015;126:790-797}}. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ==ביבליוגרפיה== | |
| − | + | <blockquote> | |
| − | + | {{הערות שוליים|יישור=שמאל}} | |
| − | + | <div style="text-align: left; direction: ltr"> | |
| − | + | *Tefferi A. Novel mutations and their functional and clinical relevance in myeloproliferative neoplasms: JAK2, MPL, TET2, ASXL1, CBL, IDH and IKZF1. Leukemia. 2010;24:1128-1138. | |
| − | + | </div> | |
| − | + | </blockquote> | |
| − | |||
| − | |||
| + | {{ייחוס|ד"ר מרטין אליס - מנהל המכון ההמטולוגי ובנק הדם, בית חולים מאיר, 2 בית הספר לרפואה, אוניברסיטת תל אביב, תל אביב{{ש}}ד"ר נועה לביא - רופאה בכירה, המכון ההמטולוגי, הקריה הרפואית לבריאות האדם, רמב"ם, חיפה}} | ||
<center>'''פורסם בכתב העת "במה", ספטמבר 2016, גיליון מס' 21, [[האגודה למלחמה בסרטן]]'''</center> | <center>'''פורסם בכתב העת "במה", ספטמבר 2016, גיליון מס' 21, [[האגודה למלחמה בסרטן]]'''</center> | ||
[[קטגוריה:המטולוגיה]] | [[קטגוריה:המטולוגיה]] | ||
[[קטגוריה:פנימית]] | [[קטגוריה:פנימית]] | ||
| + | [[קטגוריה:משפחה]] | ||
גרסה אחרונה מ־04:00, 9 ביולי 2023
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלות מיאלופרוליפרטיביות
מבוא
תסמונות מיאלודיספלסטיות (Myelodysplastic Syndrome - MDS) וגידולים מיאלופרוליפרטיביים (Myeloproliferative Neoplasms - MPN) הם מחלות של ייצור לא תקין של תאי דם במח העצם. הן חולקות מאפיינים דומים בשל היותן מחלות כרוניות שמקורן בתא האב הרב תכליתי במח העצם. מאפיין נוסף הוא הפוטנציאל להתקדם ללוקמיה חריפה. עם זאת, המאפיינים הקליניים והמעבדתיים שלהן שונים: MDS בדרך כלל מתאפיינת בירידה בספירת הדם של שורת תאים אחת או יותר, ואילו ב-MPN ישנה עלייה בספירות הדם. MDS ו-MPN כוללות מחלות שונות המסווגות על פי ארגון הבריאות העולמי, WHO - World Health Organization (תרשים 1). במאמר זה נביא סקירה על MDS והתסמונות הקלאסיות של Philadelphia negative MPNs, כולל: פוליציטמיה ורה (Polycythemia Vera - PV) טרומבוציטוזיס ראשונית (Essential Thrombocytosis - ET) ומילופיברוזיס ראשונית (Primary Myelo-Fibrosis - PMF).
פתוגנזה
אף שלמחלות MDS ו-MPN מאפיינים קליניים ומעבדתיים שונים, הן חולקות שינויים מולקולריים חשובים בהתפתחות והתקדמות המחלה. אמנם לא נמצאו גורמים אטיולוגיים ספציפיים למחלות אלו, אך זוהו שינויים גנטיים ב-MDS ו-MPN ששופכים אור על הבנת תהליכים מולקולריים ותאיים המעורבים בהתפתחות מחלות אלו. כמו כן, שינויים מולקולריים אלו חשובים בניבוי הפרוגנוזה של החולה וסיכויי תגובה לטיפול.
פתוגנזה MDS
בכ-90 אחוזים ממקרי MDS מוצאים לפחות מוטציה אחת בגן או בגנים הידועים כמשפיעים על התפתחות ממאירות במח עצם. הגנים המעורבים שייכים למשפחות שונות של גנים האחראים על תהליכים שונים בתא. המוטציות מכונות "Driver mutations" אם הן קורות מוקדם או מתחילות אירוע אונקוגני. אם הן "Passenger mutations" הן קרויות מופיעות מאוחר יותר בתהליך. גנים מוטנטים "driver" כוללים גנים של שחבור של RNA (Ribo-Nucleic Acid) כגון SF3B1 ,U2AF1 ,SRFS2 גנים שאחראיים למתילציה של DNA (Deoxyribonucleic Acid) כגון TET2 ,DNMT3A ,DH1/2 גנים המשתתפים במודיפיקציה של הכרומטין כמו ASXL1 ו-EZH2, ויסות שיעתוק - RUNX1, תיקון DNA בעיקר TP53 והעברת סיגנלים CBL ,NRAS ,KRAS.
לרוב החולים יש בדרך כלל שתיים או שלוש driver mutations בעת ההתייצגות הקלינית. חלק מהשינויים הגנטיים מופיעים בתתי-קבוצות ספציפיות של MDS, כגון המוטציה SF3B1 ב-Refractory anemia with ringed sideroblasts, שילוב של המוטציות TET2/SRSF2 בלוקמיה מיאלואידית מונוציטית כרונית, והמוטציה CSF3R בלוקמיה נויטרופילית כרונית. מוטציות אלו ואחרות שימושיות לצורך אבחנה מדויקת וסיווג תתי-סוגים של MDS, ובעתיד הן עשויות להיות בעלות ערך פרוגנוסטי וטיפולי[1].
פתוגנזה MPNs
כמו MDS, ה-MPNs נובעות מתא אב/תא פרוגניטורי קדום במח העצם. מספר גנים עוברים מוטציה בשכיחות גבוהה ב-MPNs.
JAK2 הוא גן המעורב בהעברת אותות כימיים מדופן פני התא לגרעין. מוטציה ספציפית בגן JAK2 מופיעה כמעט בכל החולים עם PV, ובקירוב ב-50 אחוזים מהחולים עם ET ו-PMF. הגן המוטנטי גורם לשגשוג בלתי מבוקר של תאים. התגלתה מוטציה בגן CALR (קלרטיקולין), והיא קיימת ב-25 אחוזים מהחולים עם ET ו-PMF ואינה מופיעה יחד עם מוטציה ב-JAK2. המנגנון שבו גן זה מעודד שגשוג תאים מיאלואידים אינו ידוע.
גן נוסף מוטנטי בחולי ET ו-PMF בשכיחות של פחות מ-5 אחוזים הוא MPL. מניחים שחלק מהמוטציות המוזכרות עשויות להספיק כדי לגרום ל-MPN, אך לא בהכרח חיוניות להתחלת תהליך המחלה. אחת התעלומות הלא פתורות היא כיצד אותה מוטציה בגן, למשל ב-JAK2, יכולה להופיע בחולים עם מחלות MPN שונות, שיש ביניהן שונות רבה ברמה הקלינית. הסברים אפשריים כוללים "מינון" של הגן המוטנטי או Zygosity; שונות במעורבות מולקולות אחרות הנקראות "STATs" בתאים של חולי MPN; וקיום מוטציות בגנים אחרים.
אבחנה
אבחנת MDS
החשד ל-MDS עשוי לעלות כאשר בספירת הדם ישנה ירידה לא מוסברת של שורת תאים אחת או יותר. כאשר יש אנמיה, היא לרוב מקרוציטית, אך עשויה להיות נורמוציטית ונורמוכרומית. משטח דם עשוי להדגים נויטרופילים דיספלסטים או תאי Pelger-Huet - תאים עם גרעין דו-אונתי אופייני. אולם ממצאי משטח דם פריפרי אינם ספציפיים ומביאים לאבחנה מבדלת רחבה, ולכן יש צורך לבצע בדיקה אבחנתית של אספירציית וביופסיית מח עצם, כשיש חשד לאבחנה. שינויים מורפולוגיים של התאים המוגדרים על ידי ארגון הבריאות העולמי הם אבחנתיים ל-MDS ומאשרים את האבחנה. חשוב לדגום תאי מח עצם לאנליזת כרומוזומים, כולל קריוטיפ ו-FISH (Fluorescence In-Situ Hybridization), שיש להם השפעה חשובה על הפרוגנוזה וההחלטות הטיפוליות.
אבחנת MPNs
סימן ההיכר של MPNs הוא עלייה של אחת או יותר משורות תאי הדם בדם הפריפרי. ארגון הבריאות העולמי הגדיר קריטריונים לאבחנה של MPNs שכוללים פרמטרים המטולוגיים (למשל המטוקריט), ביולוגיים (למשל מוטציה ב-JAK2, רמת אריתרופויאטין בדם) ופתולוגיים (רטיקולין פיברוזיס במח עצם, מורפולוגיית מגה קריוציטים). ישנה חפיפה משמעותית בין שורת התאים המוגברת ובין האבחנה הספציפית. כאשר ההמוגלובין מוגבר, האבחנה היא PV, גם אם יש לויקוציטוזיס וטרומבוציטוזיס. לעומת זאת, חולים עם ET יכולים להיות עם לויקוציטוזיס וחולים עם PMF בשלבים מוקדמים יכולים להיות עם לויקוציטוזיס ו/או טרומובוציטוזיס. שורות התאים בדרך כלל יורדות עם הזמן ב-PMF, ובשלבים המתקדמים של המחלה שכיח לראות פנציטופניה. אנליזת כרומוזומים עם קריוטיפ ו-FISH חשובה ב-PMF מאחר וזה עוזר לקבוע פרוגנוזה. אנליזה מולקולרית של לויקוציטים במח העצם או בדם היא בעלת חשיבות לא רק על מנת לבסס אבחנה של מחלה המטופויטית קלונלית, אלא גם כדי לקבוע פרוגנוזה. קרוב לוודאי שהפרעות מולקולריות יכוונו החלטות טיפוליות בעתיד.
מהלך קליני
מהלך קליני MDS
המהלך הקליני של MDS משתנה ונע בין אורך חיים כמעט נורמלי בחולים עם Refractory anemia או Refractory anemia with ring sideroblasts, ועד מחלה המתקדמת מהר עם מעבר ללוקמיה מיאלואידית חריפה תוך 6–12 חודשים בחולים עם Multilineage dysplasia with excess of blasts. מערכות ניקוד פותחו ועודכנו על מנת לנבא את המהלך הקליני של החולים באופן פרטני. הראשון היה International Prognostic Scoring System) IPSS) המורכב מהפרעות בקריוטיפ, אחוז בלסטים במח עצם ומספר הציטופניות בדם[2]. פורסמה גרסה מעודכנת של ה-IPSS, הנקראת IPSS-R, והיא מאפשרת סיווג ברור יותר של החולים בהתבסס על פרמטרים המטולוגיים במח העצם ושינויים ציטוגנטיים (טבלה 1 וטבלה 2)[3]: בחולים עם MDS בסיכון נמוך, תלות במנות דם הגורמת לעומס ברזל בגוף או המוכרומטוזיס משני לעירויי דם, עשויה להיות בעיה קלינית רצינית. לחולים אלה צפוי משך חיים ארוך למרות התלות במוצרי דם, ולכן נזק לאיברים מעומס ברזל, במיוחד לב וכבד, עשוי להפוך לגורם המרכזי לתחלואה ותמותה. בחולים עם MDS בסיכון גבוה, סיבוכים כמו דימום או זיהומים הנגרמים מציטופניה קשה, לעתים קרובות מביאים למוות. חולים בסיכון גבוה יכולים גם להתקדם ללוקמיה מיאלואידית חריפה הניתנת לריפוי רק אם ניתן לבצע השתלת מח עצם מתורם.
מהלך קליני MPNs
משך החיים הצפוי ב-MPNs הוא קצר יותר מאשר באוכלוסייה הכללית. משך ההישרדות הממוצע הוא 20 שנה ל-ET, 14 שנה ל-PV ו-6 שנים ל-PMF. הישרדות ב-PV ו-ET מושפעת מגיל מבוגר, לויקוציטוזיס ואירוע טרומבוטי, ובנוסף ב-PV, קריוטיפ לא תקין[4]. ב-ET, גיל מעל 60, לויקוציטוזיס מעל 15.000 למיקרוליטר והמוגלובין פחות מערך נורמלי קשורים עם פרוגנוזה טובה פחות. בנוכחות שניים או יותר מגורמים אלו, ההישרדות הצפויה היא 9 שנים בלבד[4]. נוכחות מוטציה ב-CALR/JAK2 לא משפיעה על הישרדות, לא ב-ET ולא ב-PV. מעבר ללוקמיה מיאלואידית חריפה קורה בפחות מ-10 אחוזים מחולי PV במהלך של 20 שנה וב-5 אחוזים מחולי ET. שיעור המעבר למילופיברוזיס גבוה מעט יותר.
הפרוגנוזה של PMF נקבעת על ידי שימוש במודל "DIPSS plus" שכולל שמונה מאפיינים פרוגנוסטיים: גיל מעל 65, המוגלובין פחות מ-10 גרם לדציליטר, לויקוציטים מעל 25,000 למיקרוליטר, בלסטים בדם פריפרי לפחות 1 אחוז, "B symptoms", קריוטיפ בעל משמעות פרוגנוסטית לא טובה, צורך במנות דם, טסיות פחות מ-103,000 למיקרוליטר. במודל זה מוגדרות ארבע קבוצות סיכון, וההישרדות הצפויה נעה בין 1.3 ל-15.4 שנים[5].
נצפה שמוטציות ב-CALR קשורות בפרוגנוזה טובה ומוטציות ב-ASXL1 קשורות בפרוגנוזה לא טובה ב-PMF. ממצאים אלו מביאים לפיתוח מערכות ניקוד פרוגנוסטיות הכוללות מדדים מולקולריים, שיצטרכו לעבור ולידציה במחקרים קליניים[6].
טיפול
טיפול MDS
טיפול בחולים בסיכון נמוך מתבסס על הצורך בעירויי דם. לגבי חולים שאינם תלויים במוצרי דם - בדרך כלל עוקבים אחריהם עד שהם נזקקים למוצרי דם. גישה חדשה בחולי MDS בסיכון נמוך יותר היא התערבות מוקדמת בחולים עם Poor prognosis lower risk MDS, על ידי מתן Hypomethylating agents במינון נמוך[7]. השימוש ב-Erythroid stimulating agents (ESA) מקובל. אף שלא קיים מידע ממחקרים קליניים פרוספקטיביים, מידע רטרוספקטיבי מדגים שיפור בהישרדות לחולים המטופלים ב-ESA[8]. שיעורי התגובה נעים בין 30 אחוזים ל-60 אחוזים, והוספת Granulocyte colony stimulating factor (G-CSF) לאריתרופויטין מעלה שיעורי תגובה. נערכים מחקרים המעריכים את השפעתם של תכשירים טרומבופויאטים על טרומבוציטופניה ב-MDS, במיוחד Eltrombopag (Revolade). Lenalidomide (Revlimid) היא תרופה אימונומדולטורית שהראתה יעילות בחולים עם MDS בסיכון נמוך עם הפרעה כרומוזומלית מסוג 5q מינוס, והיא מאושרת לשימוש באוכלוסייה זו.
ה-hypomethylating agents כולל Azacytidine (Vidaza) ו-Decitabine (Dacogen) מהווים את הטיפול הסטנדרטי לחולים עם MDS בסיכון גבוה יותר. אף ששיעורי התגובה נראים דומים עם שני התכשירים, רק וידאזה הראתה שיפור בהישרדות במחקר קליני רנדומלי.
כימותרפיה אינטנסיבית, כמו זאת שמשתמשים בה להשריית הפוגה בלוקמיה מיאלואידית חריפה, אפשרית לשימוש בחולי MDS בסיכון גבוה, אך שיעורי התגובה ומשך התגובה נמוכים יותר מאלו המושגים בחולים עם לוקמיה מיאלואידית חריפה ושיעור הסיבוכים גבוה יותר, ולכן כימותרפיה אגרסיבית היא אפשרות לא אטרקטיבית בחולים אלו. השתלת מח עצם מתורם היא הטיפול היחידי עם פוטנציאל לריפוי לחולים עם MDS בסיכון גבוה, והישרדות ממושכת ללא מחלה היא בין 30 אחוזים ל-50 אחוזים. בכל אופן, השתלת מח עצם מוגבלת לחולים צעירים יותר עם תורם מתאים[7].
טיפול MPN
הטיפול ב-PV מתמקד במניעת סיבוכים טרומבוטיים. הטיפול היעיל ביותר למניעת אירועים טרומבוטיים הוא שילוב של ויסות המטוקריט אל מתחת ל-45 אחוזים עם נטילת אספירין 100 מיליגרם ליום. ויסות המטוקריט מושג על ידי הקזות דם חוזרות בחולים בני פחות מ-60 ללא היסטוריה של טרומבוזיס. האחרים מטופלים על ידי תרופות ציטורדוקטיביות. Hydroxyurea היא תרופת הבחירה.
הטיפול ב-ET מבוסס על סיכון החולה לפתח טרומבוזה. כמו ב-PV, חולים מעל גיל 60, או בעלי היסטוריה של אירוע טרומבוטי, מקבלים טיפול ציטורדוקטיבי, בדרך כלל Hydroxyurea, ובנוסף מטופלים באספירין. חולים צעירים יותר וללא אירוע טרומבוטי קודם מקבלים אספירין כתלות בפרופיל גורמי הסיכון הווסקולריים שלהם, וייתכן כתלות בסטטוס של JAK2. חולים בני פחות מ-60, ללא גורמי סיכון וסקולריים, יכולים להישאר בהשגחה ללא טיפול כלשהו.
חולי PMF עשויים להזדקק לטיפול על מנת לווסת תסמינים סיסטמיים הקשורים למחלה, כגון עייפות וירידה במשקל או הגדלת טחול תסמינית או בשל ציטופניות. Ruxolitinib (Jakavi), מעכב לא ספציפי של JAK, היא התרופה הראשונה שאושרה לטיפול ב-PMF ומשתמשים בה לטיפול בתסמינים כגון עייפות, ירידה במשקל והגדלת טחול סימפטומטית. טיפולים לאנמיה כוללים ESAs, סטרואידים, אנדרוגנים ותרופות אימונומדולטוריות - Thalidomide ו-Lenalidomide - כל אלה הם בעלי יעילות משתנה. השתלת תאי אב מתורם היא הטיפול היחיד שעשוי להביא לריפוי ב-PMF, אך הוא אפשרי רק במיעוט החולים.
סיכום
התקדמות בהבנת מנגנונים מולקולריים בפתוגנזה של MDS ו-MPN הביאה לתובנות חדשות, מחקר קליני ניכר הדגים מאפיינים קליניים הקשורים לפרוגנוזה ואיפשר גישה רציונלית לטיפול. התפתחויות מדעיות וקליניות אלו הביאו לפיתוח ובדיקת טיפולים חדשים ב-MDS ו-MPN ששינו את המהלך הקליני ושיפרו את תוצאות הטיפול. ריצוף גנטי עמוק (NGS - Next Generation Sequencing), עשוי לאפשר הגדרות של סמנים מולקולריים חדשים שיגדירו מחדש הערכה פרוגנוסטית, וגילוי תרופות חדשות ומחקר קליני רב צפויים לשפר עוד את תוצאות החולים[9].
ביבליוגרפיה
- ↑ Cazzola M, Della Porta MG, Malcovati L. The genetic basis of myelodysplasia and its clinical relevance. Blood. 2013;122:4021-4034
- ↑ Greenberg P, Cox C, LeBeau MM, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood. 1997;89:2079-2088
- ↑ Greenberg PL1, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012;120:2454-2465
- ↑ 4.0 4.1 Tefferi A, Pardanani A. Myeloproliferative Neoplasms: A Contemporary Review. JAMA Oncol. 2015;1:97-105
- ↑ Gangat N, Caramazza D, Vaidya R, et al. DIPSS Plus: a Refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol. 2011;29:392-397
- ↑ Vannucchi A, Guglielmelli P, Rotunno G, et al. Mutation- enhanced international prognostic scoring system (MIPSS) for primary myelofibrosis: an AGIMM & IWG- MRT project. Blood. 2014;124:405urr Opin Hematol. 2011 Mar;18 (2):83-8
- ↑ 7.0 7.1 Garcia-Manero G. Myelodysplastic syndromes: 2015 update on diagnosis, risk-stratification and management. Am. J. Hematol. 2015; 90:832-841
- ↑ Moyo V, Lefebvre P, Duh MS, et al. Erythropoiesis¬stimulating agents in the treatment of anemiain myelodysplastic syndromes: a meta-analysis. Ann Hematol. 2008;87:527-536
- ↑ Patel KP, Newberry KJ, Luthra R, et al. Correlation of mutation profile and response in patients with myelofibrosis treated with ruxolitinib. Blood. 2015;126:790-797
- Tefferi A. Novel mutations and their functional and clinical relevance in myeloproliferative neoplasms: JAK2, MPL, TET2, ASXL1, CBL, IDH and IKZF1. Leukemia. 2010;24:1128-1138.
המידע שבדף זה נכתב על ידי ד"ר מרטין אליס - מנהל המכון ההמטולוגי ובנק הדם, בית חולים מאיר, 2 בית הספר לרפואה, אוניברסיטת תל אביב, תל אביב
ד"ר נועה לביא - רופאה בכירה, המכון ההמטולוגי, הקריה הרפואית לבריאות האדם, רמב"ם, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק