הבדלים בין גרסאות בדף "אציל-קרניטין - Acylcarnitine"
| שורה 165: | שורה 165: | ||
עם הכנסת tandem mass spectrometry (MS)) למעבדה הקלינית-כימית בשנות ה-90, פענוח פרופילים של אצילקרניטינים הפך קל יחסית. בפרופילים אלה, היחס בין מסה למטען, משקפת את האורך וההרכב של שרשרת האציל (Chance וחב' ב-Clin Chem משנת 2003). טכניקה זו הפכה עד מהרה לשיטה המועדפת לאבחון מפגעים מורָשים של חמצון חומצות שומן, ולאחרונה האנליזה של אצילקרניטינים משמשת אפילו לחקר אחד המפגעים המטבוליים השכיחים ביותר, עמידות לאינסולין. למרות שאצילקרניטינים מקורם מחמצון חומצות שומן, הם יכולים להיווצר כמעט מכל CoA ester (על פי Rinaldo וחב' ב-Genet Med משנת 2008). תוצרי ביניים אחרים שיכולים להניב אצילקרניטינים הם גופי קטון (C4-3OH-carnitine) על פי Soeters וחב' ב-Metabolism משנת 2012, כמו גם תוצרי פירוק של ליזין, טריפטופן, ואלין, לאוצין ואיזו-לאוצין (C3 ו-C%-carnitine ואחרים), וכן אטומי פחמן מגלוקוזה (אצילרקניטין). | עם הכנסת tandem mass spectrometry (MS)) למעבדה הקלינית-כימית בשנות ה-90, פענוח פרופילים של אצילקרניטינים הפך קל יחסית. בפרופילים אלה, היחס בין מסה למטען, משקפת את האורך וההרכב של שרשרת האציל (Chance וחב' ב-Clin Chem משנת 2003). טכניקה זו הפכה עד מהרה לשיטה המועדפת לאבחון מפגעים מורָשים של חמצון חומצות שומן, ולאחרונה האנליזה של אצילקרניטינים משמשת אפילו לחקר אחד המפגעים המטבוליים השכיחים ביותר, עמידות לאינסולין. למרות שאצילקרניטינים מקורם מחמצון חומצות שומן, הם יכולים להיווצר כמעט מכל CoA ester (על פי Rinaldo וחב' ב-Genet Med משנת 2008). תוצרי ביניים אחרים שיכולים להניב אצילקרניטינים הם גופי קטון (C4-3OH-carnitine) על פי Soeters וחב' ב-Metabolism משנת 2012, כמו גם תוצרי פירוק של ליזין, טריפטופן, ואלין, לאוצין ואיזו-לאוצין (C3 ו-C%-carnitine ואחרים), וכן אטומי פחמן מגלוקוזה (אצילרקניטין). | ||
| − | האנליזה הסטנדרטית של אצילקרניטינים בשיטת tandem MS אינה יכולה להבדיל בין סטראואיזומרים ותרכובות איזובריות אחרות, שיש להם אותה מסה נומינלית אך בעלי מבנה מולקולארי שונה. תרכובות אלו יכולות להיפרד בשיטת liquid chromatography-tandem MS (על פי Minkler וחב' ב-Clin Chem משנת 2008). מגבלה זו מודגמת על ידי C4-OH-carnitine, שיכול להגיע מה-CoA ester של גופיף הקטון D-3-hydroxybutyrate בצורת D-C4-OH-carnitine, או מתוצר הביניים של חמצון L-3-hydroxybutyryl-CoA בצורת L-C4-OH-carnitine, או מתוצר הביניים L-3-hydroxybuyryl CoA בפירוק של ואלין | + | האנליזה הסטנדרטית של אצילקרניטינים בשיטת tandem MS אינה יכולה להבדיל בין סטראואיזומרים ותרכובות איזובריות אחרות, שיש להם אותה מסה נומינלית אך בעלי מבנה מולקולארי שונה. תרכובות אלו יכולות להיפרד בשיטת liquid chromatography-tandem MS (על פי Minkler וחב' ב-Clin Chem משנת 2008). מגבלה זו מודגמת על ידי C4-OH-carnitine, שיכול להגיע מה-CoA ester של גופיף הקטון D-3-hydroxybutyrate בצורת D-C4-OH-carnitine, או מתוצר הביניים של חמצון L-3-hydroxybutyryl-CoA בצורת L-C4-OH-carnitine, או מתוצר הביניים L-3-hydroxybuyryl CoA בפירוק של ואלין (L-isoC4-OH-carnitine). |
| − | |||
| − | |||
| + | ==המקור של אצילקרניטינים בפלזמה== | ||
העובדה שאצילקרניטינים יכולים להימדד בפלזמה מדגימה שמולקולות אלו יכולות להיות מועברות דרך ממברנת התאים. שני טרנספורטרים משתתפים בתהליך ה"ייצוא" של אצילקרניטינים: האחד מהם OCTN2 המשתתף כידוע בהחדרתם אל תוך המיטוכונדריה, יכול להשתתף בהוצאתם מגופיפים תאיים אלה (Pochini וחב' ב-Biochem Biophys Acta משנת 2004). בנוסף, גם ה-monocarboxylase transporter 9 (או SLC16A9), משתתף בהוצאת קרניטין אל מחוץ לתאים (Suhre וחב' ב-Nature משנת 2011). למרות ששני טרנספורטרים אלה זוהו, המנגנון המדויק של טרנספורט זה עדיין לא פוענח, אם כי נראה שהוא תלוי באופן מובהק בריכוז האצילקרניטינים התוך-תאי. מחקרים מוקדמים במיטוכונדריה של הלב, הכבד והמוח במכרסמים, הוכיחו שהוצאת האצילקרניטינים מהמיטוכונדריה נקבעת גם על ידי הזמינות של ריאקציות הצורכות acyl-CoA על פי Lysiak וחב' ב-J Biol Chem משנת 1986). בבני-אדם יציאת אצילקרניטינים לפלזמה אופיינית למצבים של פגם החמצון חומצות שומן. מנקודת המבט הפיזיולוגית, דיאטות וצום קשורים למודולציה של פרופיל האצילקרניטינים בפלזמה (Soeters וחב' ב-Clin Sci משנת 2009, וכן Kien וחב' ב-Obesity משנת 2011, ו-Costa וחב' ב-Pediatr Res משנת 1999). | העובדה שאצילקרניטינים יכולים להימדד בפלזמה מדגימה שמולקולות אלו יכולות להיות מועברות דרך ממברנת התאים. שני טרנספורטרים משתתפים בתהליך ה"ייצוא" של אצילקרניטינים: האחד מהם OCTN2 המשתתף כידוע בהחדרתם אל תוך המיטוכונדריה, יכול להשתתף בהוצאתם מגופיפים תאיים אלה (Pochini וחב' ב-Biochem Biophys Acta משנת 2004). בנוסף, גם ה-monocarboxylase transporter 9 (או SLC16A9), משתתף בהוצאת קרניטין אל מחוץ לתאים (Suhre וחב' ב-Nature משנת 2011). למרות ששני טרנספורטרים אלה זוהו, המנגנון המדויק של טרנספורט זה עדיין לא פוענח, אם כי נראה שהוא תלוי באופן מובהק בריכוז האצילקרניטינים התוך-תאי. מחקרים מוקדמים במיטוכונדריה של הלב, הכבד והמוח במכרסמים, הוכיחו שהוצאת האצילקרניטינים מהמיטוכונדריה נקבעת גם על ידי הזמינות של ריאקציות הצורכות acyl-CoA על פי Lysiak וחב' ב-J Biol Chem משנת 1986). בבני-אדם יציאת אצילקרניטינים לפלזמה אופיינית למצבים של פגם החמצון חומצות שומן. מנקודת המבט הפיזיולוגית, דיאטות וצום קשורים למודולציה של פרופיל האצילקרניטינים בפלזמה (Soeters וחב' ב-Clin Sci משנת 2009, וכן Kien וחב' ב-Obesity משנת 2011, ו-Costa וחב' ב-Pediatr Res משנת 1999). | ||
| שורה 175: | שורה 174: | ||
התפקיד הפיזיולוגי של מעבר (efflux) אצילקרניטינים לפלזמה אינו ברור, אך ייתכנו תרחישים אחדים: יצירת אצילקרניטין מונעת הצטברות של acyl-CoA, ומאפשרת את ההמשכיות של תהליכים מטבוליים התלויים ב-CoA (על פי Lopaschuk וחב' ב-Biochem Biophys Acta משנת 1994). בנוסף לפלזמה, אצילקרניטינים נמצאים גם בנוזל המרה ובשתן מה שמצביע על אפשרות שה-efflux של אצילקרניטין עשוי לסייע גם בתהליך הדה-טוקסיפיקציה (Mueller וחב' ב-Chim Clin Acta משנת 2003, ו-Chalmers וחב' ב-Pediatr Res משנת 1984). באופן מקובץ, סך כמות היצירה היומית של אצילקרניטים נמוכה מ-200 מיקרומול', שניתן לחשב אותה ככמות הנמוכה מ-0.01% מכלל הדרישה האנרגטית, ולכן ניתן להתייחס אליה ככמות זניחה של במושגים של איבוד אנרגיה פוטנציאלי. יתרה מזאת, הספיגה מחדש של אצילקרניטינים ממקור המרה בהחלט אפשרית. | התפקיד הפיזיולוגי של מעבר (efflux) אצילקרניטינים לפלזמה אינו ברור, אך ייתכנו תרחישים אחדים: יצירת אצילקרניטין מונעת הצטברות של acyl-CoA, ומאפשרת את ההמשכיות של תהליכים מטבוליים התלויים ב-CoA (על פי Lopaschuk וחב' ב-Biochem Biophys Acta משנת 1994). בנוסף לפלזמה, אצילקרניטינים נמצאים גם בנוזל המרה ובשתן מה שמצביע על אפשרות שה-efflux של אצילקרניטין עשוי לסייע גם בתהליך הדה-טוקסיפיקציה (Mueller וחב' ב-Chim Clin Acta משנת 2003, ו-Chalmers וחב' ב-Pediatr Res משנת 1984). באופן מקובץ, סך כמות היצירה היומית של אצילקרניטים נמוכה מ-200 מיקרומול', שניתן לחשב אותה ככמות הנמוכה מ-0.01% מכלל הדרישה האנרגטית, ולכן ניתן להתייחס אליה ככמות זניחה של במושגים של איבוד אנרגיה פוטנציאלי. יתרה מזאת, הספיגה מחדש של אצילקרניטינים ממקור המרה בהחלט אפשרית. | ||
| − | + | ||
| + | [[קובץ:אציל-קרניטין 1.gif|מרכז|700 פיקסלים]] | ||
| − | + | ==ערכי נורמה של אציל-קרניטינים שונים== | |
| − | |||
| − | ערכי נורמה של אציל-קרניטינים שונים | ||
< or =7 days (nmol/mL) 8 days-7 years | < or =7 days (nmol/mL) 8 days-7 years | ||
(nmol/mL) > or =8 years | (nmol/mL) > or =8 years | ||
גרסה מ־17:38, 17 בספטמבר 2017
| מדריך בדיקות מעבדה | |
| אציל-קרניטין | |
|---|---|
| Acylcarnitine | |
| מעבדה | כימיה בדם |
| תחום | אבחון מחלות מטבוליות מולדות או נרכשות, הכרוכות בחמצון לקוי של חומצות שומן, ומצבי אצידוריה של חומצות אורגניות או חומצות אמינו |
| טווח ערכים תקין | פירוט בגוף הערך |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
אבחון של מפגעי חמצון של חומצות שומן ומספר organic acidurias; הערכת יעילות טיפול בעת מעקב אחר מטופלים עם מפגעים של β אוקסידציה של חומצות שומן או כאלה עם organic acidurias אחדות.
מידע קליני
אנליזה של acylcarnitine מאפשרת לאבחן מספר רב של מפגעים של חמצון חומצות שומן, ושל organic acidurias אחדים, שכן חסר של האנזימים הרלוונטיים גורם להצטברות של acyl-CoAs ספציפיים.
החמצון של חומצות שומן משחק תפקיד מרכזי ביצירת אנרגיה במהלך פרקי זמן של צום. כאשר אספקת גלוקוזה לגוף מתדלדלת, מגויסות חומצות שומן מרקמות אוגרות השומן, והן חודרות לתאי שריר ולכבד, ומתחמצנות שם ל-acetyl-CoA. בכבד, acetyl-CoA מהווה את אבן הבנייה לסינתזה של גופי ketone, הנכנסים לזרם הדם ומספקים חלופה כחומר ליצירת אנרגיה ברקמות שונות כאשר מלאי הגלוקוזה אינו מספיק לשמור על רמה נאותה של אנרגיה. קבוצות ה-acyl עוברות קוניוגציה עם קרניטין ליצירת acylcarnitine שניתן למדוד בעזרת tandem mass spectrometry (או MS/MS). תוצאות אבחוניות מאופיינות בדרך כלל על ידי תמונה של סוגי acylcarnitine שונים המוגברים באופן משמעות, בהשוואה לביקורת של אנשים בריאים או כאלה החולים במחלות לא רלוונטיות.
בדיקת הפרופיל של אצילקרניטין המתבצעת במסגרת סקירה ביוכימית לאבחון מפגעים של חמצון חומצות שומן או של מטבוליזם של חומצות אורגניות. במקרים אחדים, תוצאות פרופיל זה אבחוניים עבור מפגעים מהסוג האמור, אם כי במפגעים אחרים יש לאשש ממצאי פרופיל אצילקרניטין על ידי מבחני מעבדה נוספים (Sweetman וחב' ב-Pediatrics משנת 2006). המצבים המתגלים על ידי אנליזה של אצילקרניטין משותפים בהצטברות של C2-C18 acyl-CoAs , המהווים מצעים לאחד מתוך מספר טרנספרזות של carnitine acyl-CoA הפועלות בתוך חלקיקים תוך-תאיים אחדים. אציל קרניטינים נמדדים במספר מצבים קליניים:
- הערכה של נבדקים תסמיניים;
- הערכה של אחאים א-תסמיניים (אך בסיכון גבוה) של לוקים בתרחישים האמורים;
- סקר יילודים;
- אבחון בהיריון;
- בחינת מקרים של PM.
כל המעבדות המבצעות אנליזה זו במסגרת שרות רפואי משתמשות ב-tandem mass spectrometry (MS/MS) כפלטפורמה האנליטית (Chase ב-Chem Rev משנת 2001, ו-Chase ו-Kalas ב-Clin Biochem משנת 2005). יש עדיין מעבדות העושות שימוש בשיטות פחות שכיחות כגון GC-MS, HPLC, ו-capillary electrophoresis.
מפגעים מולדים של חמצון חומצות שומן תופסים נפח הולך וגדל של בדיקות מטבוליות (Rinaldo וחב' ב-Ann Rev Physiol משנת 2002 ו-Olpin ב- Clin Lab משנת 2005). מפגעים אלה יכולים לבוא לביטוי בכל גיל, מלידה ועד גיל מבוגר, ולעתים קרובות עלולים לגרום לאפיזודות מסכנות חיים של אי-איזון מטבולי בעיקר לאחר תקופות של צריכה קלורית בלתי נאותה, או במקביל למחלה לא רלוונטית. מצבי organic acidemias, משקפים קבוצה יותר הטרוגנית של מפגעים גנטיים מוּלדים. הם מופיעים כאפיזודות נשנות של היפו- או היפרטוניה, FTT, פיגור התפתחותי, וביטויים חריפים שכיחים כגון הקאות, לתרגיה, פרכוסים ותרדמת.
באופן כללי, למעלה מ-20 מפגעים מולדים ניתנים לזיהוי בשיטה האמורה, כולל כשלים בחמצון חומצות שומן ו-organic acidurias. הביטויים הקליניים העיקריים הכרוכים במפגעי חמצון של חומצות שומן, כוללים היפוגליקמיה היפו-קטוטית, דרגות שונות של מחלת כבד או כשל כבדי, מיופתיה של שרירי שלד, dilated/hypertrophic cardiomyopathy, ומוות פתאומי או בלתי צפוי. אצידוריות של חומצות אורגניות יכולות להתבטא גם בתרחישים מסכני-חיים בגיל מוקדם כאשר הן משולבות בחמצת מטבולית, ב-anion gap מוגבר, או במצוקה נוירולוגית. מטופלים עם כל אחד מהמפגעים שצוינו, עלולים להימצא בסכנה של התפתחות משבר מטבולי אפילו עקב מצבי זיהום שכיחים. עם זיהוי מפגעים אלה, ניתן לטפל בהם באופן מידי על ידי הימנעות מצום, דיאטות מיוחדות, ואספקה מידית של ויטמינים או קו-פקטורים רלוונטיים.
אנליזה של אציל-קרניטינים בטיפות דם או מרה, מייצגת את השלב הראשון של הערכת סיבת מוות פתאומי ובלתי צפוי. אבחון של מפגע כתוצאה מחמצון לקוי של חומצות שומן, או כתוצאה מ-organic aciduria, מאפשר מתן ייעוץ גנטי למשפחה, עם אפשרות של ביצוע בדיקות בעוברים בהיריונות עתידיים, כמו גם הערכה של סיכונים עתידיים הצפויים לבני המשפחה בכל גיל. ההיארעות המשותפת של מפגעים אלה היא בין 1:5,000 ל-1:10,000 לידות חי (Watson וחב' ב-Genet Med משנת 2006). אופן ההורשה של מפגעים מולדים של מטבוליזם: כל המפגעים הללו שניתנים לגילוי על ידי אנליזה של אציל-קרניטינים עוברים בהורשה אוטוזומאלית-רצסיבית פרט ל-2-methyl-3-hydroxybutyryl-CoA dehydrogenase deficiency, שהוא מפגע הקשור לכרומוזום-X (על פי Ofman וחב' ב-Am J Hum Genet משנת 2003).
מפגעים שניתן לגלות על ידי אנליזה של אציל-קרניטין
אי-סדירוּת בחמצון של חומצות שומן (fatty acid oxidation)
חסר באנזים Carnitine palmitoyltransferase I (CPT1); חסר באנזים Medium-chain 3-ketoacyl-CoA thiolase (MCKAT); חסר באנזים Dienoyl-CoA reductase ; חסר באנזים Short-chain acyl-CoA dehydrogenase (SCAD); חסר באנזים Medium/Short-chain 3-hydroxyacyl-CoA dehydrogenase (M/SCHAD) ; חסר באנזים Medium-chain acyl-CoA dehydrogenase (MCAD) ; חסר באנזים Long-chain 3-hydroxyacyl-CoA dehydrogenase (LCHAD) וחסר ב-trifunctional protein ; חסר באנזים very long-chain acyl-CoA dehydrogenase (VLCAD) ; חסר באנזים Carnitine palmitoyl transferase type II (CPT-II) ; חסר באנזים Carnitine-acylcarnitine translocase (CACT) ; חסר ב-Electron transfer flavoprotein (ETF); חסר באנזים ETF-dehydrogenase או multiple acyl-CoA dehydrogenase deficiency (MADD); glutaric academia type II.
אי-סדירות של חומצות אורגניות
חסר באנזים Glutaryl-CoA dehydrogenase deficiency (glutaric acidemia type I); propionic academia, methylmalonic academia; isovaleric acidemia ; חסר באנזים 3-hydroxy-3-methylglutaryl-CoA carboxylase; חסר באנזים 3-Methylcrotonyl carboxylase ; חסר באנזים biotinidase; חסר באנזים Multiple carboxylase; חסר באנזים isobutyryl-CoA dehydrogenase deficiency; חסר באנזים 2-Methylbutyryl-CoA dehydrogenase ; malonic aciduria; חסר באנזים;β-ketothiolase חסר באנזים glutamate formiminotransferase או formiminoglutamic aciduria; ethylmalonic encephalopathy.
ברוב המפגעים הללו נדרשות בדיקות אישוש כיוון שהפרופיל של אציל-קרניטין יכול לרמז על יותר ממצב קליני בודד.
| Amino acid disorders (*) | Analytes (Amino acids)(**) |
|---|---|
| Phenylketonuria (PKU) or Hyperphenylalaninemia | Phenylalanine |
| Maple syrup urine disease (MSUD) | Leucine/Isoleucine, Valine |
| Homocystinuria (cystathionine synthase deficiency) or Hypermethioninemia | Methionine |
| Tyrosinemia, type I and possibly type II or type III | Tyrosine (elevations may not be detectable on filter paper in first days of life) |
| 5-oxoprolinuria (glutathione synthetase deficiency) (*) | 5-oxoproline |
| Urea cycle disorders (*) | |
| Citrullinemia | Citrulline |
| Argininosuccinic aciduria (ASA) | Citrulline, Argininosuccinic acid |
| Argininemia (*) | Arginine |
| Fatty acid oxidation disorders | (**) Analytes (Acylcarnitines) |
| Short chain acyl-CoA dehydrogenase deficiency (SCAD) | C4 |
| Isobutyryl-CoA dehydrogenase deficiency (IBCD) | C4 |
| Glutaric aciduria, type 2 (GAII) or Multiple acyl-CoA dehydrogenase deficiency (MADD) | C4, C5, C8:1 , C8, C12, C14, C16, C5-DC |
| Medium/Short chain L-3-hydroxyacyl-CoA dehydrogenase deficiency (M/SCHAD) | C4-OH |
| Medium chain acyl-CoA dehydrogenase deficiency (MCAD) | C6, C8, C10, C10:1 |
| Long chain 3 hydroxyacyl-CoA dehydrogenase def. (LCHAD) | C16-OH , C18:1-OH |
| Trifunctional protein deficiency (TFPD) | C16-OH , C18:1-OH |
| Very long chain acyl-CoA dehydrogenase deficiency (VLCAD) | C14:1 , C14, C16 |
| Carnitine palmitoyl transferase deficiency, type 2 (CPTII) | C16 , C18:1, C18 |
| Carnitine palmitoyl transferase deficiency, type 1A (CPT1A) | C0 elevated, low C16, C18 |
| Carnitine/acylcarnitine translocase deficiency (CACT) | C16 , C18:1, C18 |
| Carnitine uptake defect (CUD) | Low C0 - may not be detected in first few days of life |
| Organic acid disorders | Analytes (Acylcarnitines) |
| Propionic acidemia (PA) or propionyl-CoA carboxylase deficiency | C3 |
| Methylmalonic acidemia (MMA) or methylmalonyl-CoA mutase deficiency | C3 |
| Malonic aciduria (MA) or Malonyl-CoA carboxylase deficiency | C3-DC |
| Multiple carboxylase deficiency (MCD) or Holocarboxylase synthetase deficiency & biotinidase deficiency | C5-OH |
| 3-hydroxy 3-methylglutaryl-CoA lyase deficiency (3HMG) | C5-OH |
| 3-methylglutaconic aciduria (3MGA) | C5-OH |
(*) Some forms (genotypes) of these disorders may not be detected by neonatal screening, may not be detected in a newborn dried blood spot or are extremely rare (1:>250,000 births).
(**) Primary MS/MS analyte(s) written in bold type.
- MS/MS analytes are measured in micromoles per liter (uM/L).
- For substituted carnitines, a notation of (Cx) is used, in which (x) denotes the number of carbons in the fatty acid radical.
- Hydroxylation is designated by (-OH), dicarboxylic acids are designated by (-DC), and unsaturation of the fatty acid chain is designated by (:1).
| Type | OMIM | Gene | Locus | Also known as/Description |
|---|---|---|---|---|
| ype I | 250950 | AUH | Chr.9 | 3-Methylglutaconic aciduria type I, 3-Methylglutaconic acidemia or 3-Methylglutaconyl-CoA Hydratase Deficiency |
| Type II | 302060 | TAZ | Xq28 | Barth syndrome (BTHS), 3-Methylglutaconic aciduria type II or Cardiomyopathy-neutropenia syndrome |
| Type III | 258501 | OPA3 | 19q13.2-q13.3 | 3-Methylglutaconic aciduria type III or Costeff syndrome |
| Type IV | 250951 | ? | ? | 3-Methylglutaconic aciduria type IV |
| Type V | 610198 | DNAJC19 | 3q26.3 | 3-Methylglutaconic aciduria type V |
| 2-methyl-3-hydroxybutyryl-CoA dehydrogenase deficiency (MHBD) | C5 |
| Isovaleric acidemia (IVA) | C5 |
| Glutaric acidemia, type 1 (GAI) | C5-DC |
| Beta-ketothiolase deficiency (BKT) | C5:1, C5-OH |
אנליטים הנמדדים ב-MS/MS מבוטאים במיקרומול' לליטר (μM/L). הידרוקסילציה מבוטאת על ידי (HO-), חומצות די-קרבוקסיליות מבוטאות על ידי (DC-), ואי-ריוויון של שרשרת חומצות השומן מבוטא על ידי (1:).
אופן ההורשה של מפגעים מולדים של מטבוליזם: כל המפגעים הללו שניתנים לגילוי על ידי אנליזה של אציל-קרניטינים עוברים בהורשה אוטוזומאלית-רצסיבית פרט ל-2-methyl-3-hydroxybutyryl-CoA dehydrogenase deficiency, שהוא מפגע הקשור לכרומוזום-X (על פי Ofman וחב' ב-Am J Hum Genet משנת 2003).
התפקיד הפיזיולוגי של אצילקרניטינים
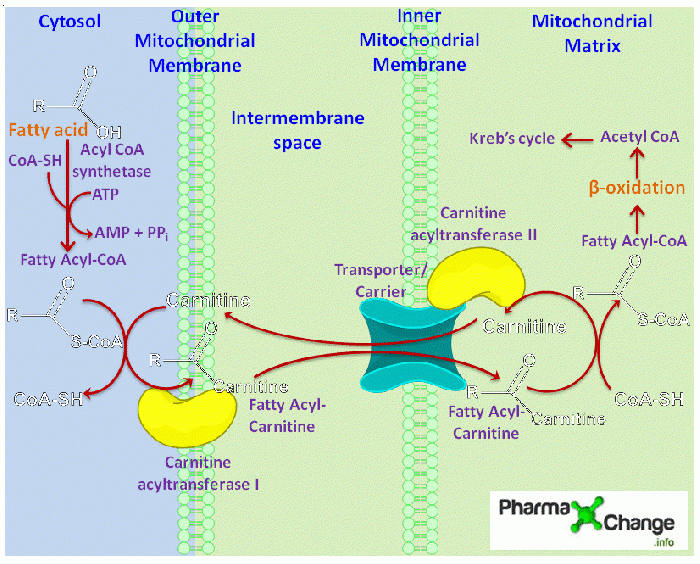
כדי להבטיח אספקה שוטפת של אנרגיה, גוף האדם מחמצן כמויות משמעותיות של שומן בנוסף לגלוקוזה. L-קרניטין מעביר חומצות שומן ארוכות שרשרת משופעלות מהציטוזול אל תוך המיטוכונדריה שם מתבצע ביקוען בתהליך β-oxidation בו משתחררות ברצף יחידות של 2 פחמנים ליצירת מולקולות ATP.
קרניטין נקלט בעיקר מהמזון אך יכול גם להיות מסונתז בתוך הגוף בתהליך בו משתתפים 4 אנזימים המתמירים trimethyllysine לקרניטין, ברצף ריאקציות שהאחרונה בהן היא הידרוקסילציה של butyrobetaine לקרניטין על ידי האנזים γ-butyrobetaine dioxygenase הידוע כ-BBD) על פי Vas ו-Wanders ב-Biochem J משנת 2002. אנזים אחרון זה נמצא רק בכבד האדם, כמו גם בכליות ובמוח, ואלה אמנם שלושת האיברים בהם מתבצעת ביוסינתזה של קרניטין. רקמות אחרות כמו שרירי השלד, חייבות להשיג קרניטין מהדם.
טיפול עם אגוניסט סינתטי של PPARα או peroxisome proliferator activated receptor α הגדיל את פעילות BBD ואת רמות קרניטין בכבד. עובדות אלה מרמזות על כל שהקולטן הגרעיני PPARα, המשחק תפקיד קריטי בתגובה הסתגלנית לצום, הוא מווסת של המטבוליזם של אצילקרניטין (van Vlies וחב' ב-Biochim Biophys Acta משנת 2007). הנשא הפלזמלמלי OCTN2 אחראי לקליטת קרניטין על ידי הרקמות השונות, כולל ספיגתו מחדש מהשתן בכליות. כמו במקרה של BBD, הביטוי של OCTN2 בכבד מווסת על ידי PPARα. אגוניסט סינתטי של PPARα הגביר את הביטוי של OCTN2 בעכברי wild-type, והגביר בהם את רמות קרניטין בפלזמה, בכבד, בכליות, ובלב. בעכברים טרנסגניים -/-,PPARα ביטוי נמוך של OCTN2 תרם לרמות מופחתות של קרניטין ברקמות השונות.
מסלולו של קרניטין
בהגיען אל תוך התא חומצות שומן משופעלות על ידי תהליך אסטריפיקציה לקואנזים-A. בשלב זה קרניטין מעביר יחידות של acyl-CoA ארוכות שרשרת לתוך המיטוכונדריה דרך מולקולות קרניטין-אסטר (Ramsay וחב' ב-Biochim Biophys Acta משנת 2001). יחידות של acyl-CoA ארוכות שרשרת מותמרות לאצילקרניטין על ידי האנזים carnitine palmitoyltransferase 1 או CPT1, המשחלף את שייר CoA בקרניטין. האנזים CPT1 ממוקם בממברנה החיצונית של המיטוכונדריון, וידועים 3 איזופורמים שלו: CPT1b; CPT1a ו-CPT1c, המקודדים על ידי גנים שונים. CPT1a מבוטא בכבד ובאיברים בטניים אחרים כמו גם בפיברובלסטים של אדם. CPT1b מבוטא באופן בלעדי בלב, בשרירי השלד, ברקמת השומן ובאשכים (Eaton ב-Prog Lipid Res משנת 2002). לעומתם, CPT1c מבוטא רק ברטיקולום האנדופלזמי (ולא במיטוכונדריה) של נוירונים במוח (Sierra וחב' ב-J biol Chem משנת 2008).
CPT1 הוא מווסת חשוב של תהליך חמצון חומצות השומן. חמצון של גלוקוזה לאחר ארוחה מביא לעיכוב של פעילות CPT1 דרך תוצר הביניים הביוסינתטי של חומצות שומן, הידוע כ-malonyl-CoA (על פי McGarry וחב' ב-J Clin Invest משנת 1977), הנוצר על ידי ACC או acetyl-CoA carboxylase (על פי Zammit ב-Biochem J משנת 1999). ישנם 2 איזופורמים של ACC: האחד, ACC1 משחק תפקיד בביוסינתזה של חומצות שומן, והאחר ACC2, נכרך עם הרגולציה של חמצון חומצות השומן, בעיקר בגלל מיקומו בממברנה החיצונית של המיטוכונדריון (Castle וחב' ב-PLos One משנת 2009). היפוכו של דבר במצבי צום, האנזים protein kinase המשופעל על ידי AMP, מעכב את ACC מה שגורם לרמות נמוכות של malonyl-CoA , מה שמאפשר את פעילות CPT1 וממילא את החמצון של חומצות השומן.
האיזואנזים CPT1a מגביל את חמצון חומצות השומן בכבד ואת תהליך הקטוגנזה (Drynan וחב' ב-Biochem J משנת 1996). למרות שהעיכוב של malonyl-CoA את פעילות CTP1b חזקה יותר משפעתו המעכבת של malonyl-CoA על CPT1a, אין ראיות מובהקות באשר לחמצון חומצות שומן בתאי שריר (Eaton וחב' משנת 2001). החמצון של חומצות שומן נמצא תחת פיקוח גם ברמת התרגום, כאשר PPARα אך גם PPARβ/δ מפקחים על השעתוק של אנזימים רבים המשתתפים בחמצון חומצות השומן. יש ראיות רבות ששני ה-PPARs משתתפים בוויסות השעתוק של CTP1b, אם כי הוויסות של שעתוק CPT1a על ידי PPAR פחות מובהק (Yu וחב' ב-J Biol Chem משנת 1998, ו-Brandt וחב' באותו כתב עת ובאותה שנה, ו-Mascaró וחב' באותו כתב עת ובאותה שנה).
לאחר יצירת אצילקרניטין על ידי CPT1, הטרנספורטר של קרניטין אצילקרניטין טרנסלוקאזה בממברנה הפנימית של המיטוכונדריה (הידוע כ-CACT או גם SLC25A20) מעביר את האצילקרניטינים אל תוך המטריקס של המיטוכונדריה. הטרנספורטר של חומצות השומן, CD36, כנראה מקל על הטרנספר של אצילקרניטינים מ-CPT1 ל-CACT (על פי Bezaire וחב' ב-Am J Physiol Endocrinol Metab משנת 2006). לבסוף, האנזים CPT2 ממיר מחדש אצילקרניטין בחזרה לקרניטין חופשי ול-acyl-CoAs ארוכי שרשרת שיכולים לעבור חמצון.
אנליזה של אצילקרניטינים
עם הכנסת tandem mass spectrometry (MS)) למעבדה הקלינית-כימית בשנות ה-90, פענוח פרופילים של אצילקרניטינים הפך קל יחסית. בפרופילים אלה, היחס בין מסה למטען, משקפת את האורך וההרכב של שרשרת האציל (Chance וחב' ב-Clin Chem משנת 2003). טכניקה זו הפכה עד מהרה לשיטה המועדפת לאבחון מפגעים מורָשים של חמצון חומצות שומן, ולאחרונה האנליזה של אצילקרניטינים משמשת אפילו לחקר אחד המפגעים המטבוליים השכיחים ביותר, עמידות לאינסולין. למרות שאצילקרניטינים מקורם מחמצון חומצות שומן, הם יכולים להיווצר כמעט מכל CoA ester (על פי Rinaldo וחב' ב-Genet Med משנת 2008). תוצרי ביניים אחרים שיכולים להניב אצילקרניטינים הם גופי קטון (C4-3OH-carnitine) על פי Soeters וחב' ב-Metabolism משנת 2012, כמו גם תוצרי פירוק של ליזין, טריפטופן, ואלין, לאוצין ואיזו-לאוצין (C3 ו-C%-carnitine ואחרים), וכן אטומי פחמן מגלוקוזה (אצילרקניטין).
האנליזה הסטנדרטית של אצילקרניטינים בשיטת tandem MS אינה יכולה להבדיל בין סטראואיזומרים ותרכובות איזובריות אחרות, שיש להם אותה מסה נומינלית אך בעלי מבנה מולקולארי שונה. תרכובות אלו יכולות להיפרד בשיטת liquid chromatography-tandem MS (על פי Minkler וחב' ב-Clin Chem משנת 2008). מגבלה זו מודגמת על ידי C4-OH-carnitine, שיכול להגיע מה-CoA ester של גופיף הקטון D-3-hydroxybutyrate בצורת D-C4-OH-carnitine, או מתוצר הביניים של חמצון L-3-hydroxybutyryl-CoA בצורת L-C4-OH-carnitine, או מתוצר הביניים L-3-hydroxybuyryl CoA בפירוק של ואלין (L-isoC4-OH-carnitine).
המקור של אצילקרניטינים בפלזמה
העובדה שאצילקרניטינים יכולים להימדד בפלזמה מדגימה שמולקולות אלו יכולות להיות מועברות דרך ממברנת התאים. שני טרנספורטרים משתתפים בתהליך ה"ייצוא" של אצילקרניטינים: האחד מהם OCTN2 המשתתף כידוע בהחדרתם אל תוך המיטוכונדריה, יכול להשתתף בהוצאתם מגופיפים תאיים אלה (Pochini וחב' ב-Biochem Biophys Acta משנת 2004). בנוסף, גם ה-monocarboxylase transporter 9 (או SLC16A9), משתתף בהוצאת קרניטין אל מחוץ לתאים (Suhre וחב' ב-Nature משנת 2011). למרות ששני טרנספורטרים אלה זוהו, המנגנון המדויק של טרנספורט זה עדיין לא פוענח, אם כי נראה שהוא תלוי באופן מובהק בריכוז האצילקרניטינים התוך-תאי. מחקרים מוקדמים במיטוכונדריה של הלב, הכבד והמוח במכרסמים, הוכיחו שהוצאת האצילקרניטינים מהמיטוכונדריה נקבעת גם על ידי הזמינות של ריאקציות הצורכות acyl-CoA על פי Lysiak וחב' ב-J Biol Chem משנת 1986). בבני-אדם יציאת אצילקרניטינים לפלזמה אופיינית למצבים של פגם החמצון חומצות שומן. מנקודת המבט הפיזיולוגית, דיאטות וצום קשורים למודולציה של פרופיל האצילקרניטינים בפלזמה (Soeters וחב' ב-Clin Sci משנת 2009, וכן Kien וחב' ב-Obesity משנת 2011, ו-Costa וחב' ב-Pediatr Res משנת 1999).
צפוי שהשריר או הכבד יתרמו רבות ל-turnover של אצילקרניטין. מחקרים מוקדמים הראו שאצילקרנטינים בכבד נמצאו במתאם עם רמת מולקולות אלה בפלזמה בקופי macaque, אם כי לא נחקרו אורכי שרשרות אינדיבידואליות בהקשר זה (Bell וחב' ב-Am J Clin Nutr משנת 1982). יחס הדדי זה בין הכבד והפלזמה בהחלט מתבקש, אם לוקחים בחשבון שהכבד אחראי לרוב פעילות החמצון של חומצות שומן במצבי צום. נתונים באדם חסרים, אך אצילקרניטינים ממקור שריר לא נמצאים בהתאמה עם האצילקרניטינים בפלזמה, במצבי צום קצרים.
התפקיד הפיזיולוגי של מעבר (efflux) אצילקרניטינים לפלזמה אינו ברור, אך ייתכנו תרחישים אחדים: יצירת אצילקרניטין מונעת הצטברות של acyl-CoA, ומאפשרת את ההמשכיות של תהליכים מטבוליים התלויים ב-CoA (על פי Lopaschuk וחב' ב-Biochem Biophys Acta משנת 1994). בנוסף לפלזמה, אצילקרניטינים נמצאים גם בנוזל המרה ובשתן מה שמצביע על אפשרות שה-efflux של אצילקרניטין עשוי לסייע גם בתהליך הדה-טוקסיפיקציה (Mueller וחב' ב-Chim Clin Acta משנת 2003, ו-Chalmers וחב' ב-Pediatr Res משנת 1984). באופן מקובץ, סך כמות היצירה היומית של אצילקרניטים נמוכה מ-200 מיקרומול', שניתן לחשב אותה ככמות הנמוכה מ-0.01% מכלל הדרישה האנרגטית, ולכן ניתן להתייחס אליה ככמות זניחה של במושגים של איבוד אנרגיה פוטנציאלי. יתרה מזאת, הספיגה מחדש של אצילקרניטינים ממקור המרה בהחלט אפשרית.
ערכי נורמה של אציל-קרניטינים שונים
< or =7 days (nmol/mL) 8 days-7 years
(nmol/mL) > or =8 years (nmol/mL) Acetylcarnitine, C2 2.14-15.89 2.00-27.57 2.00-17.83 Acrylylcarnitine, C3:1 <0.04 <0.05 <0.07 Propionylcarnitine, C3 <0.55 <1.78 <0.88 Formiminoglutamate, FIGLU <0.43 <0.08 <0.14 Iso-/Butyrylcarnitine, C4 <0.46 <1.06 <0.83 Triglylcarnitine, C5:1 <0.05 <0.09 <0.11 Isovaleryl-/2-Methylbutyrylcarn C5 <0.38 <0.63 <0.51 3-OH-iso-/butyrylcarnitine, C4-OH <0.13 <0.51 <0.18 Hexenoylcarnitine, C6:1 <0.12 <0.10 <0.15 Hexanoylcarnitine, C6 <0.14 <0.23 <0.17 3-OH-isovalerylcarnitine, C5-OH <0.08 <0.12 <0.10 Benzoylcarnitine <0.13 <0.07 <0.10 Heptanoylcarnitine, C7 <0.05 <0.05 <0.06 3-OH-hexanoylcarnitine, C6-OH <0.08 <0.19 <0.09 Phenylacetylcarnitine <0.15 <0.22 <0.29 Salicylcarnitine <0.08 <0.09 <0.09 Octenoylcarnitine, C8:1 <0.48 <0.91 <0.88 Octanoylcarnitine, C8 <0.19 <0.45 <0.78 Malonylcarnitine, C3-DC <0.09 <0.14 <0.26 Decadienoylcarnitine, C10:2 <0.11 <0.12 <0.26 Decenoylcarnitine, C10:1 <0.25 <0.46 <0.47 Decanoylcarnitine, C10 <0.27 <0.91 <0.88 Methylmalonyl-/succinylcarn, C4-DC <0.05 <0.05 <0.05 3-OH-decenoylcarnitine, C10:1-OH <0.12 <0.12 <0.13 Glutarylcarnitine, C5-DC <0.06 <0.10 <0.11 Dodecenoylcarnitine, C12:1 <0.19 <0.37 <0.35 Dodecanoylcarnitine, C12 <0.18 <0.35 <0.26 3-Methylglutarylcarnitine, C6-DC <0.28 <0.21 <0.43 3-OH-dodecenoylcarnitine, C12:1-OH <0.11 <0.10 <0.13 3-OH-dodecanoylcarnitine, C12-OH <0.06 <0.09 <0.08 Tetradecadienoylcarnitine, C14:2 <0.09 <0.13 <0.18 Tetradecenoylcarnitine, C14:1 <0.16 <0.35 <0.24 Tetradecanoylcarnitine, C14 <0.11 <0.15 <0.12 Octanedioylcarnitine, C8-DC <0.25 <0.19 <0.19 3-OH-tetradecenoylcarnitine C14:1OH <0.06 <0.18 <0.13 3-OH-tetradecanoylcarnitine, C14-OH <0.04 <0.05 <0.08 Hexadecenoylcarnitine, C16:1 <0.15 <0.21 <0.10 Hexadecanoylcarnitine, C16 <0.36 <0.52 <0.23 3-OH-hexadecenoylcarnitine,C16:1-OH <0.78 <0.36 <0.06 3-OH-hexadecanoylcarnitine, C16-OH <0.10 <0.07 <0.06 Octadecadienoylcarnitine, C18:2 <0.12 <0.31 <0.24 Octadecenoylcarnitine, C18:1 <0.25 <0.45 <0.39 Octadecanoylcarnitine, C18 <0.10 <0.12 <0.14 Dodecanedioylcarnitine, C12-DC <0.10 <0.04 <0.04 3-OH-octadecadienoylcarn, C18:2-OH <0.04 <0.06 <0.06 3-OH-octadecenoylcarnitine C18:1-OH <0.03 <0.04 <0.06 3-OH-octadecanoylcarnitine, C18-OH <0.03 <0.05 <0.03 הערות אזהרה: במקרים אחדים תוצאות שליליות-כזובות (false negative) מתקבלות באנליזה של פרופילים של אציל-קרניטינים. נבדקים עם חסר קרניטין עלולים שלא להראות רמות מוגברות באופן בלתי-נורמאלי של ריכוזי acylcarnitine, ויש צורך לחזור על הבדיקה לאחר פרק זמן בו יסופק קרניטין כתוסף למטופל. ניתן גם במסגרת המעקב אחר המטופל בצע מדידה בתנאי in vitro של רמת האנזים הרלוונטי, או לבצע בדיקה גנטית מולקולארית במקרים של קבלת תוצאות בלתי נורמאליות של acylcarnitine. לא מומלץ שבדיקת אציל-קרניטין תתבצע לאחר צום (Rinaldo וחב' ב-Genet Med משנת 2008). Matern. תיאור השיטה: ל-20 מיקרוליטר של פלזמה, מוסיפים 6 דגימות של internal standards בריכוזים ידועים: d3-acetylcarnitine, d3-propionylcarnitine, d3-octanoylcarnitine, d3-dodecanoylcarnitine, d3-palmitoyl-carnitine ו-d7-butyrylcarnitine. בנוסף מוסיפים acetonitrile לצורך דה-פרוטאיניזציה. לאחר טלטול הדגימה משך 30 דקות וסרכוז, הנוזל העליון עובר תהליך ייבוש ומטופל על ידי n-butanolic HCl, לקבלת אציל-קרניטינים, שעוברים אנליזה בצורת ה- n-butylesters שלהם על ידי electrospray ionization tandem mass spectrometry. ריכוז האנליטים נקבע על ידי השוואה ממוחשבת של עוצמות היונים של האנליטים לאלה של ה-internal standard הקרוב ביותר (Van Hove וחב' ב-J Inherit Metab Dis משנת 2000). שיטה זו טובה גם לאנליזה של דגימות דם מיובשות על נייר Guthrie (Smith ו-Matern ב- Curr Protoc Hum Genetמשנת 2008).
הוראות לביצוע הבדיקה:
כאשר הדגימה נלקחת על נייר Guthrie, יש להקפיד על שמירת הנייר במקום חשוך וייבש, אך לא בקירור למנוע לחות ורטיבות. לצורך הבדיקה בפלזמה, יש לדגום את הדם למבחנת סודיום הפארין (פקק ירוק), אך ניתן גם להשתמש במבחנת ליתיום הפארין, או במבחנת ספירת-דם (EDTA פקק סגלגל). את הדם יש לדגום מיד לפני ארוחה או לפני הנקה. יש לפסול דגימות פלזמה מאוד המוליטיות, ליפמיות או איקטריות, אך ניתן לקבל דגימות בהן 3 המדדים האחרונים מתונים. דגימת הפלזמה יציבה בטמפרטורת החדר למשך 8 ימים, בקירור למשך 64 יום, ובהקפאה (מועדפת) למשך 92 יום. את דגימת הפלזמה המופרדת יש לשגר למעבדה במבחנת פלסטיק. יש להימנע מהקפאות והפשרות חוזרות.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - אבחון תסמנות גנטיות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק