מערכת המשלים ומחלות כליה - The complement system and renal diseases
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| מערכת המשלים ומחלות כליה | ||
|---|---|---|
| Complement and renal diseases | ||
| ||
| יוצר הערך | ד"ר נועם טראוב, פרופ‘ מנחם שלזינגר, פרופ‘ אבישלום פומרנץ | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מערכת המשלים
חקר מערכת המשלים גרם לשינוי בהבנה של תהליכי מחלה שונים, ועשוי לסייע בעתיד לפיתוחן של תרופות חדשות. שמה של המערכת נגזר מכך שהיא משלימה את פעילות הנוגדנים בהרג החיידקים.
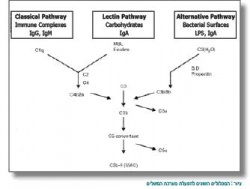
במשך הזמן נמצאו תפקידים נוספים למערכת המשלים, ובהם גם סילוק של קומפלקסים חיסוניים (Immune complex) מהגוף. מערכת המשלים מורכבת מחלבונים רבים שנמצאים בנסיוב (Serum) בצורה בלתי פעילה. הפעלתה של מערכת המשלים יכולה להיעשות באמצעות שלושה מסלולים: המסלול הקלאסי (Classical), מסלול ה-Mannose-binding lectin והמסלול החליפי (Alternative)(2,1). שלושת המסלולים מובילים אל מסלול משותף שמטרתו להביא לסילוק של אנטיגנים (Antigen) זרים, כולל הרג של חיידקים בגוף (ראו איור משמאל).
המסלול הקלאסי
כידוע, מסלול זה מורכב מחלבונים C1-C9 (Complement 1-9). המסלול מתחיל כאשר חלבון C1 נקשר לנוגדנים המוצמדים לאנטיגן על תא החיידק. C-reactive protein (CRP) יכול לשמש להפעלת C1, במקום נוגדנים. הפעלה של C1 גורמת שרשרת פעולה שבה נחתכים החלבונים C2, C4 ו-C3 (בסדר זה). C3b, תוצר הפירוק של C3, פותח את המסלול המשותף לכל מסלולי המשלים, ומוביל, בסופו של דבר, ליצירת ה-Membrane attack complex, שמביא להרס דופן החיידק.
מסלול ה-Mannose-binding lectin
חלבון ה-Lectin נקשר אל Mannose המצוי על דופן תא החיידק. לאחר הקישור, Protease המצוי עליו (mannose-binding protein-associated serine protease 2, MASP2) פועל בדומה ל-C1, וגורם לביקוע של C4 ובהמשך ליצירה של C3b.
המסלול החליפי
המסלול מתחיל מביקוע עצמוני של C3 בפלזמה. C3b נקשר אל פקטור B (Factor B), שמוביל בסופו של דבר ליצירה של C3b נוסף, המשמש במסלול המשותף במערכת המגבירה את עצמה. כדי שמערכת אנזימטית (Enzymatic) כה פעילה תפעל בצורה טובה, יש צורך בחלבונים מווסתים שאחראים לבקרה על מערכת המשלים.
מבין אנזימי הוויסות השונים, נזכיר את C1 Inhibitor, שמווסת את שפעול מערכת המשלים מיד בתחילתו, ואת החלבונים H ו-I שמשתתפים בוויסות המסלול החליפי.
כפי שראינו, C3b עשוי לגרום ללולאה (Loop) המגבירה את פעילות המערכת. כדי למנוע הגברה אין-סופית של המערכת, דבר העלול להביא להרס של תאי המאכסן, יש מערכת הגורמת לפירוק של C3b לחלבונים בלתי פעילים. פקטורים H ו-I הם הגורמים להרס של C3b. על גבי תאי המאכסן, פקטור H נקשר ל-C3b בזיקה (Affinity) גבוהה יותר מאשר פקטור B, וכך מונע הרס של תא המאכסן.
חסר של פקטור H עלול לגרום להפעלה בלתי מרוסנת של מערכת המשלים ולתגובת חיסון עצמי (Autoimmune), שמתבטאת למשל ב-Membranoproliferative Glomerulonephritis (ראה להלן) או תסמונת המוליטית-אורמית (Hemolytic-Uremic Syndrome, HUS). בהקשר זה, מעניין לציין מקרה שבו חולה כליות עם חסר תורשתי של פקטור H, עבר השתלה משולבת של כליה וכבד, דבר שהביא לייצור של פקטור H אצלו ומנע הישנות המחלה בכליה המושתלת(3).
מערכת המשלים וקומפלקסים חיסוניים
במצב רגיל, אחראית מערכת המשלים לפינויים של קומפלקסים חיסוניים (למשל נוגדנים הקשורים לדופן של חיידק). במידה והיא נכשלת בכך, עלולים קומפלקסים חיסוניים אלו, להביא להפעלה מתמדת של המשלים ולמצב של דלקת מתמשכת. הדבר קורה למשל בזיהומים כרוניים כגון: HCV (Hepatitis C Virus), דלקת זיהומית של פנים הלב (Infective endocarditis)(4), שאנט נפריטיס (Shunt nephritis) - נפריטיס הקשורה בנקז לחדרי המוח(5), או במחלות שבהן יש נוגדנים המכוונים כנגד הגוף (Autoantibodies), כמו למשל מחלת Goodpasture, שבה הנוגדנים מכוונים כנגד קרום הבסיס (Basement membrane) של פקעיות הכליה (Glomerulus) והריאות.
חסר של מרכיבי משלים יגרום לנטייה לזיהומים, מחלות חיסון עצמי ומחלות של קומפלקסים חיסוניים. עם זאת, חסרים של מרכיבי משלים מוקדמים קשורים יותר לנטייה לזיהומים, ואילו חסרים של מרכיבי משלים מאוחרים קשורים יותר בהתפתחות מחלות חיסון עצמי. בהתאם לכך נמצא, כי אנשים עם חסר תורשתי של מרכיבי המשלים C1q ,C1r ,C1s ,C4 ,C2, נמצאים בסיכון ללקות בזאבת אדמנתית מערכתית (SLE ,Systemic Lupus Erythematosus)(6) ובמחלות חיסון עצמי אחרות. נראה כי המצאות פקטורים אלו מגנה מפני התפתחות SLE. בתוך כך, פותחה השערת ה-Waste disposal המנסה להסביר תופעה זו ואחרות(2). לפי השערה זו, מרכיבי המשלים נקשרים, במצב רגיל, אל תאים שעברו מוות תאי מתוכנן (Apoptosis), ובכך גורמים לפינויים מהגוף.
מחד גיסא, היעדר תגובה זו יגרום להצטברות של מרכיבי תא ומרכיבי גרעין מפורקים, ולתגובת חיסון עצמי הכוללת יצירת נוגדנים נגד אותם מרכיבים, ובכך יביא החסר במשלים להופעה של מחלות חיסון עצמי, כגון SLE. מאידך גיסא, בזמן מחלת ה-SLE פעילה יש צריכה מוגברת של מרכיבי משלים, המתבטאת ברמות משלים נמוכות בדם.
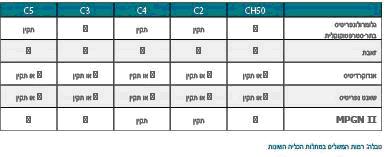
ואכן, רמות נמוכות של C3 ו-C4 נמצאו בחולי SLE בעת שסבלו ממחלה כלייתית פעילה(7), (ראה טבלה). כמו כן, נמצאו רמות נמוכות של C3 ו-CH50 בחולי SLE בשנתיים שלפני הופעת הנפריטיס(8).
רמות נמוכות של משלים (Hypocomplementemia) אופייניות גם לגלומרולונפריטיס בתר-סטרפטוקוקלית (Post-Streptococcal Glomerulonephritis, PSGN). במחלה זו, רמות המשלים לרוב חוזרות לנורמה בתוך 8 שבועות, אולם לעתים ההיפוקומפלמנטמיה ממושכת יותר(9). הנפריטיס ב-Henoch-Schönlein Purpura (HSP) דומה לזו של PSGN(10), ורמות המשלים (CH50 ,C3 ,C4) הנמוכות ב-HSP חוזרות לנורמה בתוך 5 שבועות.
מערכת המשלים ומחלות כליה
כפי שראינו, מערכת המשלים נמצאה קשורה למחלות כליה רבות(11). זאת ניתן להבין בזוכרנו שהכליה היא איבר עשיר בכלי דם, ולתוך פקעית הכליה מתנקזים מרכיבי משלים רבים, וכך היא חשופה להשפעתם. זאת ועוד, תאי הכליה עשויים לייצר בעצמם מרכיבי משלים(13,12), וכך עלולים לתרום להיווצרות דלקת בכליה.
פקטורים נפריטיים
פקטורים נפריטיים (Nephritic Factors) הם נוגדני IgG שמגנים על מערכת המשלים מפני דגרדציה. בעשותם כך, הם מביאים להגברה של פעולת המשלים, ולכן גם לירידה של רמת C3 בפלזמה.
- פקטורים אלה כוללים
נוגדנים נגד C1q תוארו ונמצאו קשורים לנפריטיס בחולי זאבת (14). נוגדן IgG נוסף, הנקרא C4NeF, נקשר אל C4b2a, הקונברטאז של המסלול הקלסי (15), והוא מייצב אנזים זה, ומאריך את זמן מחצית החיים שלו. הוא תואר בגלומרולונפריטיס בתר-סטרפטוקוקלית וכן בזאבת. הצריכה המוגברת של C3 במחלות אלו עשויה להיות מוסברת על ידי פקטור זה או על ידי מכלולים אימוניים או על ידי שניהם.
גם במסלול האלטרנטיבי תואר גורם נפריטי, (C3 Nephritic Factor - C3 NeF), הנקרא גם הפקטור הנפריטי של מסלול האמפליפיקציה (Nephritic Factor of the Amplification Loop) או בקיצור NFa. זה נוגדן המייצב את האנזים C3bBb, הקונברטאז של המסלול האלטרנטיבי (16). הימצאותו נמצאה כקשורה לגלומרולונפריטיס ממברנופרוליפרטיבית (Membranoproliferative Glomerulonephritis - MPGN) וכן ל-Partial Lipodystrophy. במחקר אחד נמצאה פעילות C3NeF לפחות ב-60% מהחולים עם MPGN, דבר שהביא לרמות נמוכות של C3 ושל CH50י (17). אולם, יש לציין כי פקטור זה נמצא במחלות גלומרולריות אחרות, ובכללן נפריטיס של זאבת (18) וגלומרולונפריטיס בתר-סטרפטוקוקלית (19) ואף באנשים בריאים.
Membranoproliferative Glomerulonephritis
MPGN מהווה כ-10%-5% מתסמונת נפרוטית בילדים. הוא יכול להיות אידיופתי או משני למחלות אחרות. MPGN מתבטא בדרך כלל כתסמונת נפרוטית עם מרכיב נפריטי והמטוריה. המהלך הקליני הוא של התקדמות אטית אך מתמדת לעבר מחלת כליה סופנית. במיקרוסקופ האור מתאפיין MPGN בהיפרצלולריות (בשל פרוליפרציה של תאים במזנגיום) ובעיבוי של קרום הבסיס של הגלומרולוס (Glomerular Basement Membrane) וכן בהגברה של מטריקס המזנגיום. כאשר בוחנים את הביופסיות במיקרוסקופ האלקטרונים, מתגלה תת-חלוקה של MPGN לסוג I, סוג II וסוג III.
MPGN מסוג I מתאפיין בהכפלת קרום הבסיס שליד נימיות הדם, וכן במשקעים תת-אנדותליאליים, שבהם ניתן למצוא C1q ,C4י, C3 וכן IgG.
MPGN מסוג II מתאפיין במשקעים דמויי עניבה ב-GBM, הנראים במיקרוסקופ אלקטרונים. משום כך וריינט זה נקרא גם Dense Deposit Diseaseי (20) ובקיצור DDD. בחולים עם DDD ניתן למצוא רמות נמוכות של C3, אך רמות תקינות של C4. כמו כן ניתן למצוא אצלם רמות נמוכות של פקטור B ושל Properdin, מרכיבים של המסלול האלטרנטיבי.
ביותר מ-70% מהחולים בווריינט זה, נמצא (C3 NeF) אC3 Nephritic Factor, או בשמו האחר NFa, שהוא כאמור נוגדן שמתקשר ל-C3bBb. קישור זה מייצב את הקונברטאז הזה של C3, ומגן עליו מפני דגרדציה אנזימטית, ולפיכך גורם ביקוע מתמיד של C3. MPGN סוג III הוא נדיר, ומהווה שילוב של מאפייני הסוגים I ו-II.
כאמור, MPGN יכול להיות משני למצבי מחלה אחרים ובכלל זה מצבים הקשורים במכלולים אימוניים כרוניים (זאבת, הפטיטיס B, הפטיטיס C, אנדוקרדיטיס, אבצסים כרוניים, סכיסטוזומיאזיס), ממאירויות, Partial Lipodystrophy ומצבים תורשתיים של חסר במרכיבי מערכת המשלים.
המצבים התורשתיים של חסר במרכיבי מערכת המשלים שנמצאו קשורים ל-MPGN כולם גורמים לפגיעה בתפקוד של פקטור H: כאמור, פקטור זה מונע הפעלת-יתר של מערכת המשלים ליד תאי המאכסן, ופגיעה בתפקוד שלו תביא בהכרח להפעלת-יתר של המערכת ולירידה ב-C3. המצבים התורשתיים הללו הם כדלקמן (21): חסר הומוזיגוטי של פקטור H, מחלת Marder (חסר הטרוזיגוטי של אתר קישור לפקטור H על C3b), הימצאות נוגדן המעכב את פקטור H או פקטורים נפריטיים.
בין הפקטורים הנפריטיים ציינו כבר את NFa. פקטור נפריטי נוסף הוא הפקטור הנפריטי של המסלול הסופי (The Nephritic Factor of the Terminal Pathway) או בקיצור NFt. פקטור זה אחראי לרמות המשלים הנמוכות ב-MPGN סוג III (רמות נמוכות של C3 ,C5 ופקטורים נוספים של המסלול הסופי של מערכת המשלים). ייתכן שזה קונברטאז של C5. יש לציין כי על אף היותו קשור ל-MPGN, בכ-20% מהסובלים מ-MPGN סוג I נמצא NFt.
סיכום
הבנת מערכת המשלים מאפשרת לנו להבין פתופיזיולוגיה של מחלות שונות, ובהן MPGN. יש לקוות כי הבנה זו תוביל לשיפור באבחנה ובטיפול במחלות אלו בעתיד.
ביבליוגרפיה
- Walport MJ. Complement (First of two parts) N Engl J Med 2001;344:14:1058-1066
- Walport MJ. Complement (Second of two parts) N Engl J Med 2001;344:1140-1144
- Remuzzi G, Ruggementi P, Codazzi D, et al. Combined liver and kidney transplantation for familial haemolytic uraemic syndrome. Lancet 2002;359:1671-1672
- Messias-Reason IJ, Hayashi SY, Nisihara RM, Kirschfink M. Complement activation in infective endocarditis: correlation with extracardiac manifestations and prognosis. Clin Exp Immunol 2002;127:310-315
- Haffner D, Schindera F, Aschoff A, et al. The clinical spectrum of shunt nephritis. Nephrol Dial Transplant 1997;12:1143-1148
- Pickering MC, Botto M, Taylor PR, et al. Systemic lupus erythematosus, complement deficiency, and apoptosis. Adv Immunol 2001;76:227-324
- Ho A, Barr SG, Magder LS, Petri M. A decrease in complement is associated with increased renal and hematologic activity in patients with systemic lupus erythematosus. Arthritis Rheum 2001;44(10):2350-2357
- Wada Y, Ito S, Ueno M, et al. Renal outcome and predictors of clinical renal involvement in patients with silent lupus nephritis. Nephron Clin Pract 2004;98(4):105-111
- Deodoglu IO, Springate JE, Waz WR, et al. Prolonged hypocomplementemia in poststreptococcal acute glomerulonephritis. Clin Nephrol 1996;46(5):302-305
- Motoyama O, Iitaka K. Henoch-Schonlein purpura with hypocomplementemia in children. Pediatrics International 2005;47:39-42
- Trouw LA, Seelen MA, Daha MR. Complement and renal disease. Molecular Immunology 2003;40:125-134
- Sheerrin NS, Sacks SH. The local production of complement in the pathogenesis of renal inflammation. Nephrologie 1999;20:377-382
- Zhou W, Marsh JE, Sacks SH. Intrarenal synthesis of complement. Kidney International 2001;59:1227-1235
- Horvath L, Czirjak L, Fekete B, et al. High levels of antibodies against C1q are associated with disease activity and nephritis but not with other organ manifestations in SLE patients. Clin Exp Rheumatol 2001;19:667-672
- Daha MR, van Es LA. Relative resistance of the F-42 stabilized classical pathway C3 convertase to inactivation by C4-binding protein. J Immunol 1980;125:2051-2054
- Daha MR, Fearon DT, Austen KF. C3 nephritic factor (C3NeF): stabilization of fluid phase and cell-bound alternative pathway convertase. J Immunol 1976;116:1-7
- Schwertz R, Rother U, Anders D, et al. Complement analysis in children with idiopathic membranoproliferative glomerulonephritis: a long-term follow-up. Pediatr Allergy Immunol 2001;12:166-172
- Walport MJ, Davies KA, Botto M, et al. C3 nephritic factor and SLE: report of four cases and review of the literature. Q J Med 1994;87:609-615
- Fremeaux-Bacchi V, Weiss L, Demouchy C, et al. Hypocomplementemia of poststrptococcal acute glomerulonephritis is associated with C3 nephritic factor (C3NeF) IgG autoantibody activity. Nephrol Dial Transplant 1994;9:1747-1750
- Walker DW. Dense deposit disease: new insights. Curr Opin Nephrol Hypertens 2007;16:204-212
- West CD, McAdams AJ. The alternative pathway C3 convertase and glomerular deposits. Pediatr Nephrol 1999;13(5):448-453
המידע שבדף זה נכתב על ידי ד"ר נועם טראוב, היחידה למחלות כליה, בית החולים מאיר, כפר סבא; פרופ‘ מנחם שלזינגר, מנהל מח’ ילדים ואימונולוגיה קלינית, בית החולים ברזילי, אשקלון; פרופ‘ אבישלום פומרנץ, מנהל היחידה למחלות כליה בילדים והמרפאה לאי שליטה על מתן שתן, בית החולים מאיר, מרכז רפואי ספיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק