המדריך לטיפול בסוכרת - סיווג סוגי הסוכרת והמשמעות הטיפולית - Classification of diabetes and its therapeutic significance
המדריך לטיפול בסוכרת
מאת המועצה הלאומית לסוכרת, משרד הבריאות. עורכים מדעיים: ד"ר עופרי מוסנזון, פרופ׳ איתמר רז
| המדריך לטיפול בסוכרת | ||
|---|---|---|

| ||
| שם המחבר | ד"ר מאיה איש-שלום, ד"ר עופרי מוסנזון, ד"ר מריאלה גלאנט | |
| שם הפרק | סיווג סוגי הסוכרת והמשמעות הטיפולית | |
| עורך מדעי | פרופסור איתמר רז | |
| מאת | המועצה הלאומית לסוכרת, משרד הבריאות |
|
| מועד הוצאה | 2022 | |
| מספר עמודים | 614 | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סוכרת
מבוא
סוכרת היא קבוצה מגוונת של מחלות שהמשותף להן הוא היפרגליקמיה (Hyperglycemia). תהליכים פתוגנים רבים מעורבים בהתפתחותה ונעים מהיעדר מוחלט של הפרשת אינסולין ועד לתנגודת לאינסולין המלווה בחסר יחסי של אינסולין. הבעיה, בשני המקרים, היא כמות לא מספקת של אינסולין יחסית לדרישה לאינסולין.
אנו מסווגים את מחלות הסוכרת לשתי קבוצות עיקריות: מסוג 1 (5% עד 10%) ומסוג 2 (90%~), עם שארית קטנה של סוגי סוכרת שונים. עד שנות ה-60 של המאה ה-20 התייחסו רופאים לכל מקרי ההיפרגליקמיה כאל מצב זהה. הילד הצעיר והרזה הצפוי למות ללא אינסולין והמבוגר הסובל מהשמנת יתר המסוגל לשרוד בעזרת שינוי הרגלי חיים נכנסו שניהם תחת המטרייה הגדולה של "סוכרת". ההבחנה בין סוג 1 וסוג 2 נעשתה בשנות ה-70 של המאה ה-20, כאשר בחולי סוכרת צעירים התגלו נוגדנים כנגד האיים של תאי הלבלב (islet cell antibodies) וזיקה ל-HLA. אנו יודעים שלמרות שאנו מתארים סוכרת כמשתייכת לאחת משתי קטגוריות גדולות, ישנם גווני אפור רבים כגון סוכרת אוטואימונית חבויה של מבוגרים (LADA, Latent Autoimmune Diabetes of Adults) המציגה תכונות הן של סוג 1 והן של סוג 2, וסוכרת מועדת לקטוזיס (Ketosis-prone diabetes), בה חולים הסובלים לכאורה מסוכרת מסוג 2 מתייצגים עם חמצת קיטוטית סוכרתית (Diabetic ketoacidosis, DKA). בנוסף, כ-20% עד 30% מחולי הסוכרת מסוג 1 סובלים מעודף משקל/ השמנה ועשויים ללקות בתנגודת לאינסולין, בפרט אם יש להם סיפור משפחתי של סוכרת מסוג 2[1]. לאור זאת חוזרת ועולה השאלה האם סוכרת היא רצף של מחלות או שהיא מייצגת שתי ישויות פתופיזיולוגיות נפרדות. ככל שאנו מטיבים להבין את הבסיס הגנטי והמולקולרי לסוכרת, ייתכן שהסיווג הנוכחי יתפורר לשיטות סיווג אחרות.
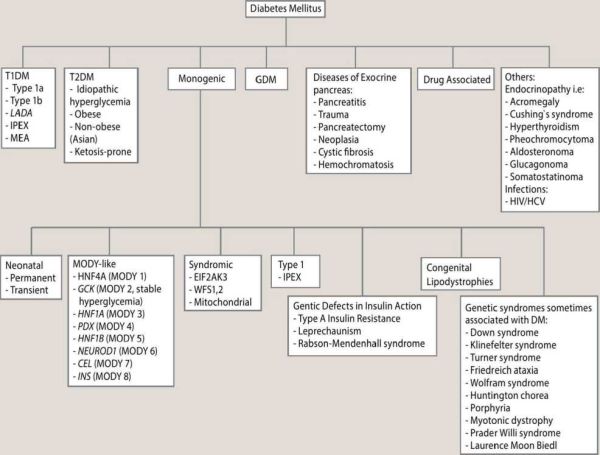
בינתיים, הבה נבחן את הקטגוריות כפי שהן קיימות כעת, לפי האגודה האמריקאית לסוכרת (American Diabetic Association, ADA) בתרשים מספר 1[2]. מטרת הסיווג היא לתאר את סוג הסוכרת, מהלך המחלה, הגנטיקה, התורשתיות שלה, הפנוטיפ הקליני והטיפול האופטימלי[3]. בהקשר זה חשוב להיות מודע לקיומה של הסוכרת המונוגנטית ,MODY אשר אמנם אינה שכיחה, מהווה 3% עד 4% מכלל הסוכרת, אך נמצאת בתת אבחון ניכר. הטיפול בה עשוי להיות שונה בחלק מהמקרים (1,3 MODY), בהם ניתן לרוב לגמול מאינסולין והטיפול המתאים ביותר הוא פומי (סולפונילאוריאה). בתת סוג נוסף (2 MODY) אין צורך לטפל בסוכרת בשל סיכון אפסי לפתח סיבוכי סוכרת.
סוכרת סוג 1
ראו גם – סוכרת מסוג 1 - Type 1 Diabetes, סוכרת מסוג 1 בגיל הרך - Toddlers Diabetes
סוכרת מתווכת-מערכת החיסון (Immune-mediated diabetes) (סוג 1a)
סוכרת סוג 1a נקראה בעבר סוכרת נעורים או סוכרת תלוית-אינסולין. היא נגרמת מחוסר אינסולין עקב הרס אוטואימוני של תאי ביתא באיי הלבלב. מחלה זו מהווה בין 5% עד 10% ממקרי הסוכרת, ונראה כי היארעותה עולה בעד 5% כל שנה (אם כי חלקה היחסי מכלל מקרי הסוכרת בעולם יורדת לאור העלייה החדה עוד יותר במקרי הסוכרת מסוג 2) [4] [5].
סוכרת סוג 1a מאופיינת בנוכחות נוגדנים עצמיים כנגד אנגדים (Antigens) של תאי ביתא, המהווים סמן להרס תאי ביתא. נוגדנים אלה כוללים נוגדנים עצמיים כנגד: אינסולין (IAA, Insulin Auto-Antibodies), אנטיגן טירוזין פוספטאזה של אינסולינומה (IA-2A ,Tyrosine phosphatase insulinoma antigen), האנזים GADA) Glutamic acid decarboxylase) ונוגדן כנגד נשא אבץ (ZnT8A, 8 Zinc Transporter)[6][7]. אחד, ולרוב יותר, מנוגדנים אלה נוכח ב-85% עד 95% מהחולים המאובחנים כסובלים מסוכרת מסוג a1, אולם שיעור זה משתנה עם גיל החולה, איכות הבדיקה והמוצא האתני של החולה[6]. אצל עד 10% מכלל חולי הסוכרת מסוג 1 לא נמצאו נוגדנים חיוביים בעת האבחון ואל לנו להחמיץ את הטיפול הנכון בחולים אלה - טיפול אינטנסיבי באינסולין כמקובל בכלל חולי סוכרת מסוג 1.
באופן טיפוסי סוכרת מסוג 1 מופיעה בנוכחות הפלוטיפים (Haplotypes) HLA-DR3,DQB1*0201 (המכונה גם DR3- DQ2) ו/או (DR4,DQB1*0302 (DR4-DQ8. קצב הרס תאי ביתא משתנה בין אנשים שונים. לרוב, ככל שהחולה צעיר יותר כך ההרס אלים יותר וההסתמנות חדה יותר, ועלולה להגיעה ביתר קלות לחמצת קטוטית סוכרתית (DKA). אחרים יכולים לחיות זמן רב עם היפרגליקמיה מתונה היכולה להידרדר בפתאומיות עקב גורם עקה (Stressor) כגון זיהום או חבלה.
בעוד שה-ADA מקבץ את כל החולים עם נוגדנים עצמיים כנגד אנטיגנים של תאי בטא תחת הקטגוריה של סוכרת מסוג a1, חולים עם נוגדנים עצמיים כנגד איי הלבלב שאינם מתייצגים עם קטוזיס מסווגים בנפרד תחת השם "סוכרת אוטו-אימונית חבויה של מבוגרים" (LADA ,Latent Autoimmune Diabetes of Adults), (המכונה לעתים גם "סוכרת מסוג 1.5", ו-"סוכרת מסוג 1 אטית-התקדמות")[8]. השאלה האם הסתמנות זו אכן מייצגת קטגוריה נפרדת של מחלה נתונה בוויכוח, אולם נראה כי לחולים אלה תכונות הנמצאות היכן שהוא בין סוכרת מסוג 1 ו-2. לחולי LADA קצב איטי יותר של ירידה ברמת C-peptide בהשוואה לזו של חולי סוכרת מסוג 1 מבוגרים אולם מהיר יותר מזה של חולי סוכרת מסוג 2[7].
הפלוטיפים הקשורים לסיכון מוגבר (susceptibility): במטופלי LADA קיימים ואריאנטים גנטים שקשורים לסוכרת מסוג 1, אך גם לסוכרת מסוג 2.
במטופלי LADA רואים הפלוטיפים שקשורים לסיכון מוגבר לסוכרת מסוג 1, כגון (HLA (DRB1*03-DQB1*0201 and DRB1*04-DQB1*0302[9], אך הם מעלים את הסיכון לסוכרת מסוג 1 משמעותית יותר בהשוואה לסיכון לפתח LADA. ההפלוטיפים באסיאתים שונים מאלו של לבנים[9]. הפלוטיפים שמגנים מפני טייפ 1 מגנים גם מפני (0602*DQB1-0102*DQA1) LADA[9]. ואריאנטים נוספים שקשורים לסוכרת מסוג 1 בגנים INS (protein tyrosine insulin), phosphatase non-receptor 22 (PTPN22) נמצאו גם הם קשורים ל-LADA[10]. עם זאת, ואריאנטים ב-MHC מסוג 1, שנמצאו קשורים לסוכרת מסוג 1, לא נמצאו כמעלים את הסיכון ל-LADA[11]. ואריאנטים של גנים הקשורים בסיכון ללקות בסוכרת מסוג 2, כגון TCF7L2 (2 transcription factor 7-1ike) היו שכיחים במטופלים עם LADA בדומה לשכיחותם בקרב מטופלים עם סוכרת מסוג 2[10][12][13]. עם זאת, הבדלים אלה יכולים להסביר את ההתפרצות המאוחרת של LADA רק באופן חלקי. בנוסף להם, ישנם מספר הבדלים בשכיחות הסוגים השונים של הנוגדנים העצמיים בין סוכרת מסוג 1 ו-LADA. בהשוואה לסוכרת מסוג 1, נוגדנים כנגד GAD ו- IA2 הם השכיחים ביותר בקרב חולי LADA[14]. בחולי LADA, נוגדני ANTI GAD הם השכיחים ביותר ולמרות שהטיטר שלהם משתנה במשך הזמן, הם ניתנים לזיהוי פעמים רבות גם 12 שנה לאחר האבחון, וזאת בניגוד לנוגדנים האחרים (ICA, ZNT8, 1A2, IAA) שיכולים להופיע לתקופה קצרה ולהעלם בחולי LADA[15]. בנוסף, מבין תת הקבוצות של נוגדנים כנגד GAD, תת הקבוצה IgG4 שכיחה יותר בקרב חולי LADA מאשר בקרב חולי סוכרת מסוג 1 יתכן וזה מתקשר לפתוגנזה האימונית השונה[16].
נוכחות סוג אחד בלבד של נוגדן עצמי או כייל נמוך של נוגדנים כנגר GAD נמצאת בזיקה לגיל מתקדם יותר, התקדמות אטית יותר של המחלה וסיכון נמוך יותר לתלות באינסולין. לעומת זאת, נוכחות מספר סוגי נוגדנים עצמיים או בייל גבוה של נוגדנים כנגד GAD נמצאת בזיקה לגיל צעיר יותר, קצב התקדמות מהיר יותר וסיכון גבוה יותר לתלות באינסולין ולשכיחות נמוכה יותר של תסמונת מטבולית[17].
הימצאות LADA מבין כלל החולים המאובחנים עם סוכרת חדשה משתנה באופן ניכר ונעה בין 4% עד 14%, כתלות בגאוגרפיה, הנטייה (susceptibility) הגנטית, גורמים סביבתיים, מגדר, גיל בעת האבחנה ובדיקות נוגדנים. השכיחות גבוהה יותר בצפון אירופה נעה סביב 7% עד 14%[15][18][19]. לעומת זאת, בדרום אירופה, בצפון אמריקה ובאסיה השכיחות נמוכה יותר ונעה סביב 4% עד 6% [20][21][22][23]
בהעדר קריטריונים מוגדרים לאבחון LADA, רבים נעזרים בקריטריונים הבאים[24]:
- גיל > 30 שנים
- תוצאה חיובית בבדיקה אחת לפחות לאחד מארבעת הנוגדנים הנפוצים בחולי סוכרת מסוג 1: נוגדנים עצמיים כנגד תאי איים (Islet cell autoantibodies, ICA), האנזים anti-GAD) ,Glutamic acid decarboxylase), חלבון נלווה-אינסולינומה 2 (IA-2A, Insulinoma-associated protein-2 antibodies) אינסולין (Insulin auto-antibodies, IAA) ונוגדנים לנשא אבץ ZN8T
- ללא צורך בטיפול באינסולין בששת החודשים הראשונים לאחר האבחנה
סיבוכי סוכרת בחולי LADA
שכיחות הסיבוכים המיקרווסקולרים דומה לזו של חולים עם סוכרת מסוג 2[15][25] למעט אולי סיכון קטן יותר לנפרופתיה לפי מחקר אחד קטן[26]. למרות שלחולי LADA יש לרוב פחות גורמי סיכון קריווסקולרים או תסמונת מטבולית, הסיכון שלהם לסבוכים מאקרווסקולרים דומה לסיכון של חולים עם סוכרת מסוג 2[15][25][26]. לכן, יש לטפל בצורה אגרסיבית בגורמי הסיכון הקרדיווסקולרים בחולי LADA באופן דומה לזה של חולים עם סוכרת מסוג 2.
הטיפול בסוכרת בחולי LADA
מבחינת הטיפול בסוכרת, לחולי LADA סיכוי גדול יותר להזדקק לטיפול באינסולין לעומת חולים עם סוכרת מסוג 2. עם זאת, מועד ההגעה לטיפול באינסולין או הצורך בטיפול באינסולין וריאבילי ונמצא קשור לטיטר של ANTI GAD. חולים עם LADA מטופלים ע"י אינסולין פעמים רבות מאוזנים פחות טוב לעומת חולים עם סוכרת מסוג 2 שמטופלים ע"י אינסולין[27]. לגבי טיפולים נוספים: לא בוצעו מחקרים מבוקרים לגבי השמוש במטפורמין, אשר נראה על פניו בטוח לשמוש וכנראה יעיל בחולים אלו. לעומת זאת, מתן של סופלניל-אוריאה (GLUBEN) אינו מומלץ מכיוון שהוא גורם לאיזון מטבולי פחות טוב וכן לירידה מהירה בתפקוד תאי הבטא, כפי שמתבטאת ברמת ה-c-peptide[28][29][30]. עבודה קטנה הדגימה שיפור בתפקוד תאי הבטא בשילוב תיאזולאדינדיאון עם אינסולין[31]. קיימות מספר עבודות שהדגימו יעילות של מעכבי 4-DPP בטיפול בחולי LADA עם שיפור ברמות c-peptide לעומת אינבו[32][33][34]. מבחינת אנלוגים ל-1-GLP, טיפול בדולגלוטייד היה יעיל באופן דומה במטופלים עם וללא נוגדנים, באנליזה על סמך נתונים ממספר מחקרי AWARD[35]. עם זאת, בחולים עם תפקוד ירוד של תאי בטא, יש להיזהר מהפסקת אינסולין והחלפתו ב-1-GLP מחשש ל-DKA[36]. באופן דומה, בטיפול עם מעכבי SGTL2, חולי LADA עם רזרבה לבלבית ירודה, נמצאים ככל הנראה בסיכון מוגבר ללקות ב-DKA.
תחלואה נלוות בחולי LADA
בדומה לחולים עם סוכרת מסוג 1, חולי LADA נמצאים בסיכון מוגבר לפגיעה אוטואימונית נוספת בעיקר תת או יתר פעילות של בלוטת התריס, אך גם חסר בוויטמין B12 על רקע אוטואימוני (Pernicious anemia), צליאק, מחלת אדיסון, הפטיטיס אוטואימונית ומיאסטניה גרביס.
סוכרת סוג 1b
סוכרת סוג 1b, הנקראת גם סוכרת עלומה (Idiopathic), מתייחסת להרס לא-אוטואימוני של איי הלבלב המביא לבסוף לחמצת קטוטית סוכרתית (DKA). באופן טיפוסי לחולים אלה הופעה קלינית של סוכרת סוג 2.
מיעוט קטן מאוד של חולי סוכרת סוג 1 נכלל בקבוצה זו, כשרובם ממוצא אפריקאי או אסייתי. מחלה זו מורשת בצורה חזקה, אין לה כל סמן של אוטואימוניות ואינה בזיקה ל-HLA. מהלך הרס תאי ביתא משתנה, כאשר חלק מהחולים זקוקים לאינסולין באופן מוחלט כל הזמן וחלק אחר נזקק לאינסולין במידה משתנה[2].
כיוון שתסמונת זו עודנה מעורפלת, פותחו מערכות סיווג שונות נוסף לזו של האגודה האמריקאית לסוכרת על מנת לסווג קבוצת חולים מגוונת זו, אשר מצד אחד סובלת מחמצת קטוטית סוכרתית, אולם מצד שני אינה מתאימה למערך החזותי (Phenotype) הטיפוסי של סוכרת סוג 1. בין מערכות אחרות אלו נכללות מערכת המבוססת על מדד מסת הגוף (BMI, Body Mass Index), הסגלה (modification) של סיווג האגודה האמריקאית לסוכרת ומערכת Aβ. מטרת שיטות הסווג הללו היא לחזות אילו חולים יזדקקו לאינסולין באופן רציף ואילו באופן זמני אינטרמינטי.
שיטת הסיווג המבוססת על מדד מסת הגוף מחלקת את החולים בסוכרת המועדים לקטוזיס לרזים (28>BM1 ק"ג למ"ר), המדמים קלינית חולי סוכרת סוג 1 בעלי תפקוד ירוד של תאי ביתא ולשמנים (Obese) (BMI≥ 28 ק"ג למ"ר) המדמים קלינית חולי סוכרת סוג 2 עם תפקוד שמור של תאי ביתא [37].
במודיפיקציה של סיווג Modified ADA classification) ADA) מבחינה רטרוספקטיבית, בהתבסס על התלות ארוכת הטווח באינסולין, בין חולי סוכרת מועדת לקטוזיס (Ketosis-prone diabetes, KPD) התלויים באינסולין (insulin KPD-ID ,dependent KPD) ושאינם תלויים באינסולין (KPD-NID ,non-insulin dependent KPD) - הן חולי סוכרת מסוג 1a והן חולי KPD-ID מציגים מאפיינים קליניים של סוכרת מסוג 1 עם תפקוד ירוד של תאי בטא, בעוד שחולי KPD-NID מציגים מאפיינים קליניים של סוכרת מסוג 2 עם תפקוד שמור של תאי בטא במשך תקופה ארוכה[38].
מערכת Aβ משתמשת במערכת סיווג המבדילה בין ארבע תת קבוצות של KPD בהתבסס על נוכחות או היעדר נוגדנים עצמיים ונוכחות או היעדר עתודה תפקודית של תאי בטא, כנמדד על ידי רמת c-peptide בצום או בתגובה לגלוקגון[39].
סוכרת סוג 2
ערך מורחב – סוכרת מסוג 2 - Type 2 Diabetes
צורה זו של סוכרת מהווה 90% עד 95% ממקרי הסוכרת. היא נקראה בעבר "סוכרת שאינה-תלויה באינסולין" (Non-insulin dependent diabetes) (זהו שם מוטעה כיוון שחולים רבים נזקקים לאינסולין) או סוכרת מבוגרים (שגם הוא אינו מדויק, כיוון שהיא מופיעה גם בגילאים צעירים יותר ויותר). היא מאופיינת בתנגודת אינסולין עם הפרשת אינסולין שאינה מספיקה לפצות על תנגודת זו ויצור מוגבר של גלוקוז בכבד (HGO, Hepatic Glucose Output מוגבר). תנגודת לאינסולין ניתן לתאר כמצב שבו, עקב פגיעה בשליחים משניים בתוך התא, גם בעת חיבור של אינסולין לרצפטור שלו על פני התא, לא נצפית התגובה שלה אנו מצפים, כגון עלייה במספר התעלות המכניסות גלוקוז לתוך התאים. תנגודת האינסולין לרוב, אך לא תמיד, קשורה להשמנת יתר בטנית או עלייה ביחס מותן-ירך. ההיפרגליקמיה יכולה להתפתח באטיות לאורך שנים ולרוב אינה תסמינית. כאשר היא מאובחנת, שיעור מסוים של החולים פיתח כבר סיבוכי סוכרת. הסיכון לפתח צורה זו של סוכרת עולה עם השמנת יתר ומיעוט בפעילות גופנית [40]. הסיכון גם עולה עם הגיל ומחלה זו נתפסה באופן מסורתי כמחלה של אנשים מבוגרים בניגוד לסוכרת סוג 1. עם זאת, עקב העלייה בשכיחות השמנת היתר בקרב ילדים, בעיקר אלה מקרב מיעוטים אתניים, אבחנה של סוכרת בילד אין משמעותה בהכרח שהילד סובל מסוכרת מסוג 1. ksudnv' בקרב ילדים בארה"ב בגילאי 10 עד 19, מחצית מחולי הסוכרת ממוצא אפרו-אמריקאי והיספני ולמעלה ממחצית מהחולים ממוצא אסייתי/ איי האוקיינוס השקט וילידים אמריקאים סובלים מסוכרת סוג 2.
סוכרת הריונית (Gestational diabetes meiiitus, GDM) מהווה גורם סיכון להתפתחות סוכרת מסוג 2 לאחר הלידה. במחקר מבוסס אוכלוסייה גדול, שיעור התפתחות סוכרת לאחר סוכרת הריונית עמד כמעט על 20% לאחר 9 שנים[41]. לעומת זאת, בנשים הסובלות מהשמנה לאחר הלידה, שיעור הסוכרת מגיע ל-50% עד 75%[42]. אנשים הסובלים מיתר לחץ דם ויתר שומנים בדם נמצאים גם הם בסיכון מוגבר לסוכרת מסוג 2. יתר לחץ דם נמצא בזיקה לעלייה בסיכון הצולב (OR) של פי כמעט 5 לסוכרת ויתר שומנים בדם נמצא בזיקה לעלייה בסיכון הצולב לסוכרת של כמעט פי 4[43]. השכיחות שונה כקכוצות גזעיות/אתניות שונות. המחלה שכיחה יותר פי 2 עד 6 באפרו-אמריקאים, אמריקאים ילידים, אינדיאנים מקבוצת Pima ואמריקאים היספנים בארה״ב מאשר בלבנים[44].
מבחינת הפתוגנזה של סוכרת מסוג 2, מדובר בשילוב של אובדן מסת תאי בטא ופגיעה בתפקוד תאי הבטא בלבלב. אובדן מסת תאי הבטא מתרחש, ככל הנראה, בשלבים מוקדמים, במצב של טרום סוכרת, עוד טרם התפתחות הסוכרת (לפי מחקרי נתיחות של גופות)[45]. הפגיעה בתפקוד תאי הבטא נובעת מ"רעילות" של סוכר במצב של היפרגליקמיה ומנזק של חומצות שומן חופשיות[46]. יתכן שלהצטברות עמילואיד לבלבי יש גם תרומה בהתקדמות הסוכרת[47]. בנוסף, קיימת נטייה גנטית חזקה ללקות בסוכרת מסוג 2, והיא חזקה יותר מאשר בצורה האוטואימונית של סוכרת מסוג 1. הסיכון לפתח סוכרת מסוג 2 עומד על כ-40% בצאצא של הורה אחד הסובל מהמחלה, אולם הסיכון מתקרב ל-70% כאשר שני ההורים סובלים מסוכרת. עם זאת, הגנטיקה של סוכרת מסוג 2 מורכבת. במחקרי GWAS (GENOME WIDE ASSOCIATION STUDIES) נמצאו מעל 400 ואריאנטים בגנים שונים המגבירים את הסיכון ללקות בסוכרת, אך מדובר על עלייה בסיכון רק של 5% עד 40%. גנים אלו קשורים בעיקר בהתפתחות הלבלב ותפקוד תאי הבטא ומיעוטם בתנגודת לאינסולין וגלוקונאוגנזה כברית[48][49][50]. הוואריאנטים השכיחים נותנים הסבר רק ל-20% מהתורשתיות של סוכרת מסוג 2. כנראה שאינטראקציות בין גנים ובין גנים וסביבה מהווות הסבר לפער שנותר בנטייה התורשתית. חשיפות סביבתיות שונות יכולות להביא לשינויים אפגנטיים המגדילים משמעותית את הסיכון ללקות בסוכרת מסוג 2[48].
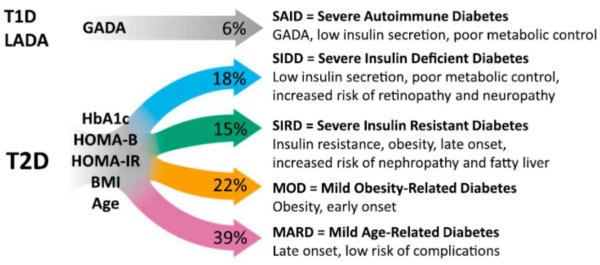
סוכרת מסוג 2 היא מחלה הטרוגנית, עבודה רסנטית הדגימה שישנם 4 פנוטיפים קלינים עיקריים שקשורים לפתוגנזה שונה וסיכון שונה לסבוכים[51]. החלוקה היא בהתאם לתפקוד תאי בטא, תנגודת לאינסולין, BMI המוגלובין מסוכרר, וגיל:
- סוכרת עם חסר משמעותי באינסולין (נוגדנים שלילים) קשה לאיזון מטבולי וקשורה לסיכון מוגבר להיארעות רטינופתיה ונוירופתיה
- סוכרת עם עמידות קשה לאינסולין, סוכרת זו מופיעה לרב בגיל מתקדם יותר, באנשים שסובלים מהשמנה, קשורה לכבד שומני וסיכון מוגבר לנפרופתיה
- סוכרת שקשורה להשמנה מופיעה בגיל צעיר יותר
- סוכרת שקשורה לגיל מתקדם, סוכרת קלה יותר פחות קשורה לסיבוכי סוכרת (ראו תרשים 2)
סוגי סוכרת ייחודיים אחרים
פגמים גנטיים בתאי ביתא
מספר צורות של סוכרת מקושרות לליקויים חד-גניים בתפקוד תאי ביתא. צורות סוכרת אלו מאופיינות ב-2 סוגים עיקריים של סוכרת כזו, המופיעה בינקות (Permanent or transient neonatal diabetes) וכזו המופיעה בגיל הבגרות הצעיר, לרוב לפני גיל 25, ומכונה "סוכרת נעורים המופיעה בבגרות" (MODY Maturity Onset Diabetes of the Young) הן מאופיינות בהפרשת אינסולין לקויה עם פגם מזערי או לא קיים בפעילות האינסולין. הן מורשות בתבנית אוטוזומלית שלטת ואחראיות לשני אחוזים עד 5 אחוזים ממקרי הסוכרת. איחור וטעות באבחנה כסוכרת סוג 1 או 2 נפוצים (עד כ-95% ממקרי MODY לא מאובחנים במקומות שונים בעולם). אבחנה נכונה של MODY חשובה לחולים ומשפחותיהם כיוון שיש לה השלכות טיפוליות.
זוהו ליקויים ב-13 גנים שונים, אך מוטציות ב-3 גנים מהוות כ-80% עד 90% ממקרי ה-MODY: מוטציות ב-HNF1α (52% עד 65% ממקרי ה-MODY), מוטציות ב-glucokinase (15% עד 31% ממקרי ה-MODY), ומוטציות ב-HNF4α (עד 10% ממקרי ה-MODY)[52]. עד 7% מהחולים סובלים ממוטציות חדשות ולכן לא יהיה סיפור משפחתי.
האבחון נעשה בעזרת Targeted next generation sequencing, עם ריצוף של גן אחד או מספר גנים במסגרת פאנל אבחוני.
קיים מחשבון סיכון אשר מסייע בחישוב הסיכון ל-MODY [53] ובכך בהחלטה אם יש טעם בביצוע הבדיקות הגנטיות, מכיוון שפרט לבדיקה ל-MODY2 הן כרגע אינן כלולות בסל, אלא אם במחשבון MODY הסיכוי הוא 50% ומעלה ואז הפאנל (NGS) כן ממומן בסל.
גורם גרעיני של תאי כבד -4אלפא - Hepatocyte nuclear factor-4-aipha
מוטציות בגן ל-HNF4U (Hepatocyte nuclear factor-4-aipha) על כרומוזום 20 גורמות למצב המכונה MODY1[54]. HNF4α מבוטא הן בכבד והן בתאי בטא בלבלב. ל-HNF4α תפקיד בהתפתחות הלבלב וגם בהפרשת אינסולין. החולים מתייצגים בצורה אופיינית עם היפרגליקמיה בתקופת ההתבגרות או בילדות המוקדמת. כ-50% מהילודים נולדים מאקרוזומיים וכ-15% מהמקרים מתייצגים עם היפוגליקמיות בינקות שחולפות מאליהן כעבור שבועות או שנים ומגיבות ל-Diazoxide. על אף תגובה התחלתית טובה לתרופות ממשפחת הסולפונליאוריאה, החולים יכולים להזדקק לאינסולין עם התקדמות הליקוי ההפרשתי. חולים אלה נמצאים בסיכון לסיבוכים בכלי דם קטנים וגדולים (מיקרו- ומאקרווסקולרים) בדומה לחולי סוכרת מסוג 1 ו-2. פרופיל הליפידים הטיפוסי של חולים אלו כולל HDL נמוך, TG גבוהים ו-LDL גבוה.
גן גלוקוקינאז - glucokinase
למעלה מ-600 מוטציות בגן לגלוקוקינאז על כרומוזום 7 תוארו וכונו MODY2. ליקויים בביטוי גלוקוקינאז, שפועל כחיישן גלוקוז, מביאים לסף גבוה יותר להפרשת אינסולין בתגובה לגלוקוז. ההיפרגליקמיה הנוצרת היא לרוב יציבה, קלה וללא זיקה לסיבוכים בכלי-דם הנמצאים בסוגים אחרים של סוכרת[55] בהעמסת סוכר של 75 גרם עולים לרוב ערכי הסוכר כעבור שעתיים בפחות מ-55 מ"ג/ד"ל. חולים הלוקים ב-MODY2 לא נזקקים לטיפול תרופתי במחלתם ובנוסף, טיפול באינסולין ובתרופות פומיות אינו משפיע בדרך כלל על רמות הסוכר. יש לשקול טיפול של הסוכרת אצל האם בהיריון, במקרים בהם יש חשד לעובר בריא (שאינו נושא את המוטציה) לפי הערכת משקל בשבוע 26, מכוון שללא טיפול העובר מסתכן במאקרוזומיה בחשיפה לערכי סוכר גבוהים יותר במהלך ההיריון[56]. אין לטפל באם, אם החשד הוא שהעובר לוקה אף הוא ב-MODY2 (50% סיכון) מכוון שאז הטיפול מיותר ואף עשוי לגרום לעובר קטן. עובר שירש את הגן מאביו צפוי להיוולד במשקל גוף נמוך יותר (450 גרם~) אם אימו בריאה. בדיקה מדם אימהי של DNA עוברי לאבחון קיום המוטציה נמצאת בשלבי פיתוח מתקדמים. יש אפשרות לאבחונים הסטנדרטים אם העובר ירש את המוטציה בגן הגלוקוקינז בעזרת סיסי שליה/מי שפיר אך לרוב ההחלטה אך צורך בטיפול היא לפי הערכת משקל של העובר ובדיקות אלו אינן מבוצעות.
גורם גרעיני של תאי כבד -1אלפא - Hepatocyte nuclear factor-1-aipha
מוטציות בגן HNF1α (Hepatocyte nuclear factor-1-alpha) על כרומוזום 12 נקראות MODY3. צורה זו של סוכרת נפוצה יותר בקרב חולים אירופאים. HNF1α הוא מגביר-ביטוי (transactivator) של גן אינסולין בתאי בטא. מוטציות ב-HNF1α יכולות לגרום להפחתה בהפרשת אינסולין וכן לסף כלייתי נמוך לגלוקוז, דבר המביא לגליקוזוריה גם כשערכי הסוכר בדם נמוכים מ-180 מ"ג/ד"ל. על כן, קודם להופעת הסוכרת, ניתן למצוא בנשאי המוטציה סוכר בשתן (גליקוזוריה) בתגובה להעמסת סוכר. בדיקת רמת סוכר בשתן שעתיים לאחר העמסת סוכר יכולה לשמש כבדיקת סקר בילדים של נשאי המוטציה ולהתוות את הצורך בהערכה נוספת[57]. מבחינת הטיפול, לחולים אלו תגובה טובה לסולפונילאוריאה, שיכולה להמשך אף שנים רבות. יש להם פעמים רבות רמות HDL גבוהות, אך הסיכון שלהם לסיכון מיקרווסקולרים ומאקרוסקולרים דומה לזה של חולי סוכרת מסוג 1 ו-2. מספר מחקרים קטנים הדגימו יעילות גם של מעכבי 4-DPP או אנלוגים ל-1-GLP במטופלים אלו[58][59]. אין מידע לגבי יעילות הטיפול במעכבי SGLT2 במטופלים אלו.
מוטציות ב-1 insulin promoter factor
מוטציות בגן IPF1 (insulin promoter factor-1) יכולות לגרום ל-MODY4 דרך הפחתת קישור החלבון לפרומוטור לגן האינסולין והשפעה על גורם הגדילה הפיברובלסטי (Fibroblast growth factor) בתאי בטא’[60] מוטציות חמורות פחות ב-IPF1 יכולות להביא לנטייה להופעת סוכרת מסוג 2 בגיל המבוגר{{הערה|שם=הערה60|Hani EH, Staffers DA, Chevre JC, Durand E, Stanojevic V, Dina C, Habener JF, Froguel P. Defective mutations in the insulin promoter factor-1 (IPF-1) gene in late-onset type 2 diabetes mellitus. J Clin Invest. 1999;104(9):R41.}.
גורם גרעיני של תאי כבד -1בטא - Hepatocyte nuclear factor-1-beta
מוטציות בגן HNFiβ (Hepatocyte nuclear factor-1-beta) יוצרות את התסמונת MODY5. קיים ספקטרום קליני נרחב הקשור למוטציות ב-HNFiβ. מאפיינים אחרים הקשורים למוטציה זו כוללים אטרופיית לבלב (בבדיקת CT), הפרעה בהתפתחות הכליות (ציסטות כליתיות, מחלה גלומורולוצסטית ואוליגומגנפרוניה), אי ספיקת כליות מתקרמת-לאטה, חסר מגנזיום בדם (היפומגנזמיה), רמת אמינוטרנספרזות מוגברת והפרעות בהתפתחות אברי המין (צסטות אפידידמליות, אטרזיה של ואס רפרנס, ורחם דו קרני). בנוסף, חולים מסוימים מציגים פנוטיפ המתאים למחלת כליה משפחתית מסוג Familial juvenile hyperuricemic nephropathy[61].
גורם התמיינות עצבי-1 - 1-Neurogenic differentiation factor
מוטציות בגן 1-Neurogenic differentiation factor (הנקרא גם NEURODI או BETA2) הן הגורם ל-MODY6. NEURODI משחק תפקיד חשוב גם בהתפתחות הלבלב האנדוקריני[62].
צורות נדירות יותר של MODY קשורות למוטציות בגנים: KLF11, CEL, PAX4, אינסולין, ,BLK, ABCC8 ו-KCNJ11. מוטציות באינסולין, ABCC8, KCNJ11 נמצאו קשורות בסוכרת מינקות.
פגמים גנטיים אחרים בתאי הבטא יכולים להימצא במוטציות נקודתיות בדנ"א המיטוכונדריאלי, שנמצאו קשורות לסוכרת וחירשות. התסמונת מועברת בתורשה אמהית בלבד. היא קשורה לירידה בהפרשת אינסולין שמביאה, בסופו של דבר, לצורך בטיפול באינסולין. ישנה גם ירידה סנסורינוראלית בשמיעה דו"צ המתחילה בגיל 40-30. בנוסף, התסמונת כרוכה בהפרעות הולכה לבביות עם תגובה אפשרית ל-Q10 coenzyme, מיופתיה, סיכון מוגבר לתחלואה כבדית, פגיעה עינית שמתאפיינת באופתלמופלגיה, כפל ראיה, רטיניטיס פיגמנטוזה ודסטרופיה רטינלית, סיכון לאי ספיקה שחלתית מוקדמת, וסיכון מוגבר לסיבוכי סוכרת מיקרווסקולרים כגון נוירופתיה ונפרופתיה. טיפול במטפורמין עשוי להיות כרוך בסיכון מוגבר לחמצת לקטית[63].
הפרעות גנטיות המביאות להיעדר יכולת להפוך פרו-אינסולין לאינסולין זוהו במספר משפחות והן מורשות בתבנית אוטוזומלית דומיננטית. ליקוי זה מביא לאי-סבילות קלה לגלוקוז. במקביל, ייצור מולקולות אינסולין מוטנטי, שבעקבותיהן נפגעת קשירת מולקולות האינסולין לקולטן, זוהו גם כן במספר משפחות ונמצאו בזיקה להורשה אוטוזומלית ופגיעה קלה בלבד ואף ללא פגיעה כלל במטבוליזם הגלוקח.
פגמים גנטיים בפעילות אינסולין
ישנם גורמים חריגים לסוכרת הנובעים מהפרעות גנטיות בפעילות אינסולין. הפרעות חילוף החומרים הקשורות למוטציות בקולטן אינסולין יכולות לנוע בין עודף אינסולין בדם (Hyperinsulinemia) והיפרגליקמיה קלה, ועד לסוכרת חמורה. חלק מהאנשים עם מוטציות אלו יכולים לסבול מהתכהות קפלים (Acanthosis nigricans). נשים יכולות לסבול משיעור יתר (Virilization) ומשחלות מוגדלות וכיסתתיות (Cystic). בעבר, התסמונת נקראה תנגודת לאינסולין סוג A (Type A insulin resistance).
לפרקואניזם (Leprechaunism) ותסמונת רבסון-מנדנהול (Rabson-Mendenhall) הן שתי תסמונות ילדות בעלות מוטציות בגן לקולטן לאינסולין הגורמות לשינויים בתפקוד הקולטן לאינסולין ותנגודת קיצונית לאינסולין. הראשונה מאופיינת בתווי פנים טיפוסיים ולרוב קטלנית עוד בינקות, בעוד שהאחרונה קשורה להפרעות בשיניים וציפורניים ושגשוג יתר של בלוטת האצטרובל (Pineal gland). לא ניתן להדגים שינויים במבנה או בתפקוד קולטן אינסולין ועל כן נראה כי הליקוי(ים) חייב(ים) להיות במסלול האיתות שלאחר הקולטן [64][65].
מחלות של הלבלב האקסוקריני (Exocrine)
ראו גם – כירורגיה של הלבלב
כל תהליך ההורס את הלבלב באופן מפושט יכול להביא לסוכרת. תהליכים נרכשים כוללים דלקת לבלב, חבלה, זיהום, כריתת לבלב וסרטן הלבלב. הנזק ללבלב חייב להיות נרחב על מנת שתופיע סוכרת, פרט למקרה של אדנוקרצינומה (Adenocarcinoma), בו גם כאשר רק חלק קטן של הלבלב מעורב היא יכולה להיות קשורה לסוכרת, מכאן שייתכן שיש מנגנון אחר פרט להפחתת כמות תאי הבטא. לכן במקרה של הופעה פתאומית או החמרה פתאומית של סוכרת באדם מבוגר וללא גורמים ברורים אחרים יש לשקול אפשרות של התפתחות סרטן של הלבלב. לייפת כיסתית (Cystic fibrosis) והמוכרומטוזיס (Hemochromatosis) יכולות גם הן להרוס תאי ביתא ולפגוע בהפרשת אינסולין. ב-Cystic fibrosis ישנן עדויות שהפגיעה היא ישירות בתאי הבטא ואינה מתווכת דרך פגיעה בלבלב האקסוקריני[66].
בקרב חולים הסובלים ממחלה של הלבלב האקסוקריני, הסבירות לסוכרת גבוהה יותר בקרב אלה עם עבר משפחתי של סוכרת סוג 1 או 2. תצפית זו מציעה שלירידה סמויה בעתודה הלבלבית או בתגובתיות לאינסולין יש תפקיד בהגדלת הסיכון לסוכרת ברורה בחולים עם אי-ספיקת לבלב.
מחלות של מערכת ההפרשה הפנימית (Endocrinopathies)
מספר הורמונים כגון הורמון גדילה, קורטיזול (Cortisol), גלוקגון ואפינפרין (Epinephrine) נוגדים את פעילות האינסולין. סוכרת יכולה להופיע כאשר ישנן כמויות עודפות של הורמונים אלה כגון באקרומגליה (Acromegaly), תסמונת קושינג (Cushing) (עקב מחלה של יותרת המוח, יותרת הכליה או מחמת טיפול באמצעות גלוקוקורטיקואידים, בגלוקגונומה או בפאוכרומוציטומה (Pheochromocytoma)). הסוכרת מופיעה לרוב באנשים עם פגיעות קודמות בהפרשת אינסולין וההיפרגליקמיה נעלמת כאשר עודף ההורמון נעלם[67][68][69]. מצבים של סומטוסטטינומה והיפוקלמיה בעקבות אלדוסטרינומה מביאים להפחתה בהפרשת אינסולין, שעשויה להוביל לסוכרת והיא הפיכה בהוצאת הגידול.
סוכרת מושרית-תרופות
תרופות רבות יכולות לפגוע בסבילות גלוקוז דרך הפחתת הפרשת אינסולין, חיזוק תנגודת אינסולין או הגברת יצור גלוקוז בכבד. התרופות הנפוצות יותר כוללות גלוקוקורטיקואידים, גלולות למניעת היריון, נוגדי יתר לחץ דם כגון חסמי ביתא (Beta blockers), משתנים מקבוצת ה-Thiazides ותרופות להפחתת כולסטרול כגון סטטינים (Statins) ו-Tredaptive (Nicotinic acid). תרופות אחרות כוללות תרופות נוגדות דחיית שתל כגון: Tacrolimus ו-Ciclosporin, מעכבי פרוטאזה (Protease inhibitors) ואנלוגים לנוקלואוזידים המשמשים לטיפול בנגיף הכשל החיסוני האנושי (HIV, Human Immunodeficiency Virus), תרופות אנטיפסיכוטיות לא-טיפוסיות כגון Clozapine ו-Olanzapine, מסייעים (Agonists) של הורמון משחרר גונדוטרופין (Gonadotropin releasing hormone) ו-Pentamidine [70].
תרופות אנטיסרטניות אשר עושות מודולציה למערכת החיסון (immune checkpoint inhibitors) עלולות לגרום להופעה של סוכרת מסוג 1 ב-1.8% מהמטופלים. הסוכרת שכיחה יותר בעקבות טיפול בPembrolizumab (2.2%) לעומת ניבולומד (1%) ולא תוארו מקרים תחת איפילומב. הסוכרת מופיעה בממוצע אחרי 5 חודשים. באחת הסדרות 67% מהחולים התייצגו עם סוכרת קטוטית, ל-83% הייתה רמת C PEPTIDE לא מדידה או נמוכה מאוד. ל-71% מהחולים היו נוגדנים לאיי הלבלב בהתיצגות המחלה[71]. עבודה אחרת הדגימה שמטופלים עם נוגדנים לאיי הלבלב התייצגו עם סוכרת מוקדם יותר והיה להם סבון גבוה יותר לפתח חמצת קטוטית[72].
זיהומים
ראו גם – זיהומים בחולי סוכרת - Infections in diabetic patients
נגיפים מסוימים קושרו להרס תאי ביתא. סוכרת מופיעה בחולי אדמת מולדת, על אף שלמרבית חולים אלה יש HLA וסמנים חיסוניים האופייניים לסוכרת סוג 1. בדיקה קפדנית שלאחר המוות לא מצאה עדות כל שהיא לזיהום חריף או מתמיד על ידי נגיף קוקסקי (Coxsackie), אפשטין-באר (Epstein-Barr), חזרת (Mumps) או נגיף ציטומגלו (Cytomegalovirus) ברקמת הלבלב של 75 חולים שנפטרו מספר שבועות לאחר שפיתחו סוכרת סוג 1. זיהום כרוני בנגיף דלקת כבד C קושר להיארעות מגוברת של סוכרת. גם נגיף ה-Hiv קשור לעלייה בסיכון לסוכרת ככל שהעומס הוויראלי גבוה יותר והמחלה ממושכת יותר. המנגנון הוא הצטברות שומן בטני עמוק (Visceral fat) והידללות של השומן התת עורי. הללו כרוכים בעלית ציטוקינים כגון TNFα והתפתחות תנגודת לאינסולין.
צורות לא שכיחות של סוכרת מתווכת-חיסון
תסמונת האיש הנוקשה (Stiff-man syndrome) היא הפרעה אוטואימונית של מערכת העצבים המרכזית המאופיינת בנוקשות שרירי השלד הצירי (Axial) עם עוויתות כואבות. לרוב לחולים כייל גבוה של נוגדנים עצמיים כנגד GAD וכשליש מבניהם מפתחים סוכרת [73].
נוגדנים כנגד הקולטן לאינסולין יכולים לגרום לסוכרת דרך קישור לקולטן אינסולין וכך לחסום את האינסולין מלהיקשר לקולטן שלו ברקמות המטרה. נוגדנים אלה יכולים להיות מסייעים או נוגדים (Antagonists) ולהביא להיפו או להיפרגליקמיה. כמו במצבים אחרים של תנגודת אינסולין קיצונית, חולים עם נוגדנים כנגד קולטן אינסולין סובלים פעמים רבות מהתכהות קפלים (Acanthosis nigricans). בעבר נקראה תסמונת זו תנגודת אינסולין סוג B (Type B insulin resistance). [74]
תסמונות גנטיות אחרות הקשורות לעתים לסוכרת
תסמונות גנטיות רבות מלוות בהיארעות מוגברת של סוכרת. בהן נכללות התסמונות כרומוזומליות על שם דאון (Down), קליינפלטר (Klinefelter) וטרנר (Turner). תסמונת וולפרם (Wolfram) היא הפרעה אוטוזומלית נסגת (Recessive) המאופיינת בסוכרת חסרת-אינסולין. ביטויים נוספים כוללים היפוגונדיזם (Hypogonadism), סוכרת תפלה (Diabetes insipidus), דלדול עצב הראיה וחירשות עצבית.
סוכרת הריונית (Gestational diabetes mellitus)
ערך מורחב – סוכרת והיריון
היריון מאופיין כתקופה של תנגודת אינסולין מוגברת. תנגודת מוגברת זו נובעת הן מתנגודת אינסולין המושרת על ידי הורמונים נוגדי-אינסולין המופרשים מהשליה במהלך ההיריון (לדוגמה אסטרוגן, פרולקטין, סומטוממוטרופין כוריוני אנושי (Human chorionic somatomammotropin), קורטיזול ופרוגסטרון) והן "מגורמים סביבתיים" כגון: עלייה באגירת השומן, ירידה בפעילות הגופנית ועלייה בצריכה הקלורית, המופיעים לרוב במהלך ההיריון. כאשר הלבלב אינו יכול לענות על דרישה מוגברת זו לאינסולין מתפתחת סוכרת. מוערך שבכ-7% מכלל ההריונות (1% עד 14%, כתלות באוכלוסייה הנבדקת) מתפתחת סוכרת הריונית, לרוב במהלך השליש השני או השלישי.
נשים שלקו בסוכרת היריון נמצאות בסיכון מוגבר (20% עד 75%) לפתח סוכרת ב-10 שנים שלאחר הלידה. גורמי הסיכון הם השמנה לאחר הלידה, סוכרת שאובחנה לפני שבוע 24 בהיריון, צורך באינסולין כטיפול בסוכרת הריון5[75], רמות סוכר מוגברות בצום בהיריון ולאחר הלידה, היריון נוסף (כשלעצמו בשל הסטרס על תאי הבטא), היריון נוסף עם סוכרת היריון, והפוגלקמיות בילוד. סיפור משפחתי בקרובי משפחה מדרגה ראשונה נמצא פחות קשור להתפתחות סוכרת בהמשך.
השלכות טיפוליות של סיווג סוגי הסוכרת
הטיפול בסוכרת בנקודת זמן זו הוא סוג של אומנות, כיוון שחסרים לנו הכלים לבדוק בצורה מדויקת במרפאה את רמת התנגודת לאינסולין או את יכולת ההפרשה שנותרה בתאי הבטא. תנגודת לאינסולין יכולה להשתנות לאורך זמן, בהינתן שינויים בעקה החמצונית, מחלה, תרופות או משקל. התפקוד ההפרשתי יכול להשתנות גם הוא, כאשר הרעילות מגלוקוז מטופלת, או כפי שנלמד מה-UKPDS (United Kingdom Prospective Diabetes Study), עצם חלוף הזמן מוביל לירידה בתפקוד תאי בטא.
עם זאת, האבחנה הנכונה היא חיונית לאור ההשלכות הטיפוליות שלה. לדוגמה, חולי סוכרת אוטואימונית חבויה של מבוגרים, המאובחנים בטעות כסובלים מסוכרת סוג 2, ועל כן עלולים לקבל תרופות ממשפחת מעכבי SGLT2 שעלולים לסכנם בחמצת קטוטית.
דוגמה שנייה לחשיבות האבחנה הנכונה היא חולי MODY, אשר גם הם פעמים רבות מסווגים בטעות כסובלים מסוכרת מסוג 2. חולים עם מוטציה בגן לגלוקוקינאז, לדוגמה, יכולים להיות מטופלים פעמים רבות בעזרת שינויי תזונה בלבד. וחולים עם 3 MODY או 1 שמאובחנים בטעות כסוכרת מסוג 1, ניתן פעמים רבות להפסיק אינסולין ולעבור לטיפול פומי בסולפונילאוריאה או מעכבי 4-DPP.
דוגמה שלישית אפשר למצוא בחולי דלקת לבלב כרונית המפתחים סוכרת כסיבוך. מחלתם נראית כסוכרת סוג 2, אולם הטיפול בהם דומה יותר לזה של סוכרת סוג 1, עם שונות גדולה ברמת גלוקוז עקב חסר אינסולין וכן גלוקגון. אחד המצבים הנפוצים יחסית המערימים קושי באבחון הוא חולה צעיר עם סוכרת חדשה שלא ברור האם מדובר בסוכרת מסוג 1 או סוכרת מסוג 2. בין הסמנים שנתן להיעזר בהם לצורך בצוע האבחנה הם: משקלו של החולה, גילו, נוכחות מרכיבים אחרים של התסמונת המטבולית, סיפור משפחתי של מחלת סוכרת - גיל הופעתה והטיפול בה, נוכחות נוגדנים, סיפור אישי או משפחתי של מחלות אוטואימוניות, רמות C-peptide ועוד. אולם למרות כל הנ"ל ישנם חולים שהאבחנה בין סוכרת סוג 1 ל-2 עדיין לוטה בערפל. עבור חולים אלה, כאשר הם מאובחנים לראשונה עם רמות גלוקוז גבוהות מאוד ולעתים קרובות אף תסמיניים, הטיפול הנכון עבורם, לפחות לזמן מוגבל, הוא טיפול באינסולין, ללא קשר לאבחנתם.
- מסיבות אלו, חשוב שהרופא המטפל יהיה מודע לסיווג הסוגים השונים של סוכרת והטיפול המתאים לכל סוג.
דגשים חשובים על סיווג סוכרת
- לאבחון סוג הסוכרת יכולה להיות השפעה מהותית על הטיפול ולכן יש חשיבות לאבחון נכון.
- כ-95%-90% מחולי סוכרת סובלים מסוכרת מסוג 2, כ-5% מסוכרת מסוג 1 ואחוזים בודדים סובלים מסוגים נדירים אחרים.
- בכ-90% מחולי סוכרת מסוג 1a ניתן למצוא נוגדנים באבחנה (נגד GAD, נגד חלבון נלווה אינסולינומה 2, נגד אינסולין, נגד נשא אבץ 8). למספר הנוגדנים, סוג הנוגדנים ולרמתם יש משמעות פרוגנוסטית.
- הדרישות לאבחנה של סוכרת אוטואימונית חבויה של מבוגרים הם: חולים מעל גיל 35, עם נוגדנים חיוביים (לרוב נוגד-GAD) שאינם נזקקים לטיפול באינסולין בחצי השנה הראשונה לאחר איבחונם.
- חשוב לאבחן חולי סוכרת אוטואימונית חבויה של מבוגרים מכיוון שטיפול בסולפנילאוריאה עלול להחיש את החמרת מחלתם ולכן מומלץ להמנע מטפול בסולפנילאוריאה בחולים אלה.
- אבחון גנטי בתחום הסוכרת דרוש בדרך כלל רק בעת חשד לקיומה של תסמונת חד-גנית יחודית.
- סוכרת נעורים המופיעה בבגרות, הן קבוצה מגוונת של תסמונות המתאפיינות בתורשה שלטת, היפרגליקמיה בגיל צעיר (לרוב לפני גיל 25), ונגרמות מפגיעה גנטית יחודית בהפרשת האינסולין.
- חולים הלוקים ב-1-MODY מגיבים בד"כ לטיפול בסולפנילאוריאה אך לעתים נזקקים לטיפול באינסולין. חולים הלוקים ב 2-MODY לעתים קרובות לא נזקקים לטיפול תרופתי כלל ובד"כ לא סובלים מסיבוכי סוכרת.
- כאשר עולה הספק בקשר לאבחנת סוג הסוכרת אצל חולה מסוים יש להיעזר בגילו של החולה בעת האבחנה, משקלו, נוכחות מרכבים אחרים של התסמונת המטבולית, סיפור משפחתי של סוכרת כולל גיל האיבחון והטיפול בה, סיפור אישי או משפחתי של מחלות אוטואימוניות ורמות הגלוקוז וההמוגלובין המסוכרר בעת האבחנה.
- בכל החולים המאובחנים לראשונה עם ערכי גלוקוז קיצוניים ו/או תסמני היפרגלקמיה, ללא קשר לסוג הסוכרת ממנה הם סובלים, יש לשקול טיפול באינסולין, לפחות לתקופה מוגבלת.
ביבליוגרפיה
- ↑ Purnell JQ, Dev RK, Steffes MW, Cleary PA, Palmer JP, Hirsch IB, Hokanson JE, Brunzell JD. Relationship of family history of type 2 diabetes, hypoglycemia, and autoantibodies to weight gain and lipids with intensive and conventional therapy in the Diabetes Control and Complications Trial. Diabetes. 2003 Oct;52(10):2623-9.
- ↑ 2.0 2.1 Diagnosis and classification of diabetes mellitus. American Diabetes Association. Diabetes Care. 2019;42(Suppl. 1):S13-S28.
- ↑ 3.0 3.1 Thomas CC, Philipson LH. Update on diabetes classification. Med Clin North Am. 2015 Jan;99(1):1-16. doi: 10.1016/j. mcna.2014.08.015. Review.
- ↑ DIAMOND Project group. Inceidence and trends of childhood type 1 diabetes worldwide 1990-1999. Diabet Medicine 2006; 23: 857-66.
- ↑ Harjutsalo V, Sjoberg L,Tuomilehto J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet 2008; 371:1777-82
- ↑ 6.0 6.1 Marian Rewers. Challenges in diagnosing type 1 diabetes in different populations. Diabetes Metabolism Journal 2012; 36:90- 97.
- ↑ 7.0 7.1 Borg H, Gottsater A, Fernlund P, Sundkvist G. A 12-year prospective study of the relationship between islet antibodies and beta-cell function at and after the diagnosis in patients with adult-onset diabetes. Diabetes. 2002;51:1754-1762.
- ↑ Naik RG, Palmer JP. Latent autoimmune diabetes in adults (LADA). Rev EndocrMetabDisord. 2003;4(3):233.
- ↑ 9.0 9.1 9.2 Chen W, Chen X, Zhang M, Huang Z. The association of human leukocyte antigen class II (HLA II) haplotypes with the risk of Latent autoimmune diabetes of adults (LADA): Evidence based on available data. Gene. 2021 Jan 30,767:145177. doi: 10.1016/j. gene.2020.145177. Epub 2020 Sep 28.
- ↑ 10.0 10.1 1Ramu D, Perumal V, Paul SFD. Association of common type 1 and type 2 diabetes gene variants with latent autoimmune diabetes in adults: A meta-analysis. J Diabetes. 2019 Jun;11(6):484-496. doi: 10.1111/1753-0407.12879. Epub 2018 Dec 12.
- ↑ 1R. Mishra, M. Akerlund, D.L. Cousminer, E. Ahlqvist, J.P. Bradfield, A. Chesi, K.M. Hodge, V.C. Guy, DJ. Brilion, R.E. Pratley, M.R. Rickels, A. Vella, F. Ovalle, R.l. Harris, O. Melander, S. Varvel, H. Hakonarson, P. Froguel, J.T. Lonsdale, D. Mauricio, N.C. Schloot, K. Khunti, CJ. Greenbaum, K.B. Yderstraede, T. Tuomi, B.F. Voight, S. Schwartz, B.O. Boehm, L. Groop, R.D. Leslie, S.F.A. Grant, Genetic discrimination between LADA and childhood-onset type 1 diabetes within the MHC, Diabetes Care 43 (2020) 418-425.
- ↑ Basile KJ, Guy VC, Schwartz S, Grant SF. Overlap of genetic susceptibility to type 1 diabetes, type 2 diabetes, and latent autoimmune diabetes in adults. Curr Diab Rep. 2014,14(11):550
- ↑ Andersen MK, Sterner M, Forsen T, Karajamaki A, Rolandsson O, Forsblom C, Groop PH, Lahti K, Nilsson PM, Groop L, Tuomi T. Type 2 diabetes susceptibility gene variants predispose to adult-onset autoimmune diabetes. Diabetologia. 2014 Sep;57(9):l 859-68.
- ↑ Lampasona V, Petrone A, Tiberti C, Capizzi M, Spoletini M, di Pietro S, Songini M, Bonicchio S, Giorgino F, Bonifacio E, Bosi E, Buzzetti R; Non Insulin Requiring Autoimmune Diabetes (NIRAD) Study Group.. Zinc transporter 8 antibodies complement GAD and IA-2 antibodies in the identification and characterization of adult-onset autoimmune diabetes: Non Insulin Requiring Autoimmune Diabetes (NIRAD) 4. Diabetes Care. 2010 Jan;33(l):104-8.
- ↑ 15.0 15.1 15.2 15.3 Hawa Ml, Buchan AP, Ola T, Wun CC, DeMicco DA, Bao W, Betteridge DJ, Durrington PN, Fuller JH, Neil HA, Colhoun H, Leslie RD, Hitman GA. LADA and CARDS: a prospective study of clinical outcome in established adult-onset autoimmune diabetes. Diabetes Care. 2014 Jun;37(6):l643-9.
- ↑ Hillman M,Torn C, Thorgeirsson H, Landin-Olsson M. lgG4-subclass of glutamic acid decarboxylase antibody is more frequent in latent autoimmune diabetes in adults than in type 1 diabetes.Diabetologia. 2004;47:1984-1989.
- ↑ VanDeutekom AW, Heine RJ, Simsek S. The islet autoantibody titers: their clinical relevance in latent autoimmune diabetes in adults (LADA) and the classification of diabetes mellitus. Diabet Med.2008;25:117-125.
- ↑ Turner R, Stratton I, Horton V, Manley S, Zimmet P, Mackay IR et al. UKPDS 25: autoantibodies to islet-cell cytoplasm and glutamic acid decarboxylase for prediction of insulin requirement in type 2 diabetes. UK Prospective Diabetes Study Group. Lancet 1997; 350 1288-1293
- ↑ Radtke MA, Midthjell K, Nilsen Tl, Grill V. Heterogeneity of patients with latent autoimmune diabetes in adults: linkage to autoimmunity is apparent only in those with perceived need for insulin treatment: results from the Nord-Trondelag Health (HUNT) study. Diabetes Care 2009; 32:245-250.
- ↑ Buzzetti R, Di PS, Giaccari A, Petrone A, Locatelli M, Suraci C et al. High titer of autoantibodies to GAD identifies a specific phenotype of adult-onset autoimmune diabetes. Diabetes Care 2007; 30:932-938.
- ↑ Maioli M, Pes GM, Delitala G, Puddu L, Falorni A, Tolu F et al. Number of autoantibodies and HLA genotype, more than high titers of glutamic acid decarboxylase autoantibodies, predict insulin dependence in latent autoimmune diabetes of adults. Eur J Endocrinol 2010; 163: 541-549.
- ↑ Zhou Z, Xiang Y, Ji L, Jia W, Ning G, Huang G et al. Frequency, immunogenetics, and clinical characteristics of latent auto- immune diabetes in China (LADA China study): a nationwide, multicenter, clinic-based cross-sectional study. Diabetes 2013; 62: 543-550.
- ↑ Zinman B, Kahn SE, Haffner SM, O'Neill MC, Heise MA, Freed Ml. Phenotypic characteristics of GAD antibody-positive recently diagnosed patients with type 2 diabetes in North America and Europe. Diabetes 2004; 53:3193-3200.
- ↑ Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care. 1997;20(7):l 183-97.
- ↑ 25.0 25.1 Isomaa B, Almgren P, Henricsson M, Taskinen MR, Tuomi T, Groop L et al. Chronic complications in patients with slowly progressing autoimmune type 1 diabetes (LADA). Diabetes Care 1999; 22:1347-1353.
- ↑ 26.0 26.1 Myhill P, Davis WA, Bruce DG, Mackay IR, Zimmet P, Davis TM Chronic complications and mortality in community-based patients with latent autoimmune diabetes in adults: the Fremantle Diabetes Study. Diabet Med 2008; 25:1245-1250.
- ↑ Andersen CD, Bennet L, Nystrom L, Lindblad U, Lindholm E, Groop L et al. Worse glycaemic control in LADA patients than in those with type 2 diabetes, despite a longer time on insulin therapy. Diabetologia 2013; 56:252-258
- ↑ Brophy S, Davies H, Mannan S, Brunt H, Williams R. Interventions for latent autoimmune diabetes (LADA) in adults. Co- chrane Database Syst Rev 2011; 9: CD006165
- ↑ Kobayashi T, Nakanishi K, Murase T, Kosaka K. Small doses of subcutaneous insulin as a strategy for preventing slowly pro- gressive beta-cell failure in islet cell antibody-positive patients with clinical features of NIDDM. Diabetes 1996; 45:622-626.
- ↑ Maruyama T, Tanaka S, Shimada A, Funae O, Kasuga A, Kanatsuka A et al. Insulin intervention in slowly progressive insu- lin-dependent (type 1) diabetes mellitus. J Clin Endocrinol Metab 2008; 93:2115-2121.
- ↑ Yang Z, Zhou Z, Li X, Huang G, Lin J. Rosiglitazone preserves islet beta-cell function of adult-onset latent autoimmune diabetes in 3 years follow-up study. Diabetes Res Clin Pract 2009; 83: 54-60.
- ↑ diabetes patients with glutamic acid decarboxylase antibodies. Diabetologia 2013; 56: S390.
- ↑ Zhao Y, Yang L, Xiang Y, Liu L, Huang G, Long Z et al. Dipeptidyl peptidase 4 inhibitor sitagliptin maintains beta-cell func- tion in patients with recent-onset latent autoimmune diabetes in adults: one year prospective study. J Clin Endocrinol Metab 2014; 99: E876-E880.
- ↑ Johansen OE, Boehm BO, Grill V, Torjesen PA, Bhattacharya S, Patel S et al. C-Peptide levels in latent autoimmune diabetes in adults treated with linagliptin versus glimepiride: exploratory results from a 2-year double-blind, randomized, controlled study. Diabetes Care 2014; 37: E11-E12.
- ↑ Pozzilli P, Leslie RD, Peters AL, Buzzetti R, Shankar SS, Milicevic Z, Pavo I, Lebrec J, Martin S, Schloot NC. Dulaglutide treatment results in effective glycaemic control in latent autoimmune diabetes in adults (LADA): a post-hoc analysis of the AWARD-2, -4 and -5 trials. Diabetes Obes Metab 2018;20:1490-8.
- ↑ Gooderick D, Dashora U, Kumar S. Ketoacidosis in type 2 diabetes-is it type 1 and 1/2 diabetes? BMJ Case Rep. 2011 Aug 11 ;2011.
- ↑ Umpierrez GE, Woo W, Hagopian WA, Isaacs SD, Palmer JP, Gaur LK, Nepom GT, Clark WS, Mixon PS, Kitabchi AE . Immuno-genetic analysis suggests different pathogenesis for obese and lean African-Americans with diabetic ketoacidosis. Diabetes Care. 1999;22(9):151
- ↑ Mauvais-Jarvis F, Sobngwi E, Porcher R, Riveline JP, Kevorkian JP, Vaisse C, Charpentier G, Guillausseau PJ, Vexiau P, Gautier JF. Ketosis-prone type 2 diabetes in patients of sub-Saharan African origin: clinical pathophysiology and natural history of beta-cell dysfunction and insulin resistance. Diabetes. 2004;53(3):645.
- ↑ 39. Maldonado M, Hampe CS, Gaur LK, D'Amico S, Iyer D, Hammerle LP, Bolgiano D, Rodriguez L, Rajan A, Lernmark A, Bala- subramanyam A. Ketosis-prone diabetes: dissection of a heterogeneous syndrome using an immunogenetic and beta-cell functional classification, prospective analysis, and clinical outcomes. J Clin Endocrinol Metab. 2003;88(11):5090
- ↑ Sullivan PW, Morrato EH, Ghushchyan V, Wyatt HR, Hill JO. Obesity, inactivity, and the prevalence of diabetes and diabe- tes-related cardiovascular comorbidities in the U.S., 2000-2002. Diabetes Care. 2005;28(7):1599.
- ↑ Feig DS, Zinman B, Wang X, HuxJE. Risk of development of diabetes mellitus after diagnosis of gestational diabetes. CMAJ. 2008;179(3):229.
- ↑ O'Sullivan JB. Body weight and subsequent diabetes mellitus. JAMA. 1982 Aug 27;248(8):949-52
- ↑ שם הערה43
- ↑ 44. Shai I, Jiang R, Manson JE, Stampfer MJ, Willett WC, Colditz GA, Hu FB. Ethnicity, obesity, and risk of type 2 diabetes in women: a 20-year follow-up study. Diabetes Care. 2006;29(7):1585
- ↑ Butler AE, Janson J, Bonner-Weir S, et al. b-cell deficit and increased b-Cell apoptosis in humans with type 2 diabetes. Diabetes 2003;52(1):102-10.
- ↑ Del Prato S. Role of glucotoxicity and lipotoxicity in the pathophysiology of Type 2 diabetes mellitus and emerging treat- ment strategies. Diabet Med 2009; 26(12):1185-92.
- ↑ Epstein FH, Hoppener J, Ahre'n B. Islet amyloid and type 2 diabetes mellitus. N Engl J Med 2000
- ↑ 48.0 48.1 Stancakova A, Laakso M. Genetics of Type 2 Diabetes. Endocr Dev. 2016;31:203-20.
- ↑ Scott RA, et al. An expanded genome-wide association study of type 2 diabetes in Europeans. Diabetes. 2017;66:2888- 2902. doi: 10.2337/db16-1253.
- ↑ Mahajan A et al;. Fine-mapping type 2 diabetes loci to single-variant resolution using high-density imputation and islet-specific epigenome maps. Nat Genet. 2018 Nov;50(11):1505-1513.
- ↑ 51.0 51.1 Ahlqvist E, Prasad RB, Groop L. Subtypes of Type 2 Diabetes Determined From Clinical Parameters. Diabetes. 2020 0ct;69(10):2086-2093. doi: 10.2337/dbi20-0001. Epub 2020 Aug 25.
- ↑ Shields BM, Hicks S, Shepherd MH, Colclough K, Hattersley AT, Ellard S. Maturity-onset diabetes of the young (MODY): how many cases are we missing? Diabetologia. 2010 Dec;53(12):2504-8.
- ↑ MODY Probability Calculator
- ↑ Yamagata K, Furuta H, Oda N, Kaisaki PJ, Menzel S, Cox NJ, Fajans SS, Signorini S, Stoffel M, Bell Gl.Mutations in the hepato- cyte nuclear factor-4alpha gene in maturity-onset diabetes of the young (MODY1). Nature. 1996;384(6608):458
- ↑ Steele AM, Shields BM, Wensley KJ, et al. Prevalence of vascular complications among patients with glucokinase mutations and prolonged, mild hyperglycemia. JAMA 2014.
- ↑ Hakera AJ, Steele AM, Gloyn AL, et al. Recognition and management of individuals with hyperglycemia because of a het- erozygous glucoki- nase mutation. Diabetes Care. 2015;38(7):1383-1392.
- ↑ Stride A, Ellard S, Clark P, Shakespeare L, Salzmann M, Shepherd M, Hattersley AT. Beta-cell dysfunction, insulin sensitivity, and glycosuria precede diabetes in hepatocyte nuclear factor-lalpha mutation carriers. Diabetes Care. 2005;28(7):1751
- ↑ 4.0stoft SH, Bagger JI, Hansen T, et al. Glucose-lowering effects and low risk of hypoglycemia in patients with maturity-on- set diabetes of the young when treated with a GLP-1 receptor agonist: a double-blind, randomized, crossover trial. Diabetes Care. 2014;37(7):1797-1805.
- ↑ Katra B, Klupa T, Skupien J, et al. Dipeptidyl peptidase-IV inhibitors are efficient adjunct therapy in HNF1A maturity-onset diabetes of the young patients—report of two cases. Diabetes Technol Ther. 2010;12(4):313-316.
- ↑ שפ הערה59
- ↑ Bellanne-Chantelot C, Chauveau D, Gautier JF, Dubois-Laforgue D, Clauin S, Beaufils S, Wilhelm JM, Boitard C, Noel LH, Vel- ho G, Timsit Clinical spectrum associated with hepatocyte nuclear factor-1 beta mutations J. Ann Intern Med. 2004;140(7):510.
- ↑ Kristinsson SY, Thorolfsdottir ET, Talseth B, Steingrimsson E, Thorsson AV, Helgason T, Hreidarsson AB, Arngrimsson R. MODY in Iceland is associated with mutations in HNF-1alpha and a novel mutation in NeuroD!. Diabetologia. 2001 ;44(11):2098.
- ↑ Yeung RO, Hannah-Shmouni F, Niederhoffer K, Walker MA. Not quite type 1 or type 2, what now? Review of monogenic, mitochondrial, and syndromic diabetes. Rev Endocr Metab Disord. 2018 Mar;19(1):35-52.
- ↑ Kahn CR, Flier JS, Bar RS, Archer JA, Gorden P, Martin MM, Roth J. The syndromes of insulin resistance and acanthosis nigri- cans. Insulin-receptor disorders in man. N Engl J Med. 1976;294(14):739.
- ↑ Musso C, Cochran E, Moran SA, Skarulis MC, Oral EA, Taylor S, GordenP.CIinical course of genetic diseases of the insulin receptor (type A and Rabson-Mendenhall syndromes): a 30-year prospective. Medicine (Baltimore). 2004;83(4):209.
- ↑ Ode KL, Moran A. New insights into cystic fibrosis-related diabetes in children. Lancet Diabetes Endocrinol 2013;1(1):52-8..
- ↑ Ezzat S, Forster MJ, Berchtold P, Redelmeier DA, Boerlin V, Harris AG Acromegaly. Clinical and biochemical features in 500 patients. Medicine (Baltimore). 1994;73(5):233.
- ↑ Wermers RA, Fatourechi V, Wynne AG, Kvols LK, Lloyd RVThe glucagonoma syndrome. Clinical and pathologic featurein 21 patients. Medicine (Baltimore). 1996;75(2):53.
- ↑ Stenstrom G, Sjbstrbm L, Smith U Diabetes mellitus in phaeochromocytoma. Fasting blood glucose levels before and after surgery in 60 patients with phaeochromocytoma..ActaEndocrinol (Copenh). 1984;106(4):511.
- ↑ Luna B, Feinglos MN. Drug-induced hyperglycemia. JAMA. 2001 ;286(16):1945 .
- ↑ Kotwal A, Haddox C, Block M, Kudva YC. Immune checkpoint inhibitors: an emerging cause of insulin-dependent diabetes. BMJ Open Diabetes Res Care. 2019 Feb 13,7(1)
- ↑ Akturk HK, Kahramangil D, Sarwal A, Hoffecker L, Murad MH, Michels AW. Immune checkpoint inhibitor-induced Type 1 diabetes: a systematic review and meta-analysis. Diabet Med. 2019 Jun 14.
- ↑ Autoantibodies to GABA-ergic neurons and pancreatic beta cells in stiff-man syndrome. Solimena M, Folli F, Aparisi R, Pozza G, De Camilli P. N Engl J Med. 1990;322(22):1555
- ↑ Taylor SI. Lilly Lecture: molecular mechanisms of insulin resistance. Lessons from patients with mutations in the insulin-re- ceptorgene. Diabetes. 1992;41(11):1473.
- ↑ Baptiste-Roberts K, Barone BB, Gary TL, Golden SH, Wilson LM, Bass EB, Nicholson WK. Risk factors for type 2 diabetes among women with gestational diabetes: a systematic review. Am J Med. 2009 Mar;122(3):207-214
המידע שבדף זה נכתב על ידי
- ד״ר מאיה איש-שלום, מומחית לרפואה פנימית ואנדוקרינולוגיה, רופאה בכירה במכון האנדוקריני, המרכז הרפואי ת"א ע״ש סוראסקי, מאוחדת מודיעין, ומרפאת DMC
- ד"ר עופרי מוסנזון, מומחית לרפואה פנימית ואנדוקרינולוגיה, מנהלת היחידה למחקרים קליניים, יחידת הסוכרת, האגף הפנימי, ביה״ח האוניברסיטאי הדסה עין כרם, ירושלים
- ד"ר מריאלה גלאנט, מומחית לרפואה פנימית ואנדוקרינולוניה, מנהלת את מרכז גלאנט לטיפול בסוכרת, תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 