טיפול ביתר לחץ דם עמיד - מפתוגנזה לפרמקולוגיה
יתר לחץ דם - הנחיה קלינית
מאת ד"ר סוהיר אסדי, ד"ר שוקי לשם, פרופסור אהוד גרוסמן, פרופסור עדי לייבה
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
|
| ||
|---|---|---|
| יתר לחץ דם – אבחנה, טיפול ואיזון פרק 7: טיפול ביתר לחץ דם עמיד - מפתוגנזה לפרמקולוגיה | ||
| ||
| הוועדה המקצועית | האיגוד הישראלי לנפרולוגיה ויתר לחץ דם; החברה ליתר לחץ דם בישראל; האיגוד הישראלי לרפואה פנימית; האיגוד הקרדיולוגי בישראל; האיגוד הישראלי למחלות ילדים; איגוד רופאי המשפחה בישראל; האגודה הישראלית לאנדוקרינולוגיה | |
| עריכה | פרופסור עדי לייבה וד"ר כרמית אלמוג | |
| תחום | נפרולוגיה ויתר לחץ דם | |
| תאריך פרסום | ינואר 2019 | |
| הנחיות קליניות מתפרסמות ככלי עזר לרופא/ה ואינן באות במקום שיקול דעתו/ה בכל מצב נתון | ||
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – יתר לחץ דם מערכתי
לחץ הדם נקבע על ידי מערכת יחסי גומלין בין שחקנים רבים: הכליה, הלב, כלי הדם, והמערכת הנוירוהורמונלית ואלו מושפעים מגורמים גנטיים וסביבתיים. להשמנה, אורח חיים יושבני, ואכילה מופרזת של מלח, תפקיד מכריע ביצירת התהליכים המורכבים המביאים ליתר לחץ דם. לכן שינוי אורחות חיים הוא קריטי בכל שלב, גם בשלבים מוקדמים, בהם לחץ הדם הוא מעט מעל הנורמה. התרומה של עודף משקל, השמנה, תנגודת לאינסולין ותסמונת מטבולית להיוצרות יתר לחץ דם והחמרתו יתוארו בפרק אחר.
בחלק ניכר מחולי יתר לחץ דם יש הפרעה כליתית ראשונית המתבטאת בספיגת מלח מוגברת (sodium retention), או בכיווץ כלי דם בכליה וירידה בסינון הגלומרולרי. בהמשך, עם התפתחות יתר לחץ דם כרוני, מנגנוני פיצוי מורכבים מביאים את הליקויים הכליתיים חזרה לנורמה, וממסכים על הפתולוגיה הכליתית הראשונית, אשר הביאה ליתר לחץ דם[1].
יתר לחץ דם ראשוני הקשור לגיל מבוגר, הפרעה כליתית נסתרת, קשיות עורקים, השמנה, טרשת עורקים, צריכת מלח נתרן גבוהה, צריכה נמוכה של מלח אשלגן, ושתיית אלכוהול מופרזת, עשוי להתפתח עם הזמן ליתר לחץ דם שניוני, בייחוד עם התפתחות נזק כליתי בולט או הופעת היפראלדוסטרוניזם.
בקרת לחץ דם בטווח הקצר
המרכיבים הקובעים את לחץ הדם כפי שמבוטאים בחוק אוהם הם: mean AP= CO X TPR (CO =תפוקת הלב, TPR=תנגודת פריפרית כללית, MAP=לחץ דם עורקי ממוצע). תפוקת הלב נקבעת על ידי : CO=SV X HR (נפח פעימת לב * קצב הלב). נפח הפעימה נקבע לפי הקונטרקטיליות של שריר הלב וההחזר הורידי. בדרך כלל ההחזר הורידי ותפוקת הלב הם זהים, ונקבעים על ידי הפעילות המטבולית של הרקמות. לדוגמה כאשר, בזמן פעילות גופנית או פעילות יתר של בלוטת התריס, עולה הפעילות המטבולית של רקמת השריר, יותר דם חוזר ללב, ובהתאמה תפוקת הלב עולה.
למערכת העצבים הסימפטטית (SNS) ולברורצפטורים, תפקיד עיקרי בבקרה לטווח קצר על לחץ דם. עצבוב כלי הדם והלב מאפשר שינוי לחץ דם תוך שניות על ידי השפעה מכווצת או מרחיבה על כלי הדם או הלב וכן השפעה על קצב הלב.
קיימת גם אוטורגולציה מקומית של זרימת הדם לרקמה בטווח רחב של לחצי דם בהתאם לצרכיה. למשל, לחץ דם גבוה ומתיחת דופן כלי הדם מפעילה וזוקונטריקציה מיוגנית. גם זרימת דם מוגברת מעל צורכי הרקמה גורמת למנגנונים וזוקונסטריקטוריים רקמתיים להשתפעל[2].
מסיבה זו אפילו במצבים שבהם נפח הדם והמלח בגוף עולים, כמו היפראלדוסטרוניזם או העמסת מלח לנבדקים עם הפרעה בתפקוד כלייתי, לאחר שינוי זמני שנמשך מספר ימים, נמצא שתפוקת הלב נותרה די קבועה. וזאת תודות לאוטורגולציה של זרימת הדם על ידי הרקמות[3][4].
בקרת לחץ דם בטווח הארוך
הפעלה חוזרת של הוזוקונסטריקציה הרקמתית המקומית שתוארה לעיל (בעקבות עודף נפח ומלח בגוף) מביאה לשינויים מבניים בכלי הדם, כמו עיבוי דפנות כלי הדם וירידה במספר הקפילרות ־ rarefaction. כך מתאפשרת זרימת דם תקינה לרקמות למרות עלייה בלחץ הפרפוזיה.
בעוד שוויסות לחץ דם בטווח הקצר פועל בייחוד על ידי שינוי תפקוד הלב וטונוס כלי הדם, הוויסות לטווח רחוק קשור קשר הדוק בשיווי המשקל הפנימי של מלח ומים ומכאן של נפח הדם, ולכליה תפקיד ראשי בכך.
רגישות למלח ועמידות למלח
Renal pressure natriuresis - הוא תהליך בו עלית נפח דם משנית להגדלה בצריכת מלח, גורמת לעליית לחץ דם ועליה זו מאפשרת הפרשת עודף המלח והמים. תהליך זה הכרחי לשמירת מאזן הנתרן והמים בנוכחות שינויים בצריכת המלח.
למען הדיוק, אנו יודעים על מאגרי מלח בעור וברקמות נוספות, שאינם שותפים במשוואה "מלח= נפח"[5], ונכון גם שלעיתים באופן זמני ישנן סטיות מהמשוואה "צריכת מלח= הפרשת מלח", אבל בסופו של דבר הכלל נכון, והוא מונע מאיתנו צבירת נוזלים מופרזת ובצקות או שוק היפוולמי—בעיקרון המלח שאנו צורכים בממוצע שווה למלח שאנו מפרישים בממוצע.
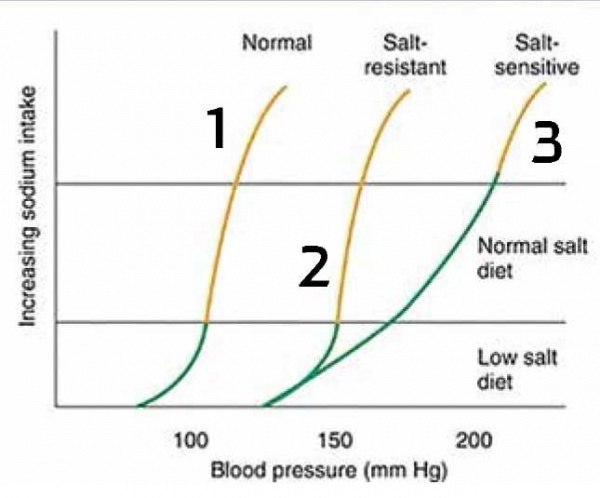
בנבדקים בריאים, כלומר אנשים שהכליה והמערכות הנוירוהורמונליות מתפקדות היטב, עלייה בצריכת המלח גוררת שינוי מינימלי בלחץ דם עם עקומה תלולה אופיינית: כלומר שינוי גדול בצריכת מלח גורר שינוי מינימלי בלחץ הדם (תרשים 1, עקומה 1). הם לא נזקקים לעליית לחץ הדם ול-pressure natriuresis מופרז כדי להפריש את המלח. גם הם יכולים לפתח יתר לחץ דם (כזכור עלייה כרונית בצריכת מלח מביאה לשינוים מבניים בכלי הדם), ואזי לחץ הדם קרוי Salt Resistant Hypertension. קיומו של יתר לחץ דם כרוני מסוג זה מחייב הזזה של עקומת הpressure natriuresis ימינה, ללא שינוי בצורת העקומה, שכן, אם לא כך, בנוכחות לחץ דם גבוה מהרגיל היינו רואים הפרשת יותר מלח ומים שהיו מביאים לירידה בתפוקת הלב ובלחץ הדם (תרשים 1 - עקומה 2).
באנשים שהם "salt sensitive" שבהם יש פגיעה כלשהי בתפקוד כליתי או או בבקרה נוירוהורמונלית (אקטיבציה פתולוגית של מערכות אנטינטריורטיות כמו RAAS (מערכת רנין־אנגיוטנסין־אלדוסטרון) או SNS, מערכת העצבים הסימפטטית), יש צורך להעלות את לחץ הדם כדי להשיג את המטרה הנשגבת של הפרשת כלל המלח - מצב שמצריך לחצי דם גבוהים יותר בכדי לשמור על מאזן הנתרן. שיפוע העקומה של הפרשת מלח לפי לחץ הדם יהיה מתון יותר, בנוסף להסטה ימינה (תרשים מס' 1 - עקומה מס' 3).
מצבים המאופיינים בעליה ברגישות למלח: פגיעה כליתית משנית לסוכרת, יתר לחץ דם ומגוון מחלות כליה אחרות, מוטציות הגורמות לספיגת מלח טובולרית מוגברת, הזדקנות, גזע שחור. הפגיעות הכלייתיות מתחלקות למספר סוגים:
- אובדן מסת נפרונים מתפקדים
- פגיעה לא הומוגנית בתנגודת פרהגלומרולרית
- חוסר יכולת לווסת את מערכת ה-RAAS 4. מוטציות שגורמות באופן ישיר להגברת ספיגת מלח בייחוד בנפרון הדיסטלי[3]
במילים אחרות כל מי שעבר כריתה של חלק מהכליה, אוטם של חלק מהכליה, דלקת טובולואינטרסטיציאלית, הסננת הכליה בתאי דלקת, IgA nephropathy, הידרונפרוזיס, כל אי ספיקת כליות כרונית -־ קשורות ל-salt sensitivity, והרגישות למלח מחמירה ככל שהסינון הגלומרולרי יורד.
למרות הגיוון במצבים המביאים ל"רגישות למלח", כולם מאופיינים ב"ויתור" על לחץ הדם התקין (כלומר עליית לחץ הדם) תמורת היכולת להפריש את כלל המלח שאכלנו. מכיוון שכלל המנגנונים שאמורים להיפטר ממלח לא עובדים, לא נותר אלא להשתמש במנגנון הבסיסי של עליית הלחץ הסיסטמי, עליית הלחץ בעורקי הכליה - ומשנית לה הגברה בהפרשת מים ומלח.
- הבנת מנגנונים אילו חיונית להבנת הצורך בטיפול מושכל במשתנים, במינונים מתאימים, ובפיזור מתאים על פני היממה, כדי להסיט את הנטייה לאצירת נתרן לכיוון השני- טיפול במשתנים הוא הכרחי במצבי יתר לחץ דם עמיד.
מערכת הרנין אנגיוטנסין אלדוסטרון : הפעילות החשובה ביותר של מערכת קריטית זו על הפרשת מלח ווויסות של יתר לחץ דם כרוני היא על ידי אנגיוטנסין II ואלדוסטרון המגבירים ספיגה של מלח.
כאשר מערכת הרנין-אנגיוטנסין-אלדוסטרון עובדת ללא דופי, ניתן לשמור על מאזן נתרן בטווחים מאד גדולים של נתרן בדיאטה, ללא שינויים גדולים בלחץ הדם.
הבעיה מתעוררת כאשר יש פעילות מוגברת של RAAS, ואז נטייה מוגברת לאצור נתרן, נטייה שלא מצליחים לדכא גם כשהמלח/נפח גבוהים[6].
באופן פרדוקסלי גם דיכוי מלא קבוע של הרנין (Liddle syndrome, apparent mineralocorticoid excess, Gordon ,Syndrome, GRA, congenital adrenal hyperplasia, activating MR mutation exacerbated by pregnancy familial hyperaldosteronism) קשור עם salt sensitive HTN. יש כאן אצירת מלח, דיכוי של הרנין, וחוסר יכולת לדכא אותו עוד יותר אם צריכת המלח עולה[6][7].
- מתן מעכבי ACE ,ARB או מעכבי אלדוסטרון, מנטרלים את מערכת ה-RAAS - רנין-אנגיוטנסין-אלדוסטרון, ואף שתרופות אילו מורידות לחץ דם, לחץ הדם הנותר הוא "רגיש למלח". על כן הטיפול יהיה יעיל יותר בנוכחות דיאטה דלת מלח.
אנגיוטנסין II - בנוסף לפעילות מכווצת כלי הדם החזקה, בייחוד כשנפח כלי הדם האפקטיבי נמוך, פעולה אשר עוזרת לשמירת לחץ הדם, יש לו תפקיד עיקרי בוויסות כרוני של לחץ דם על ידי האפקט של אצירת מלח ומים על ידי הכליה. שפעול RAAS בזמן צריכת מלח נמוכה ודיכויה בזמן צריכה מוגברת, מאפשר שינויים מינימליים בלבד בלחץ הדם למרות טווח רחב של צריכת נתרן.
הוא פועל במספר דרכים לספיגת המלח:
- הגברת ספיגת המלח בכליה באופן ישיר. אנגיוטנסין וו גורם ישירות לספיגה מחדש של נתרן על ידי פעולתו על הממברנה הלומינלית והבזולתרלית. בטובולי הפרוקוסמלי הוא מגביר ספיגה מחדש של נתרן על ידי הגברת פעילות ה-Na+/H+ exchangem Na/K+ ATPase. ב-loop of hen הוא מגביר פעילות transportem־Na+/K+/Cl. ישנה השפעה דומה גם על הטובולי הדיסטלי והצינורית המאספת
- הגברת הפרשת אלדוסטרון מהאדרנל
- כווץ הארתריולה האיפרנטית ־ efferent ־ מביאה להקטנת הלחץ ההידרוסטטי הפריטובולרי ומאידך - להגברת ה-filtration fraction והלחץ הקולואידי־אוסמוטי הפריטובולרי. כך מוגברת הספיגה מהטובולי לתוך הקפילרה הפריטובולרית של מלח ומים
פעולות אלו מתווכות על ידי הרצפטור AT1. פעולותיו של AT2 הן הפוכות - נתריורזיס, וזודילטציה וגם עיכוב פרוליפרצית תאים. קיימים תימוכין לכך שאקטיבציה של הרצפטור AT1 בכליה על ידי אנגיוטנסין II היא ההכרחית לשימור יתר לחץ דם כרוני וגרימת היפרטרופיה ולא ההשפעות אנגיוטנסין החוץ־כליתיות (דרך רצפטורים בכלי הדם ואתרים אחרים)[8].
לאנגיוטנסין II מיוחסת פגיעה באיברי מטרה, שהיא דרך פעולה ישירה על הרקמה, בנוסף לפגיעה ההמודינמית הידועה. אולם, מניסויים IN VIVO עולה שפגיעה ישירה זו אינה מתרחשת בהיעדר יתר לחץ דם.
אלדוסטרון: מופרש מקורטקס האדרנל בתגובה לעליית ריכוז אנגיוטנסין II ואשלגן. קישורו לרצפטורים המינרלוקורטיקואידיים (MR) ב-principal cells בטובלי הדיסטלי, מביא לייצור והכנסה של משאבות -+Na+/K ATPase בממברנה הבזולתרלית ושל תעלות נתרן רגישות לאמילוריד בממברנה הלומינלית ומביא לספיגת נתרן והפרשת אשלגן מוגברת. בנוסף לפעולות גנומיות אלו קיימים גם מנגנונים לא גנומיים שקורים תוך דקות, אשר עדיין לא ברורים[9].
אלדוסטרון עודף קשור עם אצירת מלח, ו"צורך" בעליית לחץ דם כדי לאפשר pressure natriuresis, כלומר היוצרות יתר לחץ דם רגיש למלח. גם בנוכחות רמות גבוהות מאוד של אלדוסטרון, לחץ הדם יכול להיות תקין, אם נשמרת צריכת מלח נמוכה. נראה שגם הפגיעה באיברי המטרה המזוהה עם רמות אלדוסטרון גבוהות דורשת צריכת מלח "נורמלית" או גבוהה.
- חוסר היכולת לדכא הפרשת אלדוסטרון בעת שצריכת המלח גבוהה - או היפראלדוסטרוניזם- נראה שכיח, ועל כן טיפול בחוסמי אלדוסטרון הוא טיפול הבחירה ביתר לחץ דם עמיד אמיתי, בחולה המטופל כבר ב-3–4 תרופות, כולל משתנים, במינונים מרביים.
- חולים רבים המגיבים לחסימת Mineralocorticoid Receptor או לאמילוריד הם בעלי עודף משקל או השמנה. השמנה מפעילה את הרצפטור למינרלוקורטיקואידים ואת ה-ENaC ללא קשר לאלדוסטרון.
מערכת העצבים הסימפטטית - SNS
ל-SNS תפקיד חשוב בוויסות לחץ דם: לטווח קרוב, דרך השפעה על כיווץ כלי דם והשפעה כרונוטרופית ויונוטרופית על הלב. לטווח רחוק, דרך המערכת הסימפטטית הכליתית, לה תפקיד חשוב בוויסות של לחץ דם ובפתוגנזה של יתר לחץ דם. אקטיבציה עודפת של ה-SNS הכלייתי גורמת להפרשת רנין מוגברת, ספיגת מלח ו-pressure natriuresis לקוי.
מערכת העצבים הסימפטטית של הכליה היא החוליה המקשרת בין "המערכת האוטונומית" והשפעתה על לחץ הדם ובין "בקרה על המלח והנפח" בגוף.
ידוע שאקטיבציה סימפטטית כליתית קיימת במצבים רבים בהם:
- ביתר לחץ דם באנשים שמנים בייחוד עם השמנה ויסצרלית
- baroreceptors dysfunction - תפקידם של ברורצפטורים בוויסות לחץ דם לטווח ארוך, או ביתר לחץ דם כרוני לא ברור, בשונה מתפקידם המוכח בוויסות לטווח קצר. ייתכן שביתר לחץ דם כרוני יש resetting שלהם לערכי לחץ דם גבוהים יותר, מה שמוריד מחשיבותם. מאידך יש תימוכין רבים שליקוי בבירורצפטורים גורם לשונות גדולה יותר בלחצי הדם. שונות זו, כשלעצמה גורמת לפגיעה באיברי מטרה (כליה, לב, כלי דם)
- Baroreflex Activation Therapy וכן הפחתת לחץ הדם על ידי דנרבציה של עורקי הכליה הן אפשרויות טיפול פולשניות ביתר לחץ דם עמיד והן בעלות היגיון פיזיולוגי. נכון לעת כתיבת מאמר זה לא הוכחה עליונות שלהם על פני טיפול תרופתי מיטבי. גם הצירוף שלהם לטיפול תרופתי מיטבי, אף שמוריד את ערכי לחץ הדם, בעיקר במרפאה ־ יעילותו לטווח הארוך טרם הוכחה.
ביבליוגרפיה
- ↑ Hypertension: A Companion to Braunwald's Heart Disease, by Drs. George L. Bakris and Matthew Sorrentino. third adition.2018. section II, chapter V.
- ↑ Carlstrom M., Wilcox C.S., and Arendshorst W.J.: Renal autoregulation in health and disease. Physiol Rev 2015; 95: pp. 405-511
- ↑ 3.0 3.1 Hall J.E.: Renal Dysfunction, Rather Than Nonrenal Vascular Dysfunction, Mediates Salt-Induced Hypertension. Circulation 2016; 133: pp. 894-906
- ↑ Cowley A.W.: The concept of autoregulation of total blood flow and its role in hypertension. Am J Med 1980; 68: pp. 906-916
- ↑ Linz P., Santoro D., Renz W., et al: Skin sodium measured with. NMR Biomed 2015; 28: pp. 54-62
- ↑ 6.0 6.1 Hall J.E., Guyton A.C., Smith M.J., et al: Blood pressure and renal function during chronic changes in sodium intake: role of angiotensin. Am J Physiol 1980; 239: pp. F271-F280
- ↑ Rossier B.C., Staub O., and Hummler E.: Genetic dissection of sodium and potassium transport along the aldosterone-sensitive distal nephron: importance in the control of blood pressure and hypertension. FEBS Lett 2013; 587: pp. 1929-1941
- ↑ Crowley S.D., Gurley S.B., Herrera M.J., et al: Angiotensin II causes hypertension and cardiac hypertrophy through its receptors in the kidney. Proc Natl Acad Sci U S A 2006; 103: pp. 17985¬17990
- ↑ Funder J.W.: The nongenomic actions of aldosterone. Endocr Rev 2005; 26: pp. 313-321


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק