הדבקויות צפקיות - Peritoneal adhesions
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | כירורגיה של הצפק | |
חתך סתמי בצפק מתרפא עד מהרה, ואינו מותיר אחריו צלקת. רקמה צלקתית בצפק נגרמת עקב חבלות מכניות, איסכמיה, זיהומים, עימדון ורידי, גופים זרים, טלק וכו'. כל אלה עלולים לגרום להידבקויות.
הסכנה העיקרית בהידבקויות היא חסימת מעי, עקב סירכה (Adhesion) הדבוקה למעי ולדופן. סביב סירכה כזו יכול המעי להתפתל ולהיחסם (פתלת - Volvulus). סירכה פיברוטית שמקורה בהידבקות יכולה ללחוץ על לולאת מעי ולחסום אותה, או ליצור מרווח בין הלולאות לדופן הבטן, או בין הלולאות עצמן, שבתוכן יכולה לולאת מעי אחרת להיכלא ולהיחסם (בקע פנימי). הידבקויות רבות בין הלולאות יכולות ליצור פקעת של לולאות מעי המאבדות את גמישותן ואת כושרן להתכווץ, ועקב כך נגרמת חסימת מעי בלתי שלמה. הלולאה שבה מתרחשת החסימה עלולה להינמק, עקב פגיעה באספקת הדם שלה, דבר העלול להסתיים בניקוב המעי, באלח ובמוות. הידבקויות אלה נוטות לחזור, ולכן ההתערבות הכירורגית היא פתרון באין ברירה (על הגישה הטיפולית לחסימת מעי ר' בפרק "המעי הדק").
הידבקויות מתרחשות גם בלא קשר לניתוחים בחולים הלוקים במחלות דלקתיות ראשוניות או משניות של הצפק, כגון דלקת צפק גונוקוקלית, שחפת הצפק או זיהומים נגיפיים אחרים.
מיימת חלבית בחלל הצפק (Chylous peritonitis)
מיימת חלבית (כילוטית) היא הצטברות של נוזל לימפתי ממקור המעי הדק בחלל הצפק, שמראהו חלבי ועכור וריכוז הכילומיקרונים בו גבוה.
מיימת כילוטית אינה מחלה בפני עצמה אלא ביטוי למחלות שרובן כרוניות ומיעוטן חדות. האבחנה נקבעת על פי רמת הטריגליצרידים (יותר מ-200 מ"ג/דל) בנוזל המיימת. הסיבה להיווצרות המיימת החלבית בחלל הצפק היא דליפת נוזל לימפתי חלבי מכלי לימפה קרועים אל חלל הצפק, בקצב הגדול מקצב ספיגתו.
המנגנונים הפתוגניים הכלולים בהתהוות התפליט החלבי כוללים קרע של כלי לימפה ראשיים והפחתה בספיגת הלימפה מסיבות שונות. כיום, שלא כבעבר, שחפת הצפק היא סיבה נדירה לתפליט חלבי, ובבירור אבחנתי יש לשלול תחילה מחלות ממאירות. תפליט חלבי יכול להיגרם עקב קשירת כלי לימפה ראשיים, פציעתם, קריעתם או ניתוקם ממערכת הניקוז הלימפתי לאחר ניתוח כלי דם בבטן וניתוחים לכריתת קשרי הלימפה האחור-צפקיים (רטרופריטוניאליים). קיימים גורמים נדירים נוספים למיימת חלבית שיש לבררם, היות שמקצתם בני תיקון בטיפול הולם.
הסיבות למיימת חלבית
- מיימת חלבית עצמונית
- חסימה לימפתית חיצונית:
- שאתות שפירות או ממאירות.
- חסימת מעי.
- שחמת הכבד.
- פקקת וריד השער.
- טיפול קרינתי.
- חסימה לימפתית פנימית:
- שחפת.
- טפילים.
- פקקת תת-בריחית של וריד עלום השם.
- טמפונדה לבבית.
- אי-ספיקה ימנית.
- שונות:
- חסימה לימפתית חיצונית:
- מיימת חבלתית
- חבלה ניתוחית בכלי לימפה.
- פציעה לא-ניתוחית חודרת.
תסמינים קליניים
החולים מתלוננים על התנפחות פתאומית או איטית של הבטן, מלווה בדרך כלל בכאבי בטן. ברקע יש סיפור של חבלה בטנית קודמת או ניתוחי בטן, בייחוד ניתוחים של כלי דם בבטן או כריתה של בלוטות הלימפה האחור-צפקיות. במקצת החולים יש סיפור של שחפת בעבר, או מחלות כבד, או מחלות כליה.
אבחנה
האבחנה נעשית על-ידי ניקור של נוזל המיימת. נוזל לבן עכור מעורר חשד למיימת חלבית. האבחנה נקבעת לפי רמת הטריגליצרידים והכולסטרול בנוזל ובנסיוב. בדיקת הנוזל לחלקיקי שומן וצביעה בסודן אדום 3. בדיקה ציטולוגית של הנוזל חשובה לזיהוי תאים ממאירים כגורם למיימת. בעל-שמע (אולטרה-סאונד) של הבטן ניתן לראות כמות גדולה של נוזל וכן פתולוגיות שיש בהן כדי לסייע בקביעת הגורם. הטומוגרפיה הממוחשבת עשויה לסייע אף היא בקביעת הגורם. לימפוגרפיה (צילום דרכי הלימפה) מאפשרת הדגמת הדלף לפני הניתוח או בעיצומו.
טיפול
הטיפול השמרני כולל ניקוז המיימת כדי להקל על הנשימה ועל נפיחות וכאבים בבטן, מתן תזונה דלה בטריגליצרידים בעלי שרשראות ארוכות ושימוש בטריגליצרידים בעלי שרשראות בינוניות וקצרות העוברות ישירות מהמעי אל מערכת הדם השערית ומשם לכבד. טיפול פולשני כולל: דלף צפקי ורידי, ניתוח סגירת נצור, קשירת כלי לימפה דולפים או כריתת חלק מהמעי.
טיפול שמרני הוא עדיין טיפול הבחירה, ומרבית החולים מטופלים בהצלחה באורח שמרני. רק אם המיימת נמשכת, יש לשקול התערבות טיפולית. יש לשקול טיפולים מסוג אחר, כגון הזנה תוך-ורידית ועוד, לפי המחלה היסודית.
שאתות (גידולי) הצפק
רוב שאתות הצפק הן משניות-גרורתיות. רק מיעוט השאתות הן ראשוניות, והשכיחה שבהן היא המזותליומה.
מזותליומה של הצפק
המזותליומה הממאירה (Malignant mesothelioma) היא מחלה נדירה וחשוכת מרפא. זו השאת הראשונית היחידה של הצפק. 65% מהמזותליומות מקורן בצדר (פלאורה), 25% בצפק ו-10% בשניהם.
שאת זו צומחת מקרומי גוף פנימיים: כ-80% מן הלוקים במחלה נפגעים בריאותיהם, ומיעוטם (20%-10%) לוקים במחלה בבטן, המכונה מזותליומה צפקית ממארת (Malignant peritoneal mesothelioma). שכיחותה של המחלה הבטנית מוערכת בפחות מ-1:1,000.000 חולים חדשים בשנה, והיא מוגדרת כמחלה תעשייתית, אם כי היא אינה קשורה בהכרח לחשיפה לאסבסט ולתוצריו כמו המזותליומה הריאתית.
פתולוגיה
מזותליומה ממארת צומחת מתאים בעלי פוטנציאל התמיינות רחב (פלוריפוטנטיים) הנמצאים בצפק. מבחינה היסטולוגית יש שלושה סוגים עיקריים של מזותליומות מפושטות:
- הצורה הסרקומטוטית-לייפתית (פיברוטית),
- הצורה האפיתליאלית השכיחה יותר
- הצורה המעורבת.
לעתים קשה האבחנה ההיסטולוגית מגרורת אדנוקרצינומה, עקב הצורה הצינורית-פטמתית (טובולו-פפילטית) של המזותליומה. בצביעות היסטוכימיות אפשר לנצל את השוני בהרכב הריר המופרש מן התאים והמצוי במשתית, כדי להבדיל בין שאתות אפיתליות לצורה האפיתלית של המזותליומה. בצביעות אימונוהיסטוכימיות מסתייעים בנוגדנים כנגד רכיבים שונים, כגון ציטוקראטינים, וימנטין ועוד. במיקרוסקופ אלקטרוני תודגם נוכחות של מיקרו-סיסים (מיקרווילי) רבים מאוד ארוכים ועדינים על קרומי התאים המזותליים.
תסמינים קליניים
המזותליומה שכיחה ביותר בעשורים החמישי והשישי לחיים, מוקדם מעט מגיל הופעתה של המחלה הריאתית. המזותליומה של הצפק תוקפת גברים ונשים במידה שווה.
ההסתמנות הקלינית השכיחה היא:
- כאבי בטן.
- הגדלת נפח הבטן.
- מיימת.
- גוש הנימוש בבטן או באגן (15%).
- לעתים ההופעה הראשונה היא של חסימת מעי חלקית או שלמה.
- ירידה במשקל.
- הפרעות בליעה (דיספגיה).
בכמה מהחולים עלולה המזותליומה ליצור חומרים פעילים, כגון הורמון אדרנוקורטיקוטרופי (ACTH), הורמון גדילה (GH), הורמון עוצר שתן (ADH) וחומרים דמויי אינסולין.
במעבדה אין בדיקות מאפיינות מיוחדות. במקצת החולים ניתן למצוא ריבוי טסיות (תרומבוציטוזיס), תוצרי פירוק של פיברינוגן (FSP) מוגברים. הוכח כי בדיקה ציטולוגית של נוזל המיימת לא תרמה לאבחנה למרות נוכחות תאים ממאירים.
אמצעי הדמיה שונים עשויים לאפשר קביעת אבחנה מבדלת מסוימת, אך אינם מספקים תשובה חד-משמעית. בטומוגרפיה ממוחשבת (CT) מודגמים נוזל מיימת וגושי שאת גדולים. אפשר לנסות לנקר את הגושים כדי לקבל אבחנה לפני טיפול.
אבחנה
האבחנה נקבעת לרוב על סמך פתיחת בטן חוקרת ונטילת דגימה גדולה מהגוש השאתי. רק חולים הלוקים בחסימת מעיים זקוקים לניתוח נרחב יותר. האבחנה המבדלת היא משחפת הצפק, מגרנולומות של טלק או מזריעה משנית גרורתית.
טיפול
תגובת המזותליומות לטיפול אונקולוגי לרוב דלה מאוד. ניסיונות להזרקת תרופות לתוך חלל הצפק נמצאו בעלי השפעה מועטה עקב חדירות לקויה לגושי שאת גדולים ותופעות לוואי קשות. טיפולים משולבים כוללים כריתה, הקרנות חוץ-בטניות או פנים-בטניות ומתן סדרות של כימותרפיה בתרופות, כגון Cisplatin ו-Doxorubicin לתוך חלל הבטן או Doxorubicin ו-Cyclophosphamide בעירוי.
פרוגנוזה
לחולים צעירים סיכוי טוב יותר להישרד. גרורות מופיעות לעתים נדירות ולרוב אינן גורמות למוות. הגרורות הן בדרך כלל לריאות ולכבד ומופיעות בשלב מאוחר. ברוב החולים השאת אינה ניתנת לכריתה. היא מתקדמת מהר ורוב החולים נפטרים בתוך 21-8 חודשים ממועד האבחנה.
Pseudomyxoma peritonei
מחלה זו מאופיינת בהצטברות רבה של ריר בחלל הצפק, המופרש על-ידי שאתות התוספתן או שאתות השחלה. השאתות השכיחות הן: מוקוצלה של התוספתן או מוקואיד אדנומה של השחלה.
התמונה הקלינית כוללת:
- תפיחות הבטן.
- חסימת מעי חלקית.
- ירידה במשקל.
השאת מתפשטת בדרך כלל בתוך הצפק על הסרוזה ואינה שולחת גרורות מרוחקות. הטיפול בחולים אלה הוא ניתוחי. לאחר פתיחת הבטן, יש להוציא כמות גדולה ככל האפשר מהרקמה הג'לטינוזית ולכרות את האומנטום, לשחרר הידבקויות כדי לשחרר את המעי ולכרות את השאת הראשונית. אם אין מזהים את השאת, יש לכרות את התוספתן והשחלות. אם אין אפשרות לסלק את כל המסה בניתוח, יש לצמצם אותה (Mass reduction), כדי להקל על חסימת המעי והמיימת.
לאחר הניתוח אפשר לטפל בחולה ב-Alkeran (Melphalan). חזרת השאת שכיחה כעבור 6 שבועות, ואז יש לבצע פתיחה חוזרת של הבטן. שאת שאינה ניתנת לכריתה יש להקרין. שיעור ההיוותרות בחיים ל-5 שנים הוא 50% ול-10 שנים - 20%.
ציסטה מזנטרית
מדובר בשאת שפירה. החולה מופיע עם גוש ציסטי קבוע בבטן, המכיל בתוכו נוזל. לציסטה אספקת דם נפרדת. כריתה כירורגית שלה היא הטיפול המומלץ. יש להבדיל שאתות אלה מסרקומות של הרטרופריטונאום.
(Mesentric panniculitis (Lipodystrophy
מחלה זו מקורה בניוון שומני כרוני הפוגע ברטרופריטונאום. מבחינה קלינית אפיוניה הם: חום, חולשה, כאבי בטן חוזרים וגוש בבטן. האבחנה נקבעת בניתוח. קשה להבדיל בין מחלה זו לשאתות אחרות של הרטרופריטונאום, או פסאודוציסטה פנקראטית.
בניתוח אין צורך לכרות את הממצא, שכן הוא נסוג עצמונית. מקצת החולים מגיבים היטב לסטרואידים.
צורה נדירה של המחלה, הנקראת retractile mesenteritis, מלווה בלייפת (פיברוזיס) של השומן במזנטריום, הגורמת לרטרקציה של המזנטריום, לחסימה של דרכי הלימפה במזנטריום וכן לחסימה של הוורידים. זו מחלה קטלנית המסתיימת בדרך כלל במות החולה.
קרצינומטוזיס פריטונאלית (Peritoneal Carcinomatosis)
קרצינוממטוזיס פריטונאלית מוגדרת כמחלה שאתית מפושטת של הפריטונאום, שיכולה להיות ראשונית או משנית. המחלה הראשונית היא מזוטליומה של הפריטונאום - מחלה נדירה, שמקורה בתאי הציפוי של הפריטונאום. המחלה המשנית נגרמת על-ידי התפשטות של תאי שאת ממאירה משאת שמקורה באיברי הבטן לפריטונאום כמו: התוספתן, השחלה, הכרכשת (קולון), הקיבה והלבלב, או מאיברים מחוץ לבטן, כמו השד. קרצינומטוזיס פריטונאלית משנית נחשבת למחלה מתקדמת (stage IV), שאין לה ריפוי ובעלת שרידות חציונית של שישה חודשים. הטיפול המקובל ברוב המרכזים הוא טיפול מקל (פליאטיבי): כימותרפיה סיסטמית לעצירת המחלה, וניתוחים מקילים לטיפול בסיבוכים כמו חסימת מעי, ניקוב מעי או דמם.
קבוצת כירורגים אונקולוגיים פיתחה שיטה לטיפול כירורגי אגרסיבי בקרצינומטוזיס פריטונאלית. אחד מחלוצי השיטה הוא Paul Sugerbaker. גישה זו מבוססת על גישה ניתוחית אגרסיבית - כריתה מסיבית של כל הגידולים הנראים לעין בפריטונאום בגדלים שבין מספר מ"מ למספר ס"מ. הניתוחים (cytoreduction) מבוססים על כריתת חלקים נרחבים של הצפק עצמו הנגועים בקשרי גידול (Peritonectomy) לפי חמישה אזורים בבטן: עליון, פריאטלי ימין ושמאל, מרכז ואגן. הכריתה כוללת איברים מעורבים בצורה משמעותית בשאת (מעי דק כרכשת קיבה, טחול ועוד). ניתוחים אלה נמשכים זמן רב (12) ודורשים מיומנות בכריתות טובה לפי כללי הניתוחים האונקולוגים (R0-1). לאחר הניתוח החולים מקבלים טיפול כימותרפי תוך צפקי, שמטרתו לחסל את הקשרים המיקרוסקופים הנותרים לאחר הכריתה הכירורגית. הטיפול יכול להינתן בזמן הניתוח על-ידי שימוש בתמיסה חמה ( 42 מעלות צלסיוס) המכילה תרופות ציטוטוקסיות ומושארת בחלל הבטן בין שעה לשעה וחצי (heated intraoperative chemotherapy intraperitoneal) או מיד לאחר הניתוח למשך 6-5 ימים (early postoperative intraperitoneal chemotherapy). השימוש בתמיסה חמה בזמן הניתוח מעלה את חדירות התרופה לקשרי הסרטן תוך שמירה על רמת נמוכה בפלסמה, דבר המבטיח את הפחתת רעילות הטיפול. עבודות מראות שבטיפול זה השרידות החציונית הממוצעת ארוכה פי 3 מהשרידות בטיפול הרגיל. השרידות לשנתיים היא 50% ולאחר שלוש שנים - 38%. כל זאת במחיר של תחלואה ב-31% מהמנותחים: דלף מהשקות, אילאוס פרליטי ממושך, דמם רב, מורסות ועוד, ותמותה גבוה המגיעה עד כדי 6.8% .
לייפת (פיברוזיס) אחור-צפקית
מחלה זו, כשמה, מלווה בלייפת של הרטרופריטונאום, הפוגעת בדרכי השתן, ולפעמים אף במעי הדק ובכרכשת. המחלה נגרמת קרוב לוודאי עקב רגישות יתר לתרופות, כגון methylsergide, או על רקע של תגובה אוטואימונית. המזנטריום עלול להיפגע אף הוא בתהליך.
התמונה הקלינית דומה לזו של חסימת מעי דק, חסימת הכרכשת וחסימות בדרכי השתן. הטיפול המומלץ במקרים אלה הוא בסטרואידים.
האומנטום
האומנטום חשוב ביותר בהגבלת תהליכים זיהומיים בצפק. הצפק משתתף בתהליכים דלקתיים כרוניים כדוגמת שחפת, או בזיהומים בלתי סגוליים. התמונה הקלינית מתבטאת בכאבי בטן, ובהתעבות ובצקת של האומנטום. במצבים אלה יש לכרות את האומנטום.
אוטם ופתלת (torsion) של האומנטום - מקרים אלה שכיחים בחולים הסובלים מהידבקויות או מהרניאציה של האומנטום. הסתמנויות המחלה הן: כאבי בטן, בחילות, הקאות, רגישות בטנית, ולעתים נימוש גוש בבטן. פקקת של כלי הדם יכולה להיות משנית לפוליארטריטיס נודוזה, וגם אז הטיפול הוא כריתה של האומנטום.
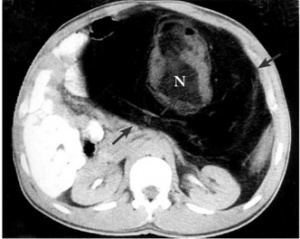
שאתות וציסטות - השאתות הן לרוב משניות ומקורן במערכת העיכול או בגניטליה. ציסטות ראשוניות או אנומליות וסקולריות מתגלות לעתים במקרה בניתוחים מסיבות אחרות. תצלום 3.2 מציג שאת משנית באומנטום (omental cake).
שאתות אחור-צפקיות והרקמות הרכות
שאתות שמקורן ברטרופריטונאום הן: פיברוסרקומות, ליומיוסרקומות, ליפוסרקומות ולימפומות.
התסמינים הקליניים האופייניים לשאתות אלה הם:
- כאבי בטן
- אי-נוחות בבטן
- חום
- מסה בטנית
צילום בטן סקירה המתבצע עקב תפיחות הבטן נראה דחיקה של המעי או הכליות על-ידי המסה. האבחנה מתבצעת על ידי CT בטן בו נתן לראות את המסה האחור צפקית.
רק לעתים נדירות השאתות הן שפירות או בעלות ממאירות מדרגה נמוכה. בשאתות ממאירות, חוץ מהליפוסרקומה, הטיפולים הכירורגיים אינם משיגים תוצאות טובות, ולרוב הניתוחים הם פלאטיביים בלבד. פתיחת בטן חוקרת, ביופסיה, והקטנת המסה השאתית, הם הטיפולים הכירורגיים המקובלים. לאחר הניתוח ניתן להקל על החולים באמצעות טיפולים כימיים והקרנות, המשפרים את ההיוותרות בחיים.
ליפוסארקומה
התיאור הראשון של ליפוסארקומה מיוחס ל-Virchow. זו אחת השאתות השכיחות ביותר מקרב הסארקומות של הרקמות הרכות, ומשקפת 11%-28% מכלל השאתות המשתייכות לקבוצה זו. סארקומה עלולה להתפתח בכל אזור בגוף, אך האזורים השכיחים ביותר להתפתחותה הם הגפיים התחתונים והחלל האחור-צפקי. בסקירה של 3,400 חולים הלוקים בסארקומות של הרקמות הרכות נמצאו 24.1% בעלי פיברוסארקומה ואילו 18.7% היו בעלי שאתות מסוג ליפוסארקומה. סוג זה עלול להופיע בכל גיל, אך שיא שכיחותה בין העשור החמישי לעשור השביעי לחיים, בגברים יותר מאשר בנשים. שאתות אלה ממאירות מעצם התהוותן. מקובל כיום, שליפומות שפירות אינן עוברות תהליך של התמרה ממארת לליפוסארקומה. כשאר הסארקומות של הרקמות הרכות, רוב הליפוסארקומות מופיעות בגפיים התחתונים ובחלל האחור-צפקי. ליפוסרקומה היא שאת שכיחה ביותר ברטרופריטונאום.
בטומוגרפיה ממוחשבת של הבטן ניתן לראות שאת ענקית, המאופיינת לעתים בנמק מרכזי הדוחק את איברי הבטן (תצלום 4.2).
התפשטות גרורתית לקשריות הלימפה האזוריות נדירה בחולים עם ליפוסארקומה ואכן רק בכ-5% מהחולים הלוקים בליפוסארקומה יתגלו קשריות נגועות על-ידי השאת. הגרורות נשלחות בעיקר דרך הדם, לריאות, לכבד ולעצמות.
פתולוגיה
הליפוסארקומות מסווגות ל-3 דרגות התמיינות: ליפוסארקומות בעלות התמיינות גבוהה (myxoid well differentiated) נחשבות כפחות ממאירות או בעלות דירוג נמוך, ולכן מסווגות כ-(1 grade) Gj, ואילו הליפוסארקומות מסוג תאים עגולים-פלאומורפיים הן ממאירות יותר וההיוותרות בחיים לאחר 5 שנים נמוכה יותר, ולכן הן מסווגות כבעלות דירוג גבוה או grade 2-3) G2-3) (טבלה 2.5).
| דרגת ההתמיינות | סוג |
|---|---|
| G1 | ליפומה דמוית ליפוסארקומה |
| G1 | מיקסואיד ליפוסארקומה |
| G2-3 | ליפוסארקומה מסוג תאים עגולים |
| G2-3 | פלאומורפיק ליפוסארקומה |
דרגת ההתמיינות של הסארקומות היא אחד המאפיינים הפרוגנוסטיים, וככל שהדירוג נמוך, כך הפרוגנוזה טובה יותר. הדירוג ההיסטולוגי ומאפיינים נוספים, כגון גודל השאת, התפשטות מקומית, מעורבות קשריות לימפה אזוריות, וכמובן נוכחות גרורות מרוחקות כל אלה יחד קובעים את שלב המחלה. מבחינה היסטולוגית יש שאתות המוגדרות מראש כבעלות דירוג גבוה, לדוגמה רבדומיוסארקומה, ואילו אחרות בעלות דירוג נמוך, לדוגמה dermatofibrosarcoma protuberance.
טיפול
בגישה הטיפולית-ניתוחית בשאתות של הרקמות הרכות חלו כמה שלבי התפתחות, מהגישה הרדיקלית שכללה קטיעות גפיים נגועים בסארקומות לגישה השמרנית יותר הנוקטת כריתה נרחבת של השאת וטיפול בתר-ניתוחי משלים בקרינה ובטיפול כימי. בכמה סדרות, רובן בשנים האחרונות, הוכח שהגישה השמרנית יותר - כריתה נרחבת של השאת, המלווה בטיפול בתר-ניתוחי משלים -השיגה תוצאות מצוינות עם שיעור היוותרות בחיים של יותר מ-80% לאחר 5 שנים. בסדרה מבוקרת היטב של Rosenberg וחבריו לא הוכח, שקטיעה מקנה שיעור גבוה יותר של היוותרות בחיים מאשר בקבוצה שטופלה בגישה שמרנית. יתרה מזו, הוכח שניתן לדחות את מועד הקטיעה לשלב שני לאחר הישנות מקומית של השאת כאשר הטיפול הראשוני נכשל, ואין גישה זו מסכנת או מחמירה את הפרוגנוזה של החולה.
הניסיון המצטבר בטיפול בחולים אלה וניסויים מבוקרים לימדו שהגישה לחולה עם ליפוסארקומה חייבת להתבסס על כריתה בשילוב טיפול משלים בתר-ניתוחי. גישה זו הניבה תוצאות מצוינות בלוקים בסארקומה בדירוג גבוה שהפרוגנוזה שלהם לפני יישום גישה טיפולית זו היתה גרועה.
גישה חדשנית לטיפול בסארקומות של הרקמות הרכות היא זילוח רקמתי מבודד של האזור הנגוע לאחר הכריתה הכירורגית של השאת.
אחת הבעיות הקשות ביותר בטיפול הכימי במחלות ממאירות היא תופעות הלוואי הנגרמות עקב פגיעות ברקמות בריאות, אם התכשיר הכימותרפי ניתן במינונים טומוריצידיים. זילוח רקמתי מבודד יספק תשובה לבעיה זו.
עקרונות השיטה כוללים בידוד מחזור הדם של האיבר המטופל ממחזור הדם הכללי וחיבורו למחזור דם חוץ-גופני מטיפוס משאבה לב-ריאה (extra corporcal pump oxygenator). כך יושגו זילוח וחימום האיבר. כאשר מושגת הטמפרטורה הדרושה, מוחדר התכשיר הכימותרפי למערכת, והזילוח נמשך פרק זמן נוסף. בדרך זו אפשר להגיע לריכוזים טומוריצידיים באזור השאת במיעוט תופעות לוואי כלליות של התרופה. כמו-כן אפשר לחמם את האיבר לטמפרטורות גבוהות יחסית, בלא חשש לנזק רב-מערכתי בגלל חימום-יתר.
האזור האנטומי הנוח ביותר לזילוח בדרך זו הוא הגפיים, בשל האפשרות האנטומית לבידוד מוחלט של מחזור הדם המקומי. ואכן שיטת טיפול זו נמצאת בשימוש נרחב במקרים של שאתות של הרקמות הרכות בגפיים, בעיקר מלאנומה ממארת וסארקומות של הרקמות הרכות. בגפיים התחתונים מבוצע הזילוח דרך כלי הדם הכיסליים (לטיפול בשאתות הממוקמות בברכיים) או כלי הדם המפשעתיים (בשאתות הממוקמות נמוך יותר). צנתרים מוחדרים לעורק ולווריד ובעזרת מערכת צינורות מתחברים למחזור החוץ-גופני. בידוד כלי הדם של הגף מבוצע על-ידי מלחציים חוסמים קריבנית למקום כניסת הצנתרים וחסם הממוקם על שורש הגף. החימום נעשה בעזרת מזרן חימום, העוטף את הגף, וחימום הדם העובר דרך משאבת המחזור החוץ-גופני. כאשר הטמפרטורה מגיעה לרמה הדרושה (93-14 מ"צ), מוחדר התכשיר הכימי ואז מתרחש זילוח למשך כ-60 - 90 דקות. בתום הטיפול מבוצעת שטיפת מחזור הדם של הגף, שנועדה להקטין את כמות התכשיר הכימותרפי שחדר למחזור הדם הכללי עם הסרת בידוד כלי הדם של הגף.
עקרונות טיפוליים אלה יפים לביצוע זילוח באיברים נוספים, כגון הגפיים העליונים, שם מבוצע הזילוח דרך כלי הדם התת-בריחיים. באגן מבוצע הזילוח דרך כלי הדם הכיסליים והוא כרוך בחסימה זמנית של הוותין הבטני, הווריד החלול התחתון וכלי הדם המפשעתיים.
כמויות התכשיר הכימי המגיעות לאזור השאת גבוהות פי 6-5 מהכמות שהיתה מגיעה לו ניתן טיפול מערכתי. המגבלה הכמותית היא גבול הנזק הרעלני הישיר של התכשיר הכימותרפי ברקמות. הנזק נגרם לכלי הדם (vasculitis), לעצבים היקפיים (peripheral neuropathy) ולעור (dermatitis, bullous changes).
תופעות אלו הן זמניות ברובן וחולפות בתוך כמה ימים מתום הטיפול. תופעות הלוואי הכלליות הן מועטות ונמצאות ביחס ישר לדרגת בידוד האיבר. שמירה על לחצי זילוח נמוכים ב-1.5 מ"מ כספית מלחץ הדם במחזור הכללי, מונעת אף היא דליפת התכשיר הכימי ומאפשרת זילוח רקמתי יעיל. דרגת הדלף למחזור הדם הכללי ניתנת למדידה על-ידי החדרת תכשיר רדיואקטיבי למחזור החוץ-גופני ומדידת הרדיואקטיביות בדגימות ממחזור הדם הכללי.
ריכוזי חמצן גבוהים באזור הזילוח הם כנראה בעלי השפעה טומוריצידית ישירה. חימום-יתר (hyperthermia) ידוע כבעל השפעה טומוריצידית ישירה.
דרגת החום הנחשבת יעילה בזילוח רקמתי מבודד היא 39 - 41 מ"צ. דרגת חום החורגת כלפי מעלה ביותר מ-2 מ"צ גורמת נזק רקמתי ישיר לאיבר המטופל, ולעתים נגרם דיכוי של פעילות התכשירים הכימותרפיים המוחדרים למערכת הזילוח הרקמתי המבודד. בידוד האיבר מונע את פגיעת החום באיברים חיוניים.
הגורם העיקרי המשפיע על ריכוז התרופה הוא קצב פירוקה הטבעי. כמו-כן, על התכשיר להיות יציב בדרגות חום גבוהות יחסית. נוסף על כך, התרופה צריכה לפעול מהר בשל משך הזמן הקצר, שבו מתקיים מגע בין התרופה לרקמות. לפיכך, סוגי התרופות המתאימים ביותר לשימוש בזילוח רקמתי מבודד הם alkylating agents ותכשירים אנטיביוטיים. התרופה השכיחה ביותר לשימוש בזילוח רקמתי מבודד בלוקים במלאנומה היא phenylanin mustard. באחרונה, בשל ריבוי יחסי של תופעות לוואי, נערכת בחינה מחודשת של תרופה זו. תרופות אחרות הן actinomycin D, decarbazin וה-cisplatin.
המינון הניתן בזילוח רקמתי מבודד מחושב ביחס לשטח הגוף. במקרי זילוח של גף מחשבים את המינון לפי נפח הגף. הכמות הניתנת היא בדרך כלל 20-10 מ"ג לכל ליטר נפח הגוף.
סיבוכים
סיבוכי זילוח רקמתי מבודד אינם שכיחים. רוב הסיבוכים הם מקומיים וקשורים בפגיעה בכלי הדם המספקים דם לאיבר או בטיפול התרופתי המקומי. הוריות הנגד לביצוע זילוח רקמתי מבודד, בעיקר בגפיים, מתקיימות בכל החולים הלוקים במחלות כלי דם היקפיים או בנוכחות סוכרת קשה.
בקבוצה של 60 חולים שטופלו בזילוח רקמתי מבודד של הגפיים התחתונים דיווח Bulman על שני חולים שלקו בפקקת ורידים עמוקה (DVT) וארבעה אחרים שלקו בחסימת עורק המפשעה בקריש (נדרש טיפול ניתוחי). Stehlin דיווח בסדרה של 175 חולים שטופלו בזילוח רקמתי מבודד על 3 חולים שבוצעה בהם כריתת גף בשל נמק רקמתי נרחב עקב מינון תרופתי מקומי גבוה.
תופעות לוואי כלליות של הטיפול התרופתי יופיעו אם אין בידוד רקמתי יעיל. Krementz דיווח על שכיחות גבוהה, יחסית, של תופעות מקומיות הקשורות בטיפול תרופתי: בצקות והפרעה בתפקוד הגף עקב פגיעה עצבית או שרירית, בקבוצה של 275 חולים שטופלו בזילוח רקמתי מבודד.
פיברוסרקומה - שאת השכיחה ברטרופריטונאום, הפוגעת בשני המינים באופן שווה. היא בעלת קופסית מדומה (pseudo capsule), כאשר תאי השאת חודרים דרכה. שאת זו שכיחה יותר בגפיים התחתונים מאשר ברטרופריטונאום. האבחנה מתבצעת על-ידי ביופסיה פתוחה. בהיסטולוגיה ניתן למצוא בחלקים שונים של השאת תבניות היסטולוגיות שונות.
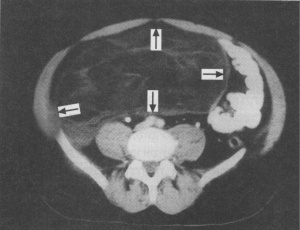
ליומיוסרקומה - שאת בעלת פוטנציאל ממאיר, השכיחה בעיקר ברטרופריטונאום, בייחוד בגילאי 40 - 80 שנה, וגדלה לממדים גדולים מאוד. לשאת זו אין קופסית מגבילה. בטומוגרפיה ממוחשבת אפשר לראות את ממדי השאת הדוחקת את איברי הבטן (תצלום 5.2).
- ראבדומיוסרקומה - שאת זו נחלקת לכמה קבוצות
- rabdomyosarcoma botrioid, השכיחה בילדים עד גיל 15, ומופיעה בעיקר בגפיים ומאחורי העין. שאתות אלה הן פוליפואידיות ושולחות גרורות לקשריות הלימפה. השאת נראית כאשכול ענבים.
שיעור ההיוותרות בחיים למשך 5 שנים הוא 42%. שיעור החזרות המקומיות הוא 14%-18%. - alveolor and pleomorphic rabdomysarcoma, שאתות ממאירות ביותר השולחות גרורות מקומיות, שכיחות יותר בכתף ובעצם השכם (scapula). בהיסטולוגיה יתגלו מיובלסטים עם שריר משורטט ותאי ענק.
סרקומה סינובית - שאת היוצאת מהסינוביה, ומכילה שני מרכיבים: (1) סינוביאל בלסט, (2) פיברובלסט. השאת היא ביפזית. בהיסטולוגיה ניתן לראות מבנה פסיפס (מוזאיקה), עם אזורים קשים וביניהם מבנים ציסטיים נקרוטיים. שאת זו גדלה מהר, ושכיחה יותר בנשים.
שאתות נוירוגניות - שואנומה שפירה או ממאירה, גנגליוניורומה, כרומופינומה ממאירה ואחרות, מדווחות ברטרופריטונאום. השאתות מופיעות לאורך שורשי העצבים, וייתכן שיופיעו כגוש יחיד או כגושים מרובים. הנוירונומות שכיחות יותר בראש ובצוואר, ונדירות יותר ברטרופריטונאום. השאתות נראות כבצל, ואפשר לקלפן בלי לפגוע בעצב.
אנגיומה - מצויה בצורה הקפילרית והקורנוזית, ובצורה הממאירה המאנגיוסרקומה ואנגיופריציטומה. שאת ממאירה ביותר ממקור לימפתי היא הלימפאנגיוסרקומה. רוב שאתות אלה מופיעות לאחר דיסקציה של בלוטות הלימפה, גורמות ללימפאדמה, ואף נוטות לשלוח גרורות לריאות.
שאתות דסמואידיות
לפני כ-150 שנה תיאר Macfarlane בראשונה שאת מסוג דסמואיד. שם השאת נגזר מהמילה היוונית "desmos", שפירושה רצועה או דמוי גיד. השאת נמנית עם השאתות הלייפתיות, ומקורה בשגשוג פיברובלסטי מהשכבות המוסקולו-אפונירוטיות, והיא עלולה להופיע בכל גיל. מבחינה היסטולוגית מורכבת השאת מתאי כישור ארוגים במצע קולאגן, בלא רכיבים אפיתליים, מאופיינת בחלוקת תאים תקינה ובהעדר גרורות מרוחקות. גורמים אטיולוגיים אפשריים כוללים חבלה, בעיקר ניתוחית, השפעות הורמוניות, בעיקר במהלך היריון וליקויים תורשתיים בוויסות רקמת החיבור.
בעבר נחשבה השאת שפירה וניתנת לטיפול פשוט, והוא - כריתה. כיום ברור, שהשאת צומחת במהירות ונוטה לחדירה מקומית ולהישנות מקומית לאחר כריתה. נטייתה לחדירה מקומית מבדילה אותה משאתות שפירות.
השאת יכולה להופיע כחלק מתסמונת Gardner, ויש הסבורים, כי שאת זו בקיר הבטן או בחלל הצפק היא התבטאות חוץ-כרכשתית של פוליפוזיס משפחתי.
דסמואיד משקף כ-0.03% מכלל הסרקומות וכ-3.6% מהשאתות ממקור לייפתי. ההיארעות השנתית של שאת זו היא 3.7 למיליון בני אדם.
המיקום השכיח ביותר של הדסמואיד הוא באזור דופן הבטן (49%). כאן השאת מערבת בעיקר את השריר rectus abdominis. בשכיחות נמוכה יותר (43%) מעורבים אזורים חוץ-בטניים בלא עירוב בולט של שריר כלשהו, ואילו המזנטריום מעורב בשכיחות הנמוכה ביותר - 8%. הדסמואיד שכיח יותר באזורי גוף שנחבלו או הצטלקו בניתוח, וכן בעצם הספנואידית וסביב צנרור עוקף של נוזל השדרה (CSF shunt tubing).
תסמינים קליניים
הדסמואיד מתבטא במעט תסמינים קליניים. התסמין השכיח ביותר הוא הופעת גוש. כאב מופיע בכשליש מהחולים, בעיקר באלה שבהם השאת קרובה לפרקים או מפריעה לתנועת השרירים. חסימת מעיים תיתכן בחולים שבהם השאתות מתפתחות בפדר.
מבחינה קלינית יש 4 קבוצות גיל, לכל קבוצה מאפייני שאת שונים. בקבוצת הילדות (4.5+3.5 שנים), לדוגמה, יש יחס של 3:1 בין מספר הילדות למספר הילדים, והיא מתאפיינת בשכיחות גבוהה יותר של שאתות חוץ-בטניות. בקבוצת הגיל 27+4.4 שנים יש יחס של 1: 1.8 בין בנות לבנים, ושכיחות השאת בדופן הבטן גבוהה פי 11 מאשר באזורי גוף אחרים. בקבוצת הגיל 44+7 שנים קיימות יותר שאתות בדופן הבטן (פי 2.6 יותר מאשר באיברים אחרים), בלא הבדלי מין, ואילו בקבוצת הגיל 68+4.4 שנים השאת ממוקמת בכל חלקי הגוף ובשני המינים באותו יחס.
בחולות רבות (59%-30%) התפתחה שאת הדסמואיד בדופן הבטן אחרי היריונן השני ובמיעוטן אובחנה השאת במהלך השליש האחרון של ההיריון. נמצאו יותר נשים פוריות הלוקות בדסמואיד, ומאופיינות ברמת אסטרוגנים גבוהה ומיעוטן בעלות רמת פרוגסטרון גבוהה. מכאן שגורמים הורמוניים יש בהם כדי לתרום לוויסות הגדילה של דסמואיד. השערה זו נתמכת בתצפיות, שבהן קצב גדילת השאת בבנים היה קבוע בכל קבוצות הגיל, בניגוד לנצפה בבנות. כמות הקולטנים לאסטרדיול גבוהה באורח ניכר מכמות הקולטנים לפרוגסטרון, אך קטנה בהשוואה לקולטני אסטרדיול שבסרטן השד.
במקצת החולים שלקו בדסמואיד אובחנו ליקויים קטנים ורבים במבנה העצם, שכללו עיבוי קליפתי, exostosis, אזורים כיסתיים, איים קומפקטיים בעצם הירך ועוד. בדיקה גנטית העלתה את האפשרות, כי הנטייה לליקויים אלה היא מורשת באופן אוטוסומלי שולטני.
פתולוגיה
מבחינה היסטופתולוגית שאתות אלה הן גושים המאופיינים ברצועות ארוגות של תאי כישור. אלה מכילים כמויות משתנות של קולאגן ולעתים תאי ענק סארקולמיים. ממצאים אלה דומים לממצאים בפיברוסרקומה מדרגה נמוכה (low grade fibrosarcoma). בדסמואיד יש חלוקות תאים מעטות ותקינות, דבר שיכול להסביר תיאורטית את התגובה הדלה של השאתות לטיפול המבוסס על קינטיקת מעגל התא (cell-cycle kinetics).
אבחנה מבדלת
האבחנה המבדלת של דסמואיד כוללת שאתות של הרקמות הרכות (פיברוסרקומות, ליפוסרקומות, ליפומות ועוד). בקעים, בעיקר מסוג Spiegelian hernia, Incisional hernia, עלולים לעוות את התמונה.
שאתות דסמואידיות תוך-בטניות או מזנטריות עלולות להיות מאובחנות בטעות כליפומות או כלייפת אחור-צפקית.
טיפול
הטיפול העיקרי הוא כריתה נרחבת. קרינה כטיפול משלים אפשרית, אם כי יעילותה מוטלת בספק. נוסו בלא הצלחה תרופות אנטינאופלסטיות, סטרואידים, נוגדי דלקת לא-סטרואידיים (NSAID) וטיפולים הורמונליים. לגבי מידת היקף הכריתה עדיין אין נתונים, אך יש עדויות, שהישנות מקומית שכיחה יותר לאחר כריתה לא-מלאה.
ראו גם
- לנושא הקודם: מורסות בצפק
- לתוכן העניינים
- לפרק הבא: כירורגיה של הקיבה והתריסריון
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן, מומחה בכירורגיה, מנהל היחידה לבריאות השד, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק