חומצות אמינו בדם ובשתן - Amino acids
| מדריך בדיקות מעבדה | |
| חומצות אמינו בדם ובשתן | |
|---|---|
| Amino acids | |
| מעבדה | כימיה בדם, כימיה בשתן ובבדיקות נוזל השדרה |
| תחום | הערכת מפגעים מטבוליים-גנטיים |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
מדידה כמותית של רמת חומצות אמינו בדם או בשתן מנסה לזהות פגיעה גנטית-אנזימטית ביכולת הגוף לחילוף חומרים תקין של חומצות אלה. ברוב המקרים הצטברות גבוהה של חומצה אמינית מסוימת או של צבר של מספר חומצות אמינו מצביעה על בעיה במטבוליזם של חומצות אלה, הגורמת להצטברותן. מדידת חומצות אמינו בשתן נדרשת גם בניסיון לאבחון מחלת כליות כגון מחלת Fanconi המתאפיינת על ידי אמינואצידוריה כללית בה כל או רוב חומצות האמינו תופרשנה באופן מוגבר בשתן, או רמה מוגברת של חומצה אמינית ספציפית (לדוגמה רמת ציסטין באלה הסובלים מאבני כליות על רקע ציסטינוריה). לעתים נדרשת הערכת רמת חומצות אמינו לאיתור בעיות של תזונה לקויה, בעיות בטרנספורט או בספיגה של חומצות אמינו ספציפיות, או בעיות קליניות מסוימות הבאות לביטוי ברמה נמוכה של חומצות אמינו מסוימות.
מדידת חומצות אמינו מתבצעת כבדיקת חרום דחופה במקרים של היפר-אמונמיה לא מוסברת, אך גם כבדיקת ברור במקרים של דיאטה דלת חלבון, בניסיון לאתר חסר בחומצות אמינו הכרחיות (essential aminoacids), וכן לאתר מפגעים מיטוכונדריאליים (כגון הצטברות אלנין בפגיעה במטבוליזם של חומצה פירובית). מדידת רמת חומצות אמינו בדם נדרשת במעקב וניטור של הקפדה על במתן דיאטה מיוחדת עם הרכב מופחת של חומצות אמינו מסוימות, כמו בדיאטה דלת חומצות אמינו מסועפות במחלת maple syrup. מטרת המדידה של חומצות אמינו בנוזל השדרה היא בגילוי מפגעים נוירו-מטבוליים, בעיקר באנצפלופתיה מולדת חמורה, או בזיהוי של non-ketotic hyperglycinemia.
בסיס פיזיולוגי
חומצות אמינו הן החוליות המרכיבות את החלבונים, כאשר חלק מהן כגון גליצין, גלוטמאט וחומצה גמא-אמינו-בוטירית מתווכות במערכת העצבים (נוירו-טרנסמיטורים), ואילו חלקן כגון פנילאלנין, טירוזין, טריפטופן וגליצין קשורות לסינתזה של הורמונים פפטידיים, קו-אנזימים, או בסיסים של חומצות גרעין. כל חומצת אמינו היא בעלת מסלול מטבולי ייחודי, וכאשר היא מאבדת בתהליך דה-אמינציה את השייר האמיני שלה, היא הופכת לחומצה אורגנית. אנו מכירים כיום עשרות רבות של חסכים אנזימאטיים במסלולי הפירוק של חומצות האמינו, באופן הגורם להצטברות חומצה אמינית זו או אחרת (aminoaciduria), או להצטברות של חומצה אורגנית מסוימת (organic aciduria). מעבר לכך, קיימות מספר הפרעות בטרנספורט של חומצות אמינו ספציפיות במעי או/ו בכליה (כגון ציסטינוריה ומחלת Hartnup), כמו גם הפרעה אחת בטרנספורט מהליזוזומים (cystinosis). יחד עם זאת יכולים להיות גם מפגעים בהם נמצא חסר בדרגות שונות של חומצה אמינית מסוימת, בעיקר בגין בעיות ספיגה או טרנספורט של חומצה זו במעי, או בשל יצירה פחותה שלה בריאקציות טרנסאמינציה בכבד, וכדומה.
שגיאות מולדות של מטבוליזם של חומצות אמינו יכולות לבוא לביטוי בכל שלב בחיים, אך רובן כבר מאובחנות בגיל רך או אף סמוך מאוד ללידה. תסמינים ספציפיים תלויים בסוג המפגע בחומצת האמינו, כאשר אלה יכולים להתבטא בכשל בשגשוג התינוק (FTT), תסמינים נוירולוגיים, בעיות במערכת העיכול, פיגור לוקומוטורי, ומגוון רחב של ממצאי מעבדה. אי זיהוי של המפגע האמור, או טיפול לקוי בו, עלולים לגרום לפיגור בגדילה, עיכובים התפתחותיים, פיגור שכלי ואף מוות.
חומצות אמינו רבות מסונתזות בגוף וההתייחסות אליהן היא כ"לא חיוניות" (non-essential) במובן שאין חובה לקבל אותן במזון, או ממקור אקסוגני אחר. חומצות אמינו "חיוניות" (essential) חייבות כאמור להגיע במזון, ובכמויות אופטימאליות. לאנליזה של חומצות אמינו יש חשיבות קלינית בהערכת מפגעים נרכשים, כמו בעיות אנדוקריניות, מחלות כבד ושריר, ממאירויות, מפגעים נוירולוגיים, הפרעות אכילה או תזונה לקויה, מחלות כליה וכוויות.
| חומצת אמינו | מבוגרים | ילדים |
|---|---|---|
| אלנין | 230-510 | 200-450 |
| ח' אלפא אמינו בוטירית | 15-41 | 8-37 |
| ארגינין | 13-64 | 44-120 |
| אספרגין | 45-130 | 15-40 |
| ח' אספרטית | 0-6 | 0-26 |
| בתא אלנין | 0-29 | 0-49 |
| ציטרולין | 16-55 | 16-32 |
| ציסטין | 30-65 | 19-47 |
| ח' גלוטמית | 18-98 | 32-140 |
| גלוטמין | 360-650 | 420-730 |
| גליצין | 170-330 | 110-240 |
| היסטידין | 26-120 | 68-120 |
| הידרוסיפרולין | לא מתבצע | 0-5 |
| איזולאוצין | 42-100 | 37-140 |
| לאוצין | 66-170 | 70-170 |
| ליזין | 150-220 | 120-290 |
| מתיונין | 16-30 | 13-30 |
| 3-מתיל-היסטידין | 0-64 | 0-52 |
| אורניטין | 27-80 | 44-90 |
| פנילאלנין | 14-68 | 26-86 |
| פוספו-סרין | 0-12 | 0-12 |
| פוספו-אתנול אמין | 0-55 | 0-12 |
| פרולין | 0-55 | 130-290 |
| סרין | 56-140 | 93-150 |
| טאורין | 45-130 | 11-120 |
| תראונין | 92-240 | 67-150 |
| טירוזין | 45-74 | 26-110 |
| ואלין | 150-310 | 160-350 |
| טריפטופן | 25-73 | 22-60 |
חומצות אמינו הכרחיות
חומצות אמינו שאין הגוף יכול לסנתז בעצמו, ולכן יש לקבלן במזון. מקובל ש-9 חומצות האמינו ההכרחיות הן: היסטידין, לאוצין, איזו-לאוצין, ליזין, מתיונין, פנילאלנין, טראונין, טריפטופן, ואלין. בנוסף, חומצות האמינו ציסטאין, טירוזין וארגינין נדרשות על ידי תינוקות בגיל הרך, ועל ידי ילדים בגיל הצמיחה. בנוסף, גם חומצות האמינו ארגינין, ציסטאין, גליצין, גלוטאמין, היסטידין, פרולין, סרין וטירוזין, נחשבות כחומצות אמינו הכרחיות בתנאים מסוימים (conditionally essential), במובן שבאופן נורמאלי הן אינן נדרשות במזון, אך יש לספק אותן באופן אקסוגני לאוכלוסיות מיוחדות ומסוימות שאינן מסנתזות אותם בכמות מספקת. לדוגמה, אלה עם פנילקטונוריה (PKU), בהם יש אמנם לשמור על רמה נמוכה של פנילאלנין למניעת פיגור שכלי וסיבוכים מטבוליים אחרים, אך כיוון שאנשים פנילקטונוריים אינם יכולים לסנתז טירוזין מפנילאלנין בגלל חסר באנזים הרלוונטי, יש צורך לכלול טירוזין בפורמולה המיוחדת שלהם.
פרט לכך, יש לציין שמספר חומצות אמינו יכולות להיות מיוצרות במטבוליזם של חומצות אמינו אחרות. לדוגמה, חומצות האמינו הנושאות גפרית מתיונין והומוציסטאין, מיוצרות אחת על ידי רעותה במעגל של דה-מתילציה/רה-מתילציה, אך אף לא אחת מהן יכולה להיות מיוצרת על ידי הגוף עצמו בבני אדם. בדומה, ציסטאין יכול להיווצר מהומוציסטאין אך לא יכול להיווצר בעצמו בגוף. דוגמה אחרת היא של ארגינין, אורניטין וציטרולין, הנוצרים אחת מן האחרת במסגרת מעגל האוריאה.
| חומצת אמינו | מ"ג למשקל 70 ק"ג |
|---|---|
| היסטידין | 700 |
| איזולאוצין | 1400 |
| לאוצין | 2730 |
| ליזין | 2100 |
| מתיונין+ציסטאין | 1050 (728+322) |
| טירוזין+פנילאלנין | 1750 |
| טראונין | 1050 |
| טריפטופאן | 280 |
| ואלין | 1820 |
מקובל שבתינוקות בשנת החיים הראשונה, בילדים עד גיל 12 שנה, ובמבוגרים, חומצות האמינו ההכרחיות יהוו 43%, 36% ו-10%, בהתאמה, מסך הצריכה היומית של חומצות אמינו.
פענוח תוצאות הבדיקה
ריכוזי חומצות אמינו בדם מראים תנודות בולטות במהלך היממה (circadian rhythm) עד כדי הפרשים של 30%, כאשר רמות חומצות אמינו גבוהות יותר בשעות אחר הצהריים, ונמוכות ביותר בשעות הבוקר המוקדמות. לכן יש להקפיד על נטילת דם או דגימת שתן במועדים קבועים. למרות שאכילת מזון חלבוני אינה משפיעה על התנודות המתוארות ברמת חומצות האמינו בדם ובשתן, יש לה השפעה ניכרת על רמה זו. לדוגמה, לאחר שעה אחת של צום, מבוגרים מפרישים בשתן בכמות המהווה רק 51% בממוצע מכמות חומצות האמינו שמופרשת ללא צום.
בשתן של מבוגר בריא בולטות ביותר חומצות אמינו כגון גליצין, סרין, אלנין, גלוטמין, היסטידין ו-ביתא-אמינו-חומצה בוטירית. בצרכנים של דיאטות עתירות בשר מוצאים בשתן רמה מוגברת של carnosine ושל מתיל-היסטידין. בשתן של יילודים בולטת חומצת האמינו taurine.
רמת חומצות אמינו בדם מוגברת בדרך כלל במצבים של סוכרת עם קטוזיס, במצבי ספיגה לקויה (כתוצאה מפירוק מוגבר של חלבונים ברקמות ליצירת מלאי חומצות אמינו), באי סבילות מולדת של פרוקטוזה, במצבי נזק כקשה לכבד, בתסמונת Reye, בתסמונת Lowe (תסמונת אוקולו-צרברו-כלייתית), בכשל כרוני וחריף של הכליות, באקלמפסיה, במצבי הלם, בכוויות, ובאמינואצידוריות ספציפיות.
רמת חומצות אמינו בדם מופחתת בתסמונת נפרוטית, במחלת Hartnup, בתסמונת קרצינואידית, בפנקראטיטיס חריפה, בגלומרולונפריטיס או במחלה פוליציסטית של הכליות, בתזונה לקויה, בפעילות יתר של בלוטת האדרנל, בדלקת פרקים שגרונית, בתסמונת Huntington.
רמת חומצות אמינו בשתן מוגברת במצבים של הפאטיטיס נגיפית, בתסמונת Fanconi, בסוכרת עם קטוזיס, בכשל כרוני של הכליות, במחלת Hartnup, בתלסמיה מאיור, בדיסטרופיה מתקדמת של השרירים, בנמק ובצמקת הכבד, בצירוזיס מרתי, ב-multiple myeloma, בהיפר-פארא-תירואידיזם, בגלקטוזמיה, באי-סבילות מולדת של פרוקטוזה, בציסטינוזיס, במחלת וילסון, באוסטיאומלציה, ברככת עצמות על רקע חסר ויטמין D, ברככת עצמות על רקע עמידות לוויטמין D, באמינואצידוריות ספציפיות.
השפעת תרופות על רמת חומצות אמינו
תרופות המעלות רמת חומצות אמינו בדם: מלחי ביסמוט (השפעה טוקסית), גלוקוקורטיקוסטרואידים, levaterenol, טסטוסטרון בגיל המתקדם, 11-אוקסי-סטרואידים.
תרופות המפחיתות רמת חומצות אמינו בדם: אסטרוגנים (מעלים חומצות אמינו ספציפיות בגברים), אפינפרין, גלוקוזה (משפיעה על מספר חומצות אמינו), גלולות למניעת הריון, פרוגסטרון (משפיע בגברים), secretin ו- cerulein.
תרופות המעלות רמת חומצות אמינו בשתן: אספירין, ביסמוט, קורטיקוטרופין, הידרוקורטיזון, isofamide, אינסולין, עופרת (השפעה טוקסית), triamcinolone.
תרופות שהשפעתן היא על הריאקציה שבה מגיב נינהידרין עם חומצות אמינו באופן שעלול לתת תוצאות מוגברות בבדיקת חומצות אמינו בשתן: אמפטמינים, אמפיצילין, דופאמין, מתילדופה, נאומיצין, קנאמיצין, גנטמיצין, colistin, אפדרין, אפינפרין, cephalexin, חומצה אמינו-קפרואית, phenacetin, פניצילאמין, פולימיקסין, levodopa ,ethylenediamine ,mafenide ,phenylephrine ,levarterenol, חומצה הידרוקסי-אמינו-בוטירית, methamphetamine ,normetanephrine ,phenylpropanolamine.
אמינואצידוריות-מפגעים במטבוליזם של חומצות אמיניות
אמינואצידופתיות נובעות בדרך כלל מאי-סדירות בקטבוליזם של חומצות אמינו בציטוזול של התאים. בנוסף, חסר של מספר אנזימים מיטוכונדריאליים כגון branched-chain ketoacid dehydrogenase הגורם למחלת maple syrup, או ornithine amino-transferase deficiency הגורם למפגע הקשה בעיניים הידוע כ-gyrate atrophy of the choroid, מסווגים כ-aminoacidopathies, שכן הם אינם כרוכים במטבוליטים המשופעלים על ידי קו-אנזים A. בכך נבדלים aminoacidopathies מהצטברות של חומצות אורגניות (organic acidurias), כאשר האחרונות מייצגות פגיעה באנזימים מיטוכונדריאליים או פגיעה במטבוליטים המשופעלים על ידי קו-אנזים A, הפוגעים בתפקודים מיטוכונדריאליים נוספים.
התסמינים הקליניים של אמינו-אצידוריות נובעים מהצטברות של תוצרי ביניים רעלניים, כמו לדוגמה פניל-אלנין, פניל-חומצה פירובית, פניל חומצה לקטית, או פניל חומצה אצטית בפניל-קטונוריה, הפוגעים באופן ספציפי במוח. יש מספר פגמים במטבוליזם של חומצות אמינו, כמו לדוגמה בהיסיטידינמיה, הנחשבים שפירים כיוון שחומר הביניים המצטבר אינו רעיל.
רוב האמינו-אצידוריות ברות טיפול על ידי הגבלות בדיאטה של חלבונים או של חומצות אמינו המצטברות במפגעים השונים. אסטרטגיה טיפולית אחרת שהוכחה כיעילה לדוגמה בטירוזינמיה עם פגיעה בכבד ובכליות, היא על ידי עיכוב השלב הביוכימי המקדים את אותו שלב בו קיים חסר אנזימי כתוצאה מהפגיעה הגנטית. בכך ניתן להסב את הפגיעה הקלינית כתוצאה מהצטברות חומצה אמינית רעלנית, לחומצה אמינית אחרת שהיא שפירה יותר ופחות רעלנית. ברוב האמינו-אצידוריות המוח הוא האיבר שנפגע בשכיחות הגבוהה ביותר, כאשר אחריו ממוקמים הכבד והכליה מבחינת דרגת הנזק הנגרמת להם.
שכיחותן של כל אחת ממחלות אלה היא נדירה ונעה בין 1 ל-10,000 של פנילקטונוריה, או ציסטינוריה ועד 1 ל- 200,000 של הומוציסטנוריה, או אלקפטונוריה, אך כקבוצה שכיחותן במקובץ היא כ-1 לכל 2,000 לידות. התורשה שלהן היא ברוב המוחלט של המקרים אוטוזומית-רצסיבית.
פגם במטבוליזם של פרולין
- Prolidase deficiency-מחלה אוטוזומאלית רצסיבית מולדת נדירה הנובעת מחסר באנזים prolidase, ומתבטאת בכיבי עור קשים, תווי פנים חריגים, חריגה כרונית של מפרקים, הדבקות חיידקיות ופיגור שכלי. בשתן הפרשה גדולה של iminodipeptides. המוטציה היא בגן PEPD על כרומוזום q13.1119
- Hyerprolinemia-מפגע אוטוזומאלי רצסיבי הנוצר כתוצאה מהצטברות פרולין ברמה גבוהה כתוצאה מחסר באנזים proline oxidase או בחסר האנזים pyrroline-5-carboxylate dehydrogense. ב- Hyperprolinemia type I יש מוטציה בגן PRODH המקודד לאנזים proline oxidase המתחיל את תהליך הפיכת פרולין ל- pyrroline-5-carboxylate. אלה עם type I הם ברובם א-תסמיניים, ורמת פרולין בדמם היא פי-3 עד 10 מהרמה התקינה. חלק קטן בהם סובלים מפרכוסים או מפיגור שכלי.
ב- Hyperprolinemia type II רמות פרולין בדם גבוהות פי-10 עד פי 15 מהרמה התקינה, בנוסף לתוצר הביניים pyrroline-5-carboxylate, וכאן המוטציה היא בגן ALDH4A1 המקודד לאנזים 1-pyrroline-5-carboxylate dehydrogenase, ההופך pyrroline-5-carboxylate ל-גלוטמין. בדומה ל-type I, גם אלה עם type 2 הם ברובם א-תסמיניים, ומיעוטם עלולים לסבול מפרכוסים, התכווצויות או מפיגור שכלי.
פגם במטבוליזם של היסטידין
- histidinemia (קרוי גם histidinuria), מפגע מטבולי אוטוזומאלי-רצסיבי נדיר הנגרם בחסר האנזים histidase. במפגע זה נמצא כמויות מוגברות של היסטידין, היסטאמין ו-imidazole בפלזמה, בשתן ובנוזל השדרה. למרות שהוא עשוי להיות ללא תסמינים משך שנים אחדות, תסמינים מופיעים בגיל צעיר יחסית כולל היפר-אקטיביות, פגיעה בדיבור, פיגור התפתחותי הפרעה בכושר הלימוד, ולעתים אף בפיגור שכלי. ביפאן, היסטידינמיה נחשבת למפגע המולד השכיח ביותר.
- Urocanic aciduria או urocanase deficiency, מפגע אוטוזומאלי רצסיבי הנגרם מחסר האנזים urocanase. חומצת האמינו היסטידין מתפרקת על ידי האנזים histidase, ליצירת acid urocanic, ובחסר אנזים זה גורם ל-histidinemia. במפגע זה רמות נמוכות של חומצה אורוקנית בעור ובנסיוב, המדד העיקרי לחסר histidase. לעומת זאת, ב-urocanic aciduria רמה מוגברת של חומצה אורוקנית בשתן מצביעה על חסר urocanase, המפרק חומצה אורוקנית ליצירת formininoglutamic acid. זהו תרחיש שפיר יחסית אם כי דווחו בו לעתים על התנהגות אגרסיבית ופיגור שכלי.
- Carnosinemia או carnosinase deficiency, מפגע מטבולי אוטוזומאלי רצסיבי נדיר הנגרם מחסר באנזים carnosinase המפרק את הדו-פפטיד קרנוזין (המורכב מביתא אלנין והיסטידין. חסר זה יביא לרמת יתר של קרנוזין בשתן, בנוזל השדרה בדם ובמערכת העצבים ולתסמינים נוירולוגיים כגון היפוטוניה, פיגור התפתחותי, פיגור שכלי, ניוון של אקסונים, רעד, דה-מיאליניזציה, אנומליה בחומר האפור, פרכוסים מיוקלוניים, ואובדן של סיבי פורקיניה. הגן CNDP1 המקודד לאנזים carnosinase ממוקם על כרומוזום 18.
פגם במטבוליזם של ארגינין
- Argininemia-ידוע גם כ-arginase deficiency, מפגע אוטוזומלי רצסיבי של מעגל האוריאה, בו חסר האנזים arginase גורם להצטברות ארגינין ואמוניה בדם. המוטציה הגורמת למפגע זה היא בגן ARG1. האנזים ארגינאזה מפקח על השלב האחרון במעגל האוריאה, בו נוצרת אוריאה על ידי הרחקת חנקן מארגינין. פגם באנזים מונע יצירת אוריאה ומביא להצטברות עודף חנקן בדם בצורת אמוניה. המפגע בדרך כלל מתחיל להופיע בגיל 3 ברוב המקרים כנוקשות בעיקר ברגליים, כתוצאה מספסטיות שרירים. תסמינים אחרים כוללים האטה בגדילה, פיגור התפתחותי, פיגור שכלי, פרכוסים, רעד, ושיגשון (אטקסיה). פרקי זמן בהם יש דיאטה עתירת חלבון או עקה הנגרמת עקב צום עלולה להגביר הצטברות אמוניה בדם ולהוליך לאפיזודות של רוגז, סרוב לאכול ולהקאות. יש מקרים בהם ארגינינמיה מופיעה בצורה יותר מתונה, ומופיעה בשלב מאוחר יותר. בנוסך ליתר אמוניה שעלולה לגרום לתסמינים נוירולוגיים, גם ההצטברות של מטבוליטים של guanidine עלולים לתרום לנוירוטוקסיות במפגע זה.
- Argininosuccinic aciduria וכן argininosuccinic acidemia, הוא מפגע מולד אוטוזומלי רצסיבי בו יש הצטברות של חומצה ארגינו-סוקצינית בדם ובשתן, כאשר תיתכן גם עלייה ברמת אמוניה כבר בימי החיים הראשונים, ומכאן אפשרות לנזק למערכת העצבים. המפגע מופיע ב-1 ל-70,000 לידות-חי, ועשוי להתגלות כתוצאה מרמת ציטרולין מוגברת בדם. הגן הפגום ASL והמפגע שייך למפגעי מעגל האוריאה, כתוצאה מפגם באנזים arginino succinase שתפקידו להפוך arginino succinate לארגינין במעגל האוריאה, וכך נמנעת התקדמות הריאקציות במעגל וחנקן מצטבר בדם כאמוניה ומכן נגרם נזק בנוסף למערכת העצבים גם לכבד. תינוקות עם מפגע זה נראים לתרגיים, מסרבים לאכול, בעלי קצב נשימה לא מווסת, וכן שינויים בטמפרטורת גוף, פרכוסים ותנועות גוף לא רגילות ועלולים להגיע לשלב של תרדמת. בנוסף עלול להופיע פיגור התפתחותי, פיגור שכלי, ונזק לכבד, לעור ולשיער.
מפגעים במטבוליזם של ואלין
- Valinuria וכן Isobutyryl-coenzyme A dehydrogenase deficiency או IBD deficiency, מפגע מטבולי אוטוזומלי רצסיבי נדיר, בו חסר באנזים שאמור לפרק את חומצת האמינו valine, מביא להצטברות גדולה של חומצה זו בדם ובשתן. המוטציה היא בגן ACAD8 המקודד לאנזים האמור. תינוקות נושאי פגם זה בריאים בדרך כלל בלידה, והתסמינים המתגלים מאוחר יותר מתבטאים בהזנה גרועה , הפרעה בשגשוג (FTT), לב מוגדל ומוחלש (dilated cardimyopathy), פרכוסים אנמיה, ורמת קרניטין נמוכה במיוחד. התסמינים מחמירים לאחר תקופת צום ארוכה, או בעקהות הדבקות בפתוגנים, בגלל הצורך המוגבר של הגוף באנרגיה. לעומת זאת, ידוע על אלה עם מוטציות בגן האמור שאינם חווים כל תסמינים קליניים.
- Hypervalinemia, מפגע אוטוזומלי רצסיבי נדיר בו מוצאים בשתן ובנסיוב רמות גבוהות של valine, אך לא של חומצות האמינו המסועפות לאוצין ואיזו-לאוצין. המפגע נגרם מחסר האנזים valine transaminase, ומתבטא בתינוקות בחסר תיאבון, הקאות, התייבשות וכשל שגשוגי.
- מחלת מייפל סירופ (Maple Syrup Urine Disease - MSUD) היא מחלה תורשתית רצסיבית קשה שסימניה הם הידרדרות נוירולוגית, חמצת מטבולית ושתן בעל ריח הדומה לסירופ מייפל או לחילבה כאשר חומר הריח הוא sotolon.
ב-MSUD יש הצטברות של חומצות אמינו מסועפות השרשרת (Branched-chain amino acid) לאוצין, איזולאוצין וואלין הנחשבות חומצות אמינו חיוניות. המחלה נגרמת כתוצאה מפגם גנטי בקומפלקס אנזימים המפרקים חומצות α-קטו מסועפות שרשרת (Branched-chain alpha-keto acid dehydrogenase complex או BCKDC). הפגם הגנטי יכול להיגרם באחד מהגנים הבאים: BCKDHA, BCKDHB, DBT או DLD. כאשר קומפלקס מפרקי חומצות α-קטו מסועפות שרשרת מתפקד באופן פגום, עלולה להיות הצטברות רעילה של חומצות אמינו מסועפות שרשרת (לאוצין, איזולאוצין, ואלין) בדם ובשתן. שכיחות המחלה היא 1 מ-180,000 לידות. אולם המחלה שכיחה יותר בקרב יהודים, בין היתר בגלל אפקט המייסדים. שכיחות המוטציה הנבדקת היא 1:113 ביהודים ממוצא אשכנזי.
פגיעה במטבוליזם של טריפטופן
- היפרטריפטופנמיה-מפגע מטבולי אוטוזומלי רצסיבי נדיר בו רמה גבוהה במיוחד של טריפטופן בדם, המגיעה לעתים לרמה הגבוהה ב-650% מעל סף הנורמה העליון של חומצת אמינו זו שהוא 73 מיקרומול' לליטר. במפגע זה שלא התגלתה בו עדיין המוטציה בגן האחראית להיפרטריפטונמיה, מוכרים פגמים במפרקים ובשרירים, הגורמים לקשיות במפרקים שונים במרפקים ובפרק האמצעי של האצבעות והבוהנים, נטיית האצבעות לנטות לכיוון אמת היד הפנימית (ulna), חולשה וכאבי פרקים, ותנוחה חריגה של הבוהן המכונסת אל תוך כף היד כתוצאה מפגיעה בשריר adductor pollicis. בהיפרטריפטופנמיה מכירים גם אי-סדירות התנהגותית כמיניות מוגברת, רגישות-יתר תחושתית, אי-יציבות רגשית ושינויים תכופים במצבי-רוח, היפר-אגרסיביות, עיניים פעורות לרווחה, פזילה ובעיות ראייה.
עודף טריפטופן מביא כצפוי להפרשה מוגברת של indole ו-indoleic acids בשתן, מה שיכול להסביר פגם במסלול בו אמור טריפטופן להפוך ל-kynurenine. טריפטופן, חומצת אמינו הכרחית, חיונית לסינתזה של חלבונים, וחלקה עוברת בעיקר מטבוליזם לקינורנין ברוב הרקמות כולל המוח ומערכת העצבים המרכזית. אחד הקינורנינים, kynurenic acid, משמש כגורם המגן על מערכת העצבים בכך שהוא פועל כאנטגוניסט בקולטנים הניקוטיניים ובקולטני גלוטמאט במוח. בכך הם בולמים את הפעילות הנוירו-טוקסית של quinolinic acid שהוא אגוניסט של קולטנים אלה, ואשר גורם להשפעה ניוונית של תאי עצב כמו במחלת Huntington. כך שפגיעה ביצירת חומצה קינורנית מטריפטופן, עלולה לאפשר פעילות נוירוטוקסית של חומצה קוינולינית. גם היצירה העודפת של indoleic acid בהיפרטריפטופנמיה, עלולה להשפיע על תפקוד נוירוני ולהשפיע על ההתנהגות כפי שפורט, שכן חומצה אינדולאית מגיבה עם תעלות נתרן שהן voltage dependant, ומשנה בכך מדדים של פוטנציאל פעולה בסינפסות. - מחלת Hartnup-מפגע מטבולי אוטוזומלי רצסיבי המשפיע על יצירת טרנספורטר הקשור לספיגת חומצות אמינו לא-קוטביות כגון טריפטופן. הגן הכרוך במפגע זה, SLC6A19, ממוקם על כרומוזום 5, והוא מפקח על הספיגה במעי של מספר חומצות אמינו, ועל הספיגה מחדש שלהם באבוביות הכליה. עודף של טריפטופן מופרש אם כן בשתן וברמת חסר של טריפטופן הגוף מתקשה ליצר כמויות מספיקות של הוויטמין nicotinamide, בעיקר באותם מצבים בהם יש דרישה גדולה לחומר זה.
תסמיני Hartnup מופיעים בגיל רך בצורת FTT, רגישות לאור, אטקסיה לסירוגין, ניסטגמוס ורעד. התסמינים יכולים להיות מושפעים מגירויים אור שמש, מחלת חום, או מעקה גופנית או נפשית, או פרק זמן של תזונה לקויה. התקפי המפגע הולכים ונעשים פחות תכופים עם הגיל. כיוון שחסר של ניקוטינאמיד אופייני ל-pellagra, גם ב-Hartnup עלולה להופיע פריחה עורית אופיינית בעיקר בחשיפה לשמש, אך הבעיות היותר משמעותיות הן פיגור שכלי, קומה נמוכה, כאבי ראש, הליכה לא יציבה, והתמוטטות או התעלפות אף הן ידועות. גם תופעות פסיכיאטריות כדאגנות יתר, שינויים מהירים במצבי רוח, והלוצינציות, יתכנו גם כן.
פגיעה במטבוליזם של ליזין
- Hyperlysinemia-מפגע אוטוזומלי רצסיבי עם רמת ליזין מוגברת בדם, אך ללא תסמינים קליניים. מפגע זה כרוך בפעילות מופחתת של האנזים saccharopine dehydrogenase, המשחק תפקיד משני במסלול המטבולי של ליזין. התרחיש accharopinuria מתבטא בעודף saccharopine בשתן.
- Lysinuric protein intolerance או LPI הידוע גם כ-hyperdibasic aminoaciduria type 2, הוא מפגע אוטוזומלי רצסיבי המשפיע על הספיגה של חומצות האמינו הקטיוניות אורניטין, ארגינין וליזין, באופן שספיגתן במעי דלה, והפרשתן בשתן מוגברת. רמת שלושת חומצות אלה נמוכה בפלזמה ובמאגרי הגוף, כאשר חסר בארגינין ובאורניטין מגביל את התפקוד של מעגל האוריאה וגורם להיפר-אמונמיה לאחר ארוחות עתירות חלבונים. חסר בליזין עלול לגרום לבעיות בשלד ובנערכת החיסון שאכן נצפות באלה עם LPI. המפגע נדיר ביותר עם דיווח על 100 מקרים, מחציתם בפינלנד.
האבחון של תרחיש זה מעבר לרמה מוגברת של ליזין, ארגינין ואורניטין בשתן ורמה נמוכה שלהם בפלזמה, הוא גם על ידי עליה ניכרת ברמת חומצה אורוטית בשתן לאחר ארוחה עתירת חלבון. תינוקות עם מפגע זה הם בדרך כלל ללא תסמינים כאשר הם ניזונים מהנקה, שכן חלב-אם הוא יחסית דל בחלבון, אך לאחר גמילתם הם סובלים מהקאות ושלשולים. הם סובלים מ-FTT, תיאבון ירוד, עיכוב בגדילה, כבד וטחול מוגדלים ומאוסטיאופורוזיס ואוסטיאופניה בולטים. האכלה במזון עתיר חלבון עלולה לגרום להתכווצויות ואף לתרדמת. במניעת תרחישים של היפר-אמונמיה ההתפתחות השכלית תקינה. בחלק מהמקרים מתפתחים סיבוכים ריאתיים וכלייתיים. - גלוטריק אצידוריה וכן Glutaric acidemia type 1, הוא מפגע מולד בו יש כשל בחילוף חומרים של ליזין, הידרוקסי-ליזין וטריפטופן. ריכוזים גבוהים של תוצרי ביניים של קטבוליזם פגום של חומצות אמינו אלה, כגון חומצה גלוטרית, גלוטריל-קו-A, וכן 3-הידרוקסי-חומצה גלוטרית וחומצה גלוטאקונית, עלולים להצטבר ולגרום נזק למוח, אך בעיקר לגנגליונים הבזליים המווסתים תנועות רצוניות. במפגע זה נרם חסר שניוני חריף של קרניטין, שכן האחרון נקשר לעודף החומצה הגלוטרית להרחקתה בשתן, גם פיגור שכלי עלול להופיע במפגע זה.
החומרה של מפגע זה מאוד הטרוגנית, וניתן להגדירו לגלוטרק אצידוריה לפני המשבר האנצפלופתי, ולזה שאחריו. תינוקות עם glutaric aciduria type 1 בדרך כלל נולדים עם מאקרוצפלוס. בשלב שאחרי השבר האנצפלופתי, לסובלים מהמפגע יש הפרעות תנועה, עוויתות, קשיחות או ירידה בטונוס השרירי בגלל החסר המשני בקרניטין.
פגמים הקשורים בחומצת האמינו לאוצין
- MGA או 3-methylglutaconic aciduria, מפגע נדיר ביותר, הפוגע ביכולת הגוף לייצר אנרגיה במיטוכונדריה, כאשר בשתן ניתן לגלות רמות גבוהות של שתי החומצות האורגניות MGA וכן -methyl glutaric acid. זוהו חמש תת-סוגים של MGA, כאשר החשוב ביותר הוא MGA type I בו המוטציה היא בגן AUH הממוקם על כרומוזום 9 המקודד לאנזים -3methylglutacony-CoA hydratase המשמש בחילוף החומרים של חומצת האמינו לאוצין במיטוכונדריה בעת תהליכי יצירת אנרגיה שם. התסמינים הקליניים הם פיגור בדיבור, פיגור מוטורי ומנטלי, חמצת מטבולית, טונוס שריר בלתי תקין (dystonia), התכווצויות שריר וחולשה בגפיים.
- Isovaleric acidemia- מפגע מטבולי אוטוזומלי רצסיבי נדירה מפריע לחילוף החומרים התקין של חומצת האמינו המסועפת לאוצין, תוך הצטברות חומצה איזו-ואלרית., הגורמת להופעת ריח אופייני של רגליים סרוחות בגוף ובנשימה. בכמחצית מהמקרים תסמיני מפגע זה מתגלים כבר ימים אחדים לאחר הלידה, עם הפרעות אכילה, הקאות, פרכוסים, וחסר אנרגיה שעלולים להתפתח לתרדמת. במחצית האחרת של המקרים המפגע מתגלה מאוחר יותר, והוא מופיע ומתפוגג לסירוגין. התחדשות התסמינים עלולה להופיע לאחר מחלות מדבקות או מדיאטה עשירה במיוחד בחלבונים. כיום מתגלה המפגע במסגרת סקר היילודים המורחב בטכנולוגיה של מס-ספקטרומטריה, בבחינת טיפות דם מוטבעות על נייר גאטרי, כאשר בדם וגם בשתן מתגלות רמות מוגברות של isovalerylglycine ושל isovalerylcarnitine.
- Methylcrotonyl-CoA carboxylase deficiency או MCC deficiency הידוע גם כ-Methylcrotonylglycinuria- מפגע מטבולי אוטוזומלי רצסיבי מולד עם חסר באנזים MCC3 המונע פירוק חלבונים המכילים את חומצת האמינו לאוצין, מפגע המופיע בשכיחות של 1 ל-50,000 לידות. התינוקות מופיעים בריאים בלידה, כאשר התסמינים מופיעים בשנת החיים הראשונה או סמוך לכך. התסמינים מופיעים הם הפרעות אכילה, הקאות ושלשולים תכופים, לתרגיה, והיפוטוניה. חוסר טיפול הולם המתבטא בדיאטה דלת לאוצין ותוספים מתאימים דוגמת ביוטין, עלול להוביל לפיגור התפתחותי, פרכוסים ותרדמת. יש דמיון בין התסמינים הללו לבין אלה המופיעים בתסמונת Reye. יש מקרים עם מוטציות הגורמות לחסר 3MCC שלעולם אינם נחשפים לתסמינים המתוארים. שני גנים, MCCC1 ו-MCCC2, מקודדים לשתי תת היחידות המרכיבות את האנזים MCC3.
- hydroxy-3-methylglutaryl-CoA lyase deficiency או HMG-CoA lyase deficiency, הוא מפגע אוטוזומלי רצסיבי לא שכיח בו יש הפרעה בחילוף החומרים של לאוצין. המפגע מתגלה בשנת החיים הראשונה, בעיקר בהקאות, התייבשות, לתרגיה, התכווצויות עד כדי תרדמת. באפיזודות של המפגע המופיעות לעתים לאחר מחלת חום, צום, או פעילות גופנית מאומצת, יש הופעה של היפוגליקמיה חריפה מלווה בחמצת מטבולית. המפגע נגרם ממוטציות בגן HMGCL המקודד לאנזים HMG-CoA lyase, הכרוך במטבוליזם של לאוצין, אך גם ביצירת קטונים בעת פירוק שומנים. לכן פגיעה באנזים זה גורמת באי-יצירת קטונים לניצול יתר של גלוקוזה לקבלת אנרגיה וממילא להיפוגליקמיה, ולעליה ברמת חומצות אורגניות בדם מה שגורם לחמצת ולפגיעה במערכת העצבים המרכזית.
- חסר ביוטינידאזה-מפגע מטבולי אוטוזומלי רצסיבי בו אין שחרור של ביוטין מחלבונים בשעת פירוקם, וכך נגרם חסר ביוטין, ונפגע חילוף החומרים של שומנים, פחמימות או חלבונים. מפגע זה בצורתו הקשה מופיע ב-1 ל-137,000 לידות, ואילו המפגע בצורתו המתונה מופיע ב-1 ל-110,000 אנשים. תסמיני המפגע יכולים להופיע ימים אחדים לאחר הלידה כפרכוסים, היפוטוניה, חולשת שרירים, אטקסיה, אטרופיה של עצב הראייה, שיתוק, איבוד שמיעה, פריחה דמוית פסוריאזיס, והתקרחות. אם לא מטופל כראוי, המחלה תתפתח לתרדמת ולמוות. יש גם ואריאנט מתון יותר של חסר ביוטינידאזה, וידוע והתסמינים דומים אם כי קלים יותר בהשוואה לצורה המחלה הרגילה. בשתי צורות המפגע מתן ביוטין עשוי לתקן את התפקוד המטבולי של לאוצין ואיזולאוצין. נזקים אחרים של ביוטינידאזה הם התנהגות תוקפנית, עיכוב בהתפתחות הקוגניטיבית ומערכת חיסון מוחלשת.
המוטציות בגן BTD המקודד לאנזים ביוטינידאזה והממוקם על כרומוזום 3p25. ללא פעילות תקינה של ביוטין כיוון שביוטינידאזה לא הסיר אותו מעל פני חלבונים אליהם הוא קשור, נמנעת פעילות תקינה של האנזים carboxylase, וכך פעילות אנזים זה על שומנים, פחמימות וחלבונים נמנעת. אלה המאובחנים במחלה, אמורים להימנע מאכילת ביצים העשירים בחלבון avidin הקושר בזיקה גדולה ביוטין ומנטרל אותו. לעומת זאת חולים אלה אמורים לצרוך 5-10 מיליגרם ביוטין מדי יום.
פגיעות במטבוליזם של איזו-לאוצין
- Beta-ketothiolase deficiency – מפגע מטבולי מולד אוטוזומלי רצסיבי נדיר ביותר, בו הגוף מתקשה לבצע חילוף חומרים של חומצת האמינו איזולאוצין, או של תוצרי פירוק של שומנים. המפגע מתגלה בגיל 6-24 חודשים, בצורת הקאות, התייבשות, קשיי נשימה, עייפות רבה, ולעתים התכווצויות. אפיזודות בעלי אופי קטו-אצידוטי שעלולות אף להסתיים בתרדמת. המוטציה היא בגן ACAT1 המקודד לאנזים הרלוונטי. כיוון שאנזים זה מעבד גם קטונים הנוצרים בקטבוליזם של שומנים, מוטציה זו מפחיתה את יכולת הגוף לחילוף החומרים של קטונים, ומכאן קצרה הדרך ל-ketoacidosis ולהפרעה תפקודית של מערכת העצבים המרכזית.
- 2Methylbutyryl-CoA dehydrogenase deficiency – הקרוי גם short/branched-chain acyl-CoA dehydrogenase deficiency או SBCADD, הוא מפגע מטבולי אוטוזומלי רצסיבי בו הגוף אינו מסוגל לבצע חילוף חומרים של חומצת האמינו איזולאוצין. המוטציה היא בגן ASADSB הממוקם על כרומוזום 10, והיא גורמת לאיבוד כישורים מוטוריים, לפיגור שכלי ולאפילפסיה.
מפגע במטבוליזם של סרין
D-glyceric acidemia-מפגע מולד הנגרם ממוטציה בגן GLYCTK המקודד לאנזים glycerate kinse, המקטלז את הפיכת D-glycerate ל-2- פוספוגליצראט. ריאקציה זו משותפת למספר מסלולים מטבוליים כגון פירוק פרוקטוזה אך גם חילוף החומרים של חומצת האמינו סרין. תסמיני מפגע זה בצורתו החמורה יותר כוללים פגיעה נוירולוגית ההולכת ומחמירה, פיגור מוטורי ושכלי, FTT, היפוטוניה, חמצת מטבולית ופרכוסים.
מפגעים במטבוליזם של טירוזין
טירוזינמיה type I- הוא מפגע אוטוזומלי רצסיבי המופיע בעולם בשכיחות של 1 ל-100,000 לידות, פרט לחבל קוויבק בקנדה עם תדירות של 1 ל-16,000 לידות. זו הצורה היותר חמורה של טירוזינמיה, והיא מופיעה בחסר האנזים fumarylacetoacetate hydrolase, אנזים המקטלז את השלב הסופי בחילוף החומרים של טירוזין ליצירת fumarate, חומצה אצטו-אצטית וחומצה סוקצינית. החומר פומאריל-אצטואצטאט, מצטבר בהפאטוציטים ובתאי האבובית הפרוקסימלית בכליה, וגורם לנזק חמצוני ל-DNA, תוך גרימת מוות לתאים או לפגיעה בתפקוד גנטי שמביא לשינויים מטבוליים כמו בסינתיזה של חלבונים או בגלוקונאוגנזה. עיכוב השלב האחרון בקטבוליזם של טירוזין מקרין על שלבים מוקדמים יותר, וגורם להצטברות טירוזין, שאמנם אינו טוקסי לכבד או לכליות , אך גורם לבעיות דרמטולוגיות ולניוון עצבי.
טירוזינמיה type I מתבטאת בתינוקות בצורת FTT וכבד מוגדל. ההשפעות הראשונות הן באי-תפקוד מתקדם של הכבד והכליות, כאשר בכבד עלולה להתפתח צמקת, רמה גבוהה של בילירובין מצומד, היפוגליקמיה ובעיות קרישה. הבעיות בתפקוד הכליה מתבטאות כתסמונת Fanconi, אצידוזיס טובולארי, היפו-פוספאטמיה ואמינו אצידוריה כללית. יתכנו גם בעיות עוריות ודרמטולוגיות וכן קרדיומיופתיה.
טירוזינמיה type II- מפגע אוטוזומלי רצסיבי המתגלה בדרך כלל בין הגילים שנתיים ל-4 שנים., כאשר מתפתחות יבלות מכאיבות בנקודות לחץ בכפות הידיים ובעקבים. מפגע זה מופיע בחסר האנזים tyrosine aminotransferase המקודד על ידי הגן TAT. אנזים זה הוא הראשון בסדרה של חמישה אנזימים המשתתפים בחילוף החומרים של טירוזין. פגיעה זו משפיעה על העיניים, העור, ועל ההתפתחות השכלית. המפגע מופיע בגיל צעיר ביותר בצורת דמעת יתר, פוטופוביה, אדמומיות וכאבי עיניים ואזורים מכאיבים על כפות הידיים והעקבים. שכיחות המפגע היא 1 ל-250,000 לידות.
טירוזינמיה type III- מפגע מאוד נדיר שתוארו בו רק מספר מקרים בספרות. החסר הוא של האנזים hydroxyphenyl pyruvate dioxygenase, המקודד על ידי הגן HPD. אנזים זה שכיח בעיקר בכבד, ובכמויות קטנות גם בכליות, והוא משתתף בקטבוליזם של טירוזין, ליצירת חומצה הומוגנטיסית. הפגם באנזים זה גורם לפיגור שכלי מתון, פרכוסים, ולעתים איבוד שווי משקל וקואורדינציה.
Alkaptonuria (מחלת השתן השחור) מפגע אוטוזומלי רצסיבי מולד נדיר הקשור למטבוליזם של פנילאלנין וטירוזין, בו יש פגם באנזים homogentisate 1,2-dioxygenase, הקשור בקטבוליזם של טירוזין. כתוצאה מכך, תוצר ביניים רעלני הידוע כאלקפטון או homogentisic acid מצטברת בדם ומופרשת בשתן בכמויות גדולות. עודף חומצה הומוגנטיסית פוגע בסחוס וגורם ל-ochronosis המוביל לאוסטיאו-ארטריטיס, פגיעה בעמוד השדרה וכאבי גב תחתון, ונזק בצוואר הירך ובכתף, לפגיעה במסתמי הלב ולהופעת אבני כליות. באנשים בריאים לא ניתן לגלות חומצה הומוגנטיסית בדם או בשתן, כאשר באלקפטונוריה רמת חומצה זו בפלזמה היא כ-7.0 מיקרוגרם למ"ל, ואילו בשתן רמתה 3.1 מילימול' למילימול' קראטינין, בממוצע.
אלקפטונוריה היא לעתים א-תסמינית, אם כי ניתן לגלות לעתים פיגמנטציה בלובן העין, באיורי עור חשופים לשמש או בסביבת בלוטת זיעה,כאשר הזיעה עצמה יכולה להיות בגוון הנוטה לחוּם. השתן הופך כהה בחשיפה לאוויר הפתוח, אך תיתכן הופעת אבנים בכליות כמו גם בבלוטת הערמונית בערך מרבע מהמקרים.
מפגע במטבוליזם של אורניטין
- Ornithine translocase deficiency ידוע גם כ-תסמונת HHH או Hyperornithinemia-Hyperammonemia-Homocitrullinuria, מפגע מעגל אוריאה אוטוזומי רצסיבי נדיר המשפיע על האנזים ornithine translocase, מה שגורם להיפר-אמונמיה, ומשפיע בעיקר על מערכת העצבים. התינוק הפגוע עלול לסבול מלתרגיה, מגלה חוסר רצון לאכול, או שיש לו נשימה לא מאוזנת ושינוי טמפרטורה. יש תינוקות בהם מופיעים פרכוסים, תנועות לא רצוניות, ואף תרדמת. ישנה צורת מפגע מתונה יותר המופיעה בגיל מתקדם, ובאלה יש אי-סבילות למאכלי בשר. עליה משמעותית ברמות אמוניה גורמת בהם לאטקסיה, בלבול, וראייה מטושטשת, אך הסיבוכים היותר קשים כרוכים בפיגור התפתחותי, בעיות למידה, ונוקשות שרירים (spasticity). מפגע זה נגרם ממוטציות בגן SLC25A15, המקודד לטרנספורטר של אורניטין אל תוך המיטוכונדריה, כדי שישתתף במעגל האוריאה. כישלון של אורניטין להשתלב במעגל האוריאה, מביא להצטברות אמוניה ולתסמינים המתוארים.
- Ornithine transcarbamylase deficiency או OTCD מפגע נדיר של מעגל האוריאה, מתרחש 1 ל-80.000 לידות. חסר באנזים זה מביא להצטברות של אמוניה וכן של חומצה אורוטית בדם. בתינוקות יכולה להופיע בימי החיים הראשונה לתרגיה ואי רצון לאכול, לעתים פרכוסים, תרדמת ואף מקרי מוות דווחו כבר בגיל ימים אחדים. סיבוכים של פיגור התפתחותי ושכלי, נזק מתקדם לכבד, פגעי עור, אנצפליטיס, שינויים במצבי רוח, וקשיי למידה. יש שהמפגע מופיע בצורה מתונה מאוחר יותר בחיים.
הגן OTC המקודד לאנזים זה ממוקם על כרומוזום X, לכן נקבות הן נשאיות של הגן הפגום, בעוד תינוקות זכרים עם מוטציות לא שגרתיות בגם זה מתים תוך 3 ימים מהלידה. אלה ששורדים עלולים למות תוך חודש, ומחצית מהשורדים שלב זה ימותו עד גיל 5 שנים. לעתים נשאיות נקבות הופכות להיות תסמיניות בגיל מאוחר יותר בתרחישים של עקה מטבולית, כתוצאה מאנורקסיה, צום ממושך, תזונה לקויה, הריון או אפילו לאחר ניתוח מעקף קיבה.
הגישה הטיפולית היא במתן דיאטה פחותה בחנקן (דלת חלבונים), ומתן תכשירים כמו סודיום בנזואט או סודיום-פניל-בוטיראט הלוכדים חנקן. מתן ביוטין יכול לסייע לעידוד האנזים הפגום, ולעתים יש לספק חומצות אמינו כארגינין, ציטרולין, ואלין, לאוצין ואיזולאוצין.
מפגע במטבוליזם של גליצין
- גליצין אנצפלופתיה-או NKH וגם non-ketotic hyperglycinemia - מחלה אוטוזומלית רצסיבית נדירה הקשורה לשיבוש במטבוליזם של גליצין. NKH הוא המפגע המולד של חומצות אמינו השכיח ביותר לאחר PKU, המפגע נגרם מפגיעה ב-GCS או glycine cleavage system, האנזים המפרק גליצין, מה שמעלה מאוד רמות גליצין בנוזלי הגוף ובעיקר בנוזל השדרה, וגורם באופן בלעדי לפגיעה נוירולוגית. גליצין יכול לפעול כנוירוטרנסמיטור במוח, כאשר הוא בעל תכונות מגרות בקליפת המוח, אך בעל פעילות מעכבת בגזע המוח ובחוט השדרה.
גליצין עובר חילוף חומרים על ידי ה-GCS, מערכת אנזימטית המורכבת מ-4 תת יחידות חלבוניות, חלבון-P, חלבון-H, חלבון-T וחלבון-L. תוצרי הקצה של מטבוליזם זה הם אמוניה ודו-תחמוצת הפחמן. עיקר פעילות SCS היא בכבד, במוח וברקמת השליה. כשל של ה-GFS מביא לעליה משמעותית ברמת גליצין במוח וב-CSF, ואחראי לתופעות הנוירולוגיות הפתולוגיות. רמת הגליצין במפגע זה בנוזל השדרה היא משמעותית גבוהה יותר מאשר בפלזמה. התופעות הבולטות ב-NKH הן פיגור שכלי, היפוטוניה, פרכוסים ונזקים מבניים במוח. התינוק נולד לאחר הריון תקין, וכבר לאחר ימים אחדים ניכרת בו לתרגיה, היפוטוניה, פרכוסים ותנועות מיוקלוניות, עד תרחיש של apnea שעלול להיות קטלני. לאחר התאוששות מהאפיזודה המוקדמת, חוזרים הפרכוסים, עיכוב התפתחותי ופיגור שכלי. ישנה גרסה מאוחרת יותר של הופעת התסמינים הללו, אם כי לאלה עם הגרסה הזו אין פגיעה שכלית, אך ממשיכים לסבול מדיספלגיה ספסטית ומניוון אופטי.
השכיחות של NKH היא 1 ל-60,000 לידות, ופגיעות ב-4 גנים כרוכות במפגע. GLDC מקודד לתת היחידה האחראית לפעילות של גליצין דהידרוגנאזה או גליצין דקרבוקסילאזה, ומוטציה בו מהווה 70-75% מכלל המקרים של NKH. הגן GCST וכן AMT מקודדים לתת היחידה המפעילה את אמינו-מתיל-טרנספראזה, ומוטציה בשני אלה מהוות 20% מהמקרים של NKH. הגן GCSH מקודד לתת היחידה של חלבון H מתוך ה-GCS, ומוטציות בה תורמות לפחות מ-1% ממקרי NKH. - האנזים AGAT או L-arginine:glycine amidinotransferase, מקטלז מעבר של שייר אמידינו מחומצת אמינו ארגינין לגליצין, כאשר תוצרי ריאקציה זו הם אורניטין וגואנידינו-אצטאט, שהוא הקודמן (precursor) המיידי של creatine. לקראטין יש תפקיד מרכזי במשק האנרגיה בשריר, וברקמות עצביות. ריכוזי קראטין גבוהים ביותר בשריר השלד, בלב, בתאי הזרע ובתאים קולטי האור בעין. יצירת גואנידינואצטאט על ידי האנזים AGAT, הוא השלב הקובע את קצב ייצור קראטין, כאשר פעילות AGAT מווסתת על ידי הורמון הגדילה (GH) ועל ידי תירוקסין, כאשר פעילות AGAT מעוכבת על ידי אורניטין, וכן על ידי קראטין.
מטופלים עם חסר בפעילות האנזים AGAT סובלים מתסמינים נוירולוגיים בלתי ספציפיים, כולל פיגור שכלי, קשיי שפה, אפילפסיה, התנהגות דמוי-אוטיסטית והפרעות בתנועה. הטיפול במפגע זה הוא במתן קראטין. - Sarcosimemia ידועה גם כ-SARDH deficiency, מפגע אוטוזומלי רצסיבי נדיר המתאפיין ברמות סרקוזין גבוהות בדם ובשתן, שעלול לנבוע מחבר חמור ברמת folate הנחוץ להפיכת סרקוזין לגליצין. סרקוזינמיה נחשבת בדרך כלל למצב שפיר, הנגרם ממוטציה בגן המקודד לאנזים sarcosine dehydrogenase, הממוקם על כרומוזום 9q34.
- Iminoglycinuria הידוע גם כ-familial iminoglycinuria, הוא מפגע אוטוזומלי רצסיבי של טרנספורט באבוביות הכליה, המשפיע על הספיגה מחדש של גליצין, ושל חומצות האמינו עם שייר imino פרולין והידרוקסיפרולין. כל שלושת החומצות הללו מופרשות בשתן באופן מוגבר. אימינוגליצינוריה מפגע נדיר, הנחשב שפיר יחסית, אם כי במקרים מסוימים הם כרוכים בתופעות אנצפלופתיות, פיגור שכלי, חרשות, עיוורון, אבני כליות, יתר לחץ-דם ו-gyrate atrophy.
לגליצין, פרולין והידרוקסיפרולין יש מנגנון משותף של ספיגה מחדש באבוביות הכליה, וכן מנגנון ספיגה דומה ב-brush border האפיתליאלי במעי. בהתאם, קו-טרנספוטרים כמו נתרן וכלוריד נקשרים לשלוש חומצות אמינו אלה, ומסייעים לספיגתם במעי. הפגם העיקרי הכרוך באימינוגליצינריה נגרם ממוטציה בגן SLC36A2 המקודד לחלבון PAT2, שהוא טרנספורטר כלייתי בעל זיקה גבוהה לגליצין, פרולין והידרוקסיפרולין. גן נוסף, SLC36A1, מקודד לחלבון PAT1, שהוא טרנספורטר של שלושת חומצות האמינו הללו, אם כי בזיקה נמוכה יותר. ההשערה היא שגם PAT1 משחק תפקיד בספיגתם הלקויה של גליצין, פרולין והידרוקסיפרולין.
מפגע במטבוליזם של ציסטאין/ציסטין
ציסטינוזיס - מחלת אגירה ליזוזומאלית אוטוזומלית רצסיבית נדירה ( 1 ל-1000,000 עד 200,000 לידות), המתאפיינת ברמות מוגברות במיוחד של חומצת האמינו ציסטין בתוך התאים, תוך יצירת גבישים וגרימת נזק לתאים. זו הצורה השכיחה ביותר של מחלת Fanconi, ואותם גבישים עלולים לפגוע בכליות ובעיניים. המפגע הוא באי היכולת לעשות טרנספורט של ציסטין מתוך הליזוזומים, וכך נגרם מוות של תאים ואובדן משמעותי של תאי אפיתל בכליות. בנוסף לתסמונת Fanconi ולרטינופתיה גורם המפגע לעתים גם לקומה נמוכה. ציסטינוזיס מתרחשת כתוצאה ממוטציה בגן CTNS, הממוקם על כרומוזום 17, והמקודד לחלבון הטרנספורט של ציסטין, cystinosin.
לציסטינוזיס שלוש צורות מוגדרות: nephropatic, intermediate ו-ocular. תינוקות עם הצורה הנפרופתית, סובלים משגשוג איטי, ובעיקר מבעיות כליה כתוצאה מאלמנטים של Fanconi, עם איבוד מינראלים חיוניים ומלחים, וכתוצאה מכך מרככת היפופוספאטמית ועצמות רגליים קשתיות. איבוד אלקטרוליטים מביא להשתנה מרובה (polyuria), צמא, התייבשות וחמצת. בגיל שנתים כבר עלולים להופיע גבישים בקרניות, עם הגברת רגישות לאור (פוטופוביה), וללא טיפול הולם בגיל 10 עלולות הכליות להגיע לכשל מוחלט. תסמינים אחרים עלולים להתבטא בפגיעה השרירים, עיוורון, קשיי בליעה, סוכרת, ובעיות של בלוטת התריס ומערכת העצבים.
התסמינים של צורת ה-intermediate של ציסטינוזיס דומים לאלה שבצורה הנפרופתית אלא שהם מופיעים בגיל מאוחר יותר (בסביבות גיל 12-15 שנה). באי טיפול נאות, כשל מוחלט של הכליות יתרחש בסביבות גיל 20 שנה. התסמין היחיד של הצורה האוקולארית של ציסטינוזיס הוא פוטופוביה מהצטברות גבישים בקרניות. הטיפול הוא בתכשיר Cysteamine, המפחית את ריכוז הציסטין התוך-תאי, על ידי שהוא נקשר לחומצת אמינו זו בתוך הליזוזום, ומוציא אותה החוצה.
ציסטינוריה - היא מפגע אוטוזומלי רצסיבי הפוגע ב-1 מ-10,000 אנשים המתאפיין על ידי יצירת אבני ציסטין בכליות, בשלפוחית השתן ובשופכן. המפגע נגרם ממוטציות בגנים SLC3A1 ו-SLC7A9, המקודדים לשני מרכיבים של טרנספורטר שנוצר בעיקר בכליות. פגמים אלה מונעים ספיגה מחדש של חומצות אמינו טעונות חיובית כגון ארגינין, ליזין ואורניטין, ואלה אמנם משתחררות לשתן. גם ציסטין אינו נספג מחדש באפוביות הפרוקסימאליות המפותלות, וכך הוא משתחרר בריכוזים גבוהים לשתן.
ציסטינוריה היא א-תסמינית עד ליצירת האבנים, ואז עלולים להופיע בחילה ו/או הקאות, כאב כרוני או חד, המטוריה, תסמונת חסימתית דוגמת הידרו-נפרוזיס, וכן pyelonephritis. אבני ציסטין לא תמיד מתגלות בצילומי X, באולטרה-סאונד, או ב-CT, אלא אם כן נוקטים בשיטת פיאלוגרם תוך-ורידי על ידי הזרקת צבע. הטיפול במקרים של ציסטינוריה על ידי שתיית נוזלים מרובה, הבססת השתן על ידי מתן ציטראט או acetazolamide, הפחתת מזון חלבוני ובעיקר הגבלת מתיונין, או טיפול בכלאטור כמו פניצילאמין.
פגיעה מטבולית בחומצות אמינו חומציות
Dicarboxylic aminoaciduria-מפגע אוטוזומלי רצסיסבי מטבולי נדיר המתאפיין על ידי איבוד של חומצה אספרטית וחומצה גלוטמית בשתן. המפגע נגרם ממוטציות בגן SLC1A1.
פגיעות במטבוליזם של מתיונין
- Hypermethioninemia – עודף של מתיונין בדם הוא בדרך כלל תרחיש ללא תסמינים אם כי אחדים סובלים מחסכים אינטלקטואליים ובעיות נוירולוגיות נוספות כמו איחור בהתפתחות מוטורית כעמידה והליכה, מגושמות, חולשת שרירים, בעיות כבד, תווי פנים לא רגילים, ו"ריח כרוב מבושל" בנשימה, בזיעה ובשתן. תרחיש זה אוטוזומלי רצסיבי זה המתבטא בפגיעה באנזימים הקשורים לחילוף החומרים של מתיונין נובע ממוטציות בגנים AHCY, GNMT ו-MAT1A.
- הומוציסטינוריה-הנובעת מחסר האנזים cystathionine beta synthase או CBS, הוא מפגע מולד אוטוזומלי רצסיבי במטבוליזם של מתיונין, המונע יצירת ציסטטיונין מהומוציסטאין. מפגע נדיר עם שכיחות ממוצעת של 1 ל-180,000 לידות הגורם לפגיעות רב-מערכתיות, ברקמת החיבור, בשרירים, במערכת העצבים המרכזית, ובמערכת הקרדיו-וסקולארית. הביטוי המיידי היא רמה גבוהה במיוחד של הומוציסטאין בפלזמה (מעל 200 מיקרומול' לליטר) ובשתן. תוחלת החיים של הלוקים בהומוציסטינוריה קצרה, ואחד מכל ארבעה חולים ימות מתחת גיל 30 שנה מסיבוכים של מערכת כלי הדם.
התסמינים בהומוציסטינוריה הם פגיעות שלדיות עם גפיים ארוכות ומבנה גבוה וכפוף (מרפנואידי), פיגור שכלי ופרכוסים, בעיות עיניים מסוג אקטופיה לנטיס, קוצר ראייה, גלאוקומה וניוון עצב הראייה, ובעיות וסקולאריות כגון טרשת עורקים בגיל צעיר ביותר, ונטייה לפקקת.
הטיפול בוויטמין B6 עשוי בכמחצית מהמקרים לסייע, ונטילת B6 חייבת להימשך כל החיים. ויטמין זה משמש קו-פקטור לאנזים CBS. במקרים אחרים טיפול ב-betaine (טרימתיל גליצין), מסייע על ידי אספקת שיירי מתיל הנחוצים לאנזים MTHFR המשתתף במסלול הרה-מתילציה, ומסב הומוציסטאין בחזרה למתיונין.
Cystathioninuria הוא מפגע מטבולי אוטוזומלי רצסיבי המביא להפרשת עודף cystathionine בשתן. כיון שיש הצטברות של ציסטטיונין שאינו עובר לציסטאין בחסר האנזים האמור, עלו להיווצר במשוב לאחור עודף גדול של הומומציסטאין. - היפר-הומוציסטאינמיה מוגדר כתרחיש קליני הנובע מרמות מוגברת של הומוציסטאין בדם. חסר בוויטמינים מקבוצת B, חומצה פולית (ויטמין B9), ויטמין B6 וויטמין B12, עלול להביא להיפר-הומוציסטאינמיה , ובהתאם אספקת ויטמינים אלה בנוסף לבטאין מפחית את רמת הוציסטאין. ברוב המקרים, רמת הומוציסטאין מוגברת בשל מוטציה A677C בה אלנין מותמר בואלין, באנזים MTHFR, המסייע להפיכת הומוציסטאין למתיונין. ראיות אפידמיולוגיות כורכות רמה מוגברת של הומוציסטאים עם תחלואה קרדיו-וסקולארית, אם כי ניסויים קליננים בעשור האחרון, לא הדגימו שהפחת רמת הומוציסטאין בטיפול עם ויטמינים, אמנם מפחית רמת תחלואה זו.
מפגע במטבוליזם של פנילאלנין
פנילקטונוריה – (PKU) המפגע המולד השכיח ביותר הקשור לאמינואצידוריות, עם שכיחות גלובאלית של מקרה אחד ל-9,500 לידות, אם כי באוכלוסיות מסוימות שכיחות זו גבוהה יותר. PKU נובע ב-99.99% מהמקרים מחסר של האנזים phenylalanine hydroxylase המקטלז את ההידרוקסילציה של פנילאלנין לטירוזין. אנזים זה נעזר ב-tetrahydrobiopterin או BH4, שהוא קופקטור פטרידיני. באדם, מבוטא אנזים זה בעיקר בכבד ובכליות, והחסר שלו נובע ממוטציות בגן PAH, וכך רמת פנילאלנין בדם שריכוזיה באופן תקין נמוכים מ-2 מיליגרם לד"ל, עלולה להגיע לרמות שמעל 20 מיליגרם לד"ל, רמות הגורמות לפנילקטונוריה.
PKU הוא מפגע אוטוזומלי רצסיבי מאוד הטרוגני עם למעלה מ-300 מוטציות מתועדות. כיוון שמפגע זה עלול לגרום לנזק בלתי הפיך להתפתחות המוח, חיוני לגלות חסר באנזים PAH מייד עם הלידה בסקר היילודים שנעשה בעבר בשיטת Guthrie הקלאסית בקטריולוגית, ואילו כיום מתבצע בטכנולוגיה של Tandem MS. במקרה של גילוי יילוד עם PKU, הוא מטופל בדיאטה דלת פניל-אלנין (המבוססת על הפורמולה הידועה כ-lofenalac). טיפול נוסף הוא במתן של BH4 במינון יומי של 2-20 מיליגרם לק"ג משקל, וכן יש המטפלים במקרים הרלוונטים עם קודמנים L-DOPA ו-5-HTP, וכן טיפול בחומצה פולינית במקרים המאוד נדירים של PKU על רקע של חסר באנזים DHPR או dihydropteridine reductase.
תרחיש של tetrahydrobiopterin deficiency נדיר ביותר, הנובע מחסר באנזים pyruvoyltetrahydropterin6 synthase , התורם אף הוא להיפר-פנילאלנינמיה. אם מפגע זה אינו מטופל בהקדם, עלול לגרום למגוון תסמינים שחלקם מתונים (ירידה ארעית בטונוס השרירים), וחלקם חמורים יותר כגון הפרעות בתנועה, קשיי בליעה, פרכוסים, שינויי התנהגות, וקושי לגוף לפקח על הטמפרטורה), ופיגור שכלי. חסר של BH4 נמצא רק ב-1-2% מהמקרים של רמות מוגברות של פנילאלנין. חסר של BH4 נובע ממוטציות בגנים GCH1, PCBD1, PTS ו-QDPR.
BH4 מסייע לחילוף החומרים של מספר חומצות אמינו, כולל פנילאלנין. BH4 כרוך ביצירת סרוטונין, דופאמין, אפינפרין, נור-אפינפרין, כולם נוירוטרנסמיטורים החיוניים לתקשורת בין תאי עצב. כאמור, חסר ב- BH4 כתוצאה ממוטציות בארבעת הגנים האחרונים,יפגע בריאקציות הידרוקסילציה, וכך פנילאלנין עלול להגיע לרמות פתולוגיות ברקמות שונות ובעיקר במוח שם גם פגיעתו הקשה ביותר.
ציטרולינמיה
מפגע אוטוזומלי רצסיבי של מעגל האוריאה, הגורם להצטברות אמוניה וחמרים טוקסיים נוספים בדם ובשתן. לציטרולינמיה שתי צורות עם תסמינים שונים כתוצאה ממוטציות בגנים שונים.
type I - הצורה הקלאסית מתגלה בשנות החיים הראשונות. הנגועים המפגע זה נראים תקינים בלידה, אך עם הצטברות אמוניה בגוף הם מתחילים להראות לתרגיים, עם קשיי אכילה, הקאות, פרכוסים, עד איבוד הכרה. זהו תרחיש מסכן חיים, אם כי מיעוטם של אלה עם מוטציה הגורמת לציטרולינמיה type I, אינם מראים כל תסמינים. צורת ציטרולינמיה זו שכיחה מבין השניים עם מקרה אחד לכל 57,000 לידות. המוטציה היא בגן ASS המקודד לאנזים argininosuccinate synthetase האחראי לאחד השלבים במעגל האוריאה. פגיעה זו גורמת לעודף חנקן שנמנע ממנו מטבוליזם תקין במעגל מהאוריאה, וכך תצטבר אמוניה ומטבוליטים אחרים של מעגל האוריאה, מה שיגרום לתסמינים הקליניים.
type II - התסמינים מופיעים בגיל מאוחר ובעיקר פוגעים במערכת העצבים המרכזית., ומופיעים בצורת בלבול, התנהגות אגרסיבית, רגזנות יתר, והיפר-אקטיביות, פרכוסים, עד כדי תרדמת. תסמינים אלה מחמירים עם נטילת תרופות מסוימות, שתיית אלכוהול או הדבקות בפתוגנים שונים. צורת type II עלולה להתפתח בצעירים עם כולסטזיס מולד כבר בילדות, אם כי במקרים רבים המפגע מתפוגג תוך מספר חודשים, אם כי בחלקם יחזרו התסמינים בגיל מאוחר.
המוטציות של ציטרולינמיה type II מופיעות בגן SLC25A13, המקודד לחלבון citrin המכניס ומוציא מולקולות לתוך המיטוכונדריה ומתוכה. מולקולות אלה חיוניות למעגל האוריאה, וכך שחסר החלבון citrin משבש את מהלך המעגל הזה, ומביא להצטברות אמוניה ומרכיבים טוקסיים נוספים תוצרי שלבי הביניים של מעגל זה. ציטרולינמיה type II שכיחה בעיקר ביפאן (1 ל-100,000 עד 250,000 לידות), אך גם באוכלוסיות במזרח אסיה ובמזרח התיכון.
הוראות לביצוע הבדיקה
מבוגרים אמורים להיות צום של 8 שעות, ותינוקות אמורים לא להיות מוזנים לפרק זמן של 4 שעות לפחות לפני נטילת דם. רצוי להשתמש בפלזמה ולא בנסיוב, וניתן ליטול את הדם במבחנת EDTA (פקק סגלגל) או מבחנת הפארין (פקק ירוק). יש לסרכז את הדם באופן מיידי ולהקפיא את הפלזמה אם האנליזה מתבצעת מייד. הפלזמה יציבה בהקפאה משך 14 יום, אך אם הדגימה לא נבדקת תוך פרק זמן זה רצוי לבצע בפלזמה עם הגיעה למעבדה הליך של דה-פרוטאיניזציה.
לצורך בדיקת שתן ניתן להשתמש בשתן נקודתי אקראי ללא חומרים משמרים. יש להקפיא את דגימת השתן לא יאוחר מ-3 שעות לאחר מתן השתן. יש גרסה שעדיף לשמר את השתן על ידי הוספת 2 טיפות כלורופורם לנפח של 10 מ"ל שתן.
נספחים
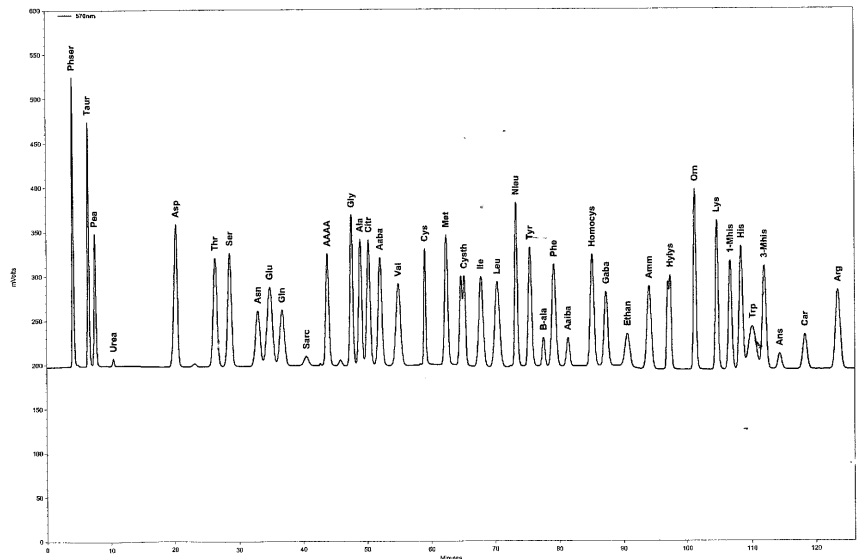
פרופיל אופייני של חומצות אמינו בהפרדה על ידי Amino Acid Analyzer
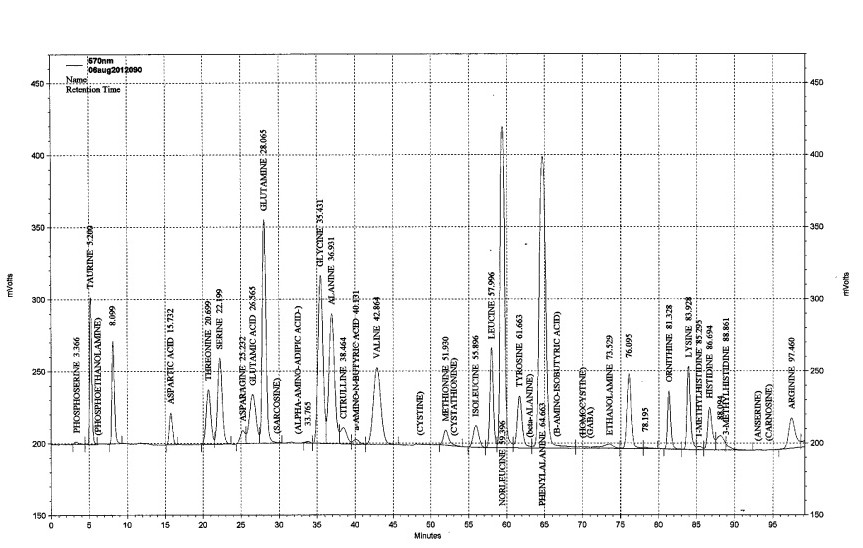
פרופיל אופייני של תינוק עם פנילקטונוריה עם שיא מאוד מוגבר של פנילאלנין
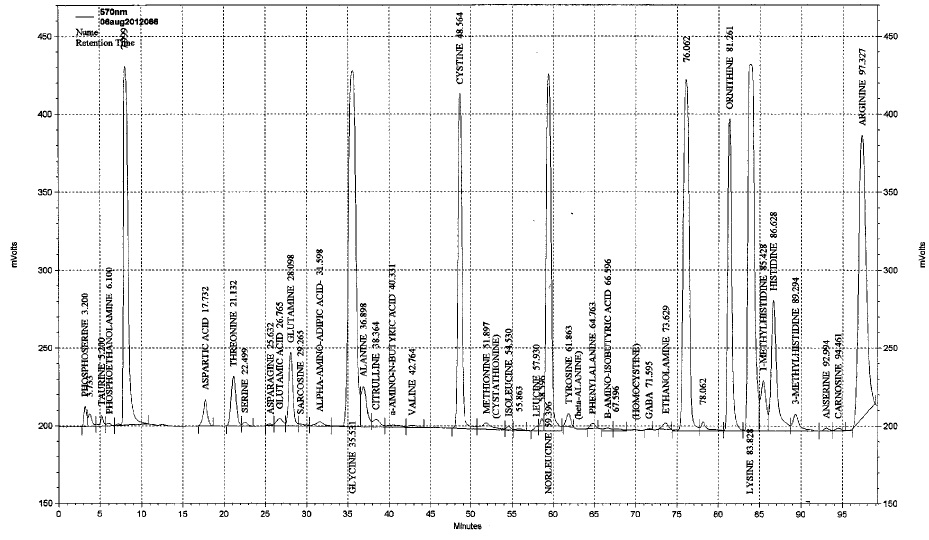
פרופיל אופייני של נער מאובחן עם ציסטינוריה. השיא של ציסטין מוגבר ביותר
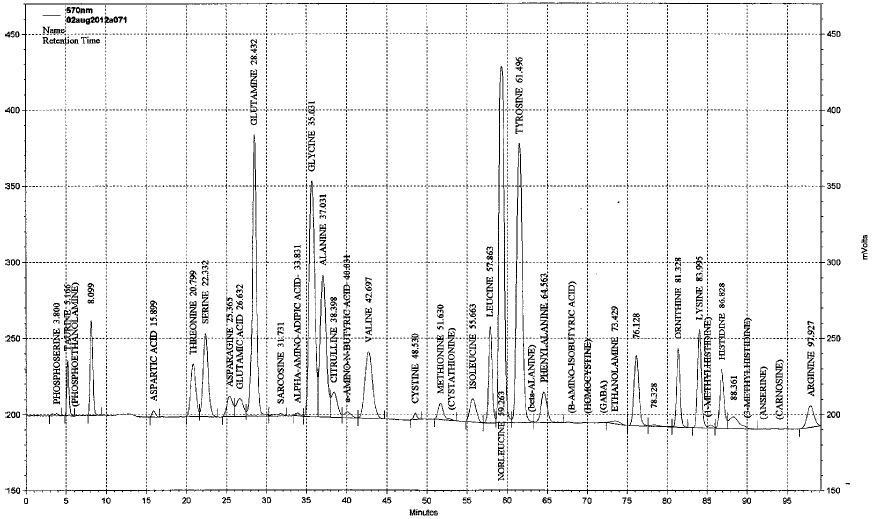
פרופיל אופייני של נער מאובחן עם טירוזינמיה type 1. השיא של טירוזין מוגבר ביותר
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק