פסוריאזיס - ספחת - טיפולים חדשים - 2021 - Psoriasis - novel therapies
הופניתם מהדף טיפולים חדשים לפסוריאזיס לדף הנוכחי.
| תרופות לטיפול בפסוריאזיס | ||
|---|---|---|
| 2021 - Psoriasis - novel therapies | ||
| ||
| יוצר הערך | פרופסור יובל רמות | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – פסוריאזיס
פסוריאזיס (ספחת) היא מחלת עור דלקתית כרונית שכיחה, הפוגעת ב-2–3 אחוזים מהאוכלוסייה בעולם המערבי, כולל בישראל, לפי הערכות אלו, סובלים כעת מספחת בארץ כ-250,000 חולים. כ-85 אחוזים מהחולים סובלים מספחת רובדית, הצורה השכיחה ביותר של המחלה, המתבטאת בפריחה מורמת, בצבע אדום ומכוסה קשקש, המערבת בעיקר את החלקים המיישרים של הגפיים, את הגו ואת הקרקפת. עם זאת, קיימות צורות נוספות של המחלה, היכולות להתבטא בנגעים מוגלתיים, מעורבות של אזורי קפלים או כפות הידיים והרגליים, או מצב קשה של דלקת של כל העור המדמה כוויה מפושטת, מצב הקרוי ספחת אריתרודרמית (Erythrodermic psoriasis).
רוב החולים יסבלו ממחלה קלה יחסית, שבה שטח הגוף המעורב אינו עולה על 5–10 אחוזים, אך כ-20 אחוזים מהחולים יסבלו ממחלה בדרגה ביונית-קשה. מחלה בדרגת חומרה כזו עלולה לגרום לנזק ממשי באיכות החיים של המטופלים ולפגוע בחיי החברה והחיים המקצועיים שלהם. הדבר עלול להביא לשכיחות גבוהה של תסמיני דיכאון, חרדה והסתגרות חברתית בקרב המטופלים. בנוסף, כ-20 אחוזים מחולי הספחת סובלים ממעורבות של המפרקים, דבר העלול להביא לפגיעה תפקודית, וכן נמצאה שכיחות רבה יותר בקרב החולים של מחלות קרדיו-ווסקולריות (Cardiovascular), סוכרת והתסמונת המטבולית (Metabolic syndrome).
ספחת היא מחלה כרונית, שאינה ניתנת לריפוי. בנוסף, לאורך שנים רבות, הטיפולים הקיימים למחלה היו מוגבלים מאוד מבחינת יעילות ולוו פעמים רבות בתופעות לוואי משמעותיות. הדבר הביא לכך שחולים רבים, במיוחד בדרגת החומרה הקשה יותר של המחלה, נזקקו לאשפוזים ממושכים שהביאו לפגיעה משמעותית באיכות חייהם. עם זאת, מתחילת שנות האלפיים חלה פריצת דרך מדעית משמעותית, אשר אפשרה הבנה מעמיקה יותר של מנגנוני המחלה, והדבר אפשר ייצור של תרופות מכוונות נגד הציטוקינים (Cytokins) האחראים למחלה. תרופות אימוניות (Immune) חדשות אלה מאפשרות להביא לעור כמעט נקי ברוב המטופלים, עם מיעוט יחסי של תופעות לוואי.
פיתוחן של תרופות ביולוגיות הביא להתקדמות משמעותית בטיפול בחולי ספחת בינונית-קשה. הדבר נכון במיוחד עם כניסתן לשימוש של התרופות הביולוגיות המכוונות כנגד IL-17 ו-IL-23, שמציגות יעילות גבוהה מאוד עם פרופיל בטיחות טוב. נמצאות בפיתוח תרופות נוספות, המכוונות כנגד ציטוקנים נוספים ואף כאלו המכוונות כנגד שני ציטוקינים, ויש לקוות שתרופות אלו יאפשרו הצלחה טיפולית טובה יותר בעתיד. עם זאת, עדיין יש נושאים רבים פתוחים, כדוגמת הסוגייה של טיפול בחולים מורכבים עם מחלות רקע כגון ממאירות בעבר או בהווה, הטיפול בנשים בהיריון או בגיל הפריון או השילוב של טיפולים ביולוגיים עם טיפולים קונבנציונליים. בנוסף, ישנם עדיין חולים שלמרות המגוון הרחב של טיפולים אינם מגיבים לטיפולים הקיימים. למרות זאת, ישנו מבחר רב של טיפולים שניתן להציע לחולים, והדבר מאפשר טיפול מותאם אישית בהתאם למחלות הרקע של המטופל, התרופות הנוספות אותן הוא נוטל, חומרת מחלתו והעדפותיו האישיות של החולה.
הפתוגנזה של ספחת
במשך שנים רבות. ספחת נתפסה כמחלת עור שמקורה באפידרמיס (Epidermis), השכבה האפיתליאלית (Epithelial) החיצונית של העור, ונגרמת כתוצאה מהתחלקות מואצת של תאים ופגיעה בהתמיינות התקינה שלהם. לכן, מטרת הטיפולים שניתנו לחולים הייתה להקטין את התחלקות התאים ולייצב את התמיינותם. לצורך כך, נעשה שימוש בנגזרות רטינואידיות (Retinoid) כדוגמת Acitretin (Neotigason), וכן שימוש ב-Methotrexate.
המהפכה בהבנת מנגנוני המחלה התרחשה לפני כ-40 שנים, כאשר טיפול ב-Cyclosporine, אשר ניתן תחילה כטיפול לדלקת מפרקים בחולי ספחת, הביא באופן מפתיע לשיפור משמעותי גם מבחינה עורית. מחקר זה ומחקרים נוספים הוכיחו למעשה כי הבסיס למחלה אינו ב-Epidermis, אלא במערכת החיסון, וספציפית קשור לתאי T[1].
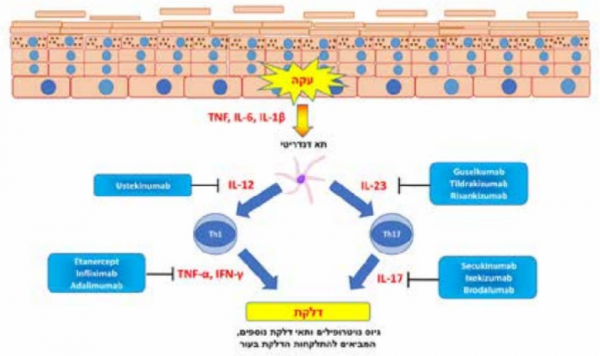
ידוע כי הבסיס להתפתחות המחלה הוא תאים דנדריטיים ׂ(Dendritic) בעור, אשר משופעלים בתחילת התהליך הדלקתי להפרשה של ציטוקינים דלקתיים, כדוגמת IL-12, IL-6, IL-1, TNF-α (Tumor Necrosis Factor alpha) ו-23-IL.
ציטוקינים אלה מביאים לשפעול של תאי T, ובמיוחד תאי T-helper מסוג +CD4, והתמיינותם לתאים מסוג T helper 17 ותאי T helper נוספים. נודעת חשיבות רבה לתאים מסוג T helper 17, המפרישים מגוון ציטוקינים, הכוללים IL-17A, IL-17F, IL-21, IL-22, ו-TNF. הפרשת ציטוקינים אלה מביאה להסננה של העור בנויטרופילים (Neutrphils), לשפעול דלקתי של הקרטינוציטים (Keratinocytes) ב-Epidermis ולשגשוג של כלי דם[2]. תרשים 1 מסכם את הציטוקינים המרכזיים הלוקחים חלק בתהליך המחלה והטיפולים הביולוגיים המכוונים ספציפית כנגד ציטוקינים אלה.
טיפולים פומיים לפסוריאזיס
הניסיון הרב ביותר בטיפול בספחת קיים עם תרופות פומיות, המכונות הטיפולים המוסכמים (Conventional) לספחת (טבלה 1)[2]. Methotrexate נחשבת לתרופת הבחירה בקבוצה זו של תרופות. גם משום שהיא יעילה בנוסף לטיפול בדלקת מפרקים ספחתית. התרופה ניתנת פעם בשבוע, אך דורשת ניטור תכוף אחר תופעות לוואי וכן ישנו חשש מהתפתחות Fibrosis כבדי בשימוש ממושך.
Cyclosporine היא תרופה יעילה ומהירה לטיפול בספחת, אך בשל החשש מהתפתחות תופעות לוואי. ובעיקר חשש מהתפתחות של יתר לחץ דם ומפגיעה כלייתית שיכולה לעיתים להיות בלתי הפיכה, השימוש בתרופה מוגבל לתקופה של עד שנה, וברוב המקרים התרופה משמשת כ"גשר" עד התחלת השימוש בתרופות אחרות המיועדות לשימוש לתקופה ממושכת יותר.
הנגזרת של ויטמין A, Acitretin, היא רטינואיד (Retinoid) מונו-ארומטי (Monoaromatic) מדור שני, אשר משמשת לטיפול בספחת, רעילה במיוחד בשילוב עם פוטותרפיה (Phototherapy). השימוש בתרופה בנשים בגיל הפריון מוגבל בשל טרטוגניות (Teratogenicity) המחייבת הימנעות מכניסה להיריון למשך שלוש שנים מתום הטיפול בתרופה (ראו טבלה 1).
| תרופה | מינון | תופעות לוואי שכיחות | תופעות לוואי נדירות |
|---|---|---|---|
| Methotrexate | 25-15 מיליגרם פעם בשבוע | פגיעה כבדית, כאב ראש, בחילה, איבוד שיער, היפראוריצמיה | פניעה כלייתית, Fibrosis כבדי או ריאתי, ציטופניה |
| Cyclosporine A | 5-3 מיליגרם/קילוגרם ליום | פגיעה כלייתית, תשערות יתר, יתר לחץ דם, רעד, היפרפלסיה של החניכיים, היפרליפידמיה | סרטן עור, היפרגליצמיה |
| Acitretin (Neotigason) | 30-10 מיליגרם ליום | היפרליפידמיה, רגישות לאור, יובש בעור ובריריות, הידללות שיער | עלייה בלחץ תוך־גולגולתי, כאבי מפרקים. פגיעה בכבד, דיכאון |
| Apremilast | 30 מיליגרם פעמיים ביום | נדודי שינה, שלשול | איבוד משקל, דיכאון |
טיפול פומי חדש יחסית לטיפול בספחת הוא Apremilast, מעכב Phosphodiesterase-4 ומוביל לעלייה ברמות cAMP (Cyclic Adenosine Monophosphate) בתאים. הדבר מביא לעיכוב גורם השעתוק NFkB (Nuclear Factor kappa-light-chain-enhancer of activated B cells) ולירידה בביטוי של ציטוקינים דלקתיים הלוקחים חלק בספחת, כדוגמת IL-12, TNF ו-IL-23. תרופה זו יעילה גם לטיפול בדלקת מפרקים ספחתית. התרופה בטוחה יחסית, ותופעות הלוואי השכיחות הן של מערכת העיכול, שברוב המקרים אינן מצריכות את הפסקת התרופה[3]. תרופות פומיות נוספות לטיפול בספחת שנמצאות בפיתוח כוללות נגזרות של חומצה פומרית (Fumaric acid) (מעבר ל-Fumaderm, שנמצאת בשימוש שנים רבות בגרמניה, אך אינה זמינה בישראל) וכן מעכבי JAK ׁ(Janus kinase).
הבעיה המרכזית של התרופות המוסכמות היא שהן אינן ספציפיות לתהליכים הדלקתיים המביאים להתלקחות המחלה, ולכן מעבר לפרופיל בטיחות נמוך, היעילות שלהן נמוכה. התרופות מביאות לירידה ב-PASI (Psoriasis Area and Severity Index) (מדד לחומרת המחלה המשקלל את שטח הגוף המעורב ואת חומרת הנגעים) של 75 אחוזים (PASI 75) בכ-30–40 אחוזים מהחולים בממוצע. כניסת התרופות הביולוגיות הביאה לשינוי משמעותי ביעילות הטיפולים, ולתפיסה שונה של המטרות הטיפוליות.
התרופות הביולוגיות לטיפול בספחת
הקבוצה הוותיקה ביותר של טיפולים ביולוגיים לספחת כוללת מולקולות שמטרתן למנוע את השפעול והגיוס של תאי T. Alefacept הייתה התרופה הראשונה מקבוצה זו שאושרה לשימוש בספחת. תרופה זו היא חלבון שעבר מיזוג (Fusion protein) בין 3-Lymphocyte Function-associated Antigen) LFA) ו-Ig-G (Immunoglobulin), הנקשר למולקולות (Molecules) CD2 על שטח פני תאי T, ובכך מונע את שפעולם. עם השנים, תרופה זו הפכה לבעלת היעילות הנמוכה ביותר בהשוואה לטיפולים הביולוגיים החדשים, ולבסוף הוצאה מהשוק[4]. Efalizumab אושרה לשימוש בחולי ספחת באותה שנה שבה אושרה Alefacept, והיא נוגדן Humanized Monoclonal מסוג IgG1, המכוון כנגד CD11a, תת-יחידה של 1-LFA. היעילות של Efalizumab אמנם הייתה גבוהה משל Alefacept, אך לאחר התחלת השיווק של התרופה החלו להצטבר דיווחים על התפתחות של לויקואנצפלופתיה רב מוקדית מתקדמת (Progressive multifocal leukoencephalopathy), זיהום נדיר ומסוכן של מערכת העצבים המרכזית על ידי נגיף ה-JC (John Cunningham). בעקבות דיווחים אלה, שיווק התרופה הופסק בשנת 2009 על ידי החברה[5].
את הטיפולים הביולוגיים הנמצאים בשימוש לטיפול בספחת ניתן לחלק לביולוגיים השייכים לדור הראשון, אשר כוללים את מעכבי ה-TNF: Infliximab ,Adalimumab ,Etanercept ו-Cetrolizumab pegol (טבלה 2). החל משנת 2009 החלו להתפתח הטיפולים הביולוגיים השייכים לדור השני, וכוללים נוגדנים המכוונים כמד מסלול ה־IL-23/T helper 17. טיפולים אלה כוללים את התרופות Ustekinumab ,Secukinumab ,Ixekizumab ,Guselkumab ,Risankizumab ו-Tildrakizumab (ראו טבלה 2).
| שם התרופה | צורת מתן התרופה | מינון | תדירות הטיפול | אורך הטיפול |
|---|---|---|---|---|
| נוגדי TNF | ||||
| אטנרספט Etanercept | זריקה תת-עורית | 50 מיליגרם פעמיים בשבוע למשך 3 חודשים ואחר כך 50 מיליגרם פעם בשבוע | המשכי | |
| Infliximab | עירוי תוך ורידי | 5 מיליגרם לקילוגרם | שבוע 6,2,0, ובהמשך כל 8 שבועות | המשכי |
| Adalimumab | זריקה תת-עורית | 80 מיליגרם פעם ראשונה | 40 מיליגרם שבוע לאחר הזרקה הראשונה. בהמשך 40 מיליגרם מדי שבועיים |
המשכי |
| Certolizumab pegol | זריקה תת עורית | 400 מיליגרם פעם בשבועיים בשבוע 0, 2, 4 | 200 מיליגרם כל שבועיים (ניתן לעלות ל- 400) | המשכי |
| נוגד 12-IL-23/IL | ||||
| Ustekinumab | זריקה תת-עורית | עד 100 קילוגרם - 45 מיליגרם מעל 100 קילוגרם - 90 מילגרם |
שבוע 0, 4, כל 12 שבועות | המשכי |
| נוגדי IL-17 | ||||
| Secukinumab | זריקה תת-עורית | 300 מיליגרם פעם בשבוע למשך 5 שבועות ואחר כך פעם בארבעה שבועות |
כל 4 שבועות | המשכי |
| Ixekizumab | זריקה תת-עורית | 160 מיליגרם חד פעמי, 80 מיליגרם פעם בשבועיים למשך 12 שבועות |
80 מיליגרם פעם ב-4 שבועות | המשכי |
| נוגדי IL-23 | ||||
| Guselkumab | זריקה תת-עורית | 100 מיליגרם בשבוע 0 ו-4 | 100 מיליגרם כל 8 שבועות | המשכי |
| Risankizumab | זריקה תת עורית | 150 מיליגרם בשבוע 0 ו- 4 | 150 מיליגרם כל 12 שבועות | המשכי |
| Tildrakizumab | זריקה תת עורית | 100 מיליגרם בשבוע 0 ו- 4 | 100 מיליגרם כל 12 שבועות | המשכי |
TNF הוא ציטוקין פרו-אינפלמטורי (Pro-inflammatory) חשוב מאוד, הלוקח חלק במספר רב של מחלות דלקתיות. חשיבותו הוכחה גם בספחת, והוא נמצא ברמות גבוהות בעור של החולים[6]. אכן, נוגדי TNF מביאים להצלחה טיפולית טובה בקרב החולים. אולם יעילותם נמוכה משמעותית מהטיפולים הביולוגיים השייכים לדור השני, ונראה שהם פועלים בעיקר על ידי השפעה בלתי-ישירה על מסלול ה-17-IL-23/T helper[7].
בזכות ההבנה כי המסלול החשוב יותר בספחת הוא המסלול של 17-IL-23/T helper, המחקר הרפואי החל להתמקד במסלול זה. IL-23 מעורב בהתפתחות של תאי 17-T helper פתוגניים (Pathogens), ותאים אלה מייצרים ומפרישים IL-17 (תרשים 1). Ustekinumab היה הנוגדן הראשון שכוון כנגד מסלול זה, ומכוון כנגד תת-יחידה p40, המשותפת ל-IL-12 ול-IL-23. ההצלחה הטיפולית הייתה מעודדת, כש-65–75 אחוזים מהחולים הגיעו לתגובה של PASI 75. עם זאת, מאוחר יותר התברר כי נוגדנים המכוונים כנגד IL-23 בלבד משיגים הצלחה טיפולית טובה אף יותר משל Ustekinumab, ועלתה ההשערה כי ל-IL-12 יש למעשה השפעה מגינה מסוימת מפני ספחת. יתרון נוסף של הטיפולים המכוונים כנגד IL-23 בלבד היא שהם אינם פוגעים במסלול המערב את T helper1, ולכן טיפולים אלה מספקים הגנה חיסונית טובה יותר כנגד פתוגנים תוך-תאיים וגידולים. העובדה כי טיפולים אלה משפיעים גם על ציטוקין הנמצא גבוה יותר במסלול הדלקתי מונעת ככל הנראה את גיוס תאי ה-17-T helper לעור, בשל כך, תאים אלה, האחראים על הפעילות הדלקתית המובילה להיווצרות המחלה העורית, אינם נמצאים ברקמה עצמה, ונדרש זמן ממושך יותר עד שאותם תאים מגויסים בחזרה לעור, לכן, השפעתם של הטיפולים המכוונים כנגד IL-23 ארוכת טווח יותר מאשר הטיפולים המכוונים כנגד IL-17, שאינם משפיעים על נוכחות תאי ה-Th17 ברקמה. בזכות עובדה זו מתאפשרת תדירות נמוכה יותר של הזרקות. נכון ל-2022 מאושרים על ידי משרד הבריאות שלושה נוגדנים המכוונים ספציפית כנגד IL-23: Guselkumab, Risankizumab ו-Tildrakizumab.
גישה חדשה לטיפול בספחת היא חסימה של IL-17. שני נוגדנים מאושרים לשימוש בארץ כנגד IL-17: Secukinumab ו-Ixekizumab (טבלה 2). טיפולים אלה מביאים להצלחה טיפולית גבוהה מאוד, כשעד 90 אחוזים מהחולים משיגים תגובה של PASI 75. הצלחה טיפולית זו הביאה למעשה למהפכה בטיפול בספחת, ותגובה של PASI 75 אינה נחשבת כהצלחה טיפולית, והרופאים מציגים כמטרה תגובה של PASI 90 ואף PASI 100, כלומר עור נקי או נקי כמעט לחלוטין מספחת. אכן, תרופות אלה מצליחות להביא במחקרים מסוימים ל-80 אחוזים תגובה של PASI 90. מעבר ליעילות הגבוהה עם טיפולים אלה, התגובה מהירה מאוד, וניתן להשיג עוד כמעט נקי מספחת תוך מספר שבועות. בזכות היותן תרופות ספציפיות מאוד למנגנונים הלוקחים חלק בספחת, פרופיל הבטיחות של תרופות אלו מעודד, וכתופעות לוואי ניתן לציין זיהומים קלים בלבד במערכת הנשימה העליונה וב-Candida. Brodalumab הוא נוגדן המכוון כנגר הקולטן ל-IL-17, המביא לתגובה טיפולית טובה מאוד. נוגדן זה מאושר על ידי ה-FDA (Food and Drug Administration), אך אינו נמצא בשימוש בישראל. במסגרת המחקרים הקליניים עם Brodalumab דווחו על 4 מקרים של התאבדויות, והדבר העלה חשש לגבי בטיחות התרופה, אם כי לא נמצא קשר ישיר בין ההתאבדויות לבין הטיפול בתרופה. בארצות הברית יש לצרף חולים המטופלים בתרופה למאגר חולים לצורך ניטור אחריהם.
לקריאה נוספת
- פסוריאזיס - ספחת (דף פירושים)
הערות שוליים
- ↑ Mueller W, Herrmann B. Cyclosporin A for psoriasis. N Engl J Med 1979; 301:555.
- ↑ 2.0 2.1 Vole S, Ghoreschi K. Pathophysiological basis of systemic treatments in psoriasis. J Dtsch Dermatol Ges 2016; 14:55772־.
- ↑ Forchhammer S, Ghoreschi K. Update on the treatment of psoriasis and psoriatic arthritis - role of apremilast. Psoriasis (Auckl) 2015; 5:11724־.
- ↑ Ahn CS, Gustafson CJ, Sandoval LF, Davis SA. Feldman SR. Cost effectiveness of biologic therapies for plaque psoriasis. Am J Clin Dermatol 2013; 14: 315-26.
- ↑ Seminara NM, Gelfand JM. Assessing long term drug safety: lessons (re) learned from raptiva. Semin Cutan Med Surg 2010; 29:16-9.
- ↑ Haider AS, Cohen J, Fei J, Zaba LC, Cardinale I, Toyoko K, Ott J, Krueger JG. Insights into gene modulation by therapeutic TNF and IFNgamma antibodies: TNF regulates IFN-gamma production by T cells and TNF-regulated genes linked to psoriasis transcriptome. J Invest Dermatol 2008; 128:65566־.
- ↑ Hawkes JE. Chan TC, Krueger JG. Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol 2017; 140:64553־.
המידע שבדף זה נכתב על ידי פרופסור יובל רמות, מחלקת עור, המרכז הרפואי אוניברסיטאי הדסה, ירושלים
פורסם לראשונה ב-חוברת סל הבריאות לשנת 2019, עמ' 31. עודכן על ידי הכותב במרץ 2022.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק