נוירובלסטומה בילדים - Neuroblastoma in children
הופניתם מהדף Neuroblastoma in children לדף הנוכחי.
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| נוירובלסטומה בילדים | ||
|---|---|---|
| Neuroblastoma in children | ||

| ||
צילום מיקרוסקופי של נוירובלסטומה אופיינית
| ||
| ICD-10 | Chapter C 74.9 | |
| ICD-9 | 194.0 | |
| MeSH | D009447 | |
| יוצר הערך | ד"ר חנה גולן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – נוירובלסטומה
הקדמה
המונח נוירובלסטומה מתייחס לקבוצת גידולים בשלבי הבשלה שונים (נוירובלסטומה, גנגליונוירובלסטומה, גנגליונוירומה) שמוצאם בתאי גנגליון פרימיטיביים במערכת העצבים הסימפתטית. מדובר בקבוצת גידולים הטרוגנית בעלת התנהגות קלינית ייחודית המשתנה בהתאם לגורמים קליניים וביולוגיים רבים, כמו שלב הגידול באבחנה, גיל החולה, היסטולוגיה של הגידול והפרעות גנטיות. בילדים מתחת לגיל שנה וחצי תיתכן נסיגה או הבשלה של הגידול באופן ספונטני או לאחר טיפול מינימלי גם כשמדובר במחלה מפושטת, ואילו בילדים גדולים יותר הגידול עמיד לטיפול ועשוי להתקדם או להישנות למרות טיפול אינטנסיבי המשלב בתוכו מספר גישות טיפוליות.
מאז סוף המאה ה-20 חלה התקדמות רבה בהבנת הבסיס הביולוגי של המחלה ובהתפתחות גישות טיפוליות שהובילו לעלייה בשיעורי ההישרדות ממחלה זו.
במאמר זה נסקרת הגישה הטיפולית העדכנית המבוססת על קבוצת הסיכון של החולים, ובנוסף מובא סיכום של ההתקדמות שחלה בכל הנוגע להבנת התהליכים הביולוגיים.
אפידמיולוגיה וגורמי סיכון
נוירובלסטומה היא הגידול המוצק החוץ גולגולתי השכיח ביותר בגיל הילדות, האחראי לכ-15 אחוזים ממקרי התמותה מסרטן בילדים. גידול זה מהווה כ-10-7 אחוזים מכלל הממאירויות בילדים, והוא הגידול השכיח ביותר בקרב ילדים מתחת לגיל שנה. בארצות הברית מאובחנים מדי שנה כ-600–700 מקרים חדשים בשכיחות של כמקרה אחד לכל 7,000 לידות, ושכיחות זו דומה למדי באזורים שונים בעולם. כ-40 אחוזים מהחולים מאובחנים בגיל מתחת שנה, 75 אחוזים עד גיל 4 שנים ו-98 אחוזים עד גיל 10 שנים[1].
האטיולוגיה של נוירובלסטומה איננה ידועה, ולא מוכרים גורמים סביבתיים הקשורים בוודאות בהתפתחות המחלה. במרבית המקרים ההופעה היא אקראית, אך ב-2-1 אחוזים מהמקרים קיים סיפור משפחתי. במקרים המשפחתיים גיל ההופעה צעיר יותר - 9 חודשים בממוצע - וב-20 אחוזים הגידול הוא רב-מוקדי. מספר מוטציות גנטיות בתאי הרבייה (germline mutation) נמצאו קשורות בנטייה תורשתית לפתח נוירובלסטומה. כ-75 אחוזים מהמקרים של נוירובלסטומה משפחתית נגרמים ממוטציה נקודתית בגן ALK ו-5 אחוזים נוספים ממוטציה בגן PHOX2B הקשור בתסמונת דום נשימה מולדת (CCHS, Congenital Central Hypoventilation Syndrome) ובמחלת הירשפרונג. מוטציות בגנים אלו נמצאו ב-10 אחוזים וב-2 אחוזים בהתאמה גם בגידולי נוירובלסטומה אקראיים שאינם קשורים בנטייה גנטית[2]. מוטציות מורשות נוספות הכוללות חסר של 1p36 או חסר ב-1q14-23 תוארו במספר מקרים בודדים של נוירובסטומה משפחתית, ואלו הן הפרעות המוכרות בגידולי נוירובלסטומה אקראיים וקשורות בפרוגנוזה לא טובה של המחלה[3].
נוירובלסטומה תוארה במספר תסמונות גנטיות בהן יש נטייה מוגברת לפתח ממאירות. תסמונות אלו כוללות מקרים בהם קיימת הפרעה במסלול ה-RAS כמו Costello syndrome, Noonan syndrome ו-1 Neurofibromatosis type. שכיחות מוגברת של נוירובלסטומה תוארה בתסמונות נוספות, דוגמת Li-Fraumeni syndrome, ROHHAD, Beckwith-Wiedemann syndrome ו-Hereditary pheochromocytoma/paraganglioma syndromes[4].
לילדים עם נוירובלסטומה משפחתית או עם אחת מהתסמונות שהוזכרו מומלץ להיות במעקב במרפאות ייעודיות העוקבות אחר מטופלים עם נטייה גנטית לפתח ממאירות, ולבצע בדיקות מעקב תקופתיות מהלידה או מזמן האבחנה ועד גיל 10 שנים[5].
הסתמנות קלינית ואבחנה
ההסתמנות הקלינית של נוירובלסטומה היא מגוונת וקשורה בגיל, במיקום הגידול ובמידת התפשטות המחלה. במחצית מן המקרים הגידול מופיע באדרנל, ובשאר מקורו בגנגליונים הסימפתטיים הפארספינלים באזור הצוואר, בית החזה, הבטן והאגן. התפשטות הגידול היא לרוב לבלוטות הלימפה, לכבד, לעצמות, למח העצם ובמקרים של הישנות גם למוח ולאזורים פאראמנינגיאלים. ילדים עם מחלה ממוקמת יכולים להיות ללא תסמינים, בעוד בילדים עם מחלה מפושטת ייתכנו גם סימנים סיסטמיים הכוללים אי שקט, חום, ירידה במשקל ויתר לחץ דם.
ההסתמנות השכיחה ביותר של נוירובלסטומה היא הופעה של מסה בטנית המלווה בתפיחות של הבטן משנית לגודל המסה או למעורבות מסיבית של הכבד על ידי גרורות. מחלה גרורתית לעצמות באזור ארובות העיניים תתבטא בבלט עיני ושטפי דם בעפעפיים (raccoon eyes), ומעורבות גרמית מפושטת בעצמות ובמח העצם תגרום לכאבי עצמות, צליעה ופנציטופניה[2][./index.php%3Ftitle=נוירובלסטומה_בילדים#cite_note-הערה2-2 [2]][3][4][5][6].
מוכרות מספר הסתמנויות ייחודיות עם גישה טיפולית ייחודית[7]:
שיתוק משני ללחץ על חוט השדרה (Clinical Cord Compression): כשמקור הגידול הוא בגנגליונים הפרספינליים תיתכן חדירה של הגידול לתעלת השדרה ולחץ אקסטרדולרי על חוט השדרה המוביל לחולשת גפיים עד כדי שיתוק מלא. זהו מצב חירום המחייב התייחסות וטיפול מידיים.
שלשול מימי: במקרים נדירים ביטוי המחלה הוא שלשול מימי בכמות רבה מלווה בהפרעות קשות ברמת המלחים בדם, הנגרם כתוצאה מהפרשת חלבון VIP (Vasoactive Intestinal Peptide) על ידי הגידול. השלשול יכול להיות הביטוי הראשוני או היחידי כבר באבחנה או יכול להופיע במהלך הטיפולים.
תסמונת הורנר: כאשר מוצא הגידול הוא ב-stellate ganglion בצוואר, ההתייצגות כוללת כיווץ של האישון, צניחת עפעף והיעדר זיעה במחצית הפנים בצד בו נמצא הגידול.
גושים תת-עוריים (Blueberry Muffin Baby): בתינוקות מתחת לגיל שנה וחצי קיימת הסתמנות ייחודית של גידול מפושט, בה בנוסף לגידול הראשוני באדרנל יש מעורבות של העור הבאה לידי ביטוי בנוכחות גושים רבים, תת-עוריים, בגוון כחול, וכן עדות למעורבות של הכבד ומח העצם. בהסתמנות זו, הנקראת 4S (Stage 4 Special) או MS, הגידול יהיה לרוב בעל מאפיינים ביולוגיים שפירים, תיתכן נסיגה ספונטנית של הגידול, והפרוגנוזה מצוינת גם במעקב בלבד.
Opsoclonus/myoclonus syndrome (OMS): תסמונת פראנאופלסטית נוירולוגית הכוללת ריצוד של העיניים, אטקסיה ואופסוקלונוס/מיוקלונוס, שיכולה להופיע כבר טרם האבחנה, במהלך הטיפולים או לאחר סיומם, והיא משנית לתגובה אימונית לגידול. בחולים עם הסתמנות זו המאפיינים הביולוגיים של הגידול הם לרוב שפירים, ושיעורי ההישרדות גבוהים. למרות טיפול בתרופות אימונוסופרסיביות ואימונומודולריות ייתכנו הפרעות קוגניטיביות והתנהגותיות לטווח ארוך.
מסה סופר-רנלית ביילוד: לעיתים מאובחנת נוירובלסטומה סופררנלית עוד בחיים העובריים בזמן בדיקות הסקר. מספר מחקרים הראו שמרבית הגידולים הסופר-רנלים שאובחנו בבדיקות אלו או בבדיקות סקר שבוצעו זמן קצר לאחר הלידה הם בעלי ביולוגיה שפירה והם עוברים נסיגה ספונטנית. הגישה היא שאין מקום לבצע בדיקות סקר בתינוקות לצורך גילוי מוקדם של נוירובלסטומה, ובאותם מקרים בהם הגידול קטן וממוקם ניתן להסתפק במעקב בלבד אף ללא ביופסיה.
האבחנה של נוירובלסטומה מתבססת על ביופסיה מהגידול או ממח העצם בשילוב עם מציאת רמות מוגברות של קטכולאמינים (VMA - Vanillylmandelic acid, HVA - Homovanillic Acid) בשתן. בדיקות נוספות שמבוצעות ומשמשות בעיקר לקביעת מידת התפשטות המחלה והדירוג שלה באבחנה (staging), כוללות אספירציה וביופסיה דו-צדדית ממח עצם, הדמיה כל-גופית ספציפית לנוירובלסטומה, דוגמת מיפוי MIBG או מיפוי F-DOPA, ובמידת הצורך בדיקת MRI (Magnetic Resonance Imaging) מוח ועמוד שדרה להדגמת מעורבות מערכת העצבים. עוד טרם התחלת הטיפול מבוצע עיבוד גנטי של רקמת הגידול באמצעות בדיקת FISH - Fluorescence In situ hybridization, CGH, SNP array ובטכנולוגיות חדשניות של NGS (Next Generation Sequencing), על מנת לאבחן הפרעות ביולוגיות שהן בעלות חשיבות לקביעת הגישה הטיפולית והפרוגנוזה[7][8].
מאפיינים הקשורים בהתנהגות הגידול ובפרוגנוזה
מאפיינים היסטולוגיים
בשנת 1984 הוצעה על ידי Shimada שיטת סיווג הקושרת בין מאפיינים היסטופתולוגיים של הגידול להתנהגותו הקלינית. הגידולים סווגו כ-favorable לעומת unfavorable, על סמך מידת ההתמיינות של התאים, כמות תאי השוואן בסטרומה, MKI (Mitosis-Karyorrhexis Index) וגיל החולה באבחנה. על בסיס שיטת סיווג זו פורסמה בשנת 1999 International Neuroblastoma Pathology Classification, שהיא שיטת סיווג בעלת משמעות פרוגנוסטית המדגימה כי גידולים שהם unfavorable הם בעלי התנהגות קלינית אגרסיבית ופרוגנוזה גרועה. שיטת סיווג זו הוכחה כבעלת יכולת ניבוי פרוגנוסטית, ולכן משמשת כאחד מהמדדים החשובים הקובעים את מדיניות הטיפול[2][9].
מאפיינים גנומיים
השינוי הביולוגי המשמעותי ביותר הקשור בפרוגנוזה לא טובה ללא קשר לגיל או למידת התפשטות המחלה ושבנוכחותו הילדים מסווגים לקבוצת סיכון גבוה (למעט במקרים בהם הגידול נכרת בשלמותו), הוא ריבוי עותקים (אמפליפיקציה) של MYCN. הפרעה זו ברקמת הגידול, המאובחנת על ידי בדיקת FISH, מופיעה ב-25-16 אחוזים מהמקרים של נוירובלסטומה וב-50-40 אחוזים מהמקרים בקבוצת סיכון גבוה[10].
ככלל, מוטציות בגנים אינן שכיחות בנוירובלסטומה בדומה לשאר הגידולים בילדים ובשונה מגידולים במבוגרים, שם יש עומס מוטציות גבוה. מקרב המוטציות הגנטיות הנצפות בנוירובלסטומה, מוטציה בגן ALK הקשור גם בנוירובלסטומה משפחתית, היא השכיחה ביותר ומופיעה בכ-10 אחוזים מן המקרים האקראיים ובשכיחות גבוהה יותר בגידולים שמוצאם בבית החזה, בהשוואה לגידולים שמקורם באדרנל. מוטציה ב-ALK קשורה בפרוגנוזה טובה פחות ובשיעורי הישרדות נמוכים יותר בקרב ילדים בקבוצת סיכון גבוה ובינוני. מוטציות ב-ALK מהוות מטרה טיפולית, והשפעתם של תכשירים מעכבי ALK נבחנת בחולים שמחלתם נשנתה או בקבוצת חולים בסיכון גבוה כבר באבחנה.
מוטציות נוספות בשכיחות נמוכה בהרבה תוארו בגנים ATRX, PTPN11, ARID1A, ARID1B. מנגנון בעל השפעה חשובה הקשור במידת האגרסיביות של הגידול ובפרוגנוזה, הוא זה הקשור לאורך הטלומר. בקבוצת הגידולים בסיכון גבוה קיימת הפרעה במנגנוני הבקרה של אורך הטלומר הגורמת להארכתו בתאי הגידול ומכאן להמשך התחלקות התאים והישרדות הגידול. ההפרעות המתוארות קשורות בביטוי יתר של TERT ובמוטציות 2-ATRX. מוטציות או חסר 2-ATRX תוארו ב-20-10 אחוזים מהמקרים של נוירובלסטומה בסיכון גבוה, כמעט אך ורק בילדים גדולים, והשפעתו על אורך הטלומר היא במנגנון הקרוי ALT (Alternative Lengthening of Telomeres). מספר מחקרים בדקו הופעת מוטציות גנטיות במהלך ההתפתחות של המחלה, תוך שהם משווים את סוג המוטציות שנמצאו באבחנה לעומת מוטציות שנמצאו בהישנות. ככלל נמצאה שכיחות גבוהה יותר של מוטציות בהישנות לעומת האבחנה כשהגנים השכיחים המעורבים שתוארו הם גנים במסלול RAS MAPK, ALK, NF1 ו-CHD5.
לבסוף, ביטוי של מדיאטורים שונים ממשפחת ה-Trk הקשורים בהעברת סיגנלים של נוירוטרופינים, נמצאו קשורים גם הם למאפיינים הביולוגיים והקליניים של נוירובלסטומה. כך למשל, ביטוי מוגבר של Trk A ו-Trk C קשור בפרוגנוזה טובה, בעוד ביטוי מוגבר של Trk B נמצא בגידולים מתקדמים עם ריבוי עותקים של MYCN, וביטוי מופחת שלו בגידולים בעלי מאפיינים טובים[11].
לסיכום, גידולים בעלי מאפיינים טובים כוללים את אותם גידולים עם הפרעות כרומוזומליות מספריות NCA (Numerical Chromosomal Aberrations), קריוטיפ טריפלואידי וביטוי TrkA. חולים עם גידול מסוג זה הם לרוב מתחת לגיל 18 חודשים, הגידול שלהם ממוקם והפרוגנוזה טובה. לעומתם, גידולים בעלי מאפיינים גרועים כוללים גידולים עם אמפליפיקציה של MYCN, הפרעות כרומוזומליות סגמנטריות - SCA (Segmental Chromosomal Aberrations) ב-1p, 1q, 3p, 11p, 14q, 17q.
קריוטיפ דיפלואידי או טטרפלואידי, שינויים הקשורים במנגנון הארכת הטלומר וביטוי TrkB. חולים עם גידול מסוג זה הם לרוב מעל גיל 18 חודשים, בעלי מחלה מתקדמת באבחנה, והפרוגנוזה שלהם גרועה גם לאחר קבלת טיפול אגרסיבי.
מאפיינים קליניים
המדדים הקליניים החשובים הם גיל החולה ומידת התפשטות המחלה (stage). ככלל, ככל שהחולה צעיר יותר - מתחת לגיל שנה וחצי - שיעורי ההישרדות שלו טובים יותר. בכל שלבי המחלה שהם מעבר למחלה ממוקמת, לתינוקות מתחת גיל שנה וחצי שיעורי הישרדות טובים בהרבה משל ילדים גדולים יותר עם נתוני מחלה זהים באבחנה. יחד עם המאפיינים הפתולוגיים והגנומיים שתוארו, המדדים הקליניים משמשים לחלוקת המטופלים לקבוצות סיכון ולקביעת הגישה הטיפולית והפרוגנוזה.
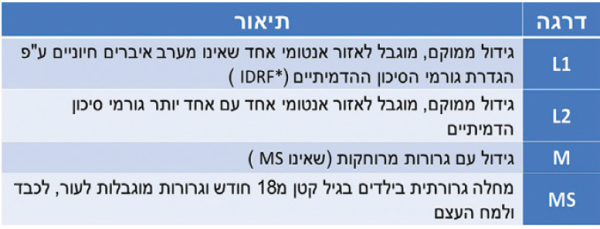
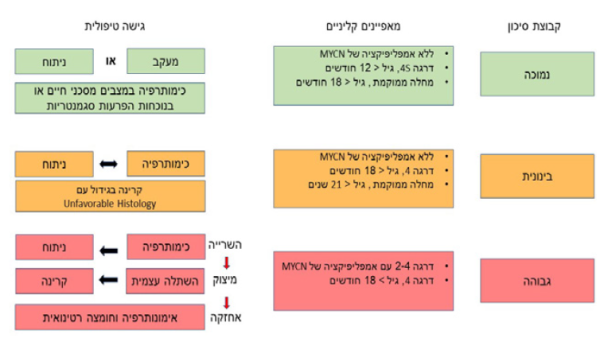
הגישה הטיפולית
לאור ההסתמנות ההטרוגנית של נוירובלסטומה, הטיפול הוא מגוון וכולל מעקב בלבד, ניתוח, כימותרפיה, קרינה, השתלה אוטולוגית ואימונותרפיה. על מנת ליצור אחידות בסיווג המטופלים ולצורך השוואה של תוצאות הטיפול באזורים שונים בעולם, הוגדרה בשנת 2009 שיטת סיווג חדשה הקרויה INRG (International Neuroblastoma Risk Group) המתבססת על גיל באבחנה, שלב הגידול, היסטופתולוגיה, ריבוי עותקים של MYCN, פלואידיות הגידול ונוכחות SCA .בנוסף הוגדר מחדש אופן הסיווג, הקובע את שלב המחלה, כשהחלוקה החדשה מתבססת על נוכחות גורמי סיכון בהדמיה IDRF (Image Defined Risk Factors) הקובעים אם הגידול ניתן לכריתה מלאה כבר באבחנה או מחייב ביופסיה בלבד מאחר שאינו נתיח (טבלה מספר 1). על פי שיטת סיווג INRG, ילדים עם נוירובלסטומה מסווגים לשלוש קבוצות סיכון, וחלוקה זו קשורה בפרוגנוזה וקובעת את הגישה הטיפולית (תמונה מספר 1).
קבוצת סיכון נמוך: ילדים השייכים לקבוצת סיכון זו הם בעלי פרוגנוזה טובה עם סיכויי הישרדות מעל 95 אחוזים. מרבית הילדים בקבוצה זו הם בגיל צעיר, פחות מ-18 חודשים, והגידול שלהם הוא בעל מאפיינים ביולוגיים הכוללים טריפלואידיות ו-NCA. הטיפול בילדים בקבוצה זו כולל מעקב בלבד או ניתוח, אולם בילדים עם גידול סימפטומטי מסכן חיים, SCA או מחלה מפושטת, יש צורך גם בטיפול כימי. הגישה הטיפולית באותם חולים מועטים עם גידול שנכרת בשלמותו כבר באבחנה וריבוי עותקים של MYCN נתונה במחלוקת, ועדיין לא ברורה הגישה הטיפולית האופטימלית בהם.
קבוצת סיכון בינוני: בקבוצה זו נכללים חולים מעל גיל 18 חודשים עם מחלה ממוקמת או תינוקות מתחת לגיל שנה עם מחלה מפושטת ללא אמפליפיקציה של - MYCN.
שיעור ההישרדות בקבוצת חולים זו הוא כ-90-85 אחוזים. ברוב החולים הופחת הטיפול הכימי, כך שהם מקבלים בסך הכל בין ארבעה לשמונה מחזורים של כימותרפיה, וטיפול בקרינה ניתן רק לחלק מהחולים בהתאם למאפיינים היסטופתולוגיים של הגידול. באופן זה יש ניסיון לשמור על שיעורי הישרדות גבוהים תוך הימנעות מתופעות לוואי לטווח קצר וארוך הנצפות בפרוטוקולים האגרסיביים יותר.
קבוצת סיכון גבוה: ילדים בקבוצה זו הם לרוב מעל גיל 18 חודשים עם מחלה מפושטת ועם גידול בעל מאפיינים מולקולריים הכוללים אמפליפיקציה של MYCN ושינויים גנומיים המעודדים הארכה של הטלומר. הפרוגנוזה של ילדים השייכים לקבוצת סיכון זו אינה טובה, ושיעורי ההישרדות שלהם לטווח הארוך נעים סביב 50 אחוזים והוא ללא שינוי מהותי מאז תחילת המאה ה-21. הטיפול בקבוצת חולים זו מורכב ממספר גישות טיפוליות, הכוללות טיפול כימי אגרסיבי ואינטנסיבי, שמטרתו להקטין את הגידול הראשוני ולהעלים את הגרורות, ניתוח לסילוק שארית הגידול, השתלת תאי אב עצמית (ובפרוטוקול 2 COG השתלות אוטולוגיות בזו אחר זו), טיפול בקרינה למיטת הגידול הראשוני ולאחריו טיפול אחזקתי למשך חצי שנה, הכולל אימונותרפיה בנוגדני anti GD2 בשילוב חומצה רטינואית. מתוך רצון לשפר את תוצאות הטיפול בקבוצת חולים זו, נבדקות גישות טיפוליות הכוללות מתן נוגדי anti GD2 בזמן האינדוקציה, שילוב מעכבי ALK בחולים עם מוטציה וקרינת MIBG בחולים אצלם לא נצפתה תגובה מספקת לאחר האינדוקציה[12][7].
הטיפול בחולים עם מחלה עמידה או בהישנות: סיכויי ההישרדות בחולים עם מחלה עמידה לטיפול או בהישנות הם נמוכים ביותר ועומדים על שיעורי הבראה נמוכים מ-10 אחוזים. הגישה הטיפולית בקבוצת חולים זו כוללת מתן קו שני של כימותרפיה (לדוגמה Temozolomide (טמודל[13]) / Irinotecan (קאמפטוסר[13]), Cytoxan, Toptecan (היצאמטין[13]), שילוב כימותרפיה עם תרופות ביולוגיות כמו Rapamycin (סירולימוס[13]) ו-Dasatinib (ספרייסל[13]) (פרוטוקול RIST), מתן קרינת MIBG במינון גבוה וכימו-אימונותרפיה המשלבת נוגדני anti GD2 יחד עם טמודל-Irinotecan - גישה טיפולית שהדגימה יעילות בכ-50 אחוזים מהחולים עם מחלה עמידה או שנשנתה. טיפולים נוספים אפשריים - ברובם טיפולים ניסיוניים הניתנים כחלק ממחקר קליני - כוללים תרופות ביולוגיות המתבססות על הביולוגיה של הגידול והמנסות לפגוע באופן סגולי בגנים, חלבונים ומסלולים הקשורים בהתמרה ובהתקדמות של נוירובלסטומה, וכן טיפולים אימונותרפיים חדשניים, כמו טיפול ב-GD2 CAR T cells, Bi-Specific antibodies, מעכבי PD1 ותאי NK[[14].
סיכום
למרות ההתקדמות הרבה שחלה בטיפול בילדים עם נוירובלסטומה בקבוצת סיכון נמוך ובינוני, שיעורי ההבראה בקבוצת הסיכון הגבוה נותרו נמוכים. חלה התפתחות עצומה בהבנת הבסיס הביולוגי של הגידול ובאיתור גנים ומסלולים חדשים החיוניים להתפתחותו והאחראים לעמידותו לתרופות. יש לקוות כי הבנה זו תוביל לפיתוח טיפולים חדשניים המבוססים על הביולוגיה והאימונולוגיה של הגידול, שיוכיחו עצמם כיעילים ויעלו את שעורי ההישרדות בילדים עם נוירובלסטומה אגרסיבית.
ביבליוגרפיה
- ↑ Li J, Thompson TD, Miller JW, et al. Cancer incidence among children and adolescents in the United States, 2001-2003. Pediatrics. 2008 Jun;121(6):e1470-7.
- ↑ 2.0 2.1 2.2 Matthay KK, Maris JM, Schleiermacher G, et al. Neuroblastoma. Nature Reviews Disease Primers. 2016 Nov 10;2:16078.
- ↑ 3.0 3.1 Satge D, Moore SW, Stiller CA, et al. Abnormal constitutional karyotypes in patients with neuroblastoma: a report of four new cases and review of 47 others in the literature. Cancer Genet Cytogenet. 2003 Dec;147(2):89-98.
- ↑ 4.0 4.1 Tonini GP, Capasso M. Genetic predisposition and chromosome instability in neuroblastoma. Cancer Metastasis Rev. 2020 Mar;39(1):275-85.
- ↑ 5.0 5.1 Kamihara J, Bourdeaut F, Foulkes WD, et al. Retinoblastoma and neuroblastoma predisposition and surveillance. Clin Cancer Res. 2017 Jul 1;23(13):e98-106.
- ↑ Maris JM. Recent advances in neuroblastoma. N Engl J Med. 2010 Jun 10;362(23):2202-11.
- ↑ 7.0 7.1 7.2 Tolbert VP, Matthay KK. Neuroblastoma: clinical and biological approach to risk stratification and treatment. Cell Tissue Res. 2018 May;372(2):195-209.
- ↑ Whittle SB, Smith V, Doherty E, et al. Overview and recent advances in the treatment of neuroblastoma. Expert Rev Anticancer Ther. 2017 Apr;17(4):369-86. Epub 2017 Mar 15.
- ↑ Shimada H, Ambros IM, Dehner LP, et al. The International Neuroblastoma Pathology Classification (the Shimada system). Cancer. 1999 Jul 15;86(2):364- 72.
- ↑ Cohn SL, Pearson ADJ, London WB, et al. The International Neuroblastoma Risk Group (INRG) classification system: an INRG Task Force report. J Clin Oncol. 2009 Jan 10;27(2):289-97.
- ↑ Johnsen JI, Dyberg C, Wickstrom M. Neuroblastoma - A neural crest derived embryonal malignancy. Front Mol Neurosci. 2019 Jan 29;12:9.
- ↑ Van Arendonk KJ, Chung DH. Neuroblastoma: tumor biology and its implications for staging and treatment. Children (Basel). 2019 Jan 17;6(1):12.
- ↑ 13.0 13.1 13.2 13.3 13.4 או תרופות המכילות חומר פעיל זהה או דומה בעלות שמות מסחריים אחרים
- ↑ Zage PE. Novel therapies for relapsed and refractory neuroblastoma [Internet]. Children (Basel). 2018 Oct 31;5(11):148. Available from: https://www.ncbi.nlm. nih.gov/pmc/articles/PMC6262328/ [Accessed Jan 10, 2021].
המידע שבדף זה נכתב על ידי ד"ר חנה גולן - המחלקה להמטו-אונקולוגיה והשתלות מח עצם בילדים, המרכז הרפואי ע"ש חיים שיבא, תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק